La mayoría de pacientes con un carcinoma hepatocelular (CHC) no son candidatos a resección quirúrgica o trasplante hepático debido al estadio en el momento diagnóstico. Para este grupo de pacientes existen una serie de tratamientos locorregionales que consiguen una alta tasa de respuestas objetivas.
La ablación percutánea está considerada la mejor opción terapéutica para el CHC (estadio 0/A-BCLC) no tributario de tratamiento quirúrgico. En el carcinoma hepatocelular multifocal sin invasión vascular ni extensión extrahepática (estadio B- BCLC) la única opción terapéutica que ha demostrado mejorar la supervivencia en estudios controlados y aleatorizados es la quimioembolización.
La valoración de la efectividad de estos tratamientos se basa en la reducción del tumor viable y se realiza mediante TC, RM o US con contraste.
En este trabajo se revisan las indicaciones, la técnica y la eficacia terapéutica de los distintos tratamientos locorregionales en el CHC.
Most patients with hepatocellular carcinoma (CHC) are not candidates for surgical resection or liver transplantation because of their stage at the time of diagnosis. There are a series of locoregional treatments that achieve a high objective response rate in this group of patients.
Percutaneous ablation is considered the best treatment option for CHC (BCLC stage 0/A) not amenable to surgical treatment. In multifocal hepatocellular carcinoma without vascular invasion or extrahepatic extension (BCLC stage B), the only treatment option that has been shown to improve survival in randomized controlled trials is chemoembolization.
The evaluation of the effectiveness of these treatments is based on the reduction of viable tumor observed at CT, MRI, or contrast-enhanced US.
In this article, we review the indications, technique, and therapeutic efficacy of the different locoregional treatments for CHC.
En el momento actual y siguiendo los documentos de consenso a nivel nacional e internacional1,2, el tratamiento percutáneo se considera una terapia con resultados altamente satisfactorios y es por ello que se incluye, junto con la resección quirúrgica y el trasplante, en el grupo de tratamientos radicales o curativos que consiguen de media una supervivencia a los 5 años del 50–70%.
Siguiendo el esquema de estadificación y tratamiento de Barcelona Clinic Liver Cancer (BCLC), el más utilizado en la comunidad científica internacional, se considera el tratamiento de elección en los pacientes con carcinoma hepatocelular (CHC) en estadio inicial en los que se ha descartado el tratamiento quirúrgico con resección o trasplante3. También se utiliza como tratamiento puente para evitar la progresión del tumor cuando el tiempo de espera estimado para el trasplante hepático excede de los 6 meses. Entre los tratamientos percutáneos más ampliamente utilizados existen 2 grandes grupos, según su mecanismo de actuación:
- 1)
Inyección de substancias químicas en el interior del tumor.
- 2)
Ablación térmica con aplicación de calor o frío (termocoagulación).
Dentro del primer grupo están los tratamientos con inyección intratumoral de etanol, de ácido acético4 o de suero salino caliente, mientras que dentro del segundo estarían el láser5, la radiofrecuencia y las microondas6 que generan calor, y la crioablación con generación de frío7.
Otro tipo de tratamientos menos utilizados, como los ultrasonidos focalizados de alta intensidad (HIFU) están en fase de valoración de su aplicabilidad y eficacia8.
En el campo del CHC los 2 tratamientos más utilizados a nivel mundial han sido la inyección intratumoral de alcohol (IIE) y la ablación por radiofrecuencia (RF).
En general, los mejores resultados del tratamiento percutáneo se obtienen en pacientes con tumores únicos menores de 2cm9,10 y con una función hepática preservada, sobre todo cuando se ha conseguido una respuesta completa tras el procedimiento percutáneo10, en cuyo caso se ha demostrado una mayor supervivencia.
El principal inconveniente de la ablación percutánea, similar al de la resección quirúrgica, es la alta recurrencia (aproximadamente 80% a los 5 años) a pesar de obtener una respuesta completa inicial9, dado el sustrato subyacente de un hígado cirrótico, con potencial para generar nuevos focos tumorales en otras localizaciones diferentes a la del nódulo tratado.
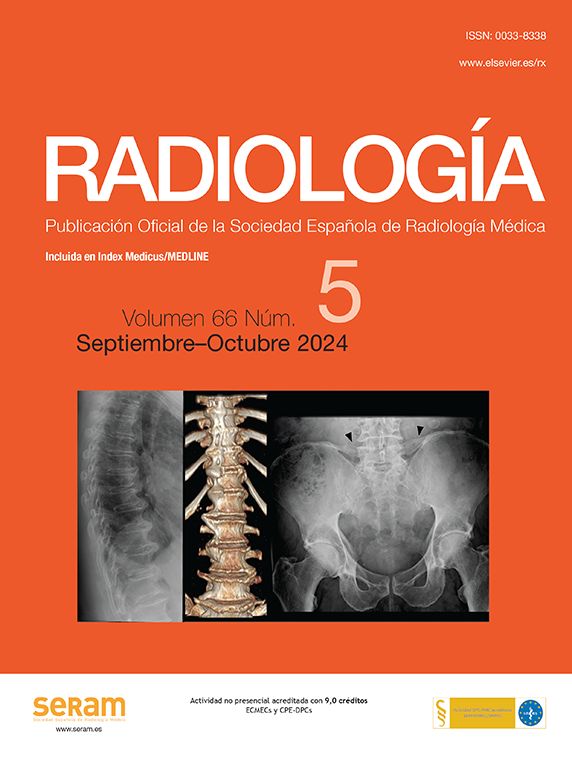
La inyección intratumoral de etanol por vía percutánea ha sido la técnica más utilizada y evaluada en los últimos 20 años, iniciándose en Japón11,12 y siendo trasladada a Europa y generalizada en todo el Occidente por Livraghi13, con resultados altamente satisfactorios. Una de sus principales ventajas y que explicaría su rápida difusión es que se trata de una técnica sencilla que requiere muy poco aparataje tecnológico y las posibles complicaciones son escasas. En algunos centros se suele utilizar de forma ambulatoria, realizando el procedimiento una o varias veces por semana a días alternos, sin necesidad de que el paciente esté ingresado, hecho que disminuye mucho el coste total de la técnica. En otros centros, al igual que en el nuestro, se recomienda un ingreso hospitalario de 4–5 días para realizar una inyección diaria bajo control ecográfico e intentar conseguir la necrosis tumoral en una semana. La técnica consiste en puncionar el tumor con una aguja fina de 22G, previa anestesia local de la zona, e inyectar lentamente etanol en su interior, procurando que el alcohol difunda en lo posible por todo el nódulo, en una cantidad que varía entre 2 y 3cc/sesión para los nódulos menores de 2cm y 3–5cc/sesión para los nódulos mayores (fig. 1). Si se utiliza sedoanalgesia controlada por un anestesiólogo se consigue inyectar más cantidad de etanol sin dolor, con lo que es posible conseguir la necrosis tumoral en menos sesiones (2–3 en una semana). La aparición de los contrastes ecográficos (USC) en los últimos años ha facilitado mucho el trabajo del médico ecografista, ya que además de permitir una mejor visualización de nódulos de difícil localización, puede ser utilizada de modo orientativo durante la tanda de sesiones para ver el efecto del tratamiento, posibilitando dirigir la punción de sesiones sucesivas a las zonas de tumor viable con hipercaptación arterial. Una vez finalizada la tanda de sesiones semanal, se realizará un control de la eficacia mediante técnicas de imagen un mes después del tratamiento (USC, RM o TC). La complicación más frecuente suele ser el dolor, no siendo rara la existencia de trombosis parciales a nivel de vasos vecinos, que suelen revertir a la normalidad de manera espontánea. Pueden ocurrir complicaciones de tipo hemorrágico, sobre todo en los nódulos subcapsulares e incluso diseminación neoplásica por el trayecto de la aguja, aunque con menor frecuencia que con la RF. En general, la IIE obtiene la necrosis tumoral completa en aproximadamente el 80% de los tumores menores de 3cm y alcanza una supervivencia a los 5 años superior al 50% en sujetos con función hepática compensada10,13. En tumores de mayor tamaño, la IIE pierde su eficacia debido a la presencia de septos fibrosos intratumorales que impiden la correcta difusión del etanol10,13,14, siendo más recomendable, si es posible, utilizar RF. La aplicación percutánea de calor dirigida al interior del tumor (termocoagulación) conseguiría la necrosis sin que se viese alterada su eficacia por la existencia de tabicaciones intratumorales, obteniéndose una mayor homogeneidad y extensión de la zona necrosada con un margen de seguridad. Estos efectos redundarían en un menor número de sesiones terapéuticas y un menor índice de recidivas tumorales. Varios trabajos han demostrado una mayor efectividad del control local del tumor mediante RF que con alcoholización, especialmente en tumores mayores de 3cm15–18. En algunos de ellos también se obtiene una mayor supervivencia en los pacientes tratados con RF. Últimamente se han publicado varios metaanálisis que apoyan este hallazgo19,20. Por estos motivos, en el momento actual, la IIE ha sido relegada a un papel menor, ya que se suele reservar para aquellos pacientes en los que no es posible la práctica de una RF, generalmente por problemas en la localización del nódulo. También es útil combinar ambos tratamientos introduciendo etanol en las zonas del tumor contiguas a estructuras vasculares, donde el efecto de la termocoagulación es menor por la refrigeración de la corriente sanguínea, o en las zonas cercanas a estructuras que no se quieran lesionar con el calor, como tumores cercanos a estructuras digestivas o a la vesícula biliar (fig. 2).
Carcinoma hepatocelular (CHC) adyacente al hilio hepático y cercano a vesícula biliar, por lo que se desestimó el tratamiento con RF y se realizó IIE. a) Material necesario para la IIE: alcohol absoluto al 100%, aguja espinal de 22G, jeringa para cargar e inyectar el alcohol, gel estéril, bolsa estéril para cubrir el transductor. b) Lesión adyacente al hilio hepático, con aguja espinal en su interior. Punta de la aguja en la porción más distal del tumor (flecha). c) Lesión completamente ecogénica que traduce la replección del tumor con alcohol y las burbujas de gas que lo acompañan.
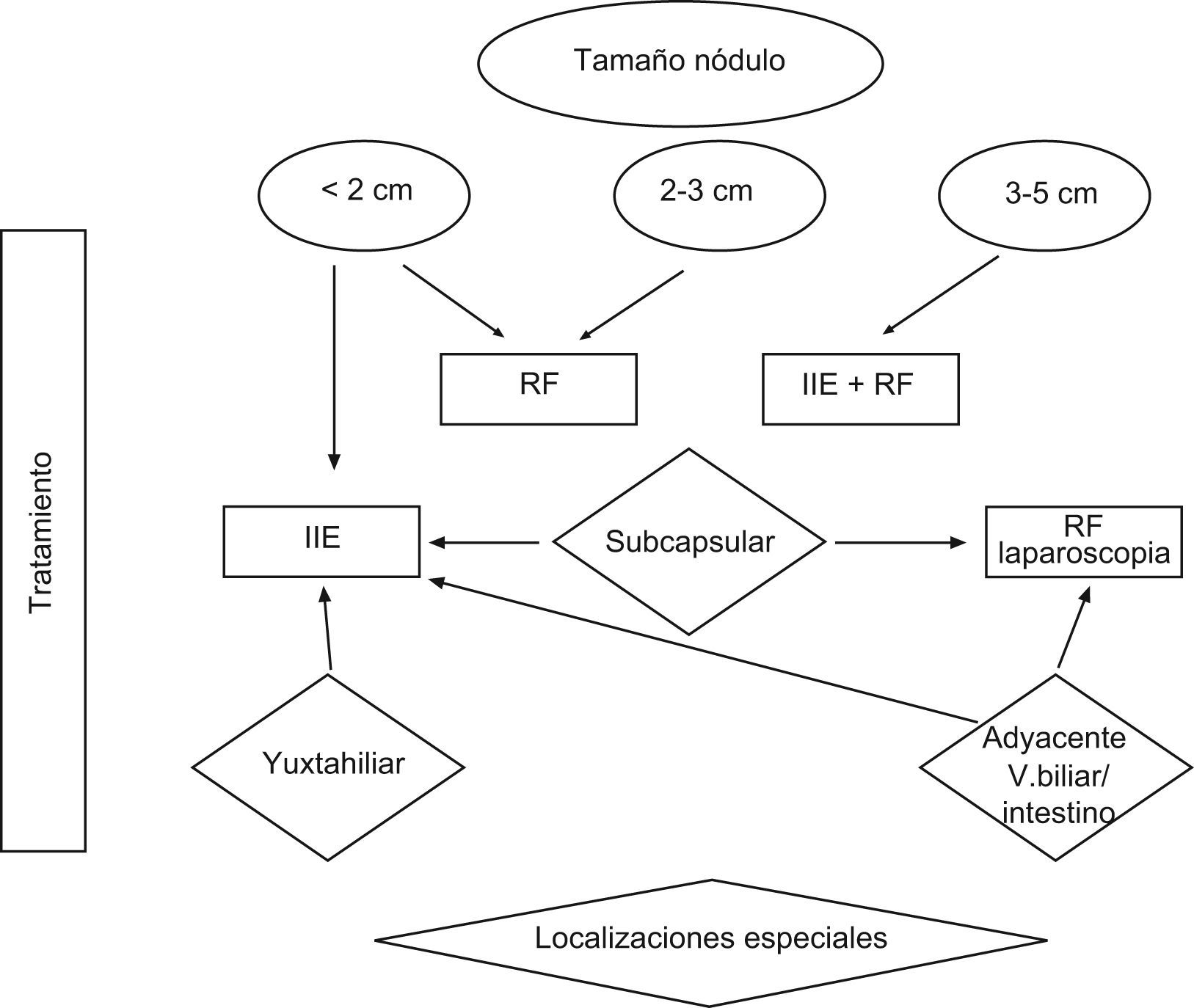
Algoritmo de tratamiento ablativo del carcinoma hepatocelular no resecable, en estadio inicial (Hospital Clinic, Barcelona) según tamaño y localización del tumor. RF: radiofrecuencia; IIE : inyeción intratumoral de etanol; IIE+RF: inyección de etanol asociada a radiofrecuencia según técnica descrita en referencia bibliográfica26.
La radiofrecuencia es el tratamiento percutáneo más utilizado en la actualidad. Se basa en ondas electromagnéticas que pertenecen al dominio de las radioondas, producidas por el paso de una corriente alterna a través de un electrodo. En el interior de los tejidos estas ondas producen una agitación de los iones celulares, causando un incremento de la temperatura, que al superar los 50° produce una necrosis tisular coagulativa.
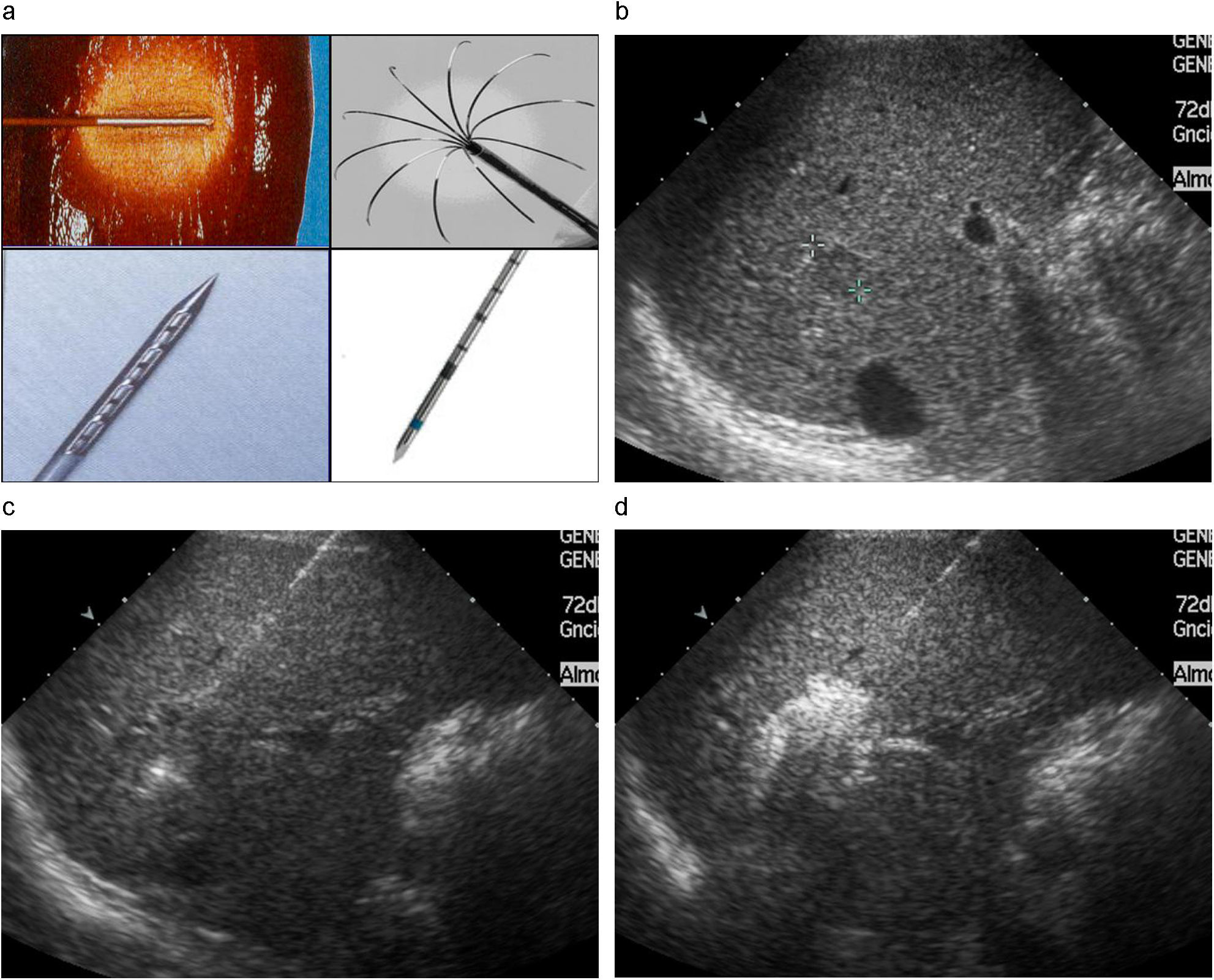
En los últimos años se han publicado múltiples trabajos en los que se han estudiado la eficacia de esta terapéutica en el tratamiento del CHC, haciendo modificaciones técnicas como generadores de mayor potencia, electrocauterios mono y bipolares, el enfriamiento de la punta de la aguja térmica mediante corriente continua de agua, agujas expandibles, etc. (fig. 3). La Radiofrecuencia también se está utilizando cada vez con más frecuencia de forma peroperatoria (por laparotomía o laparoscopia) cuando existe algún tumor no resecable o no abordable por vía percutánea. Existen algunas condiciones concretas que desaconsejan, en algunos casos, el tratamiento mediante RF: la existencia de menos de 1cm de distancia entre el punto donde debe colocarse el extremo de la sonda de radiofrecuencia y estructuras como ramas principales de la porta, vena cava inferior, aorta, corazón, vesícula biliar y ramas principales de la vía biliar, asas intestinales y tumores subcapsulares por riesgo de hemorragia o diseminación tumoral al peritoneo. Varios trabajos publicados sugieren que algunas de estas contraindicaciones no deben considerarse como absolutas21–23.
CHC tratado con RF. a) Diferentes tipos de agujas de RF (de izquierda a derecha y de arriba a abajo): unipolar refrigerada en el interior de tejido hepático, unipolar expandible, unipolar perforada para infusión de suero, bipolar. b) CHC de pequeño tamaño (<2cm) situado en el lóbulo derecho hepático. c) Aguja unipolar que atraviesa el centro de la lesión sobrepasando su límite posterior. d) Aspecto post-RF que muestra imagen ecogénica que abarca toda la lesión tumoral, y que traduce el efecto de cavitación causada por el calor emitido por la aguja.
La aplicación de este tratamiento requiere más analgesia que la utilizada en la alcoholización, por lo que se realiza con monitorización continua para poder controlar la sedación.
La eficacia del tratamiento depende fundamentalmente del tamaño, número y localización de las lesiones. Con este tipo de terapia se obtienen resultados óptimos en tumores únicos menores de 3cm, o multinodulares con un máximo de 3 nódulos, cada uno de ellos no mayores de 3cm de diámetro, consiguiéndose necrosis completas en más del 90% de casos. También se utiliza en tumores mayores de 3cm, pero los resultados son peores24. Para mejorar la eficacia en los tumores de mayor tamaño, algunos autores sugieren asociar la RF con la quimioembolización arterial25 y la inyección previa de etanol. La asociación de alcoholización inmediatamente antes de la RF parece mejorar los resultados en tumores mayores de 3cm26.
En cuanto a la supervivencia, los factores que influyen más directamente son: la existencia de una función hepática preservada y conseguir la necrosis completa del tumor10. En series extensas, el porcentaje global de supervivencia descrito se halla entre el 71 y el 77% a los 3 años y el 48 y el 54% a los 5 años23,27.
Las complicaciones post-RF son más frecuentes y más importantes que la IIE dado que el grosor de las agujas empleadas en la RF es mayor que las utilizadas en la IIE y que el radio de acción del calor puede ser más difícil de delimitar. Se han descrito varias complicaciones relacionadas con la RF consistentes en: dolor, fiebre, hemoperitoneo, hemobilia, derrame pleural, hemoneumotórax, infarto hepático segmentario, estenosis de la vía biliar, abscesos, perforación de la vesícula biliar y de asas intestinales por efecto directo del calor, diseminación en el trayecto de la aguja, etc., y una mortalidad relacionada menor del 1–2,4%23,28. Se ha observado que la diseminación por el trayecto de la aguja es más frecuente que con la IIE, pudiendo llegar al 12%, especialmente si se tratan tumores subcapsulares (sin zona de parénquima no tumoral entre la zona del abordaje percutáneo y el tumor)29. No obstante, el porcentaje referido de esta complicación en artículos que suman la experiencia en múltiples centros, es de solamente 0,5%, ocurriendo también, en la mayoría de ocasiones, en tumores subcapsulares28. En nuestro centro, para intentar evitar este tipo de complicación, en los tumores subcapsulares, optamos por realizar IIE o RF por laparoscopia en lugar de RF percutánea (fig. 2).
La valoración de la respuesta al tratamiento se realiza con los mismos métodos que los comentados en la valoración de la IIE, cuya descripción se amplía en el apartado de evaluación de la respuesta terapéutica tras el tratamiento locorregional.
En los últimos años varios grupos han comparado la ablación percutánea con la resección quirúrgica30,31, sin encontrar diferencias significativas en supervivencia ni en tasa de recidiva entre ambos tratamientos, especialmente en tumores de pequeño tamaño. Estos trabajos presentan problemas metodológicos, por lo que no existe suficiente evidencia científica para establecer la superioridad de una sobre otra en tumores menores de 2cm.
En conclusión, y según las recomendaciones realizadas en el artículo de consenso nacional2: la ablación tumoral es un tratamiento eficaz en aquellos pacientes con CHC iniciales no candidatos a resección quirúrgica o como tratamiento durante el tiempo de espera del trasplante hepático; la inyección de etanol y la radiofrecuencia poseen una eficacia similar en tumores menores de 2cm. La radiofrecuencia tiene más capacidad ablativa y su eficacia es claramente mayor a la inyección de etanol en tumores mayores de 2cm; en tumores menores de 2cm la ablación percutánea puede tener una eficacia terapéutica similar a la resección quirúrgica.
Tratamientos intraarterialesEl carcinoma hepatocelular es una neoplasia cuya progresión esta íntimamente asociada a su actividad neoangiogénica. En estadios iniciales el tumor es con frecuencia hipovascular y su flujo sanguíneo depende fundamentalmente de la vena porta. A medida que el tumor evoluciona a estados más avanzados, su flujo sanguíneo pasa a depender de la arteria hepática. Este perfil vascular específico proporciona la base racional para la aplicación de la obstrucción arterial y/o administración de fármacos intraarteriales como una terapéutica efectiva en el CHC irresecable.
Los tratamientos intraarteriales se consideran tratamientos paliativos y están indicados en el CHC no tributario de terapias radicales32. Los tratamientos intraarteriales incluyen la embolización arterial (EA), la quimiembolización (QME) y la radioterapia intraarterial.
Embolización arterial y quimioembolizaciónLa EA consiste en la obstrucción de las arterias tumorales hepáticas. La QME combina la EA tumoral con la infusión simultánea de un agente quimioterápico en las arteria nutricias del tumor hepático33. La EA y la QME producen una necrosis tumoral por oclusión de las arterias nutricias. Aunque no existen estudios que demuestren una diferencia significativa en la supervivencia entre las 2 técnicas, la QME ha demostrado beneficios en términos de supervivencia en sujetos con un CHC en estadio intermedio34–36. En base a estos resultados, la QME es el tratamiento paliativo más ampliamente aplicado.
La QME está indicada en los pacientes con un tumor en estadio intermedio (estadio B de la clasificación BCLC)3. Estos son pacientes asintomáticos con una función hepática conservada y que presentan un CHC multinodular o un tumor único mayor de 5cm. La principal contraindicación de este tratamiento es la ausencia de flujo portal debido a trombosis portal, shunt portosistémico o flujo hepatofugal. También está contraindicado si existe extensión tumoral extrahepática, invasión vascular macroscópica, síntomas clínicos relacionados con el tumor o si se presenta cualquier contraindicación para la realización de un procedimiento angiográfico o para la administración de quimioterapia3.
Desde el punto de vista técnico, la QME se realiza en una sala de radiología vascular intervencionista por personal especializado. El procedimiento se realiza bajo anestesia local y según la técnica de Seldinger, a través de una arteria periférica.
En primer lugar se practica un estudio angiográfico diagnóstico con el objetivo de confirmar la permeabilidad portal y valorar la localización y la vascularización de las lesiones tumorales hepáticas. Para ello pueden ser de gran utilidad las reconstrucciones vasculares MIP y MPR obtenidas del estudio TC multifásico realizado para estadiar la enfermedad tumoral37. Se debe localizar el origen de las arterias gastroduodenal, cística y gástricas con el objetivo de evitar el reflujo de material de embolización a estos territorios38. Una vez valorada la vascularización tumoral, se cateterizan selectivamente las arterias nutricias y bajo control fluoroscópico continuo se inyecta el material de QME (fig. 4).
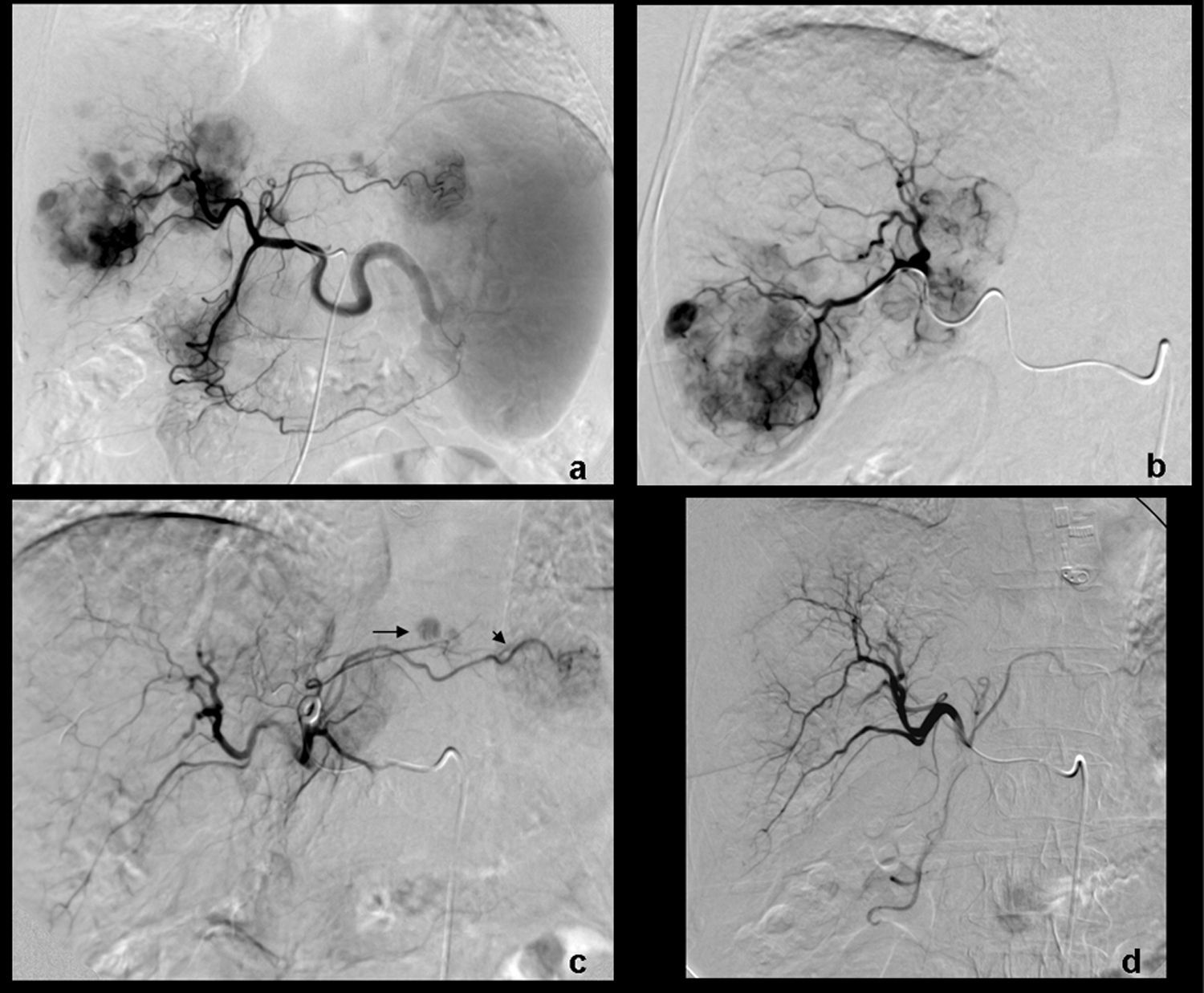
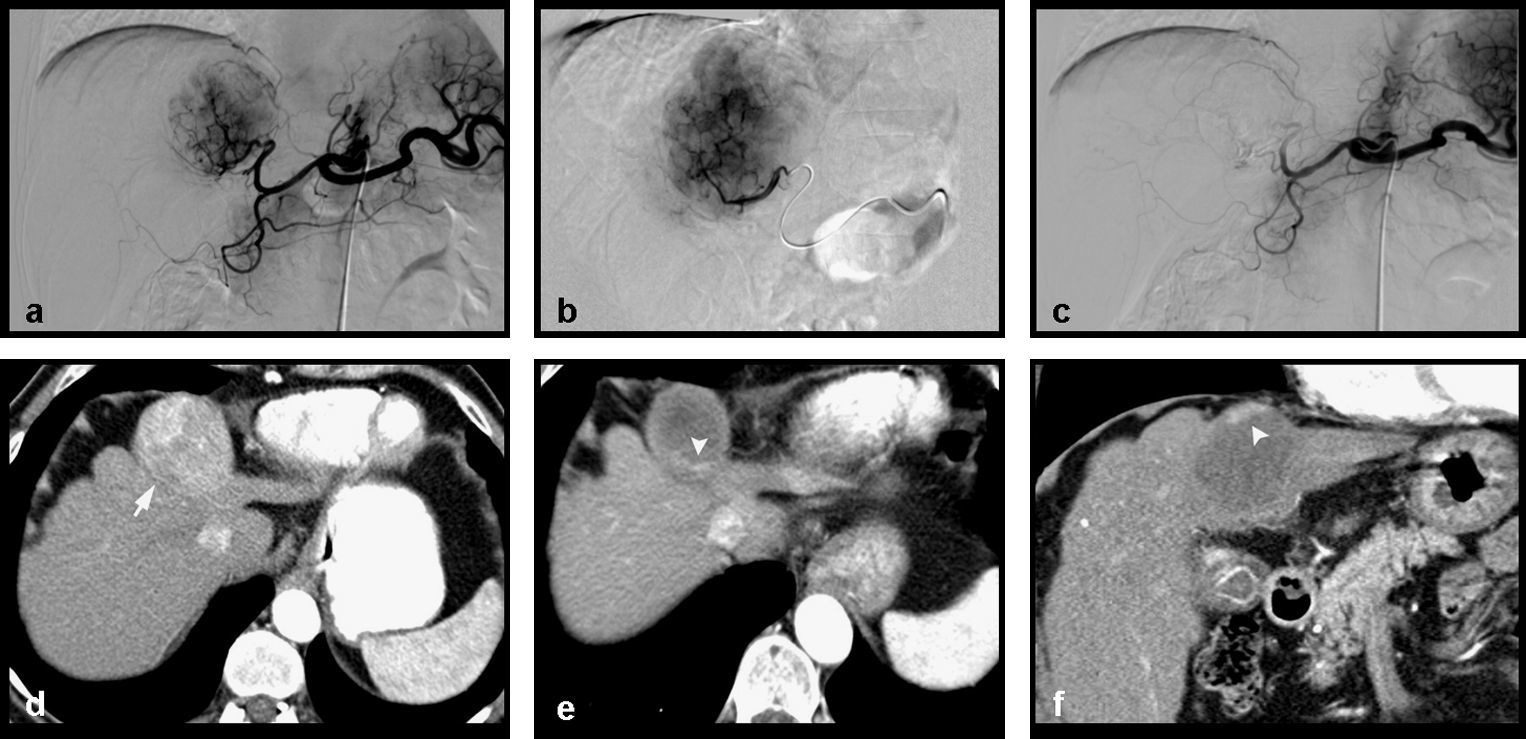
Paciente mujer de 64 años con cirrosis hepática por VHC y CHC multinodular. Tratamiento mediante QME con partículas de PVA cargadas con doxorubicina. a) La arteriografía selectiva de tronco celíaco muestra múltiples nódulos hipervasculares compatibles con CHC de predominio en el lóbulo hepático derecho. b) Estudio superselectivo con microcatéter en el que se observan los 2 nódulos de mayor tamaño así como otros nódulos adicionales de tamaño no superior a 1cm. c) Angiografía postembolización de arterias nutricias tumorales del lóbulo hepático derecho que muestra devascularización tumoral; se visualizan 2 nódulos adicionales infracentimétricos en lóbulo hepático izquierdo (flecha); arteria gástrica izquierda accesoria originada de la hepática izquierda (punta de flecha). d) Angiografía final que muestra devascularización tumoral completa tras la quimioembolización de ambos lóbulos hepáticos en una única sesión.
El tratamiento debe ser lo más selectivo posible, mediante la utilización de microcatéteres, intentando evitar la embolización total del hígado. Habitualmente, los agentes quimioterápicos se administran emulsionados en lipiodol, un contraste yodado liposoluble que queda retenido a nivel de las células tumorales39. La emulsión del agente quimioterápico en lipiodol tiene como objetivo aumentar selectivamente la fijación del mismo en el tumor (fig. 5). Una vez administrado el quimioterápico se realizará la oclusión de las arterias tumorales.
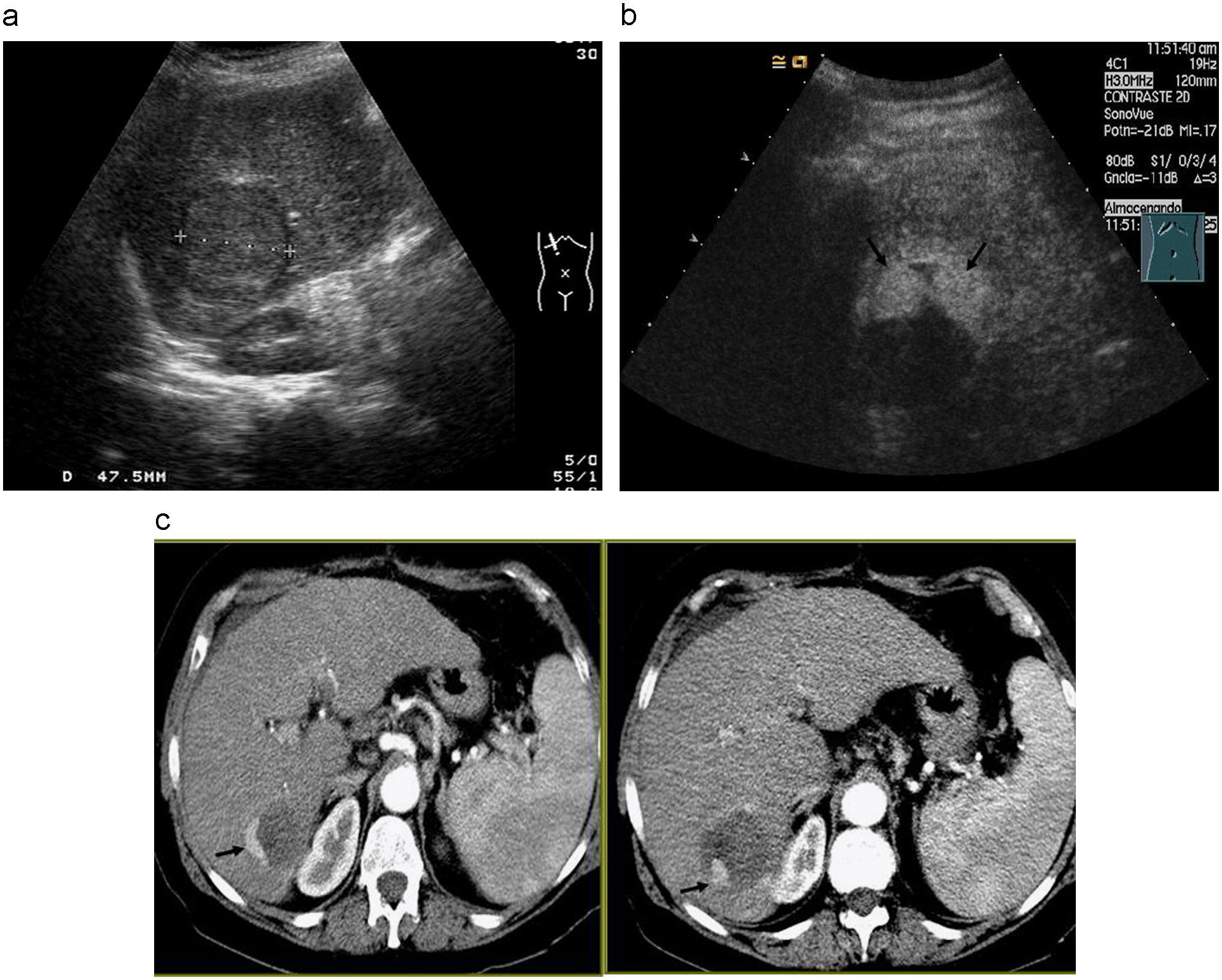
Paciente mujer de 74 años con cirrosis hepática por VHC y CHC binodular. Tratamiento mediante quimioembolización (QME) con doxorubicina-lipiodol y espongostan. a, b) La arteriografía de tronco celíaco muestra una gran lesión hipervascular correspondiente al CHC principal en el lóbulo hepático derecho. Existe un segundo nódulo hipervascular correspondiente a CHC adicional en la cúpula hepática (flecha). c) Angiografía superselectiva con microcatéter desde la arteria nutricia tumoral del nódulo de mayor tamaño, previa a quimioembolización. d, e) La TC postratamiento muestra acúmulo de lipiodol en ambas lesiones tratadas con quimioembolización con opacificación de radicales porta adyacentes a la lesión (punta de flecha).
Los fármacos mas utilizados en la QME hepática son la adriamicina y el cisplatino40. La dosis del fármaco debe ajustarse a la función hepática del paciente.
La oclusión de las arterias tumorales se realiza mediante la inyección, bajo control fluoroscópico, de diferentes materiales de embolización. Los materiales más utilizados a nivel hepático son la esponja de fibrina (Espongostan®) y las partículas de alcohol de polivinilo (PVA)40–42. El Espongostan® está considerado un material reabsorbible y se administra en forma de partículas de 1mm cortadas manualmente. El alcohol de polivinilo (PVA) es un material de embolización no reabsorbible que provoca una oclusión vascular permanente. Se presenta en forma de partículas calibradas y envasadas en función de su tamaño, que oscila entre 50 y 2.000 micras. El tamaño de las partículas recomendado en la embolización hepática es superior a 300μm. En caso de embolizaciones supraselectivas de las arterias nutricias del tumor pueden utilizarse partículas de menor tamaño.
En los últimos años, con el objetivo de optimizar la liberación de las drogas citostáticas en el tumor, se han desarrollado unas partículas de embolización capaces de cargar el fármaco citostático en su interior y liberarlo de forma controlada a nivel del tumor. Las partículas liberadoras de fármacos son micropartículas de embolización derivadas del PVA43. Estudios de experimentación han demostrado que la cantidad de droga citostática a nivel del tumor es significativamente mayor cuando se administra encapsulada con micropartículas en comparación con la administración de droga citostática directamente de forma intraarterial44.
La QME es un procedimiento generalmente bien tolerado, con un índice de complicaciones que oscila entre el 4,2 y el 10%; las complicaciones graves descritas incluyen el fallo hepático, la colecistitis isquémica y los abscesos hepáticos. La mortalidad a 30 días es inferior a un 4%. A pesar de la buena tolerancia, la mayoría de los pacientes tratados mediante EA o QME presentan el denominado síndrome post-embolización. Este consiste en un cuadro clínico transitorio caracterizado por dolor abdominal, náuseas y fiebre que se presenta con mayor o menor intensidad en el 50% de los pacientes45,46. El síndrome postembolización normalmente se autolimita en menos de 48h.
La eficacia de la EA asociada o no a quimioterapia ha sido demostrada, obteniéndose una tasa de respuestas objetivas que oscila entre el 15 y el 55%42. Estudios prospectivos han demostrado que la probabilidad de presentar progresión tumoral e invasión vascular es significativamente menor en los pacientes tratados mediante EA o QME que en el grupo control no tratado34,47.
El beneficio en términos de supervivencia de la QME se ha demostrado en 2 ensayos clínicos controlados y aleatorizados publicados en el año 2002 que comparan la EA/QME con un grupo control tratado de forma sintomática34,36. En uno de los estudios se identifica la respuesta al tratamiento como un predictor independiente de supervivencia.
Estos resultados fueron confirmados en un metanálisis acumulativo en el que se valoraron 6 ensayos clínicos controlados y aleatorizados (503 pacientes) que comparaban la EA/QME con un grupo control tratado sintomáticamente35. Los resultados globales demostraron una supervivencia significativamente más alta en el grupo de pacientes tratados que en el grupo control (41 vs. 27%). El metanálisis demostró una mejoría significativa de la supervivencia a 2 años a favor del tratamiento35. El principal inconveniente de este tratamiento es que, a pesar de la buena respuesta inicial, más del 50% de los pacientes presentan progresión de su enfermedad.
Existen aspectos de la QME que deben revisarse, como cuál es el mejor agente quimioterápico y el mejor agente embolizante, o cuál es la mejor pauta de tratamiento, ya que no existen estudios que comparen correctamente las diferentes opciones. Por otra parte, se debe investigar cómo actuar sobre la progresión tumoral después del tratamiento.
Uno de los aspectos que requiere especial atención es la aplicación de las nuevas partículas de embolización cargadas con fármacos. La respuesta tumoral evaluada en los ensayos clínicos publicados recientemente ha sido cercana al 80% (figs. 6–8), aparentemente superior a la obtenida con la QME con lipiodol48–51. Por otra parte se observa una mejor tolerancia al procedimiento52 con una baja tasa de efectos colaterales sistémicos secundaria al escaso paso de fármaco a circulación sistémica, tal y como se refleja en el estudio farmacocinético50,51.
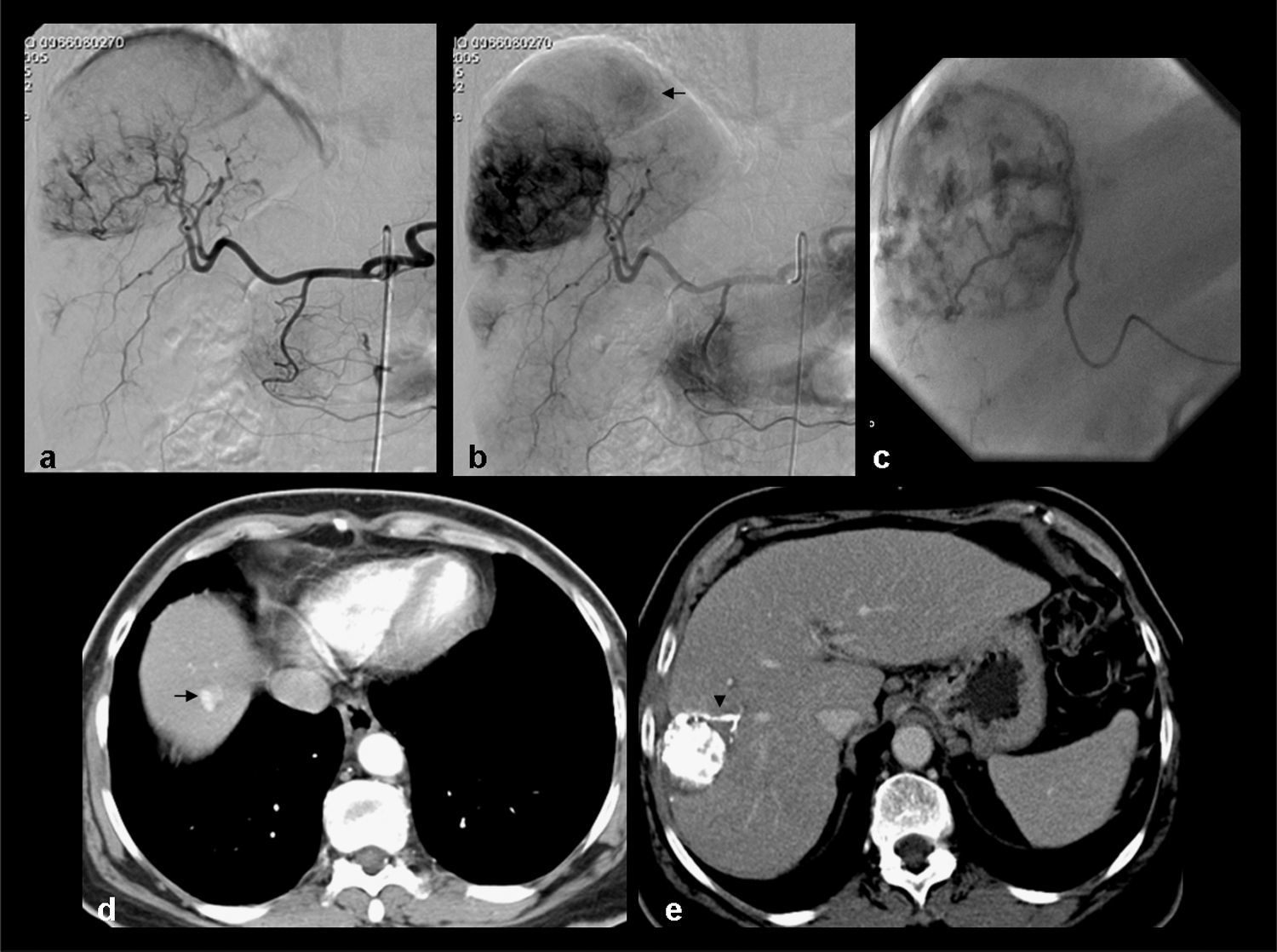
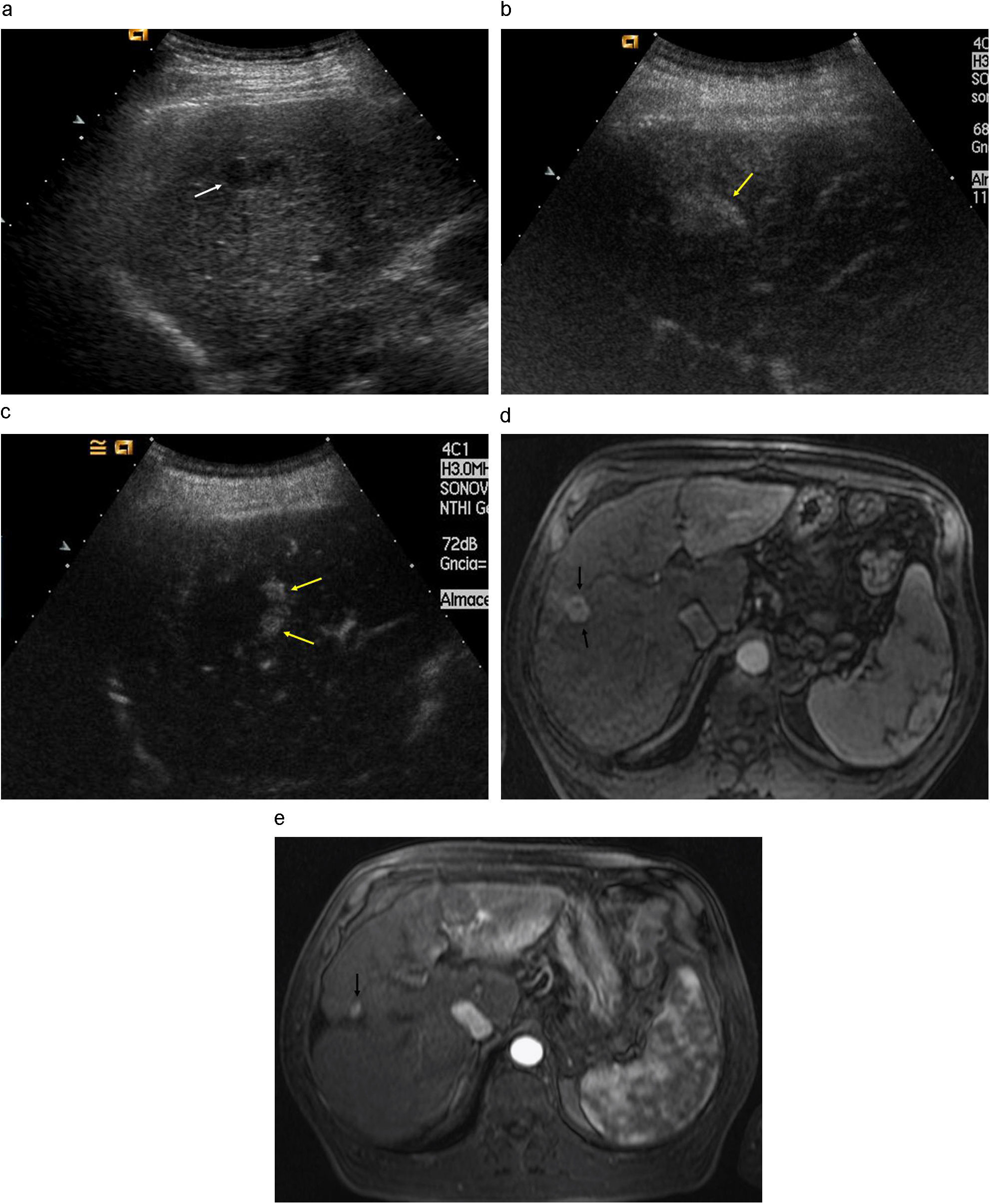
Paciente varón de 61 años con cirrosis hepática por VHC y CHC uninodular de 60mm. Tratamiento mediante QME con partículas de PVA cargadas con doxorubicina. a, b) Arteriografía de tronco celíaco y selectiva hepática que muestran una arteria nutricia tumoral que vasculariza la lesión situada en cúpula hepática (flecha). c) Estudio angiográfico superselectivo con microcatéter desde la arteria nutricia tumoral. d, e) Las angiografías posquimioembolización muestran una devascularización tumoral completa.
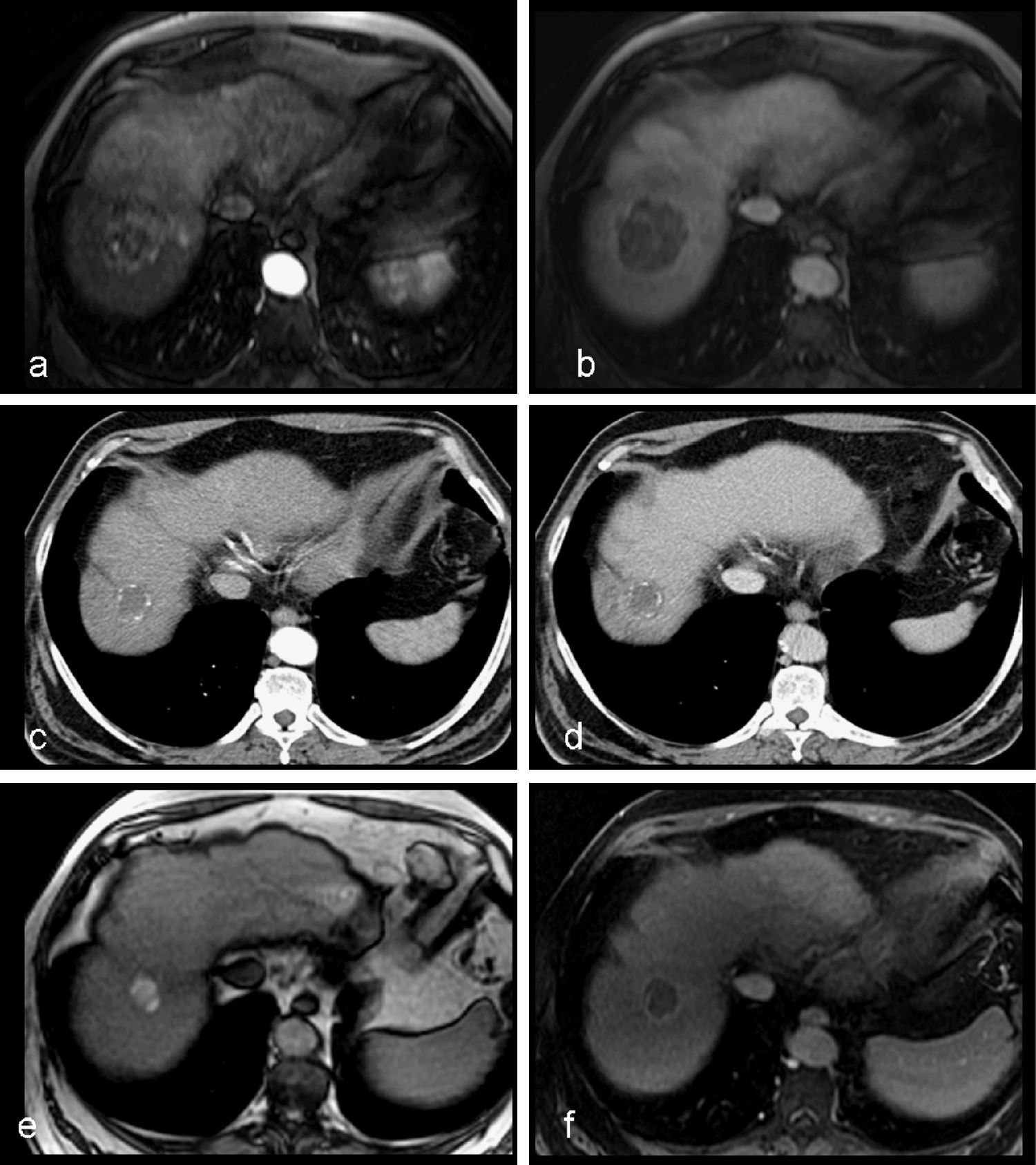
Estudios pre y postratamiento correspondientes al paciente de la figura 6. Paciente varón de 61 años con cirrosis hepática por VHC y CHC uninodular de 60mm. a, b) Estudio RM dinámico pretratamiento: secuencias de RM T1 tras la administración de contraste iv en fase arterial (fig. 7a) y tardía (fig. 7b) que muestra una lesión hipervascular en la fase arterial con lavado en la fase portal, correspondiente a CHC situado en la cupula hepatica. c, d) TC de control en fase arterial (fig. 7c) y tardía (fig. 7d) al año de la embolizacion en el que se observa reducción del tamaño de la lesion, presencia de finas calcificaciones periféricas y ausencia de captación de contraste, en relación a respuesta completa. e, f) Estudio RM a los 3 años, observándose hiperseñal de la lesión en las secuencias T1 sin contraste iv (fig. 7e) (necrosis coagulativa), y una captación periférica fina tras la administración de contraste (fig. 7f) persistiendo la respuesta completa de la lesión tratada.
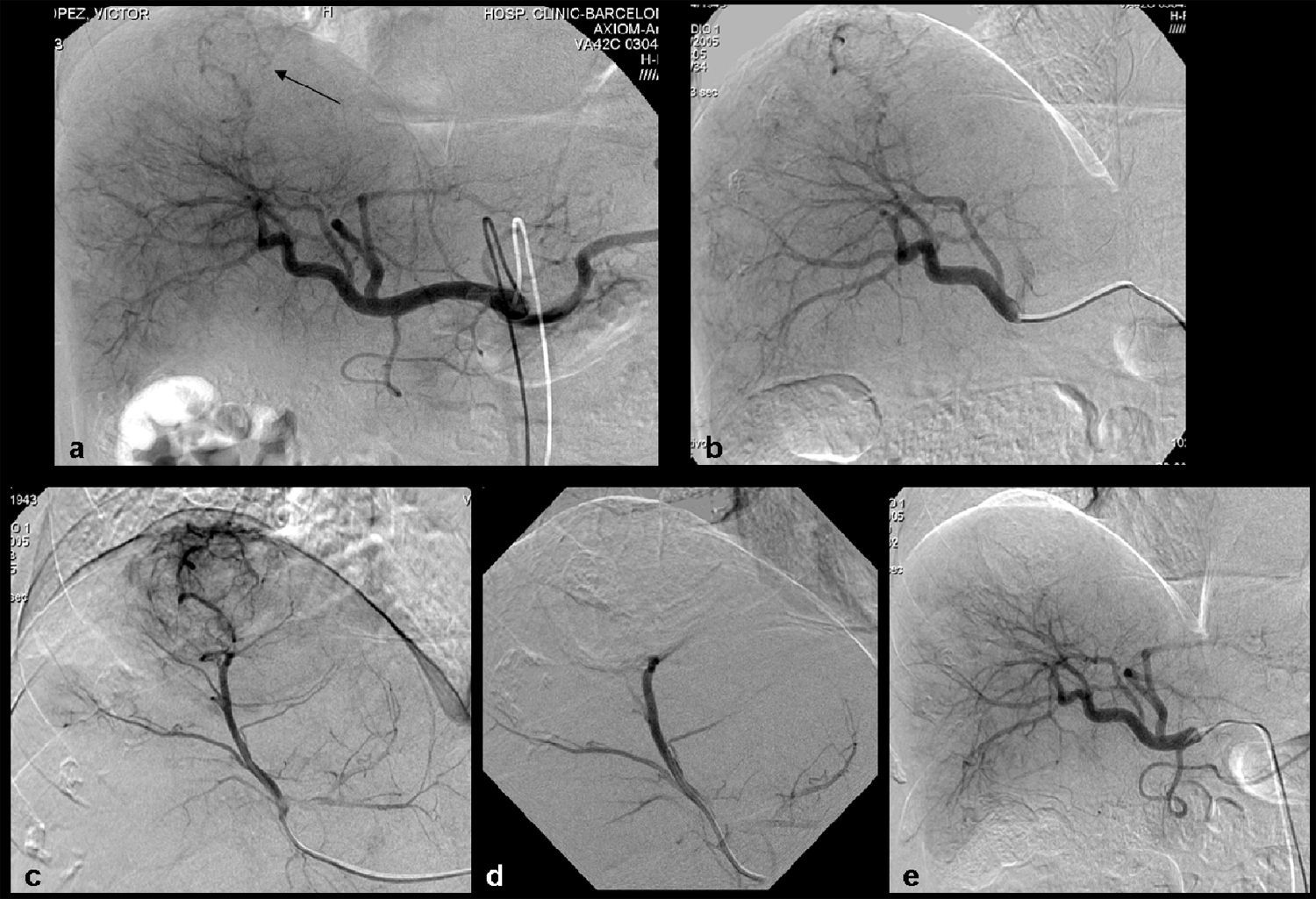
Paciente varón de 71 años con cirrosis hepática por VHC y CHC uninodular en la cúpular del lóbulo hepático izquierdo. Tratamiento QME con partículas de PVA cargadas con doxorubicina. a) Estudio angiográfico del tronco celíaco que muestra lesión hipervascular única correspondiente a CHC. b) Estudio angiográfico superselectivo con microcatéter de la arteria nutricia de la tumoración. c) Angiografía postembolización que muestra devascularización total de la lesión tumoral. d) TC en fase arterial pretratamiento que muestra hepatocarcinoma de 6cm de diámetro en la cúpula del lóbulo hepático izquierdo (flecha). e, f) En la TC de control a los 6 meses postratamiento con QME se identifica un área de extensa necrosis intratumoral con una zona de captación periférica en forma de semiluna correspondiente a restos tumorales, clasificada como respuesta parcial (puntas de flecha).
Finalmente, para actuar sobre la progresión tumoral después de la QME, los resultados positivos del Sorafenib® en el CHC avanzado y su acción (fundamentalmente antiangiogénica) han sentado las bases racionales para evaluarlo como tratamiento adyuvante tras la realización de la QME en CHC intermedio53.
Tratamientos locorregionales combinadosEntre los factores que determinan la respuesta al tratamiento con RF se incluye la dispersión calórica, que aumenta cuanto mayor es el tamaño tumoral, y su vascularización. Esta es una de las bases racionales para la realización de una quimioembolización previa al tratamiento con RF. Por una parte, la lesión hipóxica inducida por la embolización aumentaría la sensibilidad de las células tumorales al efecto hipertérmico de la radiofrecuencia. Por otra parte, la reducción del flujo vascular disminuiría la dispersión de calor, permitiendo así aumentar el área de necrosis coagulativa obtenida con la radiofrecuencia. Las series publicadas reportan tasas de respuesta completa del 60–70% para tumores de tamaño comprendido entre 30 y 80mm y del 100% para tumores de entre 30 y 50mm25,54,55. Sin embargo, no existen estudios aleatorizados y controlados que comparen la radiofrecuencia con el tratamiento combinado de radiofrecuencia con quimioembolización.
Radioterapia intraarterialLa inyección intraarterial de radioisótopos permite dirigir la radiación específicamente a la zona tumoral y evitar los efectos adversos sistémicos de la radioterapia externa, que incluyen, fundamentalmente, la hepatitis actínica.
Los radioisótopos disponibles son el yodo131, ytrio90 (Y90) y rhenium188. El más utilizado es el Y90. El Y90 se administra fijado a micropartículas de cristal o de resina, que son mínimamente embolígenas quedando fijadas a nivel arteriolar. De este modo, el radioisótopo realiza su efecto local. El ytrio90 emite una radiación beta, que tiene un radio de acción de 2,5mm, lo que permite la preservación del parénquima hepático no tumoral circundante y no obliga al aislamiento del paciente. Su vida media es de 62h y se transforma a un isótopo inactivo (zirconio90).
La técnica debe realizarse en 2 fases, la planificación y el tratamiento. La planificación del tratamiento se realiza para evaluar la anatomía vascular hepática y tumoral y determinar así el emplazamiento óptimo del catéter para el tratamiento selectivo. En caso de observarse riesgo de reflujo del material radioactivo a arterias digestivas, estas se ocluyen proximalmente mediante espirales metálicos. La dosis de radioisótopo se determina en función del grado shunt pulmonar y del volumen hepático a tratar. En el cálculo de la dosis administrada debe tenerse en cuenta el tiempo de decaimiento del radiofármaco. En la fase del tratamiento, una vez obtenido el cateterismo selectivo y haber posicionado el catéter, se procede a la administración del radioisótopo.
Estudios en fase ii han demostrado la eficacia y seguridad de esta terapia locorregional en pacientes con CHC56. La hepatotoxicidad secundaria a la radiación se observa entre 4 y 8 semanas tras el tratamiento56. Los efectos adversos en pulmón y en tracto gastrointestinal son mínimos gracias a la planificación del tratamiento57.
Con este tratamiento se obtienen porcentajes de respuesta tumoral de hasta un 70% según criterios de respuesta EASL56,58 y diferencias significativas en términos de supervivencia en función del estadio tumoral y la enfermedad hepática subyacente58,59.
En conclusión, y según las recomendaciones del artículo de consenso nacional e internacional, la QME es el tratamiento de elección en sujetos asintomáticos, con función hepática conservada, que presentan un CHC multinodular, sin invasión vascular ni extrahepática. Otros tratamientos locorregionales, como la radioterapia intratumoral con ytrio90, han mostrado eficacia en estudios preliminares, recomendándose su evaluación en el contexto de ensayos clínicos.
Valoración de la respuesta terapéutica tras el tratamiento locorregionalLa evaluación radiológica de la respuesta terapéutica al tratamiento de los tumores es un aspecto crucial por las implicaciones pronósticas en la supervivencia del paciente, por lo que es necesario disponer de unos criterios reproducibles y aplicables a diferentes grupos de pacientes.
Los criterios Response Evaluation Criteria for Solid Tumors (RECIST) son ampliamente utilizados para el seguimiento y evaluación terapéutica en múltiples tumores sólidos60. Estos criterios de respuesta, estabilidad o progresión se basan en los cambios de tamaño que experimentan las lesiones tumorales y en la aparición de nuevas lesiones durante los controles sucesivos respecto al estudio pretratamiento.
La aplicación de los criterios RECIST en la valoración de la efectividad del tratamiento locorregional sobre el CHC puede ser controvertida ya que solo tiene en cuenta los cambios en las dimensiones de las lesiones.
En cambio, las guías de la European Association for the Study of the Liver (EASL) proponen que la evaluación de la respuesta tumoral al tratamiento locorregional debe valorar la reducción de CHC viable61, ya que el criterio anatomopatológico de efectividad al tratamiento del CHC es la necrosis tumoral, reconocida como área intratumoral sin captación de contraste intravenoso en las técnicas de imagen62. La enfermedad residual se define como la persistencia de áreas de hipercaptación tumoral en el primer estudio de imagen tras el tratamiento, mientras que la recurrencia postratamiento se define como la aparición de un nuevo foco de hipercaptación tumoral tras la constatación inicial por estudios de imagen de respuesta completa63.
Hallazgos tras el tratamiento ablativoEl objetivo del seguimiento del CHC tratado por ablación mediante técnicas de imagen es la detección precoz de restos tumorales viables. Tanto la TC, RM o ecografía con contraste han demostrado un rendimiento similar para la evaluación terapéutica del CHC64–66 (figs. 9–11).
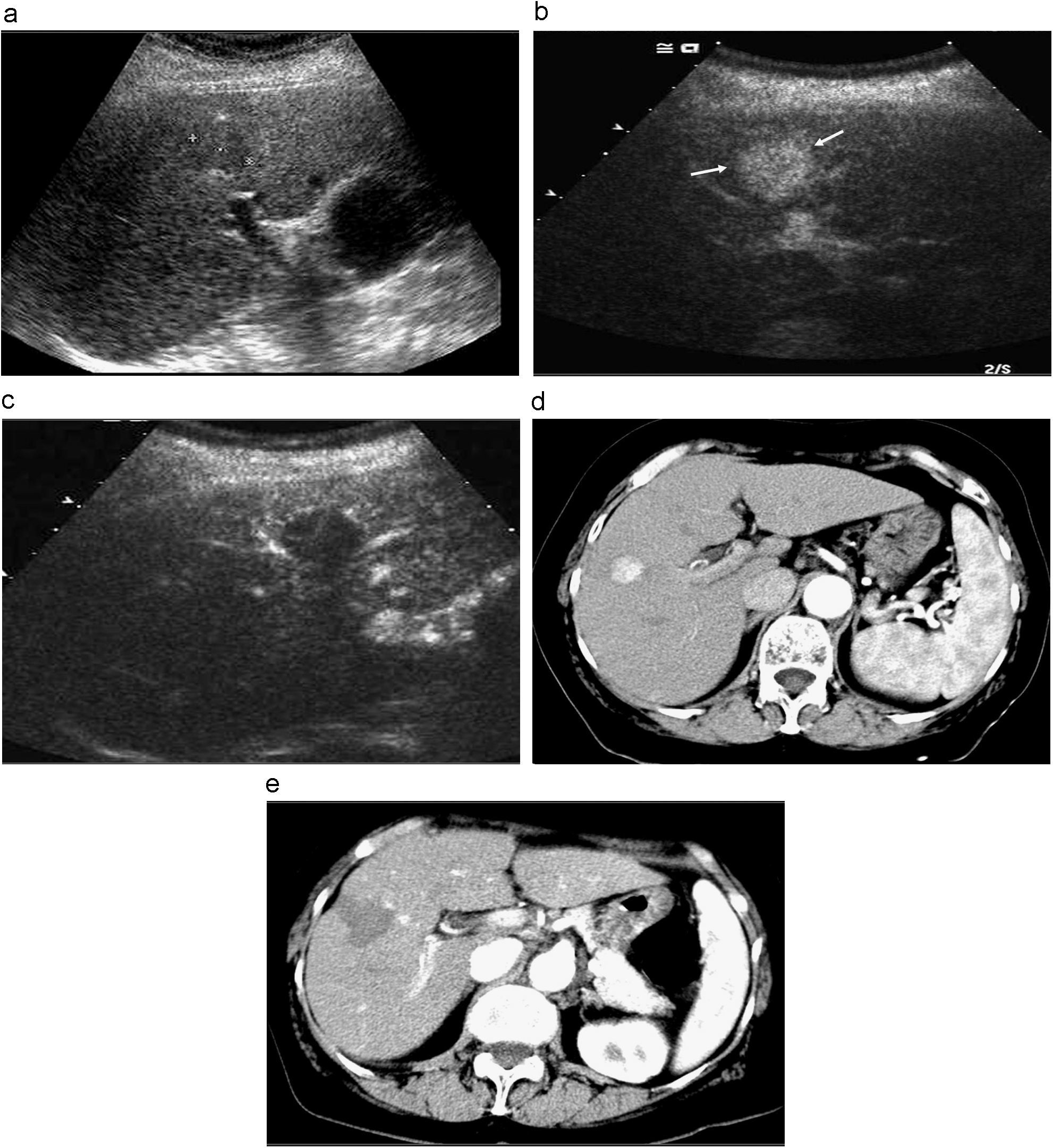
Valoración de la eficacia de la RF mediante ecografia con contraste (USC) y tomografía computarizada (TC). a) CHC de 4,7cm de diámetro en el lóbulo derecho hepático. b) Control de la eficacia del tratamiento mediante USC 1 mes depués del tratamiento, donde se aprecian captaciones periféricas que corresponden a persistencia de tumor viable (flechas), con la parte posterior del tumor, no captante, necrosada. c) Secciones de TC en fase arterial, donde se observan las mismas captaciones detectadas en la USC.
Valoración de la eficacia de la RF mediante ecografia con contraste (USC) y resonancia magnética (RM). a) CHC de 2cm de diámetro en el lóbulo derecho hepático (flecha). b) Captación completa del tumor en la USC (flecha). c) Control de la eficacia del tratamiento mediante USC 1 año depués de la RF, donde se aprecian captaciones nodulares en la periferia del tumor necrosado, que corresponden a persistencia de tumor viable (flechas). d) RM en fase arterial donde se visualiza la lesión nodular hipercaptante, antes de ser tratada con RF (flechas). e) RM en fase arterial, 1 año después del tratamiento, donde se aprecia una cicatriz y retracción capsular, el nódulo necrosado y captación nodular coincidente con la detectada en la USC (flecha).
Paciente con cirrosis hepática por VHC. En el transcurso de seguimiento mediante ecografía semestral se detectó nódulo hepático, diagnosticado de CHC mediante biopsia. La lesión se consideró tributaria de tratamiento con RF. a) En la ecografía basal se observa lesión hipoecoica de 2cm en el lóbulo hepático derecho. b) Tras administrar contraste ecográfico se observó captación nodular completa en la fase arterial (flechas). c) El control mediante ecografía con contraste, realizada un mes postratamiento, muestra los vasos arteriales adyacentes, sin captaciones patológicas en el interior del tumor. d) La TC en fase arterial, antes del tratamiento muestra el nódulo hipervascular en el lóbulo derecho hepático. e) La TC efectuada 1 mes después del tratamiento es coincidente con la ecografía con contraste, mostrando una necrosis completa del tumor.
La ausencia de captación de contraste intravenoso es el hallazgo que traduce la existencia de la necrosis coagulativa tumoral, y esta suele aparecer a las 24–36h postablación61. La región con necrosis coagulativa puede presentarse como un área de hiperatenuación en las fases basales tanto de la TC como en las secuencias T1 de la RM. En contraposición, la persistencia de tumor residual o recurrencia tumoral suele presentarse en forma de captación nodular en la periferia de la lesión o bien como la aparición de un halo de captación de contraste grueso e irregular en la periferia de la zona de ablación (figs. 9 y 10). La zona de necrosis puede disminuir lentamente de tamaño o bien quedarse estable a lo largo del tiempo67. El aumento de tamaño de la zona de ablación en el seguimiento evolutivo es muy sospechoso de recidiva tumoral, aunque este hallazgo aislado es poco frecuente.
La aparición de un halo de captación de contraste es un fenómeno transitorio secundario a cambios inflamatorios y de hiperemia, que suele desaparecer antes de los 6 meses. Su grosor no suele superar los 1–2mm, lo que permite diferenciarlo en la mayoría de ocasiones de la recidiva o recurrencia en forma de halo68.
No hay un consenso uniforme establecido sobre los intervalos de seguimiento postratamiento. Muchos grupos realizan el primer estudio al mes y posteriormente cada 3–6 meses para detectar posibles recidivas.
Hallazgos tras la quimioembolización arterialLa ausencia de captación de medio de contraste intravenoso tras la EA es indicativo de la aparición de áreas de necrosis intratumoral, mientras que la captación intratumoral de contraste debe ser considerada como zonas de tumor viable69,70 (figs. 7 y 8).
El acúmulo de aceites iodados transportadores de los agentes quimioterápicos (como el lipiodol) son un limitante en la detección de zonas de tumor residual viable por TC ya que pueden enmascarar focos de hipercaptación (fig. 5). En estas situaciones, la evaluación de los CHC mediante RM o ecografía con contraste puede ser especialmente útil ya que el acúmulo de los aceites no interfiere en la imagen obtenida en ambas modalidades71,72. Hay poca información sobre el potencial beneficio que puede aportar el uso de secuencias de difusión para la detección precoz de restos tumorales71.
En la mayoría de grupos el primer control postembolización suele realizarse por TC o RM a las 4 semanas tras el tratamiento y posteriormente cada 3–4 meses.
Hallazgos tras la radioembolizaciónLa evaluación de la respuesta al tratamiento con ytrio90(y90) en CHC no resecable está poco investigada y pocos grupos lo aplican de forma protocolizada. Los fenómenos de necrosis, hemorragia y edema pueden aumentar transitoriamente el tamaño de los tumores que responden al tratamiento73. El hallazgo que permite una mejor evaluación de la respuesta terapéutica a la radioembolización es la disminución en la captación de contraste intratumoral. Tras el tratamiento con Y90, la ausencia de captación de contraste en la TC o RM se ha asociado a una necrosis total del tumor, mientras que la identificación de una captación periférica nodular o zonas de aspecto sólido en su interior se han asociado con un alto índice de persistencia de restos tumorales viables59,73. La captación periférica de contraste puede persistir más allá de los 6 meses y se ha asociado a una respuesta completa59.
AutoríaM. Isabel Real: diseño del trabajo. Redacción de parte del capítulo, revisión critica y coordinación del mismo.
El resto de autores: Obtención de datos, diseño y redacción de parte del trabajo.
Los autores han leído y aprueban la versión final del documento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.