La L-asparraginasa es un inhibidor enzimático de la síntesis de proteínas que, en combinación con otros quimioterápicos, se utiliza en el tratamiento de la leucemia linfoblástica aguda (LLA). Causa deficiencia en plasma de proteínas implicadas en la coagulación y fibrinólisis, dando lugar a un equilibrio alterado entre anticoagulación y coagulación, lo que en el sistema nervioso central (SNC) se muestra radiológicamente como lesiones isquémico-hemorrágicas y trombóticas.
Se presenta el caso de una niña de 6 años con LLA tipo B en tratamiento de inducción de remisión con protocolo Pethema LLA RIA/96, obteniendo remisión completa en el día +14. La L-asparraginasa se administró intramuscular en tandas de 3 días consecutivos separados por un intervalo de una semana, hasta 9 dosis. La paciente presentó complicación súbita en el día +29 de la inducción, tras la administración de la 9ª dosis de L-asparraginasa, consistiendo el cuadro neurológico en una crisis comicial parcial y relajación de esfínteres.
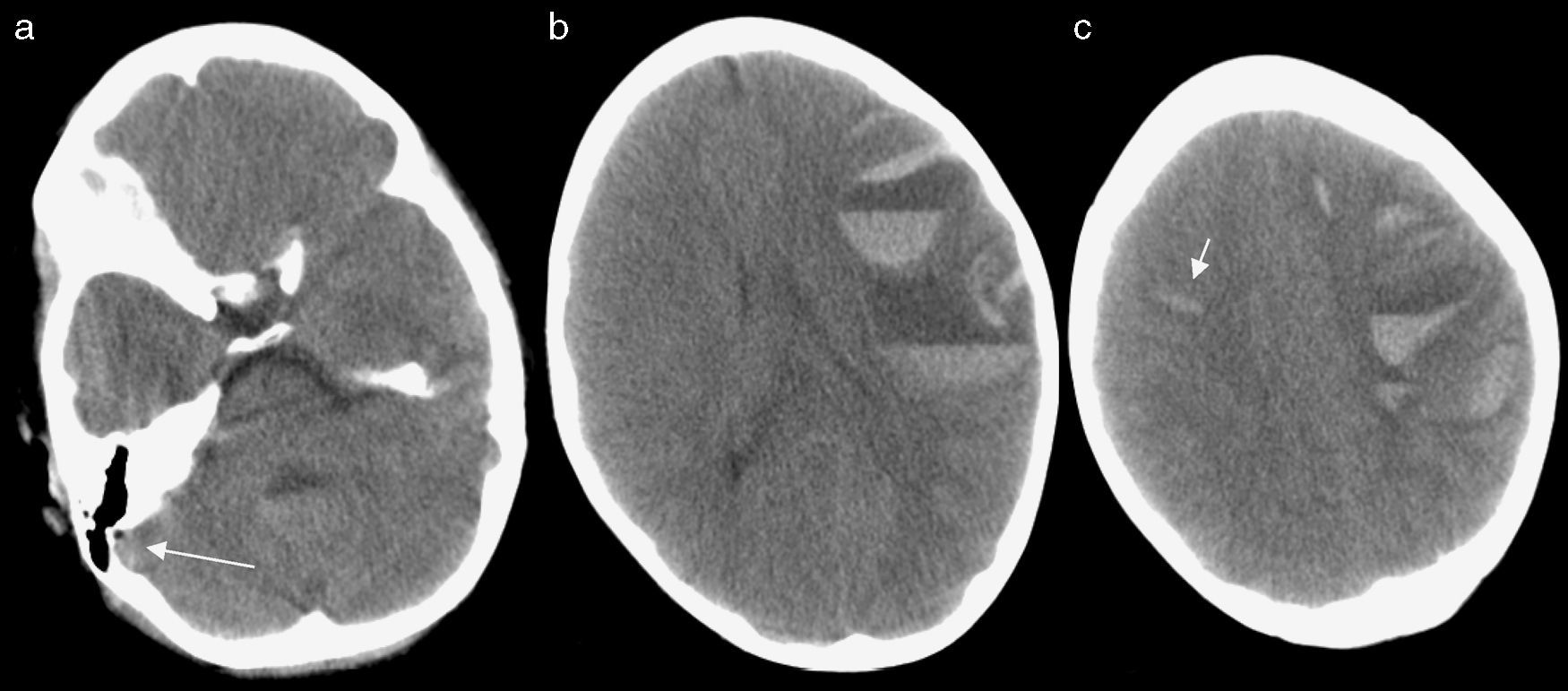
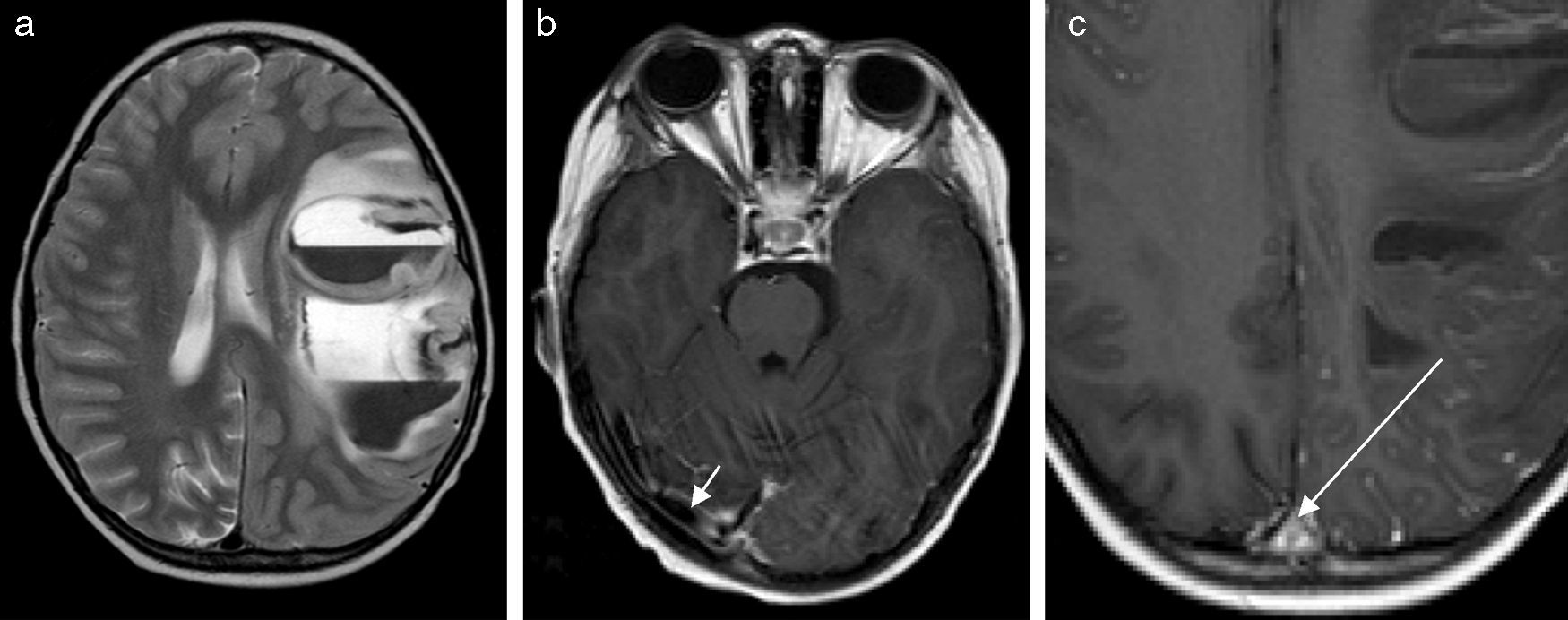
Se realizó una TC de urgencias (fig. 1) en la que se observó una hemorragia extensa hemisférica izquierda y de pequeño tamaño contralateral. Ya se planteó la posibilidad de trombosis venosa en el contexto de la paciente con enfermedad hematológica y tratamiento con L-asparraginasa. Posteriormente se realizó RM en menos de 24 horas tras el episodio (fig. 2), que profundizó en los datos sobre el evento hemorrágico supratentorial agudo, el desarrollo de edema y herniación y la confirmación de trombosis de senos venosos y venas corticales (causantes de las hemorragias parenquimatosas múltiples en territorios no vasculares).
TC sin contraste realizado de urgencias. Aumento de densidad del seno sigmoideo derecho sugerente de trombosis, trombo fresco (flecha larga), teniendo en cuenta el contexto descrito de la paciente, dado que la hiperatenuación de los senos venosos en los pacientes pediátricos puede ser un hallazgo sin significación patológica debido al mayor hematocrito relativo que presentan habitualmente (a). Hematoma agudo fronto-parietal izquierdo grande, con niveles correspondientes a sangrado en distintos estadios de evolución, hiperagudo superior y agudo inferior (b), junto a pequeño sangrado parenquimatoso subcortical frontal derecho (flecha corta) (c). Discreta compresión ventricular lateral izquierda y edema parenquimatoso generalizado, preferentemente hemisférico izquierdo (b, c).
Estudio de RM realizado a las 24 horas del episodio clínico. a) RM en plano axial secuencias TSE T2. Se identifica con mayor precisión el gran hematoma hemisférico izquierdo con niveles líquido-líquido que incluyen sangre con señal correspondiente a oxihemoglobina en la porción superior-hiperintensa T2 –sangrado hiperagudo– y deoxihemoglobina en la inferior-hipointensa T2 –sangrado agudo–. Borramiento de surcos hemisféricos izquierdos y efecto masa sobre el ventrículo homolateral, con mínima desviación de línea media. Discreto edema perilesional. b, c) Secuencias SE T1 con contraste paramagnético en plano axial, muestran la ausencia de relleno del seno transverso derecho por trombosis venosa aguda (flecha corta) y el defecto de repleción central puntiforme en el seno sagital superior (flecha larga), que aunque puede ser un simulador, en el contexto descrito sugiere trombosis parcial confirmada posteriormente.
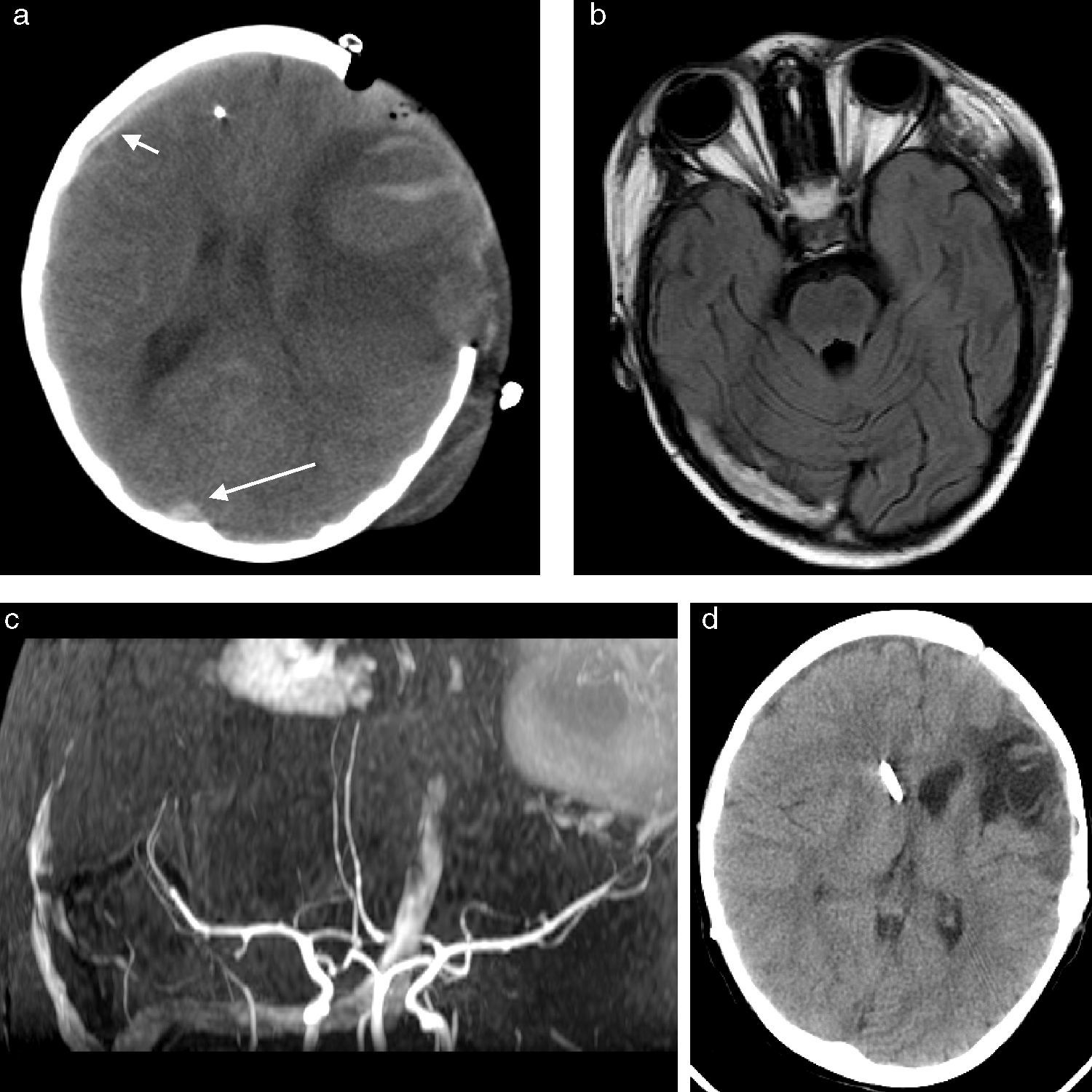
El seguimiento (fig. 3) realizado a lo largo de 10 meses mostró el tratamiento de las lesiones cerebrales y la evolución de las mismas.
Estudios de seguimiento. a) TC sin contraste a los 10 días del episodio. Aumento de densidad del seno longitudinal superior por trombosis (flecha larga). Craniectomía descompresiva frontal izquierda. Sangrado parenquimatoso izquierdo en evolución, con menor desplazamiento de línea media subfalcina y menor compresión ventricular homolateral. Extremo del sensor de presión intracraneal (PIC) frontal derecho que desarrolló tras su colocación, en el contexto de alteración de la coagulación, una colección subdural laminar homolateral (flecha corta). b) RM a los 15 días, plano axial secuencia FLAIR, visualización de trombosis en seno transverso derecho con hiperintensidad y aumento de calibre del mismo. c) Angiografía-RM de polígono de Willis, reconstrucción en plano coronal, visualización de la trombosis del tercio inferior del seno sagital superior, seno trasverso, seno sigmoideo y vena de Labbé derechos (se identifica el hematoma hemisférico izquierdo). d) TC sin contraste 10 meses después del episodio. Plastia ósea izquierda. Evolución lesional con área de poroencefalia fronto-parietal izquierda que provoca tracción del ventrículo. Válvula de derivación ventrículo peritoneal cuyo extremo craneal se sitúa profundo en el asta frontal derecha. Mínima colección subdural hemisférica derecha hipodensa, evolucionada.
La L-asparraginasa es un agente quimioterapéutico obtenido de diferentes cepas de Escherichia coli y Erwinia chrysanthemi1. Se incluye en los protocolos de tratamiento para LLA y en algunas fases del protocolo del linfoma no Hodgkin. En la LLA se usa en la inducción de la remisión, la reinducción y el mantenimiento con refuerzo2.
Las complicaciones vasculares sistémicas incluyen trombosis venosa sistémica y embolismo pulmonar, pero la gran mayoría de estas complicaciones competen al SNC; aproximadamente un 1-2% de los pacientes tratados con L-asparraginasa desarrollan patología hemorrágica o isquémica en el SNC, asociada o no a la oclusión de los senos venosos2,3.
El proceso específico por el que la L-asparraginasa induce la coagulopatía no está definido2, se han propuesto tanto mecanismos de inhibición de la producción, como de inactivación periférica de factores de coagulación. El resultado es el desequilibrio entre el sistema procoagulante y el anticoagulante y es necesario mantener un equilibrio que evite las complicaciones de trombosis y hemorragia secundarias. El déficit transitorio de proteína S inducido por la L-asparraginasa también se ha constatado como uno de los factores causantes de trombosis1.
Al efecto trombótico de la L-asparraginasa puede sumarse la invasión directa tumoral de los senos venosos y el estado de hipercoagulabilidad asociado a la patología hematológica, que aumentan la susceptibilidad a las lesiones por oclusión vascular1.
En estos pacientes seriamente afectados por su enfermedad hematológica basal y que reciben tratamiento con otros fármacos adyuvantes (por ejemplo, glucocorticoides, que potencian el efecto coagulopático), a veces es difícil atribuir la hemorragia únicamente a la L-asparraginasa2,4. Además, en pacientes en tratamiento por LLA puede presentarse un amplio espectro de complicaciones del SNC distintas a las mencionadas en esta comunicación.
Parece existir relación entre el desarrollo de complicaciones vasculares neurológicas y la cuantía de dosis de L-asparraginasa administrada, de modo que los protocolos intensos en los que se reciben mayores dosis tienen mayor tendencia a complicarse y a desarrollar patología vascular1.
La clínica es similar en los pacientes que sufren trombosis o hemorragia y consiste en sintomatología neurológica que puede ser inespecífica, al igual que puede presentarse en el contexto de una infiltración leucémica leptomeníngea, como complicación de la quimioterapia intratecal o tras la irradiación craneal.
El periodo de desarrollo de lesiones cerebrovasculares se sitúa entre los días 4 y 49 tras la administración de la L-asparraginasa. Las complicaciones hemorrágicas tienden a desarrollarse más tempranamente que las trombóticas. La trombosis de senos puede ir o no acompañada de lesión parenquimatosa subyacente, hemorrágica o no hemorrágica, dependiendo de la suma de trombosis de venas corticales2,3.
Una complicación como la descrita contraindica el uso de L-asparraginasa para siempre en ese paciente2. La evolución de las complicaciones cerebrovasculares asociadas a la L-asparraginasa generalmente es favorable, sólo algunos casos de curso fatal han sido publicados2.
En conclusión, la realización precoz del estudio de RM del SNC en el contexto de un paciente con clínica neurológica en tratamiento para la LLA es crítica, incluso en los casos en que los síntomas neurológicos no sean definitivos2,4. La RM basal craneal incluyendo secuencias potenciadas en difusión, eco de gradiente y estudio angiográfico venoso RM, junto a las nuevas técnicas de RM para la valoración venosa como la venografía phase contrast y las secuencias de susceptibilidad magnética (SWI)5, son de gran utilidad en la caracterización temprana de la patología cerebrovascular en pacientes con LLA, tratamiento con L-asparraginasa y signos y síntomas neurológicos incipientes.