Los tumores de la vía biliar son lesiones benignas o malignas que pueden asociarse a factores de riesgo o a lesiones con potencial de malignización. Constituyen un grupo heterogéneo de entidades con diferente comportamiento biológico y pronóstico dependiendo de su localización y del tipo de crecimiento. En este artículo revisamos el papel del radiólogo para detectar, caracterizar y estadificar estos tumores y, sobre todo, la importancia de clasificarlos para planificar el manejo y el tratamiento.
Bile duct tumors are benign or malignant lesions which may be associated to risk factors or potentially malignant lesions. They constitute an heterogenous entities group with a different biological behavior and prognosis according to location and growth pattern. We revise the role of the radiologist in order to detect, characterize and stage these tumors, specially the importance of their classification when deciding an appropriate management and treatment.
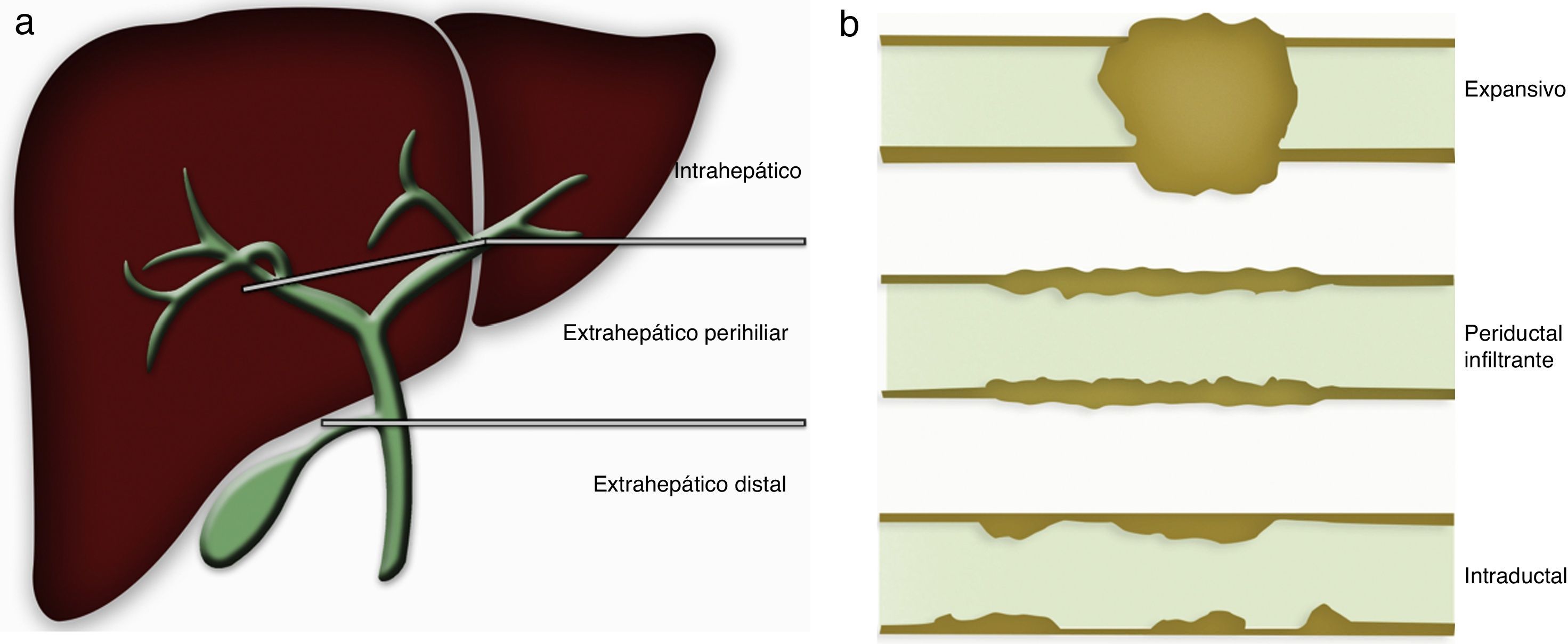
Los tumores de la vía biliar se originan en el epitelio de cualquier segmento de los conductos biliares, desde los pequeños conductos intrahepáticos hasta el colédoco1, y se clasifican en diversos tipos anatomopatológicos: benignos, premalignos y malignos, o colangiocarcinoma (CC), de localización intra y extrahepática2. La localización anatómica y el tipo de crecimiento morfológico (fig. 1) permiten clasificarlos en varios grupos con diferentes pronósticos, que requieren estrategias terapéuticas específicas. La confluencia de los conductos biliares secundarios marca el límite entre los tumores intrahepáticos y extrahepáticos, y la unión del conducto cístico al hepático común divide a los tumores extrahepáticos en perihiliares y distales2–4.
Por el tipo de crecimiento morfológico se consideran 4 grupos: expansivo, periductal-infiltrante e intraductal, o mixto si coexisten 2 de ellos5–7. La presentación clínica es variable, poco específica y generalmente tardía, en la que predominan los signos de obstrucción biliar en los tumores extrahepáticos, el dolor o pérdida de peso en los intrahepáticos, o aparecen como hallazgo incidental en pruebas de imagen5,8. No existen marcadores tumorales específicos. Pueden estar elevados el CA 19-9 (con una sensibilidad del 40-70% y una especificidad del 50-80%) y el CA-125 en los tumores malignos, en otros tumores o en colangiopatías inflamatorias, por lo que son útiles cuando se valoran junto a otras modalidades diagnósticas5,9. Por tanto, las técnicas de imagen son esenciales para detectar, caracterizar y clasificar estos tumores. No existe una técnica ideal que permita hacer una valoración global, por lo que generalmente se requieren varias modalidades de imagen que serán complementarias5.
En este artículo revisaremos el papel del radiólogo para detectar, caracterizar y estadificar estos tumores y, sobre todo, la importancia de la clasificación para planificar el manejo y el tratamiento.
Técnicas diagnósticasLa ecografía abdominal es la prueba inicial en pacientes con sospecha de obstrucción biliar por su alta disponibilidad. Es muy precisa para detectar la obstrucción y el nivel, pero limitada para detectar y caracterizar el tumor y determinar su extensión y resecabilidad10,11. No hay evidencia del papel del contraste ecográfico para detectar los tumores extrahepáticos, aunque puede ser relevante para distinguirlos del barro biliar12 o para la biopsia guiada de lesiones difíciles de ver. La tomografía computarizada multidetector (TCMD) multifásica tiene una gran resolución espacial y amplia cobertura, lo que la convierte en una excelente modalidad para detectar y estadificar los tumores biliares, tanto en la invasión vascular como en la diseminación a distancia10,13. Cuando se plantea la hepatectomía, permite calcular el volumen hepático con más facilidad y precisión que la resonancia magnética (RM)10. La RM es considerada como la mejor modalidad de imagen para estudiar los conductos biliares por su mayor resolución de contraste. Permite obtener información anatómica biliar, el nivel de la obstrucción, el tipo de crecimiento, las dimensiones tumorales, la extensión y la afectación vascular y ganglionar utilizando secuencias convencionales, colangiográficas, de difusión y con contrastes hepatobiliares3,9,10,13,14. Sin embargo, es inferior a la TCMD para detectar metástasis a distancia5. La aportación de la tomografía con emisión de positrones combinada con TC (PET-TC) para detectar CC es poca, y aunque puede ser útil para las metástasis15,16, su uso en la estadificación no está validado5.
La colangiopancreatografía retrógrada endoscópica (CPRE) ha perdido protagonismo frente a la RM para diferenciar las estenosis benignas de las malignas3,5 pero mantiene su papel para obtener la muestra anatomopatológica y colocar prótesis biliares paliativas17. La colangiografía transhepática percutánea es útil cuando la vía endoscópica es inaccesible10. La ecografía endoscópica con punción con aguja fina es recomendable cuando otras técnicas no son concluyentes, con sensibilidad del 53% y especificidad del 89% para diagnosticar el CC extrahepático17. Es más precisa para evaluar los ganglios que la TCMD o PET18. Otras técnicas, como la ecografía intraductal o la colangioscopia transpapilar, pueden aportar información relevante, la primera para detectar y estadificar el CC perihiliar, y la segunda para caracterizar la estenosis, detectar proyecciones vellosas, estenosis ulceradas o nódulos intraductales o para tomar biopsias, con sensibilidad y especificidad de 90% para diagnosticar el CC17.
En ocasiones puede ser necesaria la laparoscopia o la ecografía intraoperatoria para identificar si la lesión es irresecable4. La muestra anatomopatológica es fundamental para el diagnóstico cuando no está indicada la resección, por lo que la punción guiada por técnicas de imagen o técnicas invasivas puede desempeñar un papel importante5,10.
Factores de riesgoLa mayoría de los CC aparecen de forma esporádica, y son raros en pacientes menores de 40 años19. Tan solo un 30% se relacionan con factores de riesgo, que tienen en común la inflamación crónica de la vía biliar5,13. Entre los factores de riesgo establecidos, la colangitis esclerosante primaria (CEP) es el más frecuente en los países occidentales, con una prevalencia de 5-15%9. La duración de la enfermedad no es un factor determinante, y el intervalo medio entre el diagnóstico y la aparición de CC es de 2,5 años5,20. Aunque no existen recomendaciones para cribado, se debería investigar la existencia de un CC ante un empeoramiento clínico o analítico20,21. Otros factores reconocidos son los quistes de colédoco, con una incidencia del 6-30%22, las litiasis intrahepáticas21 o la infestación por parásitos hepatobiliares (Opisthorchis viverrini y Clonorchis sinensis), más frecuentes en Asia19. Hay otros factores de riesgo posibles, como la colangitis y la coledocolitiasis extrahepática19 o la cirrosis y las hepatitis virales crónicas (más la C que la B) en el CC intrahepático23.
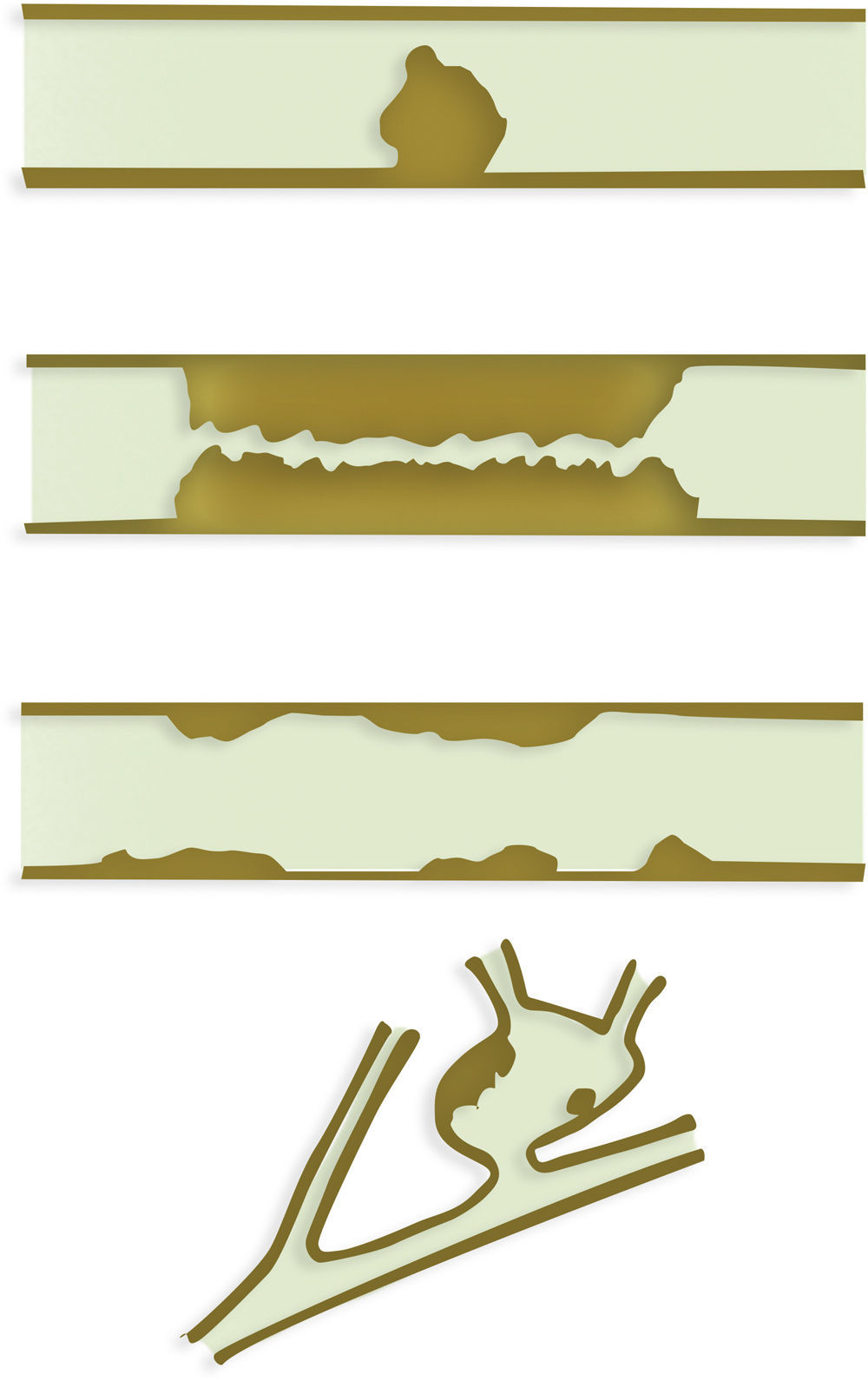
Enfermedades premalignasSe conocen 3 lesiones premalignas biliares: la neoplasia biliar intraepitelial, la neoplasia intraductal papilar de los conductos biliares y la neoplasia quística mucinosa o cistoadenoma5,24. La primera progresa a adenocarcinoma tubular y tiene carácter microscópico, por lo que no se diagnostica con imagen. La neoplasia papilar intraductal biliar incluye adenomas y tumores borderline y progresa hacia CC precoz (adenocarcinoma tubular o mucinoso), con mejor pronóstico que los carcinomas avanzados1,14. Crecen macroscópicamente dentro de la luz sin invadir la pared y se extienden superficialmente, por lo que pueden detectarse y caracterizarse con imagen. En muchos casos producen abundante mucina, que dilata difusamente los conductos biliares. Se han descrito 4 patrones de crecimiento (fig. 2): polipoideo, en forma de molde, superficial y quístico. Ningún estudio ha demostrado correlación entre los tipos de crecimiento, la localización, las características anatomopatológicas o la transformación en carcinoma invasivo24,25. Existen varios signos radiológicos que sugieren un crecimiento intraductal (fig. 3), como los nódulos o masas intraluminales, que suelen realzar más que el parénquima hepático, la ausencia de atrofia segmentaria y la multiplicidad de lesiones1,26. La dilatación biliar sin obstrucción completa se considera un hallazgo importante para diagnosticar estos tumores27. La RM con colangiografía tiene ventajas comparada con la TC y la colangiografía endoscópica27. Las imágenes de RM difusión pueden aportar información relevante tanto para distinguir las lesiones papilares de la bilis como para establecer la invasión tumoral27. Para determinar la extensión en los tumores con crecimiento superficial sin masas puede ser útil la colangioscopia17. Es importante plantear el tratamiento quirúrgico en función del tipo de crecimiento radiológico. Con la resección completa el pronóstico es más favorable que el del CC1. En el diagnóstico diferencial hay que incluir las litiasis, porque simulan una lesión intraductal. En ecografía, las litiasis presentan sombra en un 80% de los casos28. En TC es útil el estudio sin contraste para determinar la presencia de calcio o realce, ya que ambas entidades pueden tener atenuación variable. Los bordes irregulares, la estenosis ductal o el engrosamiento asimétrico de la pared apuntan al tumor papilar, mientras que los bordes finos y angulados son característicos de las litiasis28, que, además, tienen una señal baja en T1 y T2 (fig. 4), a diferencia de los tumores, cuya señal en T2 es mayor27.
Gráficos que muestran los patrones de crecimiento de los tumores intraductales papilares, de arriba a abajo: crecimiento polipoideo, que se define como una masa polipoidea pediculada o sésil cuya longitud es menor a 2 veces el diámetro del conducto biliar donde asienta; crecimiento en molde, cuando la masa rellena toda la luz del conducto dilatado, con una longitud mayor al doble del diámetro del conducto; crecimiento superficial, cuando el tumor se presenta como un fino piqueteado o de aspecto aserrado en la superficie del conducto, la pared del conducto es mayor de 1mm o hay una dilatación difusa segmentaria o lobar sin que se vea tumor; y crecimiento quístico, con dilatación aneurismática del conducto afectado con o sin excrecencias o nódulos murales.
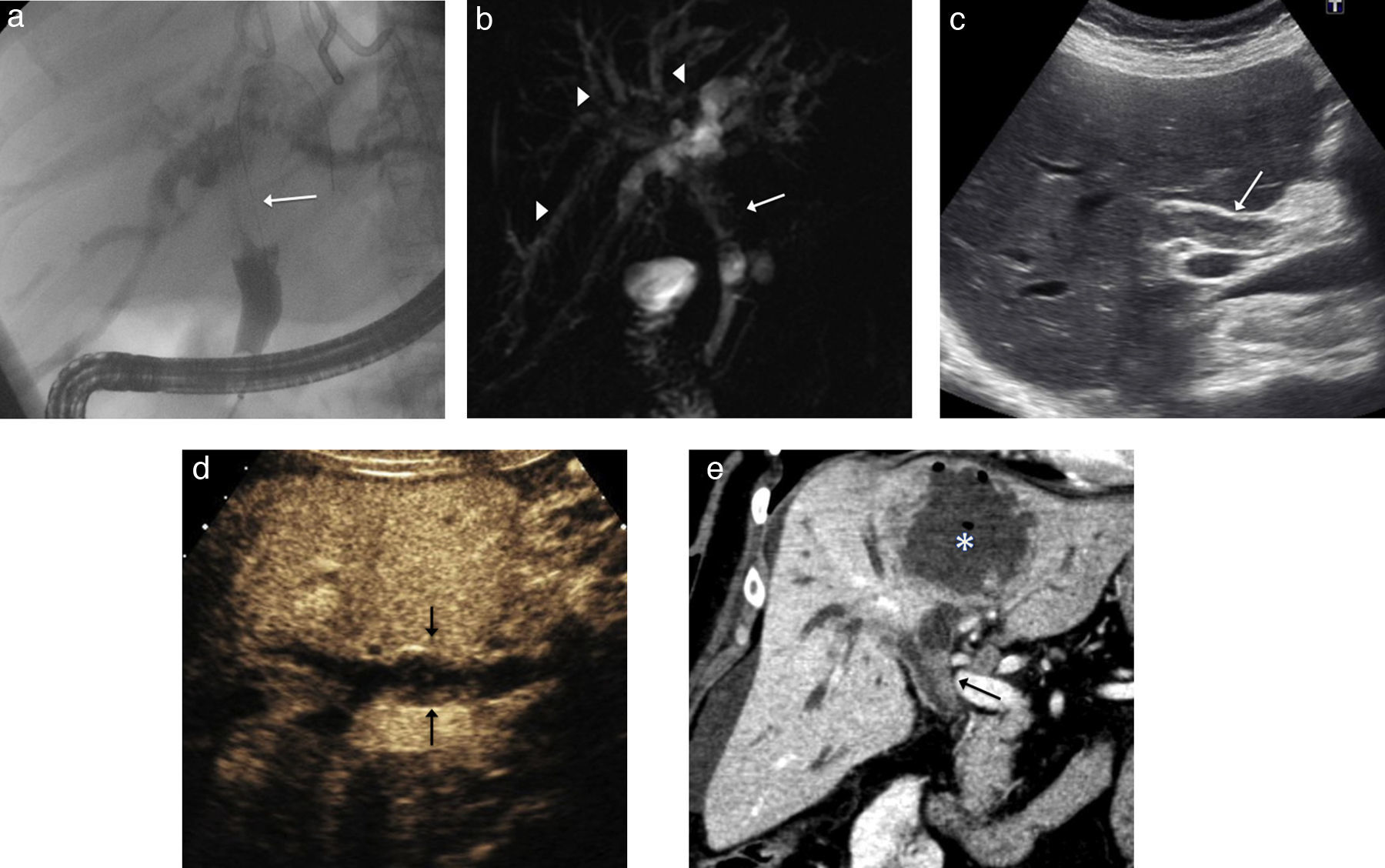
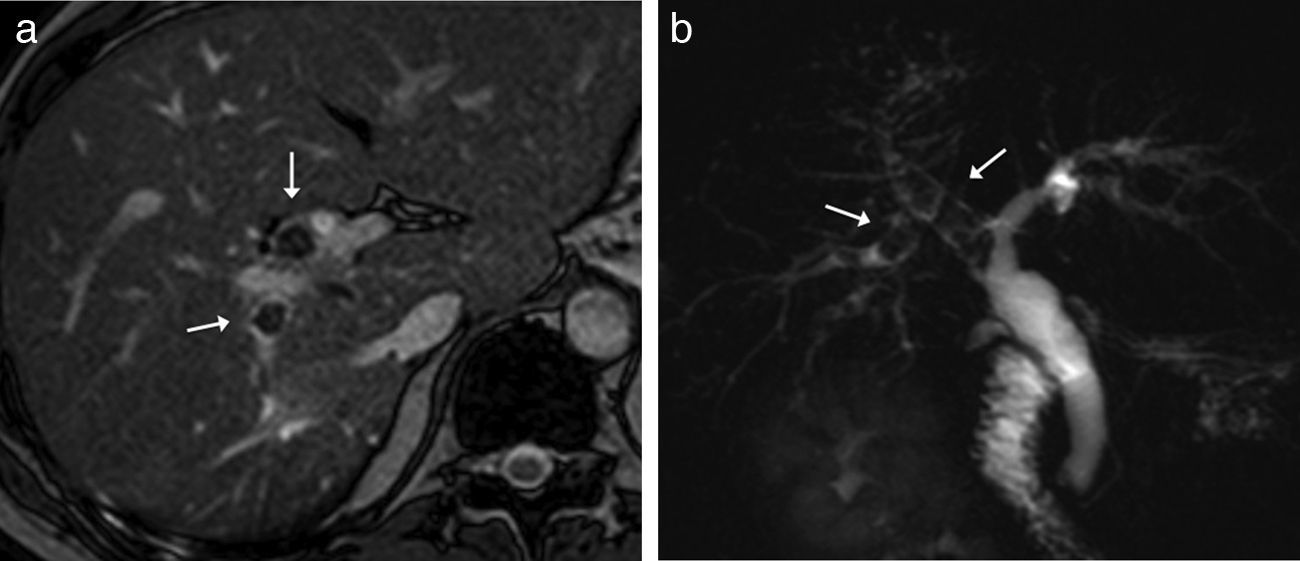
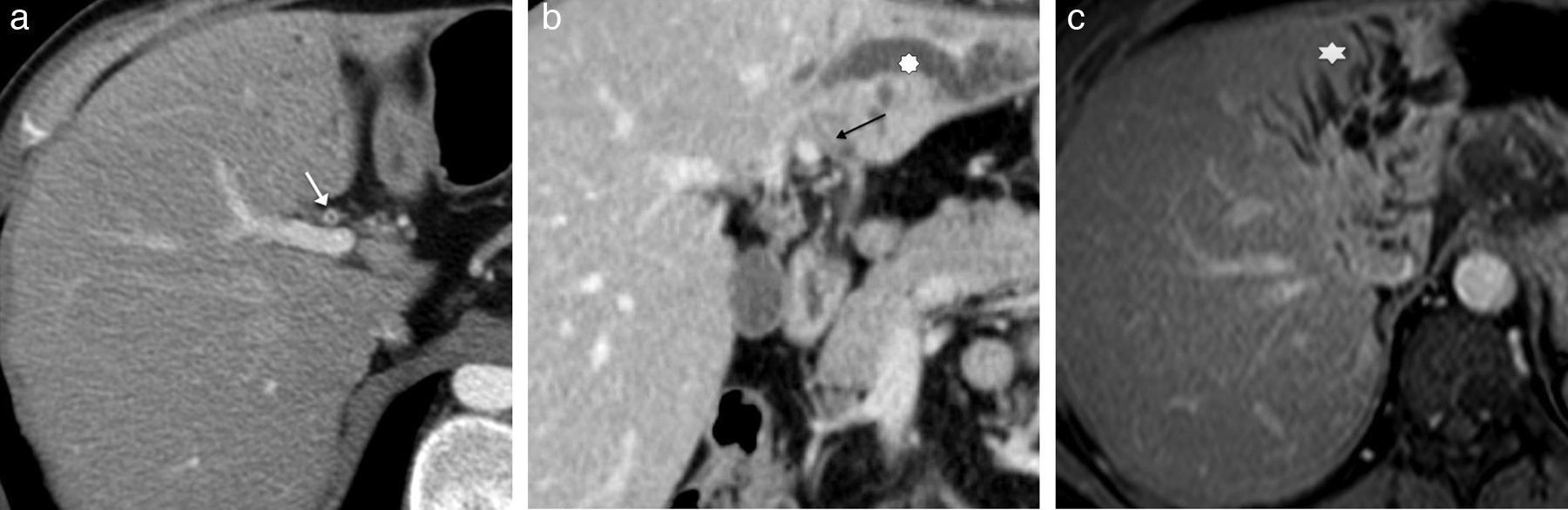
Neoplasia intraductal papilar multifocal con crecimiento polipoideo y en forma de molde. A) Imagen de colangiopancreatografía retrógrada endoscópica que muestra una masa de crecimiento intraductal en el conducto hepático común (flecha) con marcada estenosis, que no permite valorar adecuadamente los conductos biliares proximales. B) Imagen coronal de colangio-RM 2D de la masa (flecha), que permite ver la vía biliar proximal con múltiples nódulos intraductales polipoideos (puntas de flecha). C) Ecografía en el plano transversal oblicuo del hilio hepático donde se observa la lesión en forma de molde (flecha). D) Tras inyectar contraste realza menos que el parénquima hepático (flechas) y descarta que se trate de barro biliar. E) Reconstrucción coronal de TC que muestra la lesión intraductal (flecha) con menos realce que el parénquima. Se puede ver un absceso intrahepático por colangitis (asterisco).
Litiasis intrahepáticas. RM eco de gradiente T2 transversal del hígado (A) e imagen coronal de colangio-RM 2D (B) que muestran lesiones intraductales hipointensas (flechas) de bordes lisos y angulados en el conducto hepático derecho y conductos secundarios correspondientes a litiasis.
También debe plantearse el diagnóstico diferencial de estas neoplasias con la metástasis biliar intraductal en pacientes con otra neoplasia maligna extrabiliar. Los tumores que más metastatizan en la vía biliar son los de pulmón, mama, vesícula biliar, colon, testículo, próstata, páncreas, melanoma y linfoma29. La imagen puede aportar signos diferenciales: mientras el tumor primario es intraductal y polipoideo, la metástasis suele afectar también al parénquima con aspecto expansivo29.
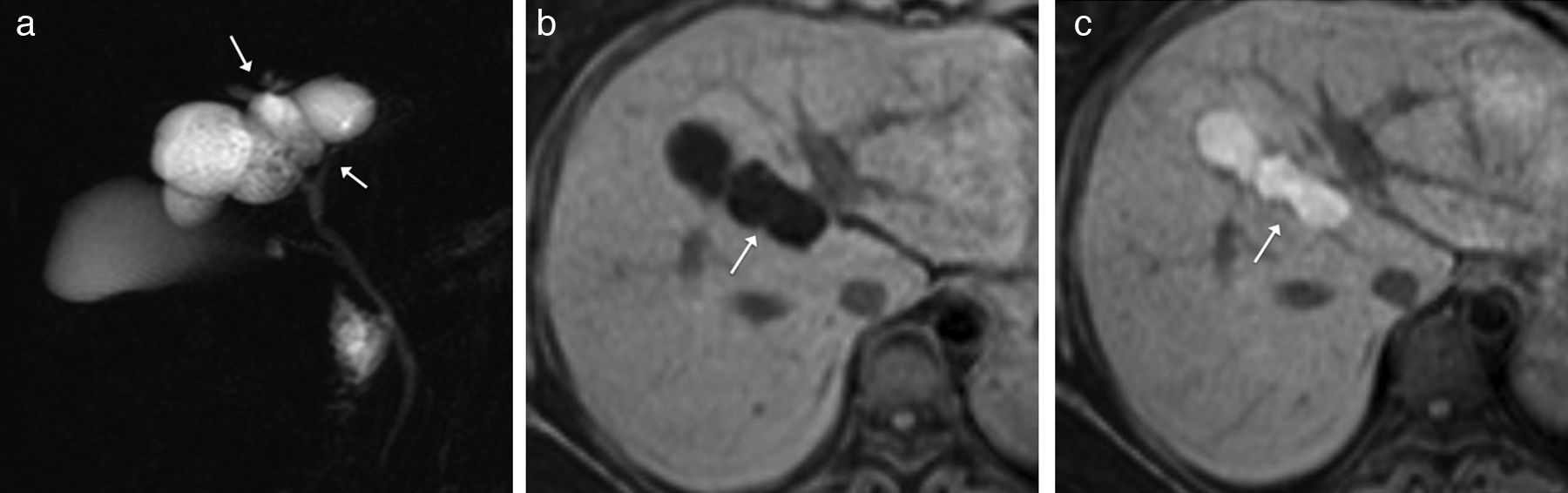
La tercera lesión premaligna es la neoplasia quística mucinosa o cistoadenoma, que hay que diferenciar de la variante mucinosa de la neoplasia papilar intraductal biliar con crecimiento quístico30. Esta última comunica con la vía biliar (fig. 5) y puede diseminar por vía intraductal (dando lugar a síntomas obstructivos intermitentes), mientras que la primera está confinada a un quiste generalmente cerrado a la vía. Para diagnosticarla es necesario que se confirme anatomopatológicamente estroma ovárico14. La neoplasia papilar intraductal biliar productora de mucina puede ser la entidad biliar análoga a la neoplasia papilar intraductal mucinosa del páncreas, ya que ambas presentan una proliferación epitelial papilar con núcleo fibrovascular, no tienen estroma ovárico en la pared, los fenotipos histológicos son similares, producen mucina y tienden a progresar a carcinoma30.
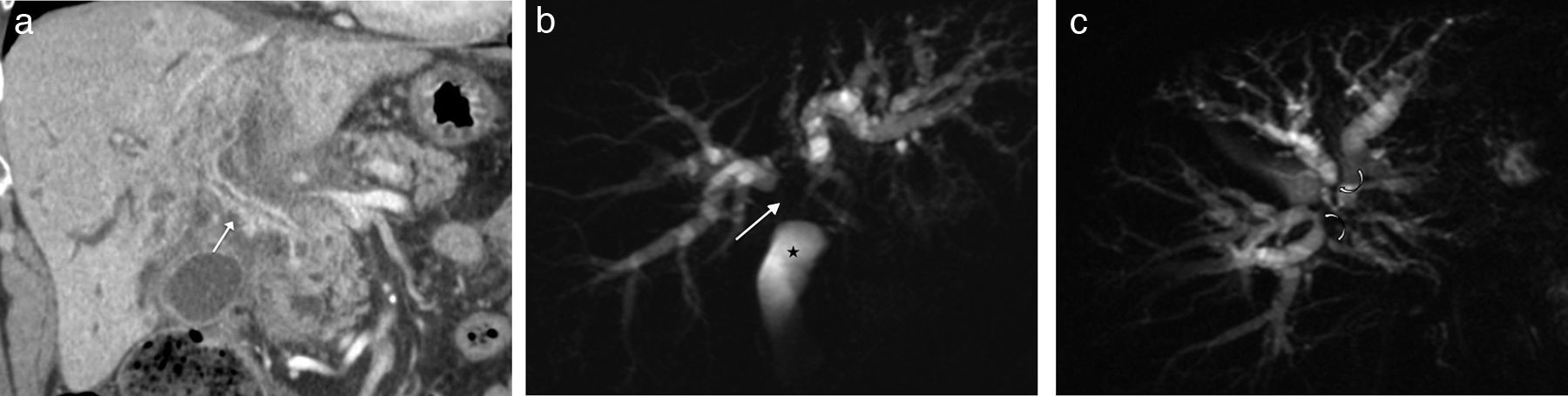
Neoplasia intraductal papilar con crecimiento quístico. A) Imagen coronal de colangio-RM 2D que muestra una lesión quística (flecha), encapsulada, sin nódulos y sin clara comunicación con la vía biliar. B y C) Imágenes transversales de RM hepática eco de gradiente T1 con supresión grasa, sin y con contraste (gadobenato de dimeglumina) en fase hepatobiliar que muestran paso de contraste a la lesión (flecha) por comunicación con la vía biliar.
El CC constituye aproximadamente el 10% de los cánceres primarios hepatobiliares y el 2% de todos los cánceres31, aunque tiene una amplia variabilidad geográfica. La incidencia del CC intrahepático ha aumentado en las últimas décadas, con un descenso concomitante del CC extrahepático5,9; sin embargo, es un dato equívoco, pues en muchos estudios el CC perihiliar se ha considerado como intrahepático, y en estadios avanzados de CC perihiliar resulta difícil determinar el origen.
El CC avanzado tiene mal pronóstico, con una vida media menor a 24 meses9. El único tratamiento curativo es la resección quirúrgica, con tasas de supervivencia a los 5 años de 22-44%, 11-41% y 27-37% en los CC intrahepáticos, perihiliares y distales, respectivamente5. El segundo factor pronóstico es la afectación ganglionar, con una prevalencia del 45%, más frecuente en el CC distal4. Las metástasis están presentes en el 30% de casos en el momento del diagnóstico4. El CC es un grupo heterogéneo de lesiones con formas de crecimiento macroscópico expansivo, periductal-infiltrante o intraductal, de localización intrahepática, perihiliar o distal, que presentan diferentes comportamientos biológicos y formas de diseminación. Se ha demostrado que existe una correlación significativa entre el tipo de crecimiento y el patrón de infiltración con la tasa de supervivencia. El subtipo intraductal se caracteriza por un crecimiento mucoso superficial y múltiple, afectando de forma tardía a la pared de los conductos, por lo que el pronóstico es mejor que el de los subtipos periductal-infiltrante o expansivo, que tienen crecimiento radial submucoso y extensión perineural, e invaden la pared precozmente24,32,33. El primero se caracteriza por tener menor realce que el hígado, mientras que los otros suelen tener realce precoz o progresivo32. La resecabilidad está determinada por la extensión del tumor al árbol biliar, la afectación del parénquima hepático, la invasión vascular, la atrofia lobar y la presencia de metástasis (tabla 1)4.
Criterios de irresecabilidad del colangiocarcinoma
| Colangiocarcinoma intrahepático | Invasión del peritoneo visceralInvasión local de estructuras extrahepáticasInvasión periductal: incluye el patrón de crecimiento periductal o mixto (periductal y expansivo)Infiltración de ganglios regionalesMetástasis a distancia (incluyen ganglios celíacos, periaórticos y pericava) |
| Colangiocarcinoma perihiliar | Criterios de invasión vascular: deformidad del contorno del vaso, estenosis u oclusión o contacto vaso-tumor ≥180° (precisión de 93 y 85% para arterias y venas respectivamente). La invasión portal del CHC viene dada por la invasión de la luz |
| Afectación bilateral de conductos secundariosAfectación de la vena porta principal o bifurcaciónInvasión de rama portal o arterial con atrofia lobar contralateralInvasión biliar de conductos secundarios con atrofia lobar contralateralInvasión de conductos secundarios de un lado con invasión vascular portal o arterial contralateralMetástasis a distancia | |
| Colangiocarcinoma distal | Invasión de vesícula, páncreas, duodeno u otros órganos adyacentes sin afectación de tronco celíaco o arteria mesentérica superiorInvasión de tronco celíaco o arteria mesentérica superiorInfiltración de ganglios regionalesMetástasis a distancia |
Aproximadamente el 20% de los CC son intrahepáticos5,8. El tipo de crecimiento expansivo es el más frecuente, que disemina por vasos venosos y linfáticos. Suele ser un tumor grande, de contornos lobulados o irregulares. Generalmente las células tumorales viables se localizan en la periferia del tumor, y el centro se compone de cantidades variables de fibrosis, necrosis coagulativa o mucina34. Los factores de peor pronóstico son las lesiones múltiples (lesiones satélites, metástasis hepáticas o tumores múltiples indistintamente), la invasión vascular y las metástasis ganglionares35,36. Tanto la TCMD como la RM permiten caracterizarlos y estadificarlos correctamente con el sistema TNM (tabla 2)37.
Estadificación TNM de los tumores biliares intrahepáticos
| Tumor primario | |
| TXT0TisT1T2aT2bT3T4 | El tumor primario no es valorableNo evidencia de tumor primarioCarcinoma en situ (tumor intraductal)Tumor solitario sin invasión vascularTumor solitario con invasión vascularTumores múltiples con o sin invasión vascularTumor que perfora el peritoneo visceral o invade de forma directa estructuras extrahepáticasTumor con invasión periductal |
| Ganglios linfáticos regionales | |
| NXN0N1 | Los ganglios linfáticos regionales no son valorablesNo hay metástasis en ganglios linfáticos regionalesMetástasis en ganglios linfáticos regionales |
| Metástasis a distancia | |
| M0M1 | No hay metástasis a distanciaMetástasis a distancia |
En ecografía son masas de ecogenicidad variable sin halo hipoecoico, a diferencia del hepatocarcinoma (CHC), y en el 31% de los casos con dilatación biliar periférica al tumor38. La TCMD y la RM son las más apropiadas para evaluar el tamaño tumoral, la multifocalidad y la afectación vascular. La TCMD es la mejor para determinar la resecabilidad, con una precisión mayor del 85%36,39. En TCMD suele ser hipodenso, y en RM la apariencia es variable. Suele tener una periferia hiperintensa en T2 e hipointensa en T1, que representa el predominio celular. El centro es característicamente hipointenso en T2, por fibrosis o necrosis coagulativa, que se diferencian por la presencia o ausencia de realce3,34, o bien hiperintenso cuando existe mucina34. En ambas técnicas es típico un mínimo realce periférico irregular e incompleto, con progresión centrípeta en fases tardías13,40 (fig. 6). Puede asociar hallazgos diferenciales como retracción capsular, dilatación y engrosamiento de conductos biliares periféricos o infiltración de vasos sin trombo visible (fig. 6) (tabla 3).
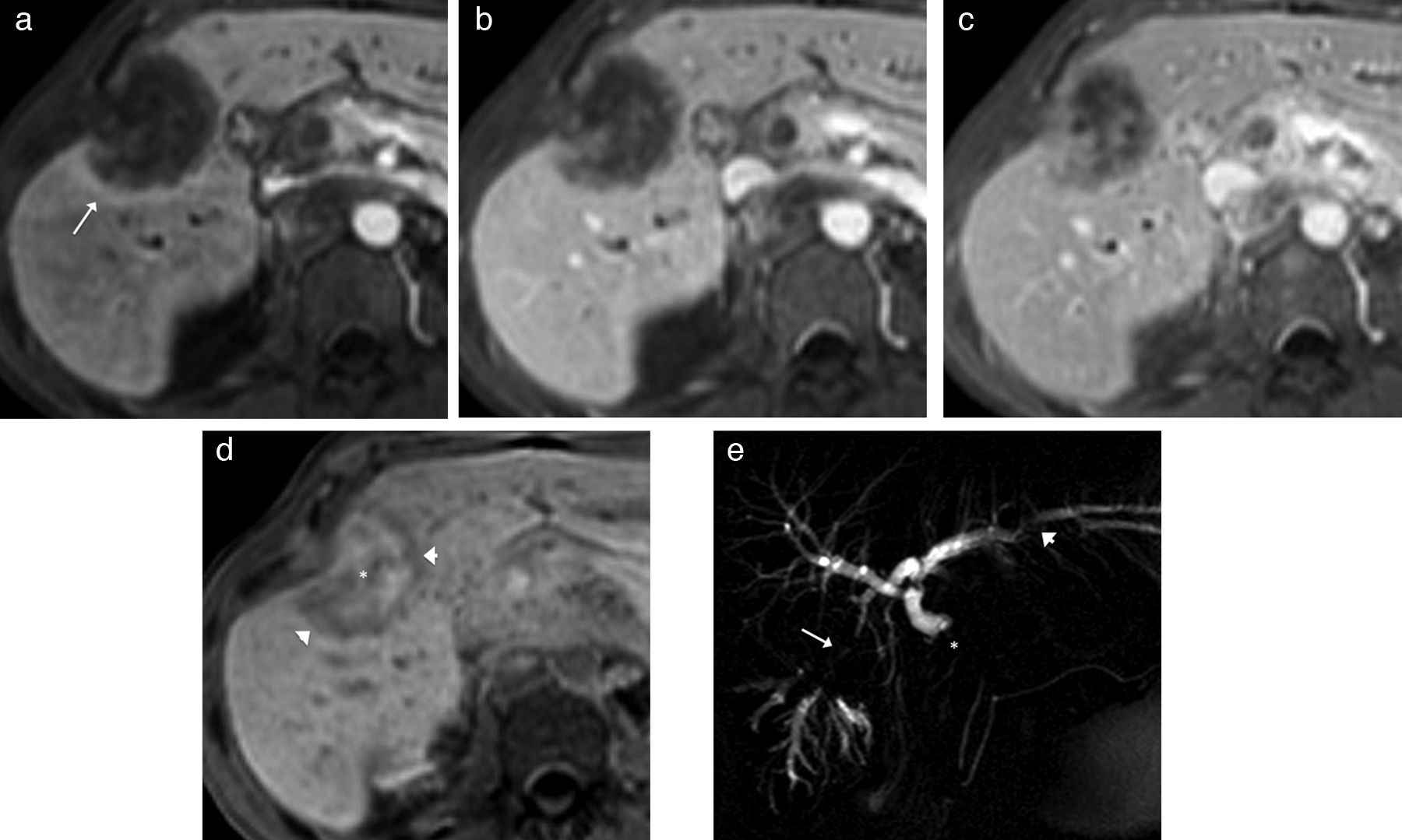
Colangiocarcinoma intrahepático con crecimiento expansivo. Imágenes transversales del hígado con RM T1, supresión grasa y contraste hepatobiliar (gadobenato de dimeglumina) en fases arterial tardía (A), portal (B), de equilibrio (C) y hepatobiliar (D) que muestran un leve realce arterial periférico (flecha en A) con progresión centrípeta y heterogénea en fases tardías. En la fase hepatocitaria se observa realce hepático que delimita mejor los bordes de la lesión (cabezas de flecha en D), que además presenta un centro hiperintenso por persistencia del contraste en intersticio por el componente fibroso (asterisco en D). E) Colangio-RM 2D en el plano coronal en la que se observa el defecto en forma de masa localizado en lóbulo hepático derecho (flecha) con dilatación de conductos proximales al tumor y lesiones intraductales en las ramas izquierdas de la vía biliar intrahepática (cabeza de flecha), así como estenosis extrínseca de la vía biliar extrahepática por adenopatías en el hilio (asterisco).
Estadificación TNM de los tumores biliares distales
| Tumor primario | |
| TXT0TisT1T2T3T4 | El tumor primario no es valorableNo evidencia de tumor primarioCarcinoma en situTumor confinado al conducto biliar histológicamenteTumor que sobrepasa la pared del conducto biliarTumor que invade vesícula, páncreas, duodeno u otros órganos adyacentes sin invasión de tronco celíaco o de arteria mesentérica superiorTumor que invade tronco celíaco o arteria mesentérica superior |
| Ganglios linfáticos regionales | |
| NXN0N1 | Los ganglios linfáticos regionales no son valorablesNo hay metástasis en ganglios linfáticos regionalesMetástasis en ganglios linfáticos regionales |
| Metástasis a distancia | |
| M0M1 | No hay metástasis a distanciaMetástasis a distancia |
El uso de contrastes hepatobiliares (gadoxetato disódico o gadobenato de dimeglumina) puede ser útil porque permite ver mejor el tumor y sus bordes y detecta lesiones múltiples, datos importantes para la planificación quirúrgica y el pronóstico (fig. 6)41,42. Respecto a la valoración de los ganglios metastásicos, la precisión total de las técnicas es del 77%36.
El diagnóstico diferencial del CC con crecimiento expansivo incluye varias entidades. El CC<3cm puede tener un comportamiento atípico en el hígado cirrótico, con realce en fase arterial con o sin lavado en fase portal40,43,44, por lo que debe plantearse el diagnóstico diferencial con el CHC por su diferente manejo terapéutico y pronóstico. El lavado en la TCMD y RM confirma el diagnóstico de CHC; sin embargo, la distribución puramente intravascular del contraste en ecografía no permite diferenciarlos, ya que ambos presentan lavado. La apariencia en diana en la RM difusión con valor b alto, que traduce fibrosis central, ha mostrado ser un factor predictivo significativo e independiente para distinguir el CC del CHC pequeño, con más sensibilidad que las imágenes T2 o con contraste hepatoespecífico45, aunque no evita la biopsia35. Distinguirlo de metástasis de carcinoma de colon puede ser muy difícil, porque también pueden ser hipointensas en T2. El realce típico, hallazgos asociados como la dilatación de la vía intrahepática y, sobre todo, la presencia de un tumor primario, son las claves para diferenciarlos34.
La cirugía consigue la curación en menos del 30% de los casos debido a márgenes quirúrgicos positivos y metástasis ganglionares, positivas en el 29% de pacientes tras la intervención quirúrgica8,39. No existe consenso sobre si es recomendable la linfadenectomía durante la resección tumoral46.
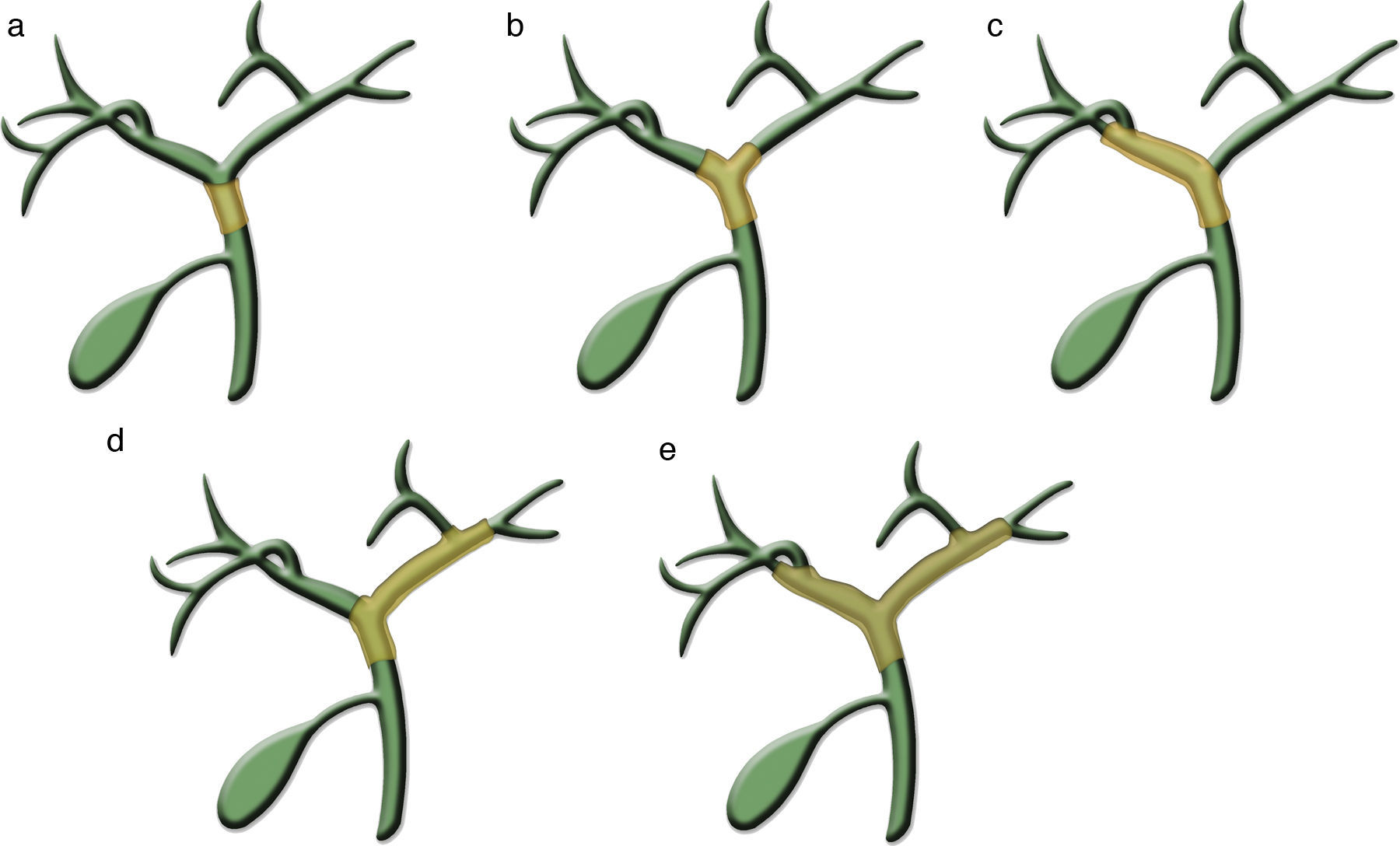
Colangiocarcinoma perihiliar (hiliar o Klatskin)Representa el 50-60% de los CC5,8. El tipo de crecimiento más frecuente es mixto, periductal-infiltrante con masa expansiva asociada35, y disemina predominantemente por vía perineural y ganglionar1. Crece a lo largo de un conducto biliar dilatado o estenótico engrosando la pared, y progresa invadiendo el parénquima hepático en el 80%4. Se han reconocido como factores pronósticos independientes los ganglios linfáticos infiltrados, la diferenciación tumoral y la resección completa35. La RM, la TCMD, la CPRE y, ocasionalmente, la ecografía endoscópica son las técnicas más usadas para estadificarlo39. Existen diferentes sistemas de estadificación, sin que ninguno de ellos se utilice con un amplio consenso. El más extendido es el sistema modificado de Bismuth-Corlette, basado en la extensión longitudinal del tumor a lo largo del árbol biliar47, que contempla 4 tipos (fig. 7). Esta clasificación no tiene en cuenta la invasión vascular, la presencia de metástasis ni las variantes anatómicas del árbol biliar. El sistema TNM37 añade signos de crecimiento radial (tejidos peribiliares o invasión vascular) y la afectación ganglionar y a distancia. No obstante, no valora adecuadamente la localización tumoral en el árbol biliar, dato importante para determinar la posibilidad de resección local31. Se considera invasión vascular la oclusión del vaso, la atrofia hepática ipsilateral, la estenosis o deformidad del contorno o el contacto tumor-vaso mayor o igual a 180¿48. Se ha introducido una nueva clasificación que tiene en cuenta tanto el crecimiento longitudinal del tumor a lo largo del árbol biliar como el crecimiento radial, valorando la invasión vascular arterial o portal31. Clasifica la afectación biliar y vascular de forma análoga al sistema modificado de Bismuth-Corlette y considera además otros parámetros relevantes para la resección, como el tamaño del tumor, el tipo de crecimiento, el volumen potencial de hígado remanente, la afectación ganglionar y a distancia, y la enfermedad hepática subyacente. Este sistema tiene puntos débiles, como el tamaño o la atrofia lobar, que no tienen implicaciones pronósticas, o la invasión vascular, que tiene valor para la resección más que para el pronóstico35 (fig. 8).
Ilustraciones que representan los tipos de crecimiento longitudinal del colangiocarcinoma perihiliar según el sistema modificado de Bismuth-Corlette. A) Tipo I. Afecta al conducto hepático común. B) Tipo II. Afecta a la confluencia de los conductos hepáticos. C y D) Tipo III. Afecta a la confluencia de conductos secundarios del conducto hepático derecho (IIIa) o izquierdo (IIIb). E) Tipo IV. Afecta a ambos conductos hepáticos y a las confluencias secundarias de ambos o a niveles múltiples y discontinuos bilateralmente.
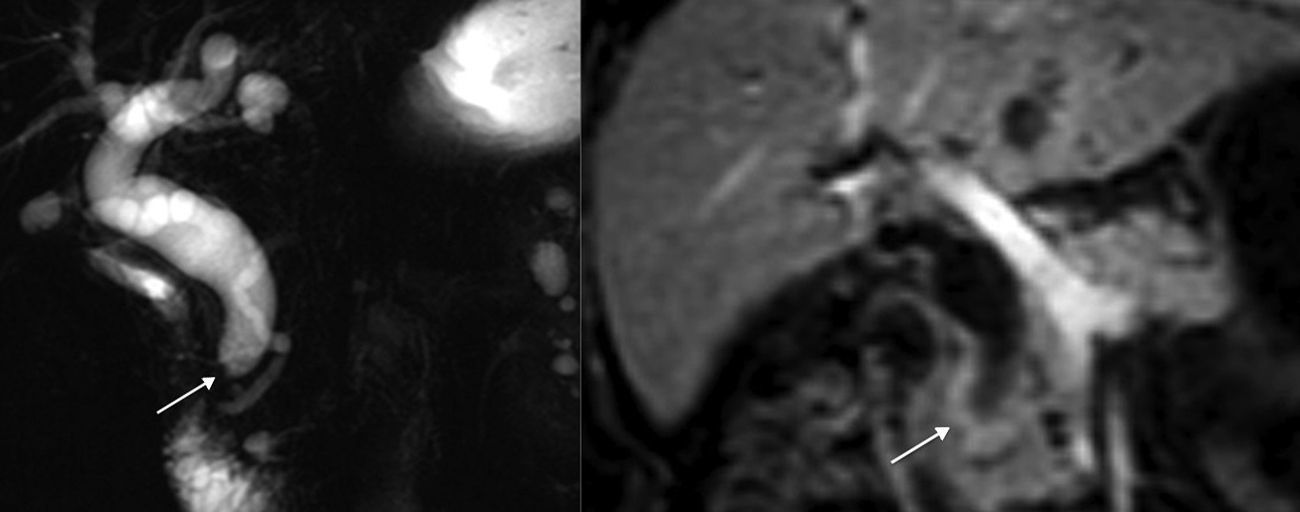
Varón de 40 años con colangiocarcinoma perihiliar tipo IIIb con crecimiento periductal-infiltrante. A) Imagen transversal de TC hepático con contraste que muestra engrosamiento y estenosis del conducto hepático izquierdo (flecha). B) Plano coronal de TC con engrosamiento del conducto hepático izquierdo y contacto cincunferencial con una rama portal por invasión (flecha) y dilatación de la vía biliar intrahepática (asterisco). C) RM eco de gradiente T1 con contraste que muestra dilatación de la vía biliar y atrofia lobar por invasión vascular (asterisco).
En ecografía el hallazgo más frecuente es la dilatación de la vía biliar intrahepática, no se ve la confluencia de los conductos hepáticos, y la vía biliar distal es de calibre normal38. La lesión suele ser igual de ecogénica que el hígado, y es difícil de identificar. El contraste ecográfico puede aumentar la precisión porque el tumor es hipoecoico en fases tardías y difiere del parénquima hepático realzado49. La multitud de conductos dilatados y la atrofia lobar apoyan el diagnóstico. Es menos frecuente ver el engrosamiento mural y periductal de la confluencia o una masa intraluminal50. La ecografía, sin embargo, no es adecuada para estudiar la diseminación y determinar la resecabilidad36,38. Con la TCMD se ve como un engrosamiento focal de la pared ductal con estenosis de la luz y dilatación proximal. Puede existir una masa con mayor realce que el parénquima hepático en todas las fases (figs. 9 y 10). Tiene tendencia a subestimar la extensión longitudinal, tanto en las formas periductal-infiltrante como intraductal51. Valora la infiltración vascular y biliar y predice la resección con precisión, para lo que son útiles las técnicas de reformateo35,36,49,52. También subestima la extensión ganglionar y peritoneal52,53. La precisión de la TCMD para determinar la resección es de un 60-87,5%4,36. La RM es excelente para establecer la extensión longitudinal en el árbol biliar identificando alteraciones en la forma y calibre ductal o lesiones polipoideas intraluminales49,53,54 (figs. 8 y 9). El realce tardío de la pared de los conductos biliares es un signo que mejora la precisión diagnóstica de la RM53 dado que no se trata de un signo indirecto como la estenosis en las técnicas colangiográficas. Para la extensión intraductal puede ser necesaria la colangioscopia, que demuestra la diseminación superficial multifocal48,54, y es además muy precisa para la infiltración del hígado y la extensión radial. La limitación principal es la menor resolución espacial, y también subestima la extensión ganglionar y peritoneal. Su precisión para planificar la intervención es del 72-83%36. El diagnóstico diferencial se plantea con entidades que pueden ser radiológicamente indistinguibles, como las estenosis benignas iatrogénicas, enfermedades inflamatorias o infecciosas, enfermedad relacionada con IgG4, colangitis eosinofílica, pseudotumor inflamatorio biliar o lesiones tumorales, como metástasis o linfoma55. Menos de la mitad de los pacientes son candidatos a una intervención quirúrgica curativa por invasión vascular bilateral o contralateral y por invasión bilateral de conductos biliares secundarios49. El tratamiento curativo requiere resecar el conducto biliar extrahepático, la linfadenectomía regional, la colecistectomía y, en la mayoría de los casos, una hepatectomía parcial, incluyendo el lóbulo caudado4. Existe controversia sobre la necesidad del drenaje biliar preoperatorio, que puede mejorar los requerimientos metabólicos y de regeneración del remanente hepático39.
Varón de 78 años con colangiocarcinoma perihiliar tipo iv. A) TC coronal con contraste en fase portal en la que se observa un engrosamiento de la pared de la vía biliar extrahepática y masa (flecha) que invade estructuras periductales por crecimiento mixto, periductal-infiltrante y expansivo. B) Colangio-RM 2D en el plano coronal que muestra la oclusión de la luz (flecha) de la vía biliar; vesícula (estrella). C) Colangio-RM 2D en el plano transversal que muestra la extensión longitudinal hasta los conductos secundarios (flechas curvas).
Constituye aproximadamente el 20% de los CC5,8. El tipo de crecimiento más frecuente es periductal-infiltrante3,56. Tiene tendencia a crecer en profundidad (infiltración neural, vascular o pancreática) y a la afectación ganglionar35, factores que van a condicionar el pronóstico.
Los signos típicos son un nódulo o masa con realce tardío en el lugar de la estenosis o el engrosamiento concéntrico o asimétrico de la pared ductal. La ecografía es el procedimiento diagnóstico inicial38,57 que identifica la dilatación proximal. Más raramente puede presentar masa asociada39.
Se estadifican mediante el sistema TNM37, para lo que son primordiales la RM y la TCMD, que delimitan el tamaño tumoral y la invasión de estructuras adyacentes (fig. 10)36. La RM difusión con valor b 800 es sensible para detectar el CC extrahepático58.
La CPRE, la colangiografía percutánea y la ecografía endoscópica con PAAF son herramientas útiles para el diagnóstico, aunque la colangiografía directa es poco eficaz para ver la extensión longitudinal del tumor, ya que el crecimiento puede ser submucoso o extramural. La ecografía endoscópica permite valorar con mayor precisión la invasión ganglionar y vascular39.
En general, cuando no se ve masa o litiasis, una estenosis larga, irregular y asimétrica sugiere una naturaleza maligna, a diferencia de las estenosis cortas, regulares y simétricas, que suelen ser benignas56. El diagnóstico diferencial incluye estenosis benignas, como CEP, colangiopatía relacionada con SIDA, pancreatitis autoinmune, pancreatitis aguda o crónica y estenosis malignas por tumores pancreáticos y periampulares3 (fig. 10). La pancreatitis autoinmune afecta al colédoco intrapancreático en el 67-96% de los casos, al que estrecha por engrosamiento de la pared, simulando un CC distal59. Un engrosamiento concéntrico de la pared ductal, con borde externo liso, poco realce y apariencia de la estenosis en reloj de arena, limitado al segmento intrapancreático y afectación múltiple, son hallazgos característicos de colangitis asociada a pancreatitis autoinmune59. En la CEP es rara la afectación unifocal del conducto biliar extrahepático21,55. Si existe una estenosis dominante (definida como estenosis de 1,5mm en el colédoco o de 1mm en conducto hepático), se recomienda el estudio citológico o la biopsia para descartar una neoplasia subyacente20. El carcinoma pancreático es difícil de distinguir de un CC distal. La ausencia de infiltración del conducto pancreático principal y accesorio orienta a un origen biliar3. Por último, los tumores periampulares se clasifican por separado en el sistema TNM37 y se originan en la región periampular, definida como el área que se extiende 2cm radialmente desde la papila mayor. Ante una obstrucción ampular, los signos que definen una neoplasia periampular son una masa, la protrusión papilar y la estenosis ductal irregular y asimétrica, con dilatación del conducto pancreático60. El tratamiento curativo del CC distal es quirúrgico, con procedimiento de Whipple. La tasa de supervivencia a los 5 años es del 27-50% cuando la resección es completa, que es el factor predictivo más importante4,39, seguido por la afectación ganglionar8.
ConclusiónLos tumores de la vía biliar son muy variables por su localización y tipo de crecimiento. Las técnicas de imagen son esenciales para detectarlos y caracterizarlos y, sobre todo, para clasificarlos en grupos que facilitan planificar el tratamiento y establecer el pronóstico. En general, es necesario combinar varias modalidades de imagen y técnicas invasivas, y puede ser necesaria la exploración quirúrgica. Estos tumores requieren un manejo multidisciplinario, por lo que es importante para el radiólogo conocer los signos radiológicos y el papel de las diferentes técnicas diagnósticas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsables de la integridad del estudio: FD, JV, GM.
- 2.
Concepción del estudio: JV, GM.
- 3.
Diseño del estudio: FD, JV, GM.
- 4.
Obtención de los datos: FD, JV, GM, MJM
- 5.
Análisis e interpretación de los datos: FD, JV, GM.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: FD, JV, GM, TR.
- 8.
Redacción del trabajo: FD, JV, GM, TR.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: TR. MJM.
- 10.
Aprobación de la versión final: FD, JV, GM, TR, MJM.
Los autores declaran no tener ningún conflicto de intereses.
Queremos expresar nuestro agradecimiento a Miriam Salvador por su colaboración en el diseño y la elaboración de los gráficos.