Con la aparición de la tomografía computarizada multidetector (TCMD) y el perfeccionamiento en las técnicas de urotomografía (UT), la evaluación del tracto urinario ha adquirido otra dimensión, obteniendo cada vez una mejor representación del uréter. Cuando el uréter es evaluado podemos encontrar una gran variedad de entidades, que incluyen anomalías congénitas y variantes anatómicas (alteración en el origen, distribución e inserción distal del uréter), todas las causas benignas y malignas de engrosamiento focal y difuso de la pared ureteral, incluyendo procesos inflamatorios e infecciosos, neoplasias, iatrogenia y cambios posquirúrgicos. Otros procesos benignos, como el asa ureteral y la estenosis por compresión extrínseca de vasos iliacos, pueden ser bien caracterizados por TCMD. El objetivo de este artículo es mostrar el espectro de patología y variantes ureterales diferentes a las entidades comunes relacionadas con cálculos.
Multidetector computed tomography (MDCT) and advances in CT urography techniques have enabled vast improvements in the depiction of the ureter. Studies of the ureter can find a wide variety of conditions including congenital defects and anatomic variants (anomalies in the origin, distribution, and distal insertion of the ureter) as well as all benign and malignant causes of focal and diffuse wall thickening (inflammatory and infectious processes, and neoplasms, as well as iatrogenic thickening and postsurgical changes). Other benign processes like ureteral kinking and stenosis due to extrinsic compression of the iliac vessels are also well characterized by MDCT. The aim of this article is to show the spectrum of ureteral variants and disease apart from common entities related to stones.
En los últimos años la urotomografía (UT) se ha posicionado como uno de los principales métodos diagnósticos de patologías del tracto urinario, permitiendo que el uréter sea mejor caracterizado y se puedan realizar diagnósticos mucho más precisos. La principal indicación de la UT es el estudio de paciente con alto riesgo de sospecha de carcinoma de células transicionales, es decir, pacientes mayores de 40 años con hematuria macroscópica. Sin embargo este método diagnóstico es usado cada vez más para la caracterización de condiciones benignas como anomalías congénitas y variantes, el asa ureteral y estenosis ureteral por vasos iliacos entre otras1. La UT tiene varias ventajas que han relegado otros métodos diagnósticos a un segundo plano. Estas ventajas son la evaluación integral de las vías urinarias en un solo estudio, mayor sensibilidad para detectar cálculos y lesiones focales renales, evaluación tanto de la luz como de la pared de los uréteres y vía renal excretora, capacidad de estadificar con el mismo estudio las lesiones tumorales detectadas, identificación de patologías externas al tracto urinario y mejor visualización de las lesiones vesicales2. El mayor inconveniente de esta técnica es la alta dosis de radiación, por lo que sólo debe utilizarse en las indicaciones establecidas1,3.
TécnicaSe han propuesto diversos protocolos y técnicas para la realización de la UT que se han ido modificando a través del tiempo. Sin embargo existe consenso sobre 4 características básicas que debe tener la UT: 1. debe ser un examen diagnóstico optimizado para la evaluación de los riñones, uréteres y vejiga; 2. debe ser un estudio realizado con tomografía computarizada multidetector (TCMD), con imágenes de alta resolución espacial (cortes finos/baja colimación); 3. requiere la administración intravenosa de medio de contraste y 4. debe incluir como requisito fundamental de una fase de excreción, indispensable para evaluar el urotelio1.
La UT fue descrita originalmente como una técnica de 3 fases (trifásica) que utiliza un bolo único de medio de contraste (MC) intravenoso4. En primer lugar se realiza una fase sin contraste, que en el caso del uréter es valiosa para visualización inicial de variantes anatómicas, detección de cálculos en las vías urinarias, detección de hematomas y alteraciones en la atenuación y grosor de las paredes ureterales. Luego se administra un bolo de MC (100–150ml), inyectado a una velocidad de 2–3ml/seg, momento a partir del cual son obtenidas 2 fases de imágenes adicionales. La fase nefrográfica se obtiene entre 70–120 segundos después de la administración inicial de MC y pretende caracterizar mejor el realce y engrosamiento anormal de la pared urotelial, especialmente en el caso de procesos inflamatorios y neoplasias. La fase excretora se obtiene tras un retraso de al menos 180 segundos después de la inyección inicial de MD (aunque la tendencia habitual es a realizarla entre 6–15min) y es útil para evaluar la opacificación con contraste de los uréteres, identificando el trayecto ureteral en el caso de variantes anatómicas y anomalías congénitas, y los defectos de repleción secundarios a tumoración, procesos inflamatorios e infecciosos. En algunos casos, y en especial cuando se sospecha una anomalía de origen vascular se puede añadir al protocolo una fase corticomedular obtenida entre 25–35 segundos posterior a la administración de MC1,3,5–7. Algunos centros prefieren la realización de la técnica en solo 2 fases, también denominada «split» que une las fases nefrográfica y excretora en el mismo tiempo para reducir la radiación1,3. La realización de algunas técnicas adicionales como la administración de furosemida intravenosa, cambios de posición y el empleo de bandas compresivas son aún en la actualidad muy debatidos y son usados de acuerdo a la experiencia de cada centro4,8–10. En nuestro centro preparamos al paciente con 1.000cc de agua vía oral durante una hora antes de la adquisición de las imágenes. Se adquiere una fase basal y posteriormente se inyectan 100cc de MC, obteniendo una fase nefrográfica 80 segundos después y una fase excretora a los 8min de la inyección de MC.
Los principales parámetros de adquisición para TC multidetector son la colimación del corte y el pitch. Estos datos en combinación con el voltaje del tubo (Kv) y la carga del tubo (mA) determinan los datos crudos. En todos los sistemas tomográficos, el voltaje del tubo para pacientes de talla y peso promedio es de 120kV. Aunque se ha recomendado el uso de kVp bajos para disminuir la dosis de radiación, ésto no se observa con frecuencia en la práctica clínica. La carga del tubo varía significativamente entre grupos, continentes y equipos, en un rango de 50–300mA, en tomógrafos de 4 detectores, y 65–200mA en tomógrafos de 16 detectores1,4,6.
En tomógrafos de 4 detectores, una colimación de 2,5–3,75mm ha sido utilizada para las fases basal y nefrográfica y colimaciones tanto de 1,25mm como de 2,5mm para las imágenes de fase excretora. En tomógrafos de 16 detectores la colimación es más pequeña; usualmente de 1,25 a 1,5 para la fase simple y nefrográfica y de 0,5–0,75mm para la fase excretora. Con el uso de tomografía de 64 detectores las colimaciones bajan en todas la fases a 0,5–0,625. Para evitar el exceso de ruido el miliamperaje puede ser incrementado. El uso de colimaciones finas requiere valores de pitch altos, de al menos 1,5, mientras que los valores de pitch para colimaciones gruesas han variado desde 0,75 hasta 1,5. En tomógrafos de 16 y 64 detectores se continúan usando pitch relativamente altos, entre 1,2–1,41,2.
La TMDC permite realizar reconstrucciones multiplanares (siendo las reconstrucciones coronales generalmente las preferidas), reconstrucciones curvas, proyecciones de intensidad promedio y de máxima intensidad (MIP), y demostraciones volumétricas en 3D que pueden ofrecer en algunos casos información adicional a la obtenida con los cortes axiales y en otros la posibilidad de aclarar diagnósticos2,4,6.
A continuación describiremos las patologías ureterales más frecuentes que pueden ser mejor caracterizadas mediante UT.
Variantes y anomalías congénitas (figs. 1–7)La TCMD y UT son técnicas que permiten caracterizar una gran variedad de anomalías congénitas y variantes del tracto urinario en las cuales tanto el origen del sistema excretor como la distribución e inserción distal del uréter pueden estar alterados. Con ellas se obtiene una detallada evaluación anatómica que permite no sólo identificar las condiciones patológicas relacionadas con dichas anomalías sino además planificar adecuadamente la cirugía cuando ésta sea necesaria. Las anomalías, congénitas se diagnostican frecuentemente en la edad adulta y para caracterizarlas la UT desempeña un papel fundamental, ya que la fase excretora será la más relevante para identificar las anomalías de la vía excretora.
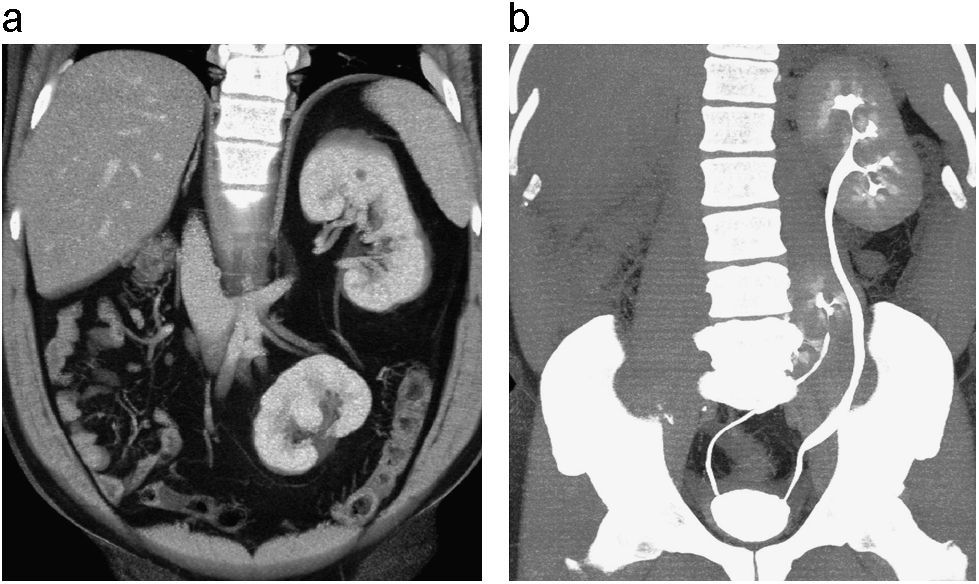
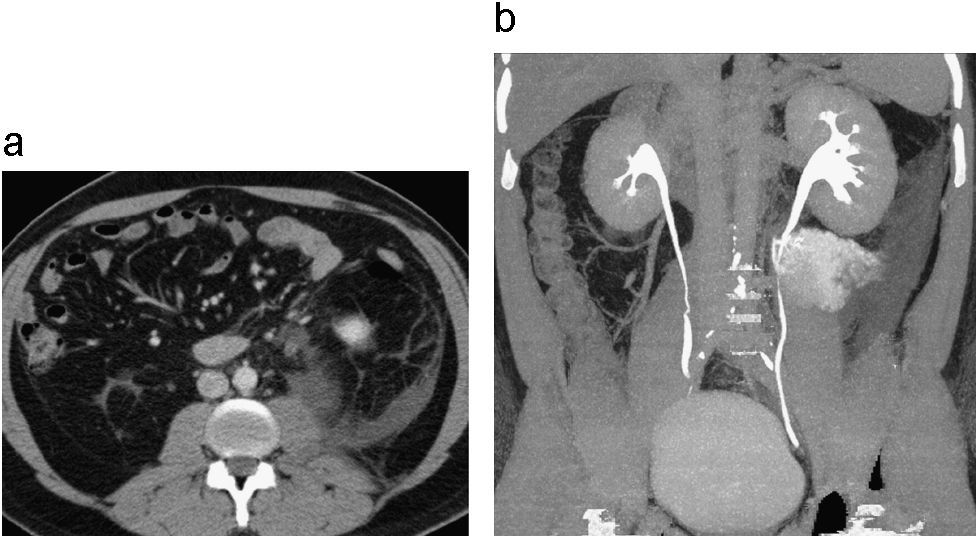
Doble sistema excretor completo asociado a proceso infeccioso. Ley de Weigert Meyer. Reconstrucción coronal de UT en fase excretora (a). Reconstrucción sagital en fase nefrográfica (b) en paciente con síntomas urinarios y fiebre. Se identifica un doble sistema excretor completo, con ureterohidronefrosis del sistema excretor y uréter que drenan el polo superior del riñón derecho, secundario a fenómeno obstructivo originado en ureterocele (b), el cual se encuentra medial e inferior a la inserción normal del uréter que drena el polo inferior. Se identifica engrosamiento y realce anormal de las paredes de la pelvis renal y uréter por compromiso inflamatorio de tipo infeccioso (a,b). En la fase excretora se observa una adecuada opacificación del sistema excretor y uréter que drenan el polo inferior del riñón derecho asociado a ectasia secundaria a reflujo vesico ureteral comprobado previamente en el paciente (a). Los hallazgos anteriores configuran las características clásicas de la ley de Weigert Meyer.
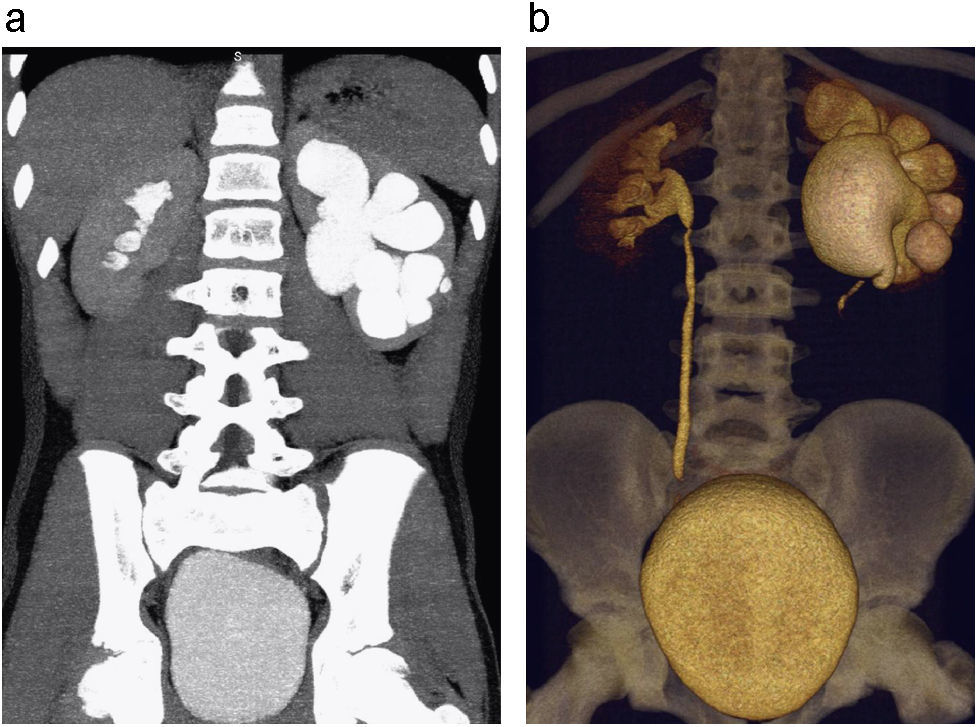
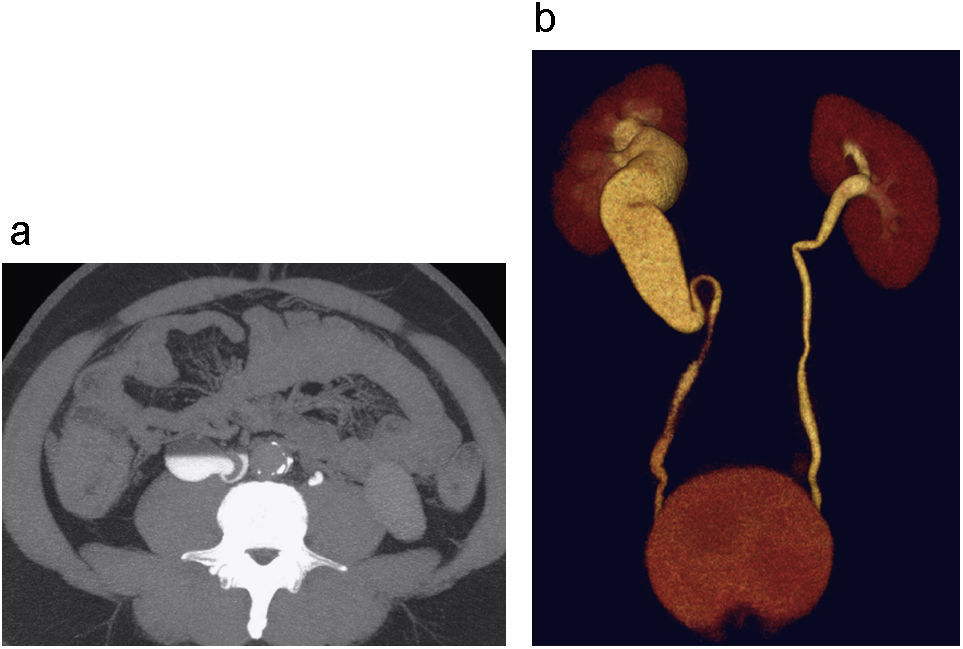
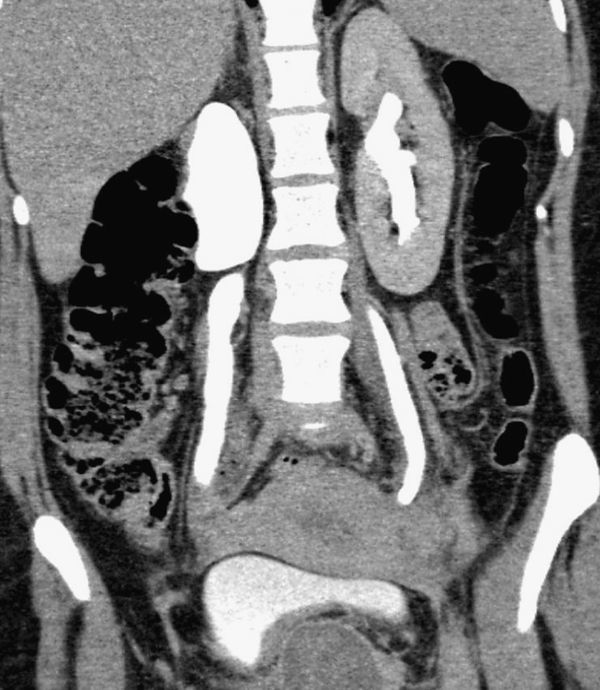
Estenosis pieloureteral. Reconstrucciones coronales – Proyección de máxima intensidad (MIP) (a) y 3D (b) de UT en fase excretora donde se observa hidronefrosis izquierda, identificando un área de transición a nivel de la unión pieloureteral, presentando una disminución abrupta del calibre por estenosis pieloureteral primaria.
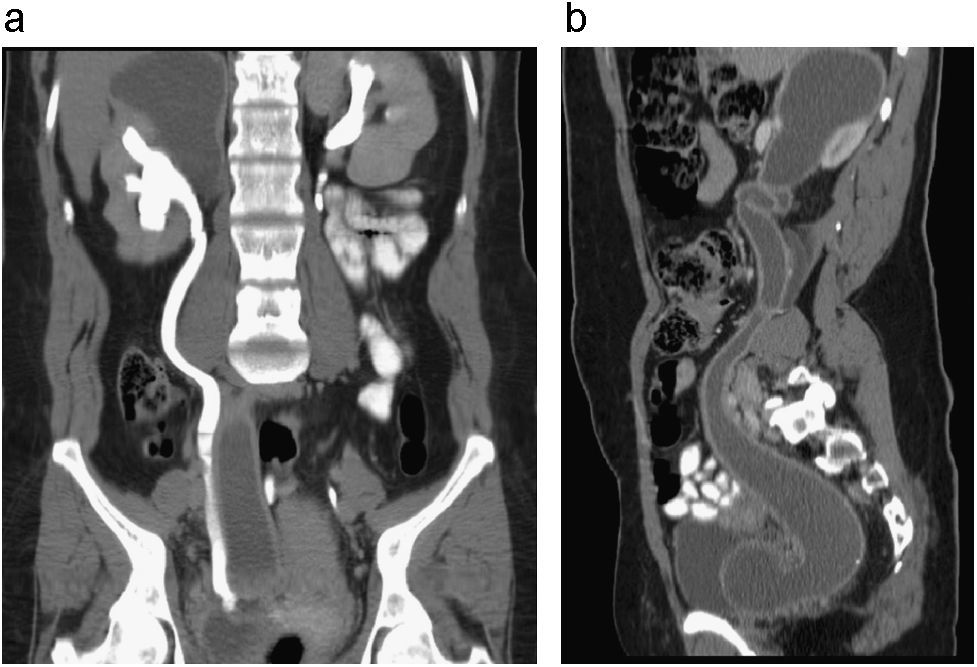
Agenesia renal izquierda Ectopia renal solitaria asociada a megauréter primario. Corte axial de UT (a) y reconstrucción coronal PMI en fase excretora (b). Se identifica riñón único derecho de localización normal. El uréter cruza la línea media hacia el lado izquierdo para descender hacia la vejiga e insertarse finalmente en una posición normal. Estos hallazgos se asocian a la presencia de ureterohidronefrosis secundaria a megauréter primario. Se observa signo del pico en (b).
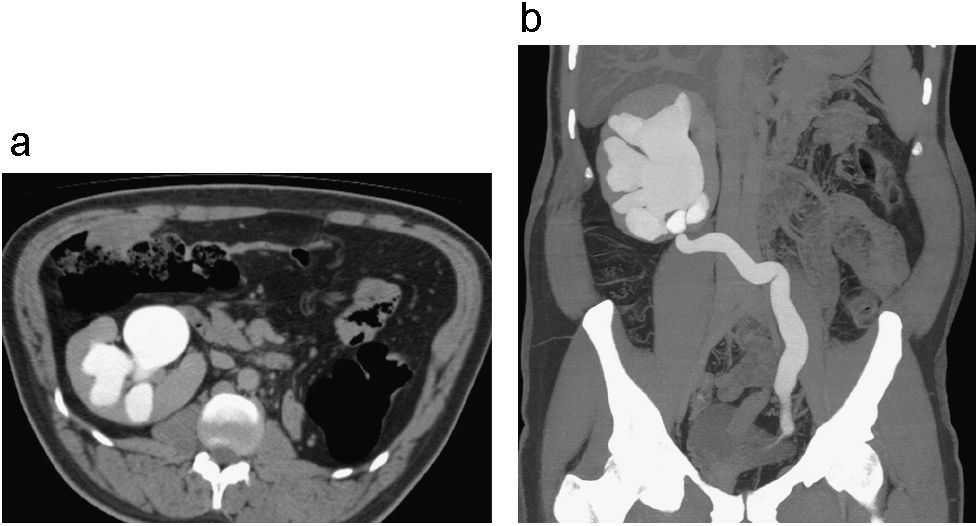
Ectopia renal cruzada no fusionada izquierda. Reconstrucción multiplanar coronal en fase nefrográfica (a) donde se demuestra la relación anatómica de ambos riñones y la no fusión de los mismos y reconstrucción coronal PMI en fase excretora (b) donde el uréter del riñón ectópico cruza la línea media para insertarse en la vejiga en una posición normal.
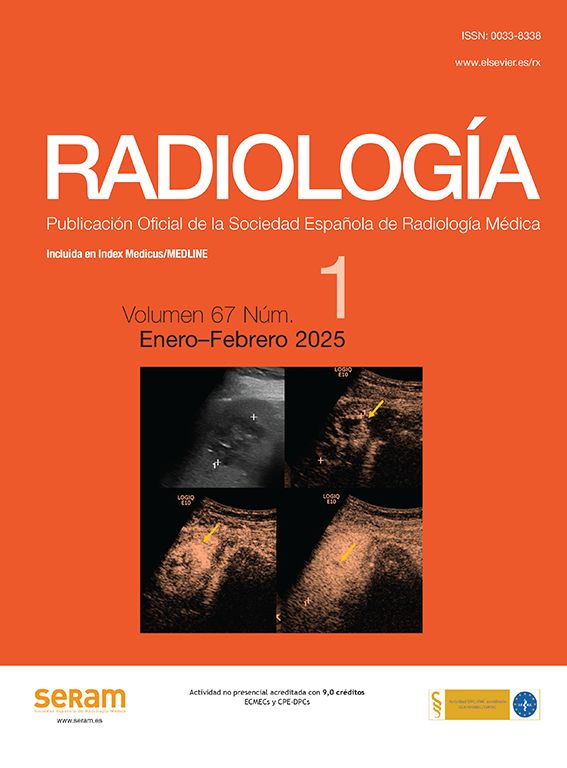
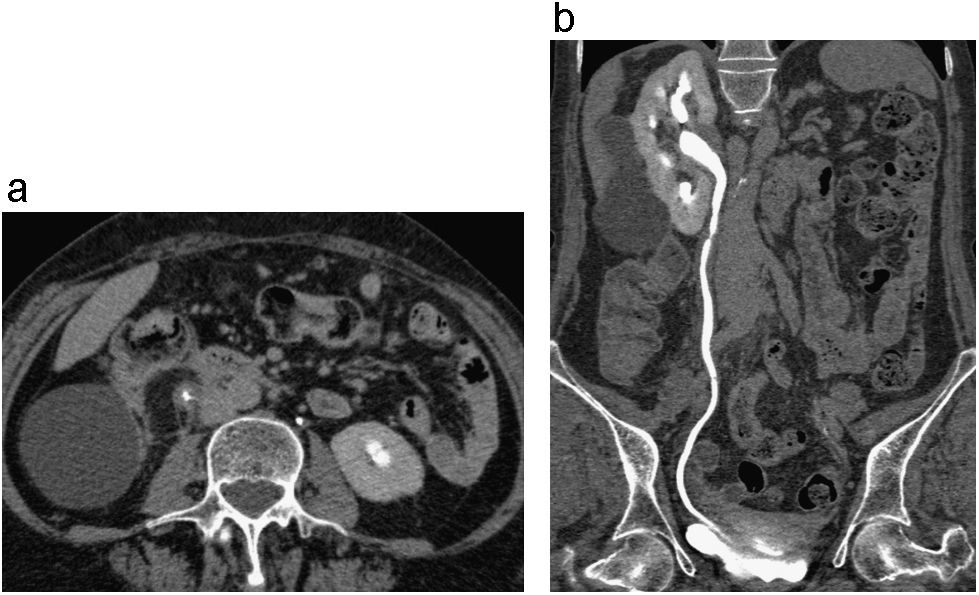
Uréter retrocavo derecho. Corte axial de TCMD en fase excretora (a); Reconstrucción coronal 3D (b). Se identifica dilatación significativa del sistema calicial y del uréter proximal derechos con una zona de transición y disminución del calibre en el tercio medio, sitio en el cual el uréter sigue un curso medial y posterior, rodeando parcialmente la vena cava inferior. Posteriormente el uréter continúa su curso descendente hacia la vejiga. Hay paso de medio de contraste al uréter distal, el cual es de calibre normal.
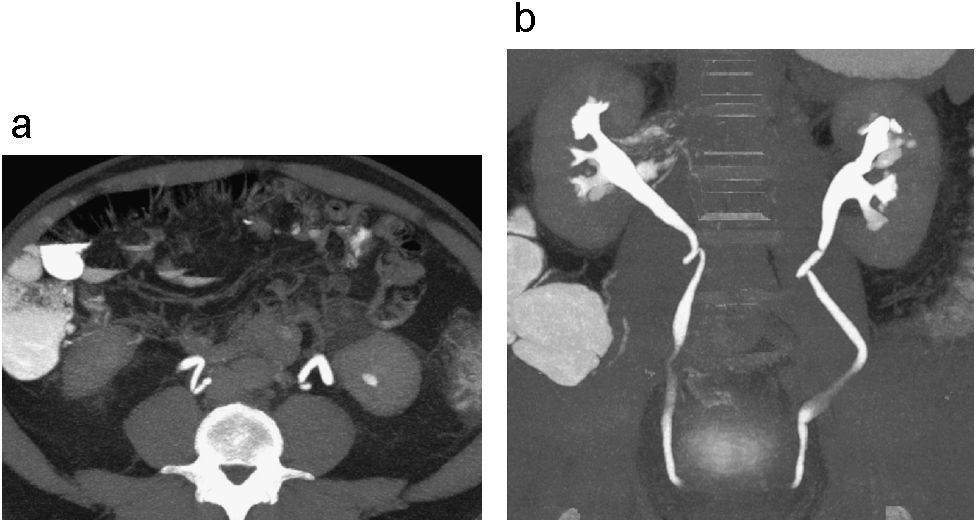
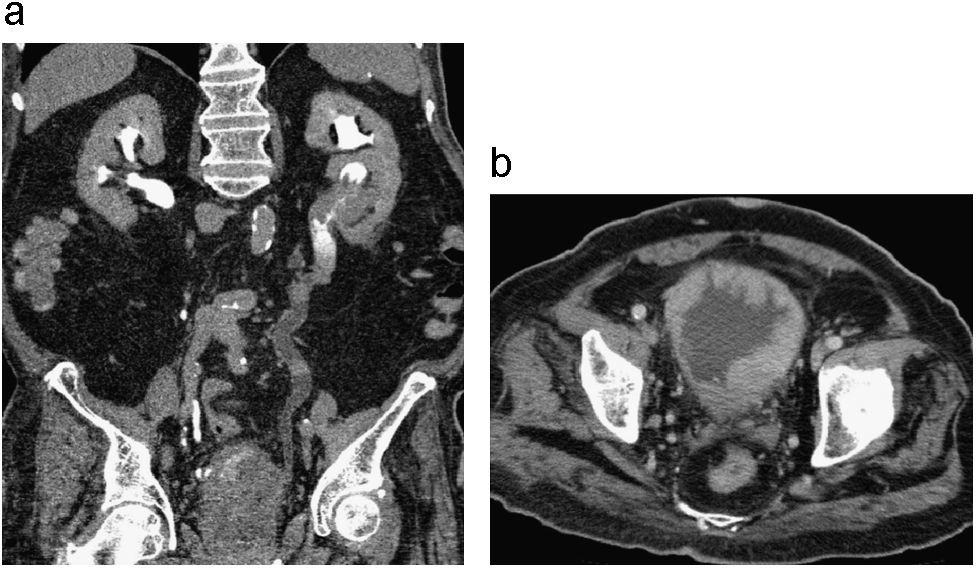
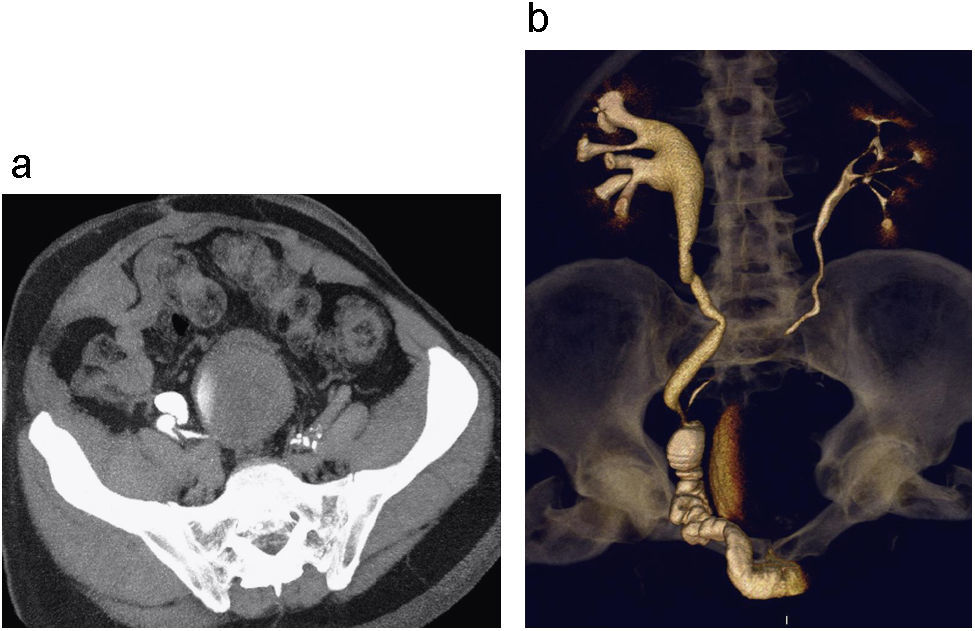
Estenosis ureteral por vasos iliacos. Corte axial de UT (a) en fase excretora donde se observa adelgazamiento del calibre del uréter derecho opacificado con medio de contraste por compresión extrínseca de vaso iliaco. Reconstrucción 3D coronal (b) donde no se identifica llenado del tercio distal del uréter derecho observándose ureteroectasia proximal secundaria a compresión vascular localizada entre el tercio medio y distal del uréter derecho.
A continuación mencionaremos brevemente las anomalías congénitas y variantes más frecuentemente relacionadas con alteración del trayecto, calibre, morfología e inserción del uréter.
Las duplicaciones del uréter y el sistema colector son las anomalías más frecuentes (1 en 160 nacidos vivos), con una fuerte asociación familiar. Las duplicaciones parciales, en las que ambos uréteres se unen para insertarse en la vejiga en un solo meato, son más comunes que las duplicaciones completas en las que cada uréter se inserta en meatos distales separados. En las duplicaciones completas se cumple la ley de Weigert-Meyer, que establece que el uréter que drena el polo superior del riñón se inserta medial y distal (inferior) al sitio de inserción del uréter que drena el segmento inferior del riñón. En estos casos el uréter que drena el polo superior frecuentemente termina en ureterocele, mientras que el uréter que drena la porción inferior del riñón muestra típicamente reflujo (fig. 1)11–13.
El ureterocele representa una dilatación quística del segmento intravesical del uréter. Hasta el 75% de ureteroceles aparecen en duplicidades ureterales completas y se localizan en el sitio ectópico de inserción del uréter que drena el polo superior del riñón (fig. 1). La mayoría de los ureteroceles ocurren en niñas y se asocian a pelvicaliectasia y ureteroectasia, mientras que en niños están usualmente asociados con sistema colector no duplicado11,13. Los ureteroceles de sistemas únicos pueden tener un sitio de inserción ureteral normal o pueden insertarse ectópicamente. Independientemente de su localización casi siempre están asociados a obstrucción de la unión ureterovesical o riñón displásico multiquístico. El ureterocele «simple» no obstructivo que se presenta en el adulto es raro en la niñez12.
El uréter ectópico puede presentarse aisladamente aunque en >70% de casos se asocia a duplicidad pieloureteral completa11. Generalmente esta ectopia se produce en una localización más caudal a la usual. En las mujeres se puede insertar en la porción más inferior de la vejiga, uretra, vestíbulo o vagina y menos frecuentemente en el útero. En el hombre el uréter ectópico puede extenderse hasta la porción más inferior de la vejiga, uretra posterior, vesículas seminales, vasos deferentes y conducto eyaculador. La diferencia fundamental entre ectopia ureteral en mujeres y en hombres es que en las mujeres los uréteres ectópicos pueden terminar distal a los mecanismos de continencia que proporcionan el cuello de la vejiga y el esfínter externo y por lo tanto pueden estar asociados a incontinencia11.
La obstrucción de la unión ureteropélvica (UUP) es la causa más frecuente de hidronefrosis fetal/ neonatal y predomina en varones. El riñón izquierdo se afecta con doble frecuencia que el derecho y es bilateral en un 10–30% de los casos (fig. 2)12,14. El origen de esta alteración puede ser primario, dentro del cual se incluyen causas intrínsecas o funcionales y causas extrínsecas como vasos aberrantes, bandas adventiciales, quistes renales y aneurismas de aorta. La obstrucción de la UUP también puede ser secundaria a procesos inflamatorios, cálculos, isquemia y lesión iatrogénica. En las imágenes se identificará una importante disminución del calibre en las UUP asociada a dilatación del sistema colector proximal12,15.
Las variantes y anomalías congénitas del uréter pueden estar íntimamente relacionadas con anomalías renales, ya que estas dos estructuras están ligadas desde el punto de vista embriológico. Los uréteres de riñones ectópicos (ej. pélvicos, intratorácicos), pueden tener una longitud variable, trayecto no usual y pueden o no insertarse de forma adecuada a la vejiga12,16. La ectopia cruzada y el riñón en herradura muy probablemente representan un mismo espectro de anomalías en el ascenso renal, posición y fusión. En la ectopia renal cruzada el riñón ectópico se encuentra localizado caudal y medial a su localización normal, en la línea media o completamente en el lado opuesto del abdomen; usualmente el riñón ectópico está fusionado al riñón de posición habitual, una condición conocida como «ectopia renal cruzada fusionada». La ectopia cruzada sin fusión ocurre en menos del 10% de los casos. La ectopia renal cruzada solitaria y ectopia renal cruzada bilateral son entidades muy raras (figs. 3 y 4). En todos los casos de ectopia renal cruzada, fusionada o no fusionada, el uréter que drena el riñón cruzado ectópico cruza la línea media para insertarse en su lado y ubicación habitual en el trígono de la vejiga12,17. En el caso del riñón en herradura el eje renal es inverso y los polos inferiores tendrán localización medial con respecto a los polos superiores. Los riñones también están malrotados anteriormente lo cual favorece que la pelvis y la unión uretero-pélvica estén localizadas anteriormente y a su vez los uréteres se encuentren desplazados anteriormente por el istmo. La obstrucción de la unión ureteropélvica ocurre en 30% de pacientes con riñón en herradura y puede ser causada por estenosis intrínseca, por inserción ureteral alta, por obstrucción extrínseca por el istmo o por un vaso anómalo12.
La UT es una herramienta diagnóstica de gran ayuda, ya que no sólo permite caracterizar adecuadamente el tipo de anomalía congénita, sino también las alteraciones en el trayecto, calibre e inserción ureterales relacionados con dichas anomalías.
El megauréter es un término genérico que se refiere a dilatación ureteral, con o sin dilatación concomitante del sistema colector superior. El megaurétér primario es debido a una alteración congénita idiopática de la unión ureterovesical. En el megaurétér primario obstructivo se observa dilatación por encima de un segmento ureteral yuxtavesical corto y aperistáltico que a su vez tiene la clásica apariencia de «pico». El orificio ureteral y el túnel submucoso son normales. El uréter normal, proximal al segmento aperistáltico se dilata por la presencia de una obstrucción relativa11.
El uréter retrocavo es una anomalía del desarrollo de la vena cava inferior (VCI) poco frecuente, con una incidencia de 1 en 1.000 y correspondiendo al 0,1% de las anomalías de la VCI18,19. Normalmente la VCI se origina de las venas supracardinales y subcardinales, superiores e inferiores al riñón respectivamente. Cuando la vena subcardinal se localiza anterior al uréter, dará origen al uréter retrocavo18,19. La mayoría de los pacientes adultos son diagnosticados por estudio de procesos infecciosos como pielonefritis18. En las imágenes de UT observaremos como el uréter derecho pasa medial y por detrás de la VCI, cefálico a la confluencia de las venas iliacas. Emerge entre la VCI y la aorta y luego pasa sobre la superficie anterior de la VCI antes de descender a la vejiga. El uréter derecho retrocavo característicamente se desvía sobre el margen superior y medial del cuarto pedículo lumbar, donde es comprimido detrás de la vena cava inferior, produciendo un grado variable de obstrucción y dilatación proximal (fig. 5)12,18.
Dentro de las variantes más frecuentes tenemos el asa ureteral y la estenosis por vasos iliacos. Ocasionalmente los uréteres pueden tener un trayecto tortuoso. Este fenómeno se encuentra más frecuentemente en pacientes en los que se hace la adquisición en inspiración (el diafragma y los riñones se encuentran localizados en una posición más caudal), en pacientes con riñones ptósicos y en pacientes que han tenido obstrucción previa del tracto urinario. En algunas ocasiones la formación de un asa ureteral puede causar defectos de llenado que pueden ser confundidos con pequeñas neoplasias uroteliales (fig. 6)20,21. Los diagnósticos erróneos debidos a asa ureteral pueden ser evitados por el reconocimiento del curso tortuoso del uréter. El posproceso de las imágenes puede ser también de gran ayuda ya que la anatomía es mejor representada cuando se revisan las imágenes en reconstrucciones 3D en el plano coronal o sagital2,6. Adicionalmente, al protocolo convencional de UT se puede adquirir una fase arterial con el fin de caracterizar mejor las estructuras vasculares e identificar con mayor precisión el origen de la anomalía1.
Por otra parte no es infrecuente encontrar vasos iliacos y vasos ováricos que se localizan en la vecindad del trayecto ureteral produciendo identación del uréter o fenómeno obstructivo por compresión extrínseca (fig. 7). Este hallazgo es mejor visualizado en la fase excretora de la UT, donde se observa como un defecto de llenado en íntima relación con una estructura vascular adyacente, que en algunos casos no es fácil de visualizar. Este fenómeno se presenta más frecuentemente en el infundíbulo del polo superior del riñón, pero también se puede presentar en la pelvis renal, unión ureteropélvica y uréter20,22.
Procesos inflamatoriosCorresponden a la condición inflamatoria del uréter causada principalmente por infección, irritación mecánica secundaria a litiasis o secundaria a procedimientos quirúrgicos. Cuando se trata de proceso infeccioso lo más frecuente es que corresponda a la extensión desde los riñones o la vejiga. Los hallazgos más típicos son el engrosamiento difuso del uréter y el realce anormal de las paredes uroteliales (fig. 1).
El engrosamiento y realce difuso del uréter puede ser originado por inflamación ureteral o neoplasias ureterales (fig. 8). Estas dos etiologías pueden ser indistinguibles por UT aún incluso en tumores multifocales. Además de las infecciones bacterianas comunes, dentro de las cuales los microorganismos gram negativos desempeñan el papel más importante, las infecciones por hongos y micobacterias se presentan con alguna relativa frecuencia, por lo cual se discutirán a continuación.
Las enfermedades fúngicas del riñón y el uréter se desarrollan como infecciones oportunistas que ocurren principalmente en pacientes con resistencia del huésped alterada, como aquellos con diabetes mellitus, uso de antibióticos sistémicos, uso de agentes quimioterapéuticos e inmunosupresores, uso de catéteres intravenosos y urinarios, inmunodeficiencia adquirida y trasplante renal. Varios tipos de gérmenes han sido identificados comprometiendo el tracto urinario, dentro de los cuales se encuentra la Candida albicans u otras Candidas spp. pero también se ha publicado asociación con coccidiodomicosis immitis, criptococo neoformans, torulopsis glabrata y Aspergillus fumigatus23,24. Las infecciones fúngicas también pueden presentarse después de una colonización previa por gérmenes bacterianos24. Los hallazgos en UT serán indistinguibles de otras causas de inflamación ureteral, consistentes en engrosamiento del uréter y realce anormal tras administrar medio de contraste intravenoso.
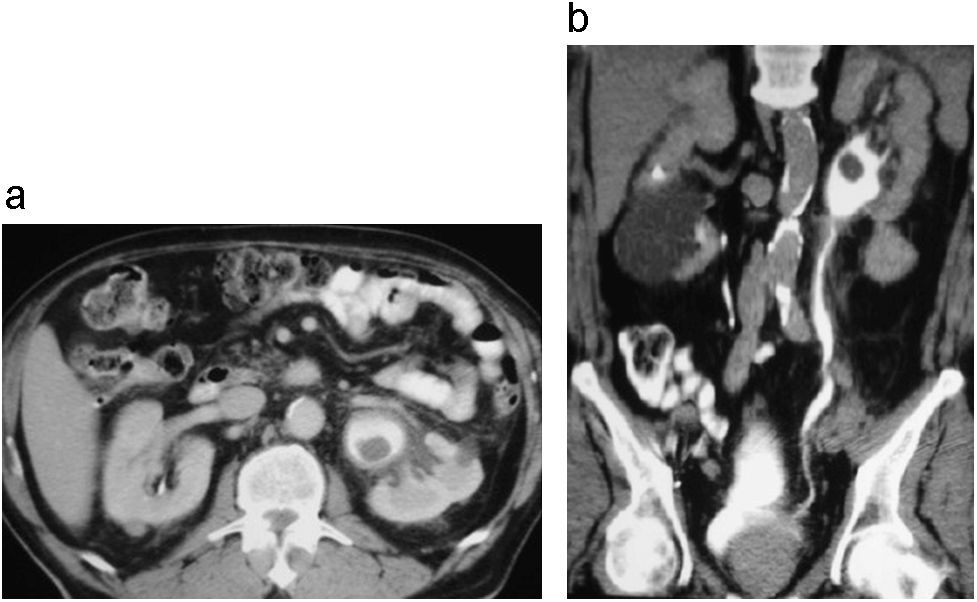
La infección del tracto urinario superior por hongos no es una entidad infrecuente; sin embargo, la formación de un micetoma (bola fúngica) en el trayecto de la pelvis renal y el uréter es rara (fig. 9). Este tipo de afectación sólo se encuentra descrito en casos aislados, generando fenómenos inflamatorios y en algunos casos obstructivos en el sistema excretor y uréter adyacentes. La candida tropicalis y el aspergillus flavus son algunos de los gérmenes que se han asociado a esta entidad25–27.
Micetoma en pelvis renal izquierda asociado a compromiso inflamatorio del uréter proximal. Corte axial (a) y reconstrucción coronal (b) de UT en fase excretora donde se identifica engrosamiento de la pared y dilatación de la pelvis renal izquierda con incremento de la atenuación de la grasa adyacente, asociado a un área de defecto de llenado ovalada con densidad de tejidos blandos. También se observa engrosamiento del tercio proximal del uréter izquierdo por afectación inflamatoria.
La tuberculosis (tbc) del tracto urinario es la manifestación más frecuente de tuberculosis extrapulmonar, afectando un 8–15% de pacientes con tbc pulmonar28. El riñón se ve afectado por diseminación hematógena desde los pulmones, con compromiso consecuente de los ureteres y la vejiga a través de una infección descendente del sistema colector. Afecta a todas las edades pero predomina en el hombre en la cuarta a quinta décadas de la vida29,30.
En la tuberculosis (tbc) del tracto urinario las lesiones progresan de una forma indolente y frecuentemente producen pocos síntomas hasta que existe afectación difusa del tracto urinario, produciendo sintomatología del tracto urinario inferior como incremento de la frecuencia, disuria y nicturia. Cerca de 1/4 de los pacientes tienen hematuria macroscópica y menos del 10% manifiestan síntomas constitucionales. Aproximadamente 10% de los pacientes son totalmente asintomáticos, pero presentan los hallazgos clásicos de laboratorio de piura estéril, característicos de esta entidad30,31.
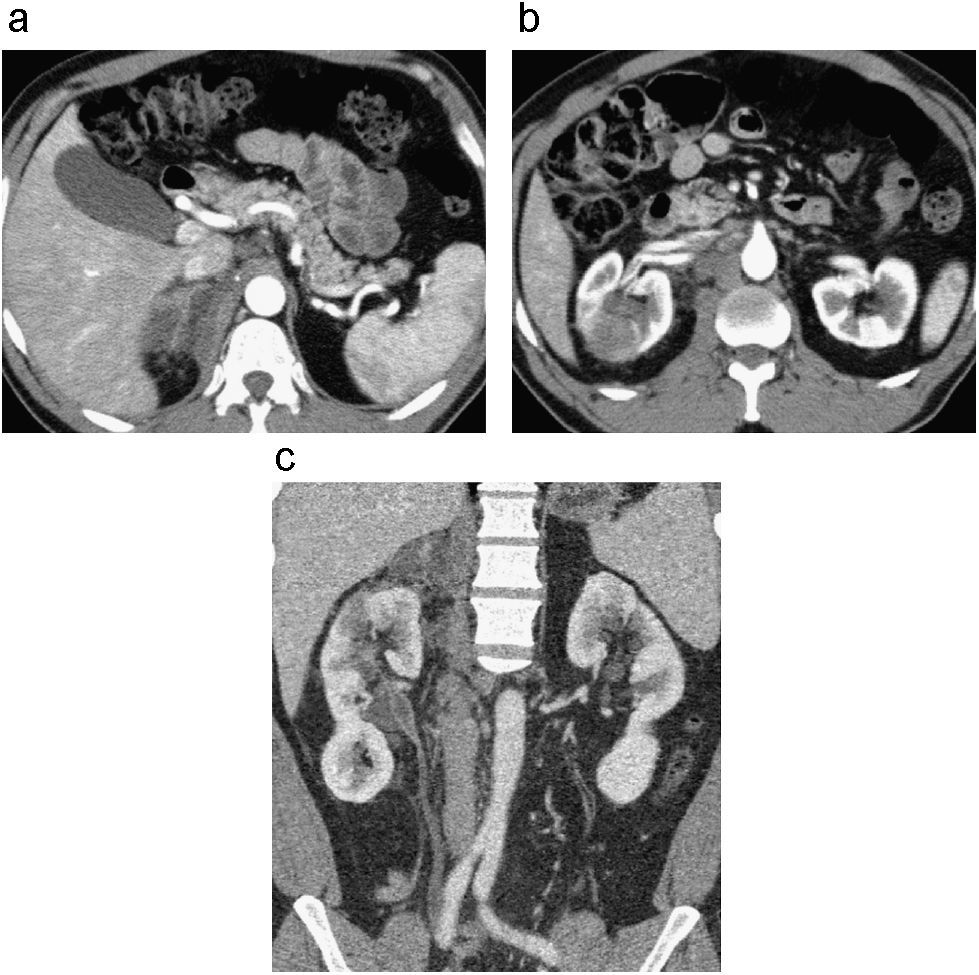
Los hallazgos radiológicos en la tuberculosis del tracto urinario dependen de la extensión de la enfermedad31. La TCMD es de gran ayuda para evaluar la extensión del compromiso renal y la diseminación en las estructuras extrarenales incluyendo el uréter. Durante la fase activa de la enfermedad los hallazgos en el sistema excretor y uréter serán indistinguibles de otras patologías inflamatorias, identificándose engrosamiento y realce anormal de la pelvis renal y uréter proximal secundarios al compromiso por contigüidad con el riñón (fig. 10). En algunos casos puede encontrarse dilatación e irregularidad del urotelio por obstrucción de la unión ureterovesical secundaria a ureteritis32,33. Cuando la enfermedad avanza se puede observar acortamiento y estrechez ureteral, que en algunos casos se asocian a ureterohidronefrosis proximal, defectos de llenado en la fase excretora o incluso calcificaciones de la pared ureteral30,33,34. En la evaluación de la UT no debe olvidarse la valoración de hallazgos que sugieran la posibilidad de afectación renal y que permitan el diagnóstico de tbc del tracto urinario. La alteración del contorno calicial será el hallazgo más temprano; en etapas más tardías podremos identificar masa renal, cicatrices parenquimatosas y atrofia cortical, necrosis papilar, calcificaciones parenquimatosas, estenosis infundibulares y autonefrectomía30,33.
TBC con compromiso renal, perirrenal, glándula suprarrenal, pelvis renal y uréter. Cortes axiales de tomografía de abdomen en fase corticomedular (a, b) y reconstrucción coronal en fase nefrográfica (c). Se identifica engrosamiento y realce anormal de la glándula adrenal derecha, asociado a estriación de la grasa adyacente por compromiso inflamatorio (a). Lesión hipodensa seudonodular de contornos mal definidos que compromete el polo superior y tercio medio del riñón derecho con cambios inflamatorios asociados de la grasa perirrenal (b, c). También se observa extensión del proceso inflamatorio granulomatoso al tercio proximal del uréter ipsolateral, representado por engrosamiento y realce anormal de sus paredes (c).
Otros hallazgos diferentes a los encontrados en el tracto urinario pueden sugerir al radiólogo el diagnóstico de tbc. Aproxidamente 1/3 de los pacientes pueden presentar este tipo de hallazgos, incluyendo el compromiso de ganglios linfáticos abdominales retroperitoneales en algunos casos calcificados, alteraciones características en bazo, hígado, suprarrenales y tbc ósea con afectación de cadera, articulaciones sacroiliacas o columna, con o sin absceso paraespinal30,32.
La ureteritis quística es una condición poco frecuente en la cual pequeños quistes que contienen líquido proteínico son encontrados en la submucosa del uréter. Cuando se localiza en el sistema colector intrarrenal se conoce como pielitis quística. Su etiología es desconocida pero generalmente está relacionada con enfermedad litiásica e infección del tracto urinario crónica. Los hallazgos por imagen consisten en múltiples defectos de llenado mural, oval, lisos que protruyen en el lumen ureteral35.
Neoplasias (fig. 11)La afectación infiltrativa neoplásica mas común del uréter es el carcinoma de células transicionales (CCT), el cual se presenta más frecuentemente en el hombre que en la mujer (relación 2:1), con un pico de incidencia en la séptima década de la vida36.
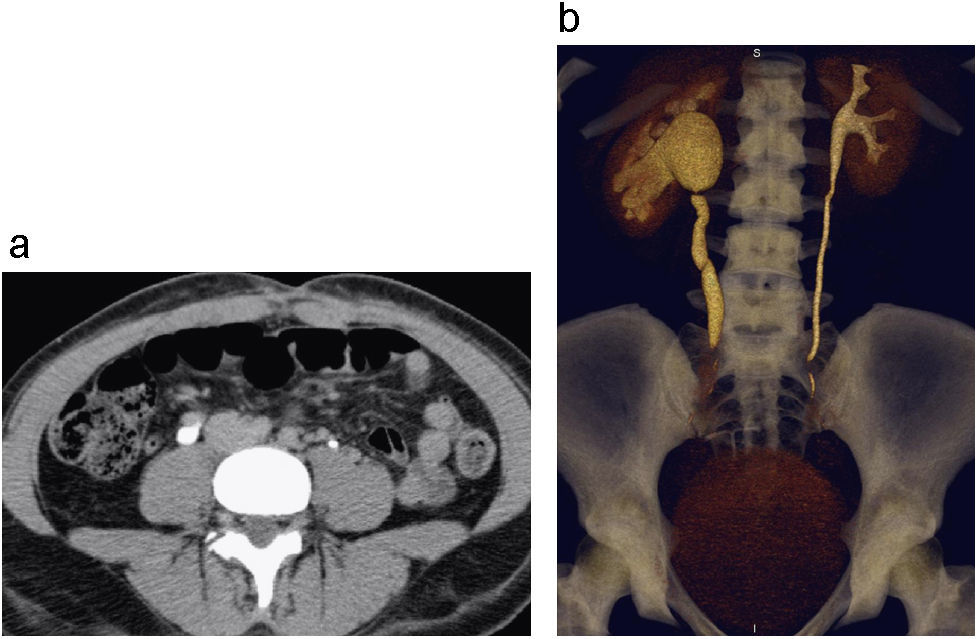
CCT multifocal. Reconstrucción coronal en fase excretora (a) donde se identifica realce anormal con atenuación de tejidos blandos por compromiso tumoral del sistema pieloexcretor inferior del riñón izquierdo, donde se observa paso filiforme del medio de contraste, asociado a deficiencia en el llenado distal con el MC (a). También hay afectación de al menos 2 niveles diferentes del uréter ipsilateral. Corte axial de CTMD (b) en fase nefrográfica con engrosamiento marcado y nodular de las paredes de la vejiga, las cuales tienen un realce anormal también por compromiso infiltrativo tumoral (b).
En los últimos años se ha incrementado la incidencia de tumores uroteliales, lo cual puede estar en relación con el mejor desarrollo de técnicas diagnósticas y elevación de tasas de supervivencia de pacientes con carcinoma de vejiga, los cuales tienen alto riesgo de desarrollar tumores del tracto urinario superior37. Éstos ocurren en el 2–4% de pacientes con cáncer de vejiga y esta es la razón por la cual estos últimos deben ser estudiados con imágenes del tracto urinario superior. Adicionalmente el 40% (rango: 20–70%) de pacientes con CCT del tracto urinario superior también desarrollarán CCT del tracto urinario inferior36.
Los tumores ureterales primarios son relativamente raros, correspondiendo aproximadamente al 1% de todos los tumores del tracto urinario31. Aproximadamente 73% de tumores uroteliales están localizados en el uréter distal, 24% en el medio y solo 3% en el proximal. El 75% de todas las neoplasias uroteliales primarias son de origen epitelial. La neoplasia epitelial más frecuente es el carcinoma de células transicionales, que se divide a su vez en un subtipo papilar y un subtipo no papilar. Los tumores papilares constituyen el 80–85% de CCT y tienen mayor tendencia a ser multicéntricos que los no papilares. El carcinoma de células escamosas es el tumor epitelial más maligno que compromete el uréter pero comprende menos del 10% de las neoplasias epiteliales ureterales primarias. El adenocarcinoma es extremadamente raro31,38.
La UT, a diferencia de otros métodos diagnósticos como la urografía excretora, permite evaluar y diferenciar adecuadamente algunas estructuras que pueden superponerse sobre el uréter distal como la vejiga, gas intestinal y hueso37. En la fase basal el engrosamiento circunferencial de la pared urotelial será el hallazgo radiológico más frecuente y durante la fase nefrográfica se podrá observar realce anormal de la pared del urotelio y lesiones endoluminales. En la fase excretora el CCT se manifiesta con áreas de defecto de llenado (fig. 11). Como mencionamos previamente estas características radiológicas serán en algunas ocasiones difíciles de diferenciar de procesos inflamatorios36,38.
Dentro de los diagnósticos diferenciales de CCT se encuentran los tumores benignos del urotelio, que corresponden aproximadamente al 20% de tumores ureterales. Dentro de los tumores benignos, más comunes se encuentra el papiloma benigno, caracterizado en las imágenes por un defecto de llenado solitario que se encuentra unido a la pared ureteral por un tallo31,38 y el pólipo fibroepitelial, el cual es una lesión de origen no epitelial que varía de tamaño, desde pocos milímetros hasta varios centímetros de longitud. Generalmente tienen una forma cilíndrica y lisa y suelen tener un tallo largo que permite que en algunos casos sean móviles. A diferencia de los tumores malignos primarios estos pólipos se encuentran más frecuentemente en el tercio proximal del uréter y típicamente ocurren en pacientes de 20–40 años de edad31,38. En nuestro concepto estas lesiones benignas la mayoría de veces son difíciles de diferenciar de CCT por lo cual el diagnóstico definitivo sólo podrá ser hecho por el análisis anatomo patológico.
Dentro de los diagnósticos diferenciales también deben ser tenidas en cuenta otras entidades que producen defectos de llenado intraluminal, como aquellos producidos por cálculos de ácido úrico (que a diferencia de los tumores producen sombra acústica en la ecografía y son más densos que los tejidos blandos en la TC), coágulos ureterales (son más densos que los tejidos blandos y se resuelven espontáneamente), papilas desprendidas (fragmentos que pueden ser recuperables en la orina y cuyo sitio de origen puede ser visualizado en la UT31,38.
Iatrogenia y Post-quirúrgicos (figs. 12–15)Una gran variedad de procedimientos quirúrgicos abdominales, pélvicos, ginecológicos y urológicos pueden producir lesión ureteral. Se calcula que la lesión ureteral puede ocurrir en 0,1–1,5% de cirugía pélvicas mayores39. Los procedimientos endo-urológicos como la ureterolitotomía y la ureteroscopia, a pesar de ser procedimientos menos invasivos, no son del todo inocuos y también se pueden asociar a lesiones ureterales, que van desde estenosis ureterales, reportadas con una incidencia entre 1–11% después de una endoscopia del tracto urinario superior, hasta perforaciones ureterales con formación consiguiente de urinoma (fig. 12). La cirugía ginecológica tiene un riesgo particularmente alto, causando más del 50% de lesiones iatrogénicas del uréter. Las cirugías urológicas ocasionan un 30% y los procedimientos quirúrgicos abdominales generales un 5–15%39,40. La histerectomía radical es el procedimiento ginecológico más frecuentemente asociado a lesión ureteral, ocurriendo en 10–30% de los casos, relacionado con ligadura inadvertida del uréter o asociada a compromiso del flujo sanguíneo de los uréteres distales durante la disección de los linfáticos periureterales. Los pacientes con esta complicación se presentan con necrosis ureteral, urinoma y formación más tardía de estenosis ureteral39–41.
Ruptura iatrogénica del uréter izquierdo. Paciente con antecedente de litotomía endoscópica. Corte axial de TCMD en fase nefrográfica (a), donde se identifica engrosamiento y realce anormal del tercio proximal del uréter izquierdo, con aumento de la atenuación de la grasa perirrenal y periureteral y reconstrucción coronal de UT en fase excretora MIP (b) donde se observa extravasación del medio de contraste y formación de urinoma.
Complicación postquirúrgica con ligadura accidental del tercio distal de ambos uréteres. Reconstrucción coronal en fase de excreción renal. Paciente de 25 años con antecedente reciente de cesárea. Se identifica ureterohidronefrosis bilateral con amputación abrupta de ambos uréteres.
Transverso uretero-ureterostomia. Paciente con antecedente de cáncer de cervix con compromiso infiltrativo del tercio distal del ureter derecho. Se observa reconstrucción 3D de urotomografía en fase excretora donde se identifica anastomosis permeable del uréter derecho al tercio distal del uréter izquierdo.
Neovejiga ortotópica de Studer. Paciente con antecedente de cistectomía radical por ca. de vejiga. Corte axial de UT en fase excretora (a) obtenida a través de la pelvis a nivel de la anastomosis uretero ileal, y reconstrucción coronal 3D de UT en fase excretora (b) donde se evidencia una adecuada preservación de la porción inferior de ambos uréteres, el cual es el objetivo primordial de este tipo de procedimiento quirúrgico. Se observa además un paso adecuado de contraste al reservorio ileal.
La lesión ureteral bilateral generalmente es reconocida en el periodo posoperatorio inmediato por la presencia de anuria (fig. 13). La lesión ureteral unilateral puede pasar desapercibida en un principio y generalmente no es reconocida hasta 10–30 días después de la cirugía. La fiebre y el dolor en el flanco ipsolateral son los síntomas más frecuentes, aunque en un número significativo de pacientes no se reconoce hasta que desarrollan una fístula ureterovaginal o ureterocutánea39–41.
Existen una gran variedad de procedimientos quirúrgicos que implican al uréter y que se realizan de acuerdo a la experiencia de cada centro. La UT cada vez tiene un papel más importante en el seguimiento de estas cirugías y el reconocimiento de sus complicaciones1,2. Algunos ejemplos de estos procedimientos son la reimplantación ureteral, ureterolitotomías ureteroscopias y evaluación de neovejigas, entre muchos otros42,43. Aunque no es el objetivo de este artículo describir cada uno de estos procedimientos, es importante que el radiólogo esté familiarizado con los aspectos generales de cada una de las técnicas quirúrgicas, para que de esta forma pueda realizar una mejor interpretación de la UT y se puedan identificar complicaciones tempranas y tardías, evaluando detalladamente las diferentes anastomosis uretero-intestinales, presencia de fistulas, colecciones, ureterohidronefrosis etc. (figs. 14 y 15)39,43.
ConclusiónLa TCMD y muy especialmente la UT constituyen hoy en día una herramienta fundamental para identificar y diagnosticar una gran variedad de patologías del uréter.
AutoríaJorge Mejia Restrepo: aporte de casos (imágenes) recolectados en los últimos años de tomografía multidetector. Revisión crítica.
Juan Esteban López: redacción del trabajo y revisión crítica.
Carlos Nicolau Molina: redacción del trabajo y revisión crítica.
Alejandro Zuluaga: redacción del trabajo y revisión crítica.
Mauricio Mazzaro: revisión Crítica.
Todos los autores anteriormente mencionados han leído y autorizan la versión final del artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.