La secuencia fluid attenuated inversion recovery (FLAIR) forma parte hoy en día de la gran mayoría de protocolos diagnósticos de RM cerebral. Esta secuencia de inversión-recuperación permite una supresión de la señal del líquido cefalorraquídeo, lo que facilita la detección de enfermedad que afecta al espacio subaracnoideo. Las causas de hiperintensidad del líquido cefalorraquídeo en esta secuencia pueden subdividirse en 2grandes grupos, las patológicas y las debidas a artefactos. Son bien conocidas la etiología tumoral, la inflamatoria, la vascular o las debidas a hipercelularidad del líquido cefalorraquídeo o a ocupación por contenido hemático. Sin embargo, existen numerosas condiciones no patológicas, principalmente debidas a artefactos, que se relacionan con este hallazgo constituyendo una potencial fuente de errores diagnósticos.
The fluid-attenuated inversion recovery (FLAIR) sequence forms part of the vast majority of current diagnostic protocols for brain MRI. This sequence enables the suppression of the signal from cerebrospinal fluid, facilitating the detection of disease involving the subarachnoid space. The causes of hyperintensity in the arachnoid space in this sequence can be divided into two main categories: hyperintensity due to disease and hyperintensity due to artifacts. Hyperintensity due to tumors, inflammation, vascular disease, or hypercellularity of the cerebrospinal fluid or hematic contents is well known. However, numerous other non-pathological conditions, mainly due to artifacts, that are also associated with this finding are a potential source of diagnostic errors.
- –
La importancia que hoy en día tiene la secuencia FLAIR obliga a los radiólogos a estar familiarizados con las distintas causas patológicas de hiperintensidad en el espacio subaracnoideo. El análisis de la distribución y de otros hallazgos asociados pueden ayudar a dilucidar su etiología.
- –
El aumento de la señal del espacio subaracnoideo en la secuencia FLAIR puede deberse a la presencia de contenido hiperproteico, hemático o a un incremento de la celularidad, ya sea debida a linfocitosis, de naturaleza inflamatoria o tumoral.
- –
En ocasiones, el aumento de señal visualizado no constituye un hallazgo patológico, sino que es debido a artefactos, que debemos conocer para evitar potenciales errores diagnósticos.
- –
El tiempo de inversión largo aporta a la secuencia FLAIR cierto grado de potenciación en T1, lo que permite valorar el realce con contraste intravenoso de determinadas lesiones, a pesar de estar muy potenciada en T2.
- –
La secuencia FLAIR con contraste permite diferenciar entre estructuras vasculares y lesiones leptomeníngeas verdaderas, pues esta secuencia no muestra captación de venas corticales, a diferencia de la secuencia T1 con contraste, siendo de especial relevancia en pacientes con sospecha de meningitis o carcinomatosis leptomeníngea.
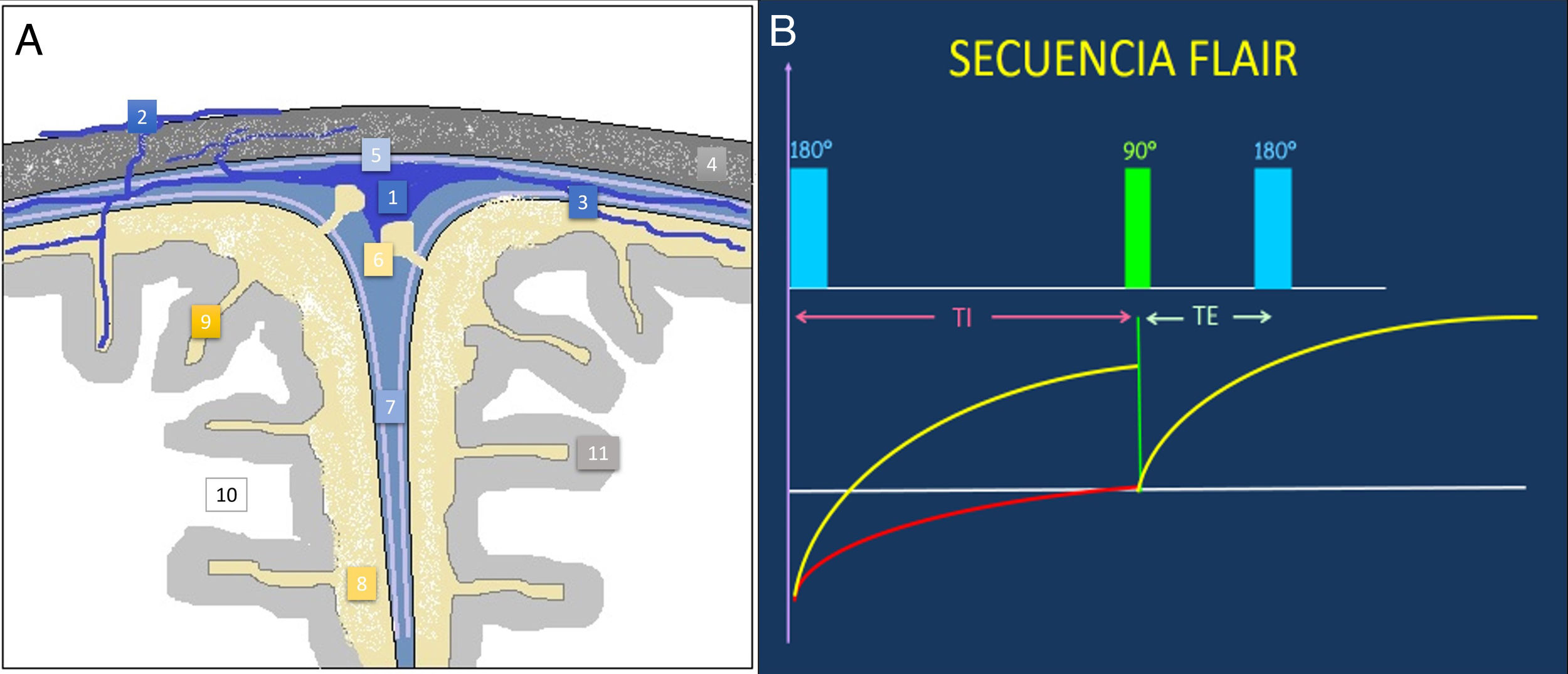
El espacio subaracnoideo (ESA) es el espacio extraaxial situado entre la piamadre en profundidad y la aracnoides superficialmente, ambas conocidas como leptomeninges (fig. 1). Contiene líquido cefalorraquídeo (LCR), canales vasculares y nervios craneales, así como una fina trama de tejido conectivo a los cuales sirve de sostén.
Ilustración anatómica del espacio subaracnoideo y cubiertas meníngeas (A). Esquema de adquisición de la secuencia FLAIR (B). Aplicando un pulso de inversión inicial de 180° y utilizando TI largo previo al pulso de excitación inicial de 90°, se logra suprimir la señal de estructuras que poseen un tiempo de relajación largo, como el LCR. FLAIR: fluid-attenuated inversion recovery; TE: tiempo de eco; TI: tiempo de inversión; 1: seno sagital superior; 2: venas emisarias y diploicas; 3: venas cerebrales piales; 4: calota craneal; 5: duramadre; 6: granulaciones aracnoideas; 7: cisura interhemisférica; 8: espacio subaracnoideo; 9: surcos de la convexidad cerebral; 10: sustancia blanca cerebral; 11: sustancia gris cerebral.
Cortesía del Dr. Javier Lafuente Martínez.
En las circunvoluciones de la convexidad cerebral, donde ambas membranas están en proximidad, este espacio es muy estrecho, prácticamente virtual. Sin embargo, en los surcos y en las cisternas de la base, la aracnoides se aleja del parénquima cerebral acompañando a la duramadre. De esta manera, el ESA se amplía y se hace visible en las distintas pruebas de imagen.
Resonancia magnética: la secuencia FLAIRLa secuencia fluid attenuated inversion recovery (FLAIR) es una secuencia de resonancia magnética (RM) con unos tiempos de repetición (TR) y de eco largos que utiliza un pulso de inversión-recuperación (fig. 1). Mediante un pulso de inversión inicial de 180° y con un tiempo de inversión lo suficientemente largo (del orden de 2.000ms) previo al pulso de excitación inicial de 90°, se logra suprimir la señal de LCR en las imágenes resultantes1. El parénquima cerebral presenta unos valores de intensidad superponibles a los de la secuencia T2, siendo la sustancia gris más hiperintensa que la sustancia blanca.
Una de sus principales aplicaciones es la valoración de cambios sutiles que ocurren en el parénquima cerebral próximo o en contacto con el LCR, como es la sustancia gris en la periferia de los hemisferios o la sustancia blanca periventricular.
A pesar de que las imágenes FLAIR resultantes están muy potenciadas en T2, el TI largo condiciona cierto grado de potenciación en T1. Esto permite valorar el realce de lesiones o de estructuras anatómicas con esta secuencia cuando se administra previamente contraste intravenoso paramagnético2.
Una de las utilidades más aceptadas de esta secuencia FLAIR con contraste es diferenciar entre estructuras vasculares y lesiones leptomeníngeas verdaderas cuando existen dudas en el T1 con contraste, puesto que en la secuencia FLAIR no se identifican captaciones de venas corticales que pueden ser confundidas con realce patológico leptomeníngeo, lo que es especialmente relevante en pacientes con sospecha de meningitis o carcinomatosis leptomeníngea2.
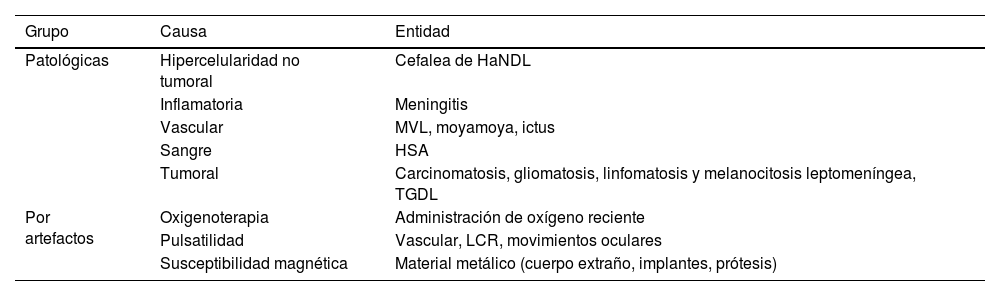
Causas de la hiperintensidad en la secuencia FLAIR en el ESALa hiperintensidad del LCR en el ESA en la secuencia FLAIR es un hallazgo inespecífico en sí mismo que ha sido descrito en numerosas entidades que pueden dividirse en 2grandes grupos (tabla 1):
- –
Patológicas: que incluyen la etiología debida a hipercelularidad del LCR (cefalea de HaNDL, del inglés, Headache and Neurologic Deficits with cerebrospinal fluid Lymphocytosis),inflamatoria (meningitis), vascular (malformación vascular leptomeníngea, enfermedad de moyamoya o en estados de hipoperfusión en el ictus), por ocupación por contenido hemático (hemorragia subaracnoidea [HSA]) o la tumoral (carcinomatosis, melanosis leptomeníngeas y tumor glioneuronal difuso leptomeníngeo).
- –
Por artefactos: en pacientes que reciben oxígeno suplementario, por movimientosoculares, de pulsatilidad vascular o del LCR, o bien, por artefactos de susceptibilidad magnética inducidos por material metálico (p. ej., implantes dentales) o por las estructuras óseas adyacentes de la base craneal. Es importante conocer este grupo para no confundirlo con la presencia de enfermedad leptomeníngea, lo que nos llevará a un error en el diagnóstico definitivo.
Tabla resumen de las principales causas de hiperintensidad de señal en el espacio subaracnoideo en la secuencia FLAIR
| Grupo | Causa | Entidad |
|---|---|---|
| Patológicas | Hipercelularidad no tumoral | Cefalea de HaNDL |
| Inflamatoria | Meningitis | |
| Vascular | MVL, moyamoya, ictus | |
| Sangre | HSA | |
| Tumoral | Carcinomatosis, gliomatosis, linfomatosis y melanocitosis leptomeníngea, TGDL | |
| Por artefactos | Oxigenoterapia | Administración de oxígeno reciente |
| Pulsatilidad | Vascular, LCR, movimientos oculares | |
| Susceptibilidad magnética | Material metálico (cuerpo extraño, implantes, prótesis) |
HaNDL: Headache and Neurological Deficits with cerebrospinal fluid Lymphocytosis; HSA: hemorragia subaracnoidea; LCR: líquido cefalorraquídeo; MVL: malformaciones vasculares leptomeníngeas; TGDL: tumor glioneuronal difuso leptomeníngeo.
Dada la importancia y el uso de rutina que hoy en día tiene la secuencia FLAIR, los radiólogos deben estar familiarizados con las distintas causas patológicas de hiperintensidad en el ESA. El análisis de la distribución y de otros hallazgos asociados pueden ayudar a dilucidar su etiología.
Sin embargo, en muchas ocasiones no habrá otros hallazgos que nos ayuden a establecer un diagnóstico definitivo, en cuyo caso será necesaria la correlación con la historia clínica y el análisis del LCR.
En términos generales, la señal de LCR en esta secuencia no se verá suprimida cuando en el LCR exista otro tipo de sustancia o estructura (material proteico, hematíes, células inflamatorias o tumorales, flujo vascular enlentecido en vasos ectásicos, entre otras causas). Ello condiciona una prolongación del tiempo de relajación T2 o un acortamiento del tiempo de relajación T1, con la consiguiente hiperintensidad en esta secuencia1.
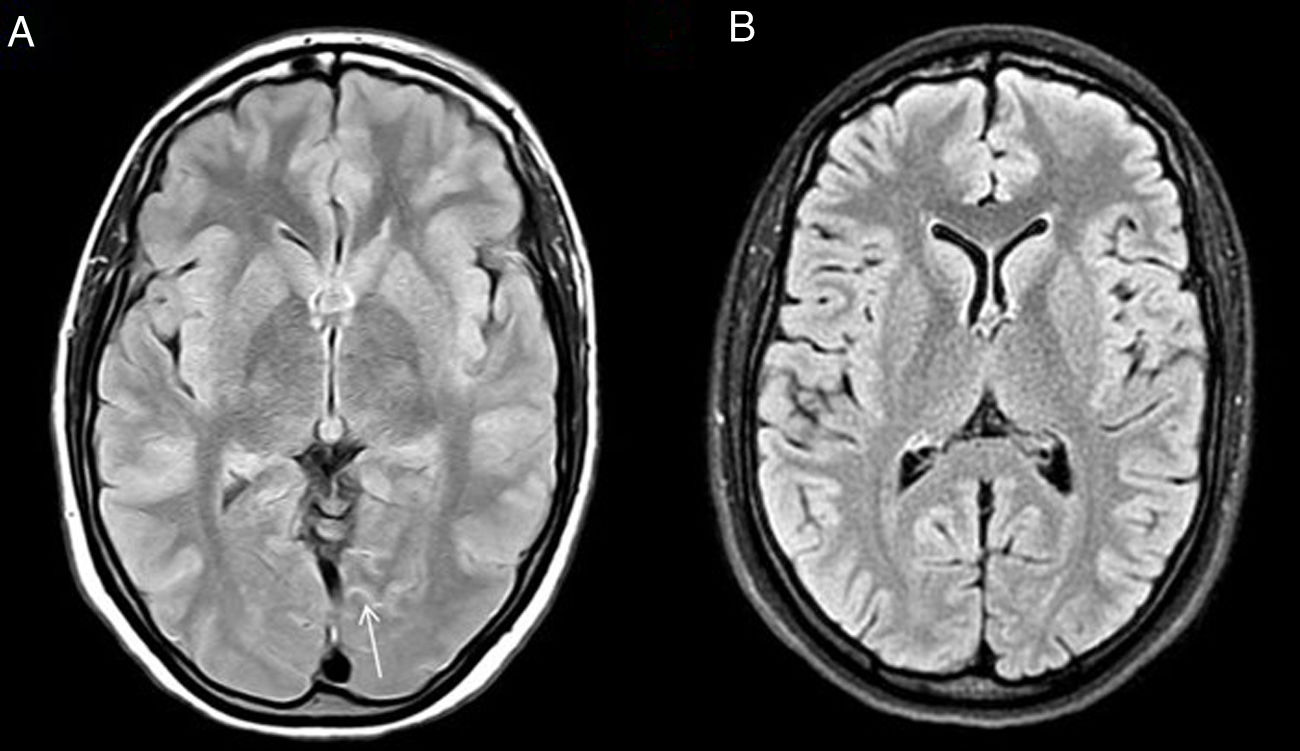
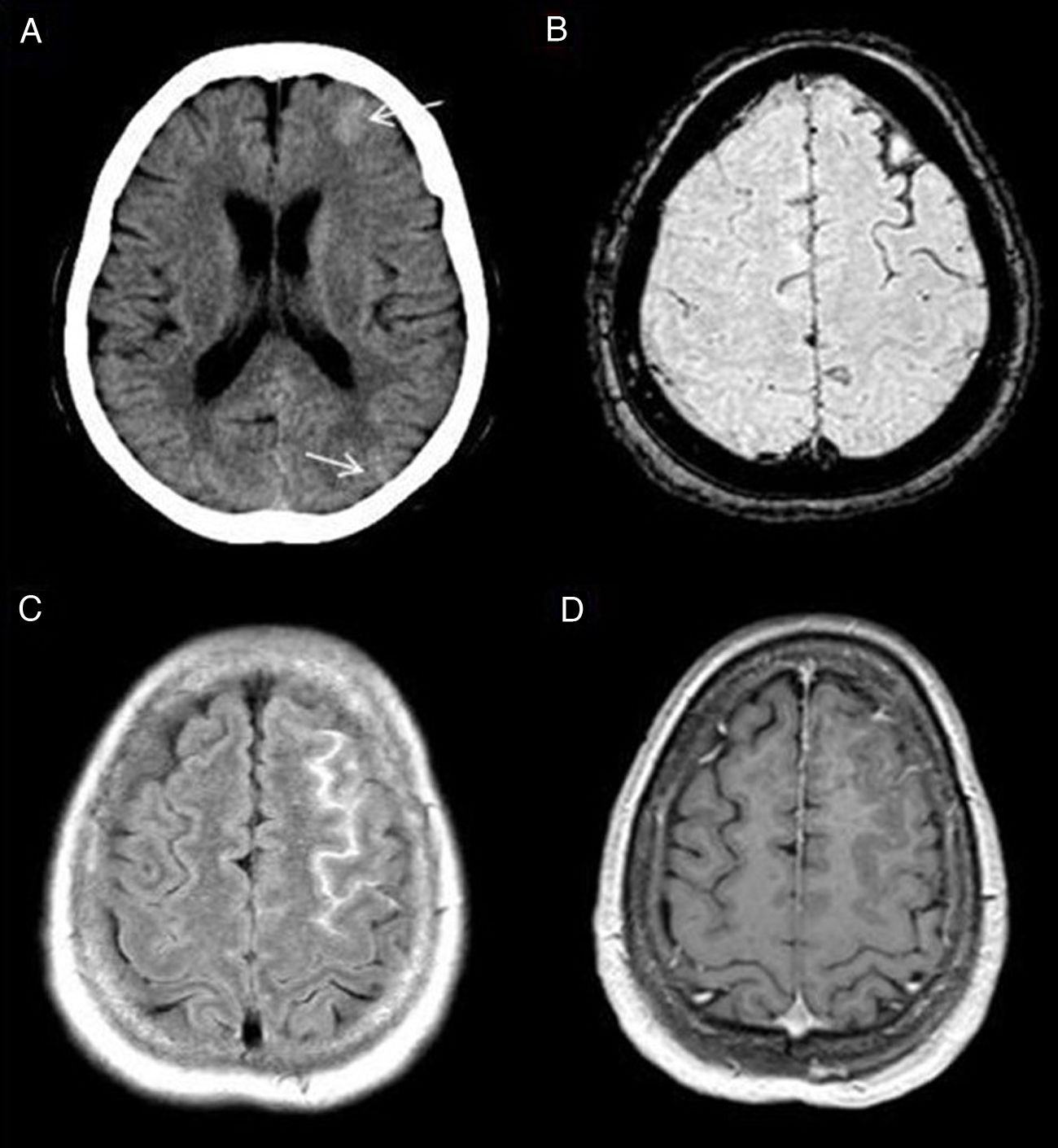
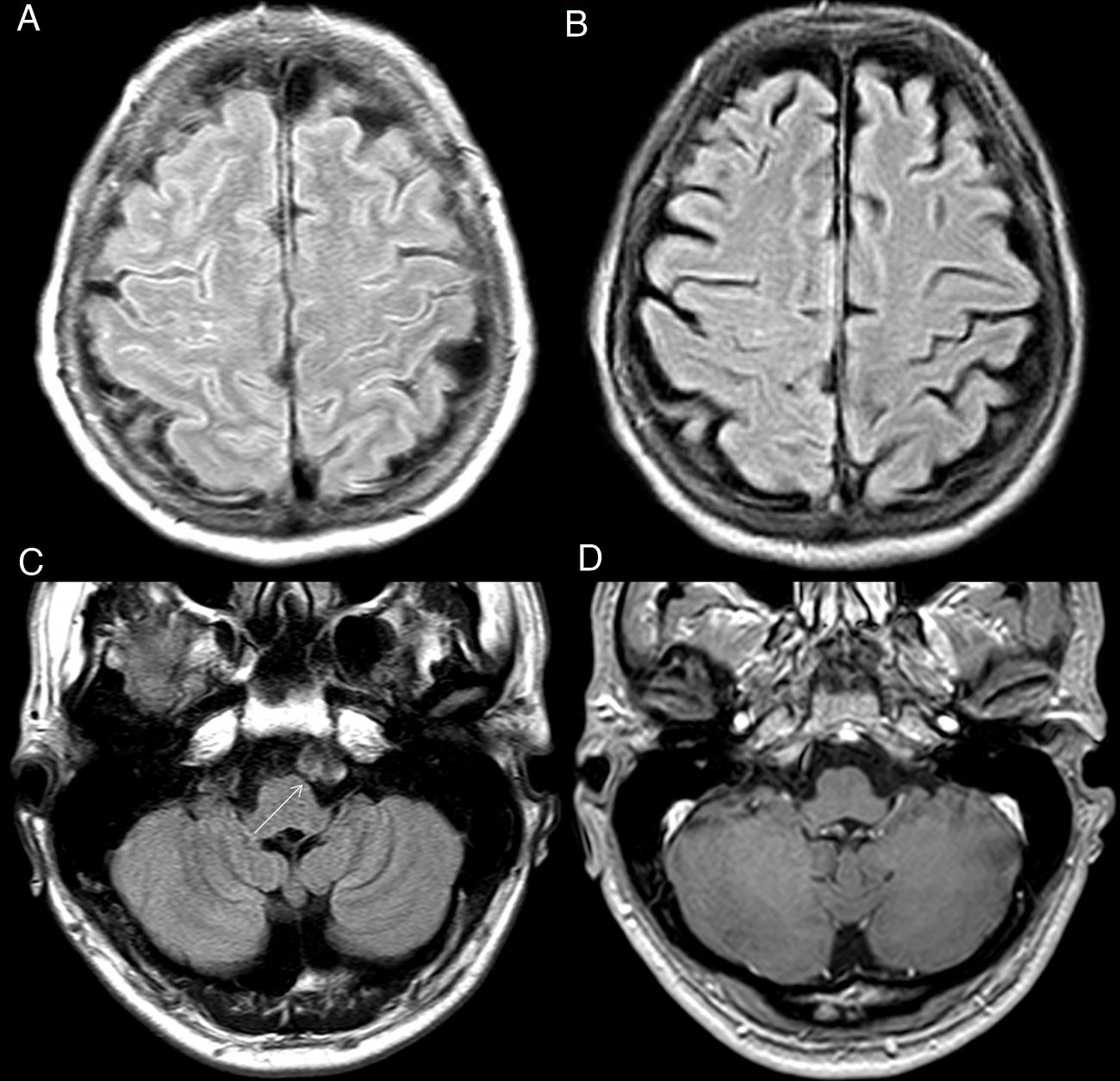
Cefalea de HaNDLEl síndrome de cefalea asociado a déficit neurológico y linfocitosis en el LCR, denominado HaNDL por sus siglas en inglés, se caracteriza por ataques de dolor, asociado a síntomas neurológicos focales motores, sensitivos o del lenguaje y pleocitosis linfocitaria en LCR. Es considerado como un trastorno de curso benigno por su carácter reversible y autolimitado3. Su etiología es desconocida, aunque las alteraciones neurovasculares que ocurren son muy similares a las de la migraña, en ocasiones constituyendo uno de los diagnósticos diferenciales clínicos.
La neurorradiología desempeña un papel fundamental en los casos en los que por su presentación clínica no es posible descartar otras enfermedades de mayor gravedad como los accidentes isquémicos, meningitis o vasculitis. Sin embargo, resulta de poca utilidad para confirmar esta enfermedad.
Algunos de los signos descritos en esta enfermedad, todos ellos inespecíficos, son: el edema cerebral focal, la existencia de una hipoperfusión en regiones temporo-occipitales y la identificación de áreas de hiperintensidad en la secuencia FLAIR en el ESA4 (fig. 2). Otro signo más recientemente descrito, la disminución de la señal venosa en el hemisferio sintomático demostrada en las secuencias de susceptibilidad magnética, puede ser de utilidad en el diagnóstico diferencial con la migraña con aura, que por contra muestra una prominencia de las estructuras venosas en esta secuencia5.
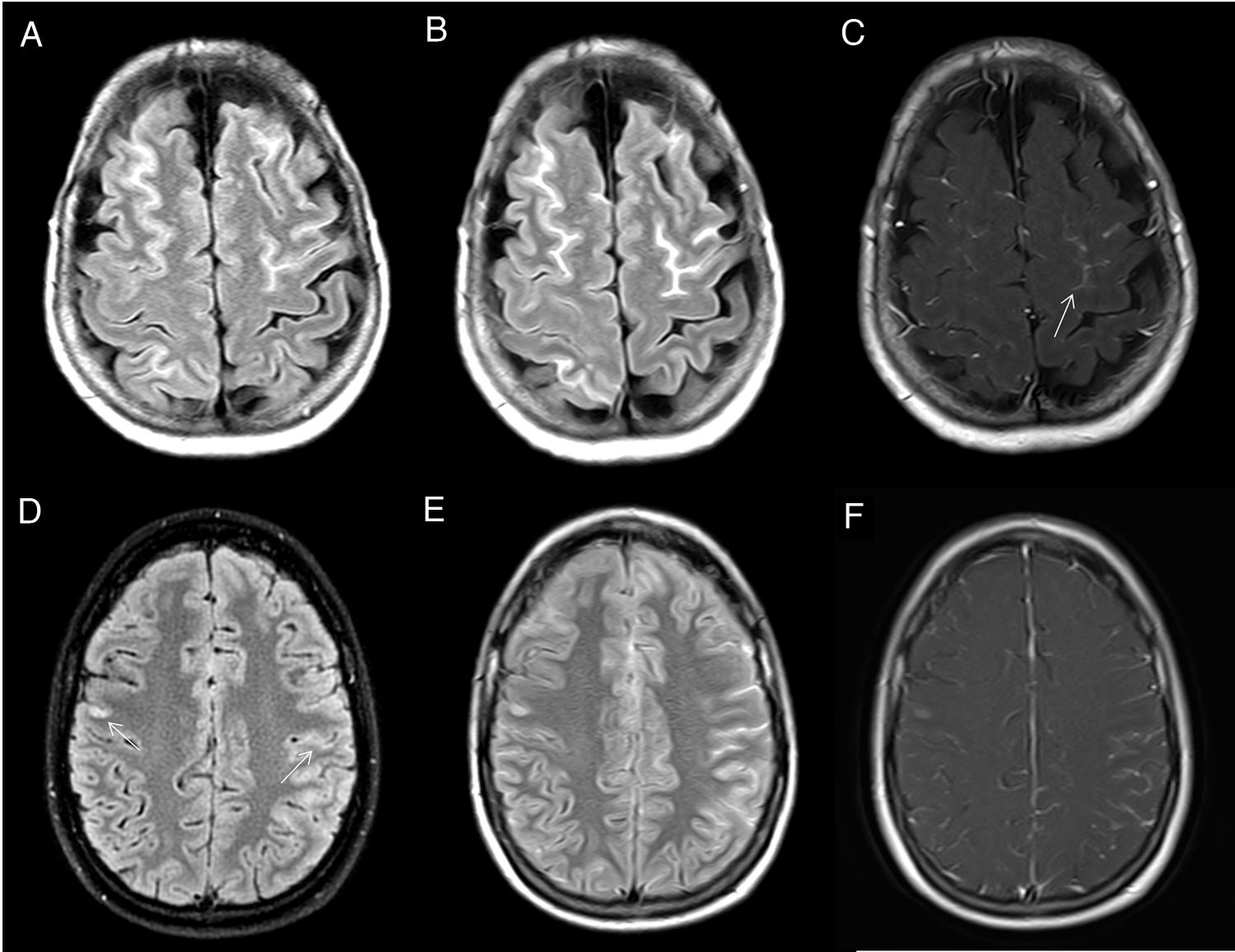
MeningitisEl diagnóstico de sospecha es eminentemente clínico, mientras que la confirmación se obtiene mediante el análisis bioquímico y celular del LCR.
Las pruebas de imagen están relegadas a un segundo plano, ya que en muchos casos muestran hallazgos poco específicos. Sin embargo, la RM cerebral cada vez es más utilizada para apoyar este diagnóstico. Algunas características en imagen son6,7:
- –
Inflamación leptomeníngea (fig. 3) en forma de captación de contraste nodular o lineal y focal o difusa en el ESA, por la rotura o alteración de la permeabilidad de la barrera hematoencefálica.
- –
Áreas de hiperintensidad en la secuencia FLAIR o diffusion-weighted imaging (DWI) en el ESA, resultado del depósito patológico de contenido proteico y el aumento de celularidad.
- –
Cerebritis resultado de los cambios inflamatorios por contigüidad en el parénquima adyacente y desarrollo de colecciones intraaxiales (absceso cerebral) o extraaxiales (empiema).
En los últimos años se está incluyendo en los protocolos de meningitis una secuencia FLAIR 3D con contraste intravenoso por haber demostrado una mayor sensibilidad en la detección de afectación del ESA que la secuencia T1 con gadolinio y una mayor capacidad para diferenciar entre una verdadera captación patológica de contraste o un realce de una estructura vascular pial2,8.
Enfermedad de moyamoyaEs una vasculopatía cerebral idiopática no arterioesclerótica que se caracteriza por una estenosis progresiva del segmento intracraneal de las carótidas internas y sus ramas terminales, generalmente bilateral, con la consiguiente reducción en el aporte de oxígeno al cerebro. En un intento de compensar ese déficit se produce una proliferación de una trama de vasos anómalos colaterales. Se denomina síndrome de moyamoya cuando existen determinadas condiciones preexistentes asociadas, como anemia de células falciformes, neurofibromatosis tipo 1, síndrome de Down, etc.
Las pruebas de imagen revelan las estenosis vasculares y en muchos casos atrofia cerebral generalizada e infartos en territorios frontera por mecanismo hemodinámico secundario a las estenosis. La neovascularización cerebral será la responsable de otros hallazgos9,12:
- –
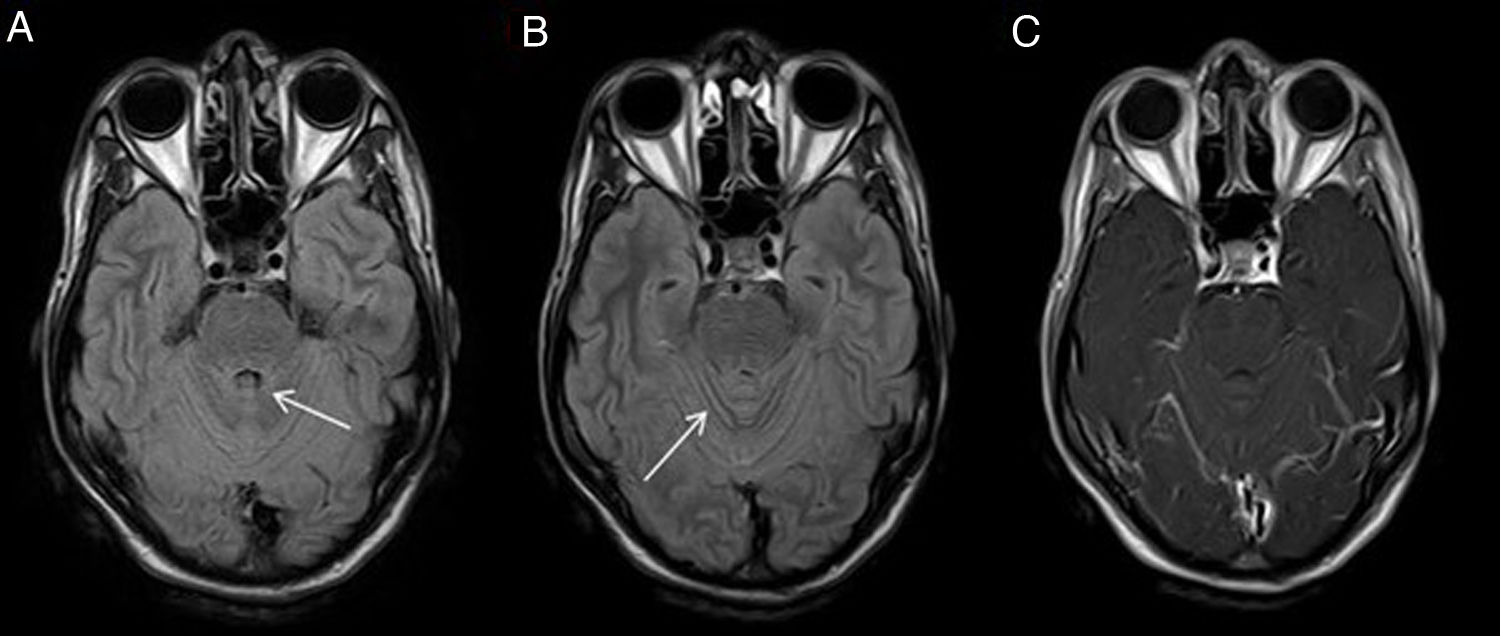
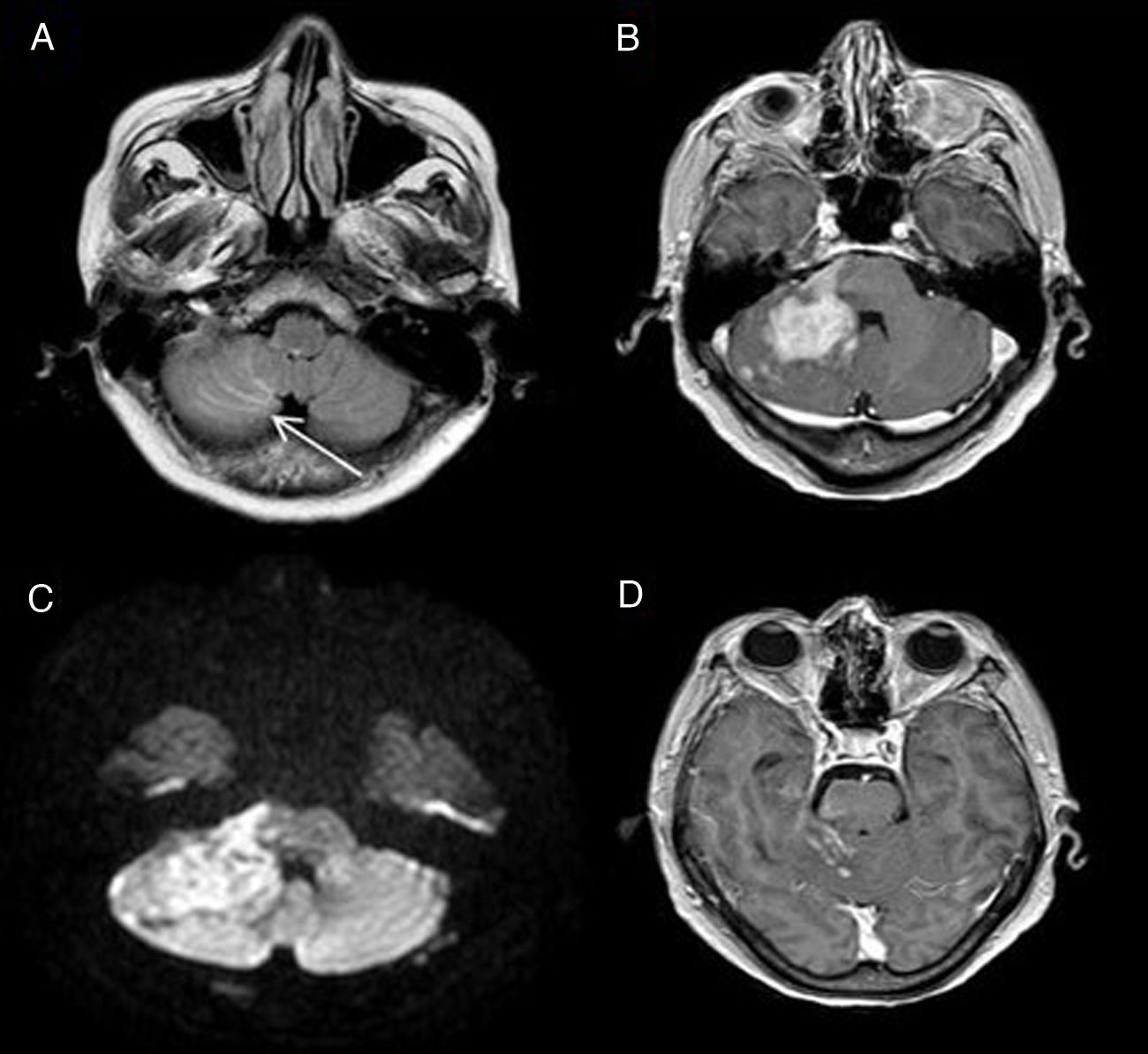
Signo de la hiedra: está presente en el 80% de los pacientes con moyamoya que tienen sintomatología y el 30% de los asintomáticos10. Es una hiperintensidad serpenteante en los surcos en la secuencia FLAIR (fig. 4) y en las secuencias T1 con contraste, donde es más fácil de detectar. Este signo es un indicador del estado dinámico de las colaterales leptomeníngeas y un predictor de enfermedad de moyamoya, especialmente en aquellas enfermedades que predisponen a su desarrollo. Se origina por el flujo enlentecido que existe en las colaterales piales ingurgitadas, que, desde regiones menos afectadas, intentan irrigar el territorio hipoperfundido10,11.
Figura 4.Enfermedad de moyamoya. Mujer de 60 años con estenosis de vasos principales intracraneales, con patrón de moyamoya. En la TC craneal sin CIV (A) se observan pequeñas lesiones isquémicas (flecha negra) de cronología indeterminada en territorio frontera subcortical. Las imágenes FLAIR (B y C) muestran una discreta hiperintensidad de señal lineal en los surcos de la convexidad adyacentes (flechas blancas), reflejando el aumento de la colateralidad pial. La angio-RM (D) confirma la estenosis del segmento supraclinoideo de la ACI y segmento M1 de la ACM (flecha blanca) izquierdas. En la angio-TC (E) también se muestra la proliferación de una red vascular profunda rodeando los segmentos estenosados (flecha blanca).
(0.14MB). - –
Venas medulares prominentes y pequeños focos de microsangrado en regiones profundas.
- –
Arterias colaterales transdurales desde las ramas de la arteria meníngea media.
El término patrón o fenómeno de moyamoya es un concepto angiográfico en el que múltiples entidades, ya sean congénitas o adquiridas, pueden ocasionar una estenosis progresiva del extremo distal de la carótida interna con el subsiguiente desarrollo de vasos colaterales leptomeníngeos, incluyendo la enfermedad de moyamoya11,12.
Malformación venosa leptomeníngea (MVL)Es una manifestación que pueden encontrarse dentro de los síndromes cerebrofaciales venosos metaméricos13,14, en los que los pacientes desarrollan una constelación de malformaciones vasculares venosas en las partes blandas, hueso, duramadre y estructuras nerviosas, incluyendo el cerebro y el globo ocular. En este grupo el síndrome de Sturge-Weber es el más conocido y se caracteriza por la tríada de malformaciones venosas leptomeníngeas, malformación capilar facial «mancha en vino de oporto» y en ocasiones glaucoma ipsolaterales son los criterios que definen esta enfermedad15.
Para la planificación del tratamiento y el seguimiento, el diagnóstico de glaucoma y la afectación intracraneal, incluso si es asintomática, es fundamental en los pacientes de riesgo15,16.
La MVL es una displasia malformativa vascular de venas superficiales que muestran un flujo enlentecido y que en las pruebas de imagen (fig. 5) recuerda a la enfermedad de moyamoya, aunque con un patrón de afectación y una fisiopatología diferentes. El signo directo más específico es el realce giral fino en las secuencias T1 con gadolinio. Sin embargo, este realce no siempre está presente y en etapas iniciales de la enfermedad habrá que buscar otros hallazgos más sutiles, indirectos, que pueden orientar la presencia de MVL13–16:
- –
Hiperintensidad en la secuencia FLAIR en los surcos de la convexidad.
- –
Inversión de los valores de intensidad en la sustancia blanca subyacente tanto en secuencias potenciadas en T1 como T2.
- –
Plexos coroideos hipertróficos, siendo debatido si es debido o a una malformación vascular venosa o es secundario a un intento de compensación del retorno venoso disminuido.
- –
Malformación vascular venosa retiniana que puede provocar glaucoma.
Síndrome de Sturge-Weber. Extensa calcificación giral y leptomeníngea (flecha negra) en el lóbulo parietal izquierdo, visualizados en la TC de cráneo sin CIV (A). RM de control 5 años después (B-D): en la secuencia T2* FFE (B) se observa el artefacto de susceptibilidad (*) provocado por las calcificaciones; en la secuencia FLAIR (C) y T1 tras administración de CIV, atrofia cortical focal, hiperseñal del ESA y realce leptomeníngeo (flecha blanca en D) en los surcos de la convexidad parietal izquierda, reflejando la malformación venosa leptomeníngea típica de esta enfermedad. También se observa hiperostosis frontal y una sutil hiperintensidad cutánea que corresponde a la mancha en vino de oporto en el lado izquierdo (flecha blanca en C).
Cortesía del Dr. Lancharro Zapata y Dra. Aguado del Hoyo.
A medida que avanza la enfermedad, disminuye la captación leptomeníngea y aparece la atrofia del hemisferio afectado y las calcificaciones girales en «vías de tren» subyacentes a la localización de las MVL, mejor valoradas por TC. Además, aumenta la prevalencia de fenómenos de oclusión venosa, trombosis y robo vascular que favorecen la aparición de gliosis y malacia parenquimatosa16,17.
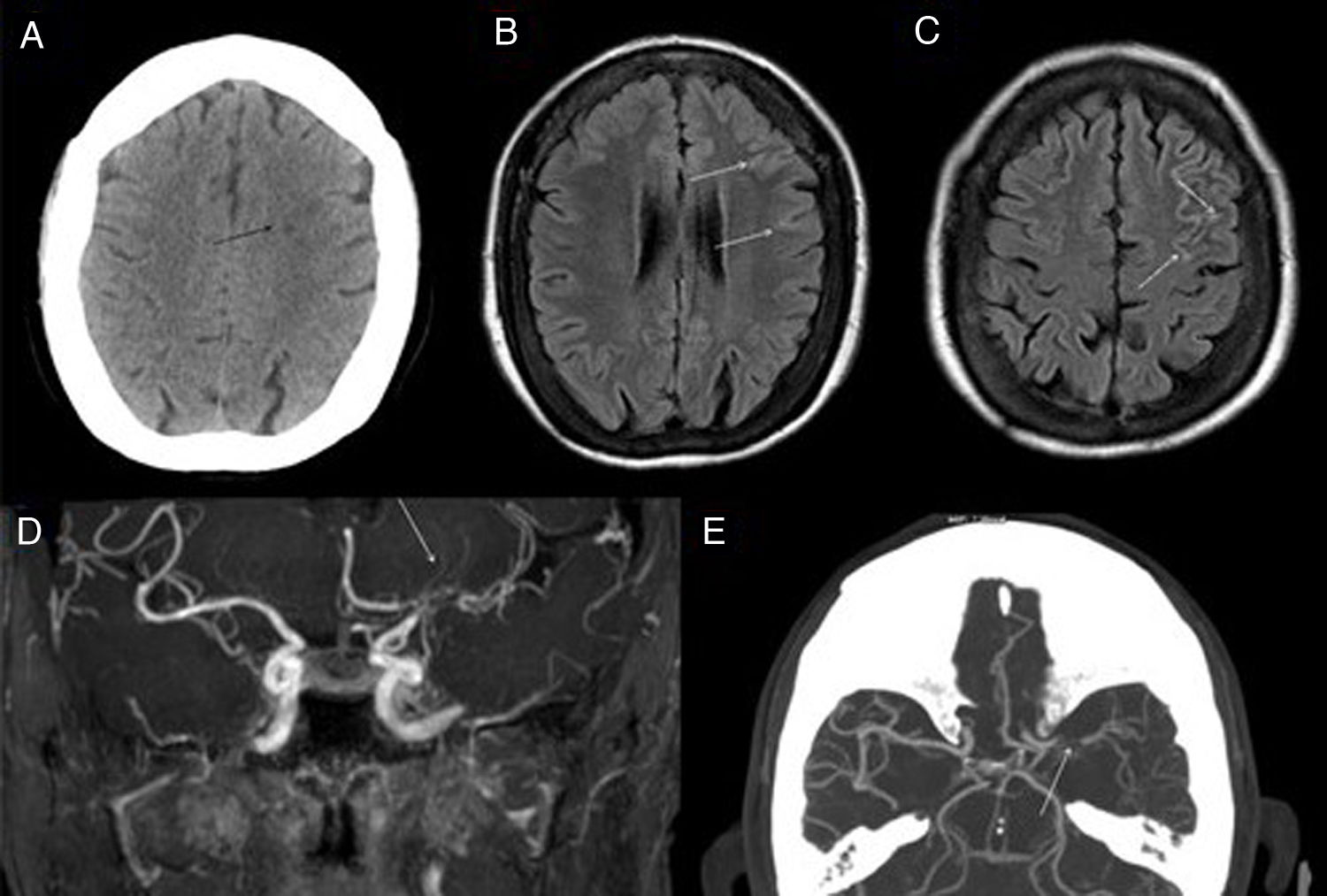
Hemorragia subaracnoideaEn las pruebas de imagen (fig. 6), la HSA aguda es difícil de detectar en secuencias potenciadas en T1 o T2, habiendo demostrado la secuencia FLAIR una mayor sensibilidad, tan alta o mayor que la de la TC, especialmente en la fase subaguda y en lugares anatómicos de difícil valoración por la TC, debido a artefactos por endurecimiento del haz, como la fosa posterior18,19. Por otra parte, los productos de degradación de la hemoglobina y la hemosiderina condicionan artefactos de susceptibilidad en las secuencias eco de gradiente T2* y secuencias de susceptibilidad magnética como susceptibility-weighted imaging (SWI) que ayudan a caracterizar focos de HSA crónica (hemosiderosis superficial).
Hemorragia subaracnoidea (HSA). En la imagen TC existe una tenue hiperdensidad en surcos frontal superior y parietooccipital izquierdos (flechas) en relación con HSA no traumática (A). El contenido hemático de los surcos frontal superior y prerrolándico produce una hipointensidad por susceptibilidad en la secuencia T2*FFE (B) y una hiperintensidad en la secuencia FLAIR (C). No presenta realce en la secuencia T1 con CIV (D). No se demostraron aneurismas o anomalías vasculares en la angiografía de sustracción digital.
A pesar de todo, la TC y angiografía por TC, junto con la sospecha clínica y la punción lumbar para el análisis del LCR, continúan siendo las modalidades de elección para el diagnóstico de HSA y sus posibles causas, quedando la RM relegada a un papel secundario en caso de dudas o para el planteamiento de diagnósticos diferenciales.
Carcinomatosis leptomeníngeaLas metástasis leptomeníngeas ocurren por la diseminación de un tumor al LCR, la aracnoides o la piamadre, en aproximadamente el 5-8% de pacientes con cáncer. Son más frecuentes en el cáncer de pulmón, mama o melanoma, pero también ocurre en tumores del sistema nervioso central (SNC) con diseminación a través del LCR, característica del meduloblastoma o el ependimoma, entre otros.
Las pruebas de imagen son de utilidad inequívoca para su detección, más aun sabiendo que en muchas ocasiones se trata de pacientes asintomáticos y que la citología de LCR tiene porcentajes no desdeñables de falsos negativos. Los hallazgos principales son20,21:
- –
Hiperintensidad en la secuencia FLAIR (fig. 7) y en DWI con valores bajos de ADC en el ESA, similar a la explicada en el caso de la meningitis, debida principalmente al aumento de la celularidad, tumoral en este caso, y del contenido proteico.
Figura 7.Carcinomatosis leptomeníngea. Paciente con antecedente de cáncer de pulmón con signos de diseminación leptomeníngea con hiperintensidad de señal en surcos de la convexidad frontoparietal bilateral en secuencia FLAIR (A), que presentan realce con contraste intravenoso tanto en la secuencia FLAIR con contraste (B) como en T1 con gadolinio con transferencia de magnetización (flecha en C). Melanosis leptomeníngea secundaria. Paciente con melanoma metastásico con signos de infiltración leptomeníngea bilateral en las imágenes SPIR FLAIR (flechas en D) y con zonas de captación leptomeníngea en secuencias FLAIR (E) y T1 con transferencia de magnetización (F) con gadolinio.
(0.17MB). - –
Engrosamiento nodular o lineal, focal o difuso de las leptomeninges, que se manifestará en secuencias T1 tras la administración de contraste intravenoso. Como ya se ha mencionado previamente, el acortamiento del tiempo de relajación T1 que ejerce el gadolinio puede aprovecharse en las secuencias FLAIR con contraste para delimitar mejor las lesiones por carcinomatosis. Sin embargo, el valor añadido de esta técnica es controvertido por lo que su uso todavía no está estandarizado en los protocolos de los pacientes con esta sospecha diagnóstica. Sin embargo, en la actualidad se están incluyendo en los protocolos de carcinomatosis, una secuencia FLAIR 3D con contraste intravenoso que ayuda a diferenciar entre una verdadera captación patológica de contraste o un realce de una estructura vascular pial8.
- –
Hidrocefalia arreabsortiva: no es infrecuente como forma de inicio de la enfermedad y es resultado de la infiltración de las vellosidades aracnoideas.
Una entidad rara, la melanocitosis leptomeníngea (fig. 7), puede mostrar unos hallazgos superponibles en los estudios de RM. Consiste en la proliferación neoplásica primaria (con origen en el tejido neuroectodérmico) o secundaria (en pacientes con melanoma metastásico) de melanocitos en la piamadre o aracnoides en cualquier localización del SNC. Debido a las propiedades paramagnéticas de la melanina, la hiperintensidad de las lesiones en secuencias T1 puede servir de orientación diagnóstica22,23.
Tumor glioneuronal difuso leptomeníngeo (TGDL)Es una entidad muy rara y de muy mal pronóstico que se define por la proliferación neoplásica focal o difusa de células de aspecto oligodendroglial con evidencia de diferenciación neuronal en un subgrupo de casos localizada en las meninges, sin evidencia de tumor primario en el SNC. La mayoría son lesiones de bajo grado desde el punto de vista histológico, pero en algunos casos pueden presentar anaplasia24.
Su diagnóstico pre mortem es difícil. Se deben conocer algunas de sus manifestaciones en las pruebas de imagen puesto que la citología del LCR para células malignas es negativa en muchas ocasiones24,25:
- –
Realce leptomeníngeo en secuencias con contraste particularmente en las cisternas de la base con extensión a la superficie cerebral y de la médula espinal.
- –
Hiperintensidad de señal focal o difusa en secuencia FLAIR del ESA.
- –
Numerosos y milimétricos quistes subpiales en superficie inferior de lóbulos temporales y frontales, fosa posterior y médula espinal. Se piensa que pueden corresponder a espacios perivasculares dilatados.
- –
Hidrocefalia arreabsortiva y signos de hipertensión intracraneal.
Mucho más frecuente que la primaria consiste en la infiltración por contigüidad de las meninges por células tumorales gliales desde un tumor primario del SNC y en pocos pacientes plantea problemas de diagnóstico diferencial.
Linfomatosis leptomeníngeaLos síndromes linfoproliferativos también pueden afectar a las cubiertas meníngeas de forma primaria (linfoma leptomeníngeo primario) o secundaria bien por contigüidad (fig. 8) o por diseminación hematógena. Sus manifestaciones en imagen son superponibles a otros procesos neoplásicos que afectan a las leptomeninges (carcinomatosis o gliomatosis)26.
Linfomatosis leptomeníngea secundaria por contigüidad. En la imagen FLAIR (A) se identifica una hiperintensidad en los surcos entre las folias cerebelosas (flecha) debido a una infiltración leptomeníngea por contigüidad a una masa linfomatosa cerebelosa que muestra un intenso realce en la secuencia T1 con gadolinio (B) y una restricción de la difusión (C). La afectación de la leptomeninge presenta captación en la T1 secuencia tras la administración de Gd (D).
Las imágenes FLAIR presentan varios artefactos que pueden degradar la calidad de la imagen y simular una enfermedad24. Algunos de los más frecuentes son los siguientes.
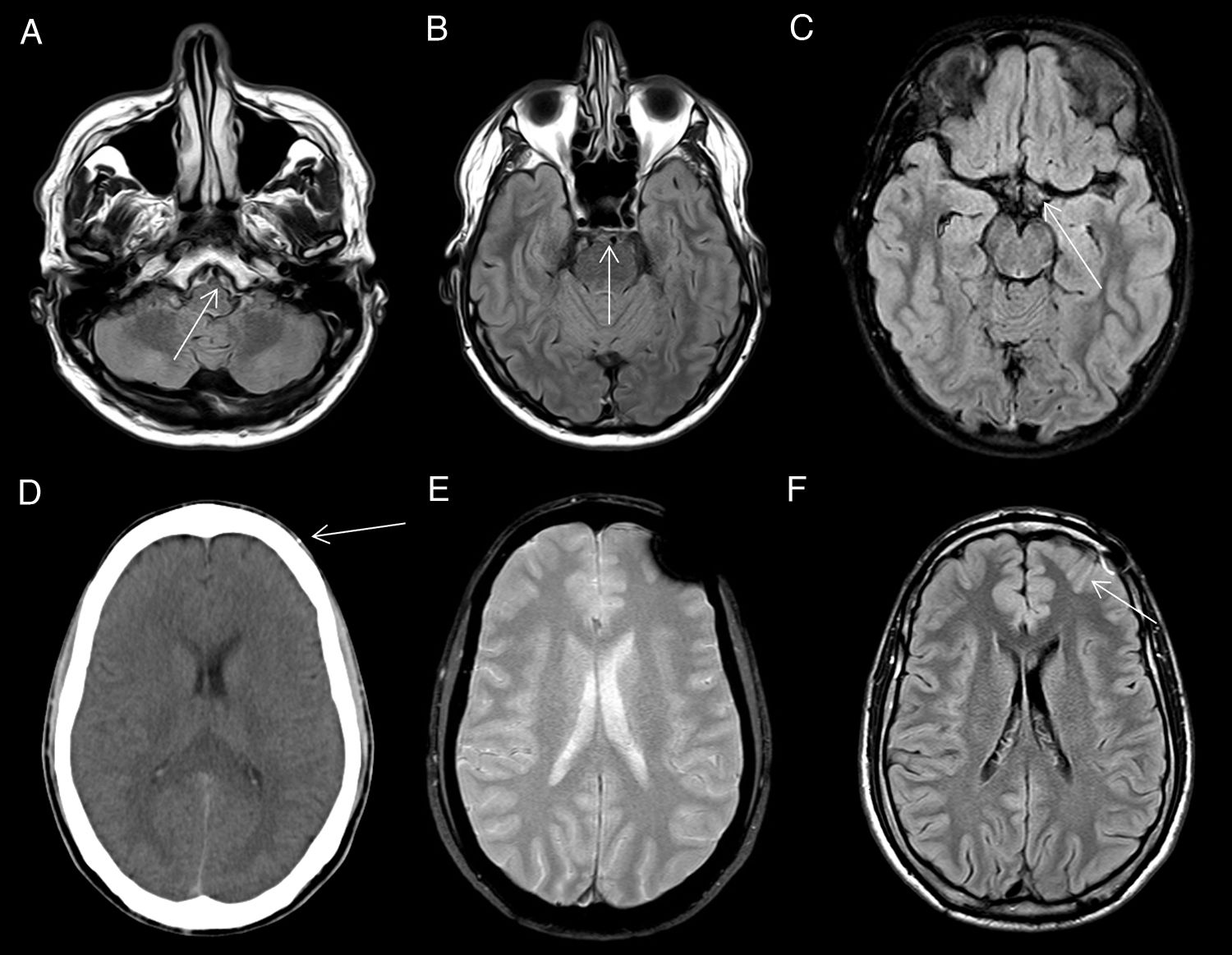
Pulsatilidad del LCRLos artefactos por pulsación del LCR en las secuencias de inversión-recuperación son una fuente de error diagnóstico muy frecuente en la RM cerebral. El flujo pulsátil de LCR condiciona el aflujo de protones que potencialmente no hayan recibido ese pulso de inversión, con el consiguiente fracaso en la anulación de la señal del LCR. Este artefacto es especialmente frecuente en las cisternas de la base (fig. 9) (cisterna prepontina o pontocerebelosa) y en el tercer y cuarto ventrículos, y menos comunes e intensos en los surcos de la convexidad donde el flujo del LCR está disminuido27.
Artefacto por pulsatilidad del LCR. En las imágenes axiales FLAIR se observa una hiperintensidad de señal de LCR no patológica en cisternas peribulbar (A), prepontina (B) y supraselar(C). Artefacto por susceptibilidad magnética. La imagen de TC (D) muestra un cuerpo extraño milimétrico de densidad metálica en el tejido celular subcutáneo (flecha) que ocasiona un artefacto por susceptibilidad magnética en secuencias T2* eco de gradiente (E) y una hiperintensidad de señal lineal por artefacto en FLAIR (F) en el espacio subaracnoideo subyacente (flecha).
Los cuerpos extraños metálicos (perdigones, braquets, etc.) y las estructuras óseas de la base craneal (suelo de la fosa craneal anterior y media) condicionan artefactos de susceptibilidad magnética en forma de hiperintensidad en secuencias convencionales FLAIR (fig. 9) como una marcada y más extensa hipointensidad que dificultan la valoración de estructuras adyacentes27.
El origen de dichos artefactos puede confundirse con hallazgos por patología, por lo que conviene consultar estudios de TC previos que permitirán en muchas ocasiones detectar el material metálico que ocasiona el artefacto.
OxigenoterapiaEl oxígeno es una sustancia con efecto paramagnético y su aumento en el LCR provocará una reducción del tiempo de relajación T1. Por este motivo, no es infrecuente observar en pacientes que están recibiendo oxígeno suplementario un aumento en la señal del LCR en la secuencia FLAIR28 (fig. 10).
Artefacto por oxigenoterapia. Paciente que estaba recibiendo tratamiento con oxígeno suplementario. En la secuencia FLAIR (A) se observa un aumento muy tenue y difuso de la intensidad del LCR en los surcos de la convexidad frontoparietales que desapareció en la RM de control tras retirar la oxigenoterapia (B). Artefacto por pulsatilidad vascular. Artefacto de pulsatilidad en la cisterna del ángulo bulbocerebeloso del lado izquierdo (C), producido por el latido de la arteria basilar, que simula una lesión. Esta imagen no se identifica en la secuencia T1 con CIV (D).
Muchos estudios han demostrado que la difusión de oxígeno desde la sangre al LCR y la consecuente hiperintensidad de señal son dependientes de los métodos de aporte y de la concentración de O2 inhalado. A mayores fracciones de oxígeno inspirado (FiO2), aumentará la tensión de oxígeno en sangre y subsecuentemente la difusión al LCR29.
Pulsatilidad vascularLa pulsatilidad de los vasos intracraneales puede generar artefactos de movimiento en las imágenes FLAIR. Se trata de imágenes espectrales bien definidas que se proyectan sobre el LCR y las estructuras anatómicas vecinas en forma de una hiperintensidad que simula el tamaño, forma y alineación del vaso responsable, y que podría confundirse con enfermedad en el LCR (fig. 10). Es importante mencionar que este artefacto no es exclusivo de la secuencia FLAIR ni de los vasos intracraneales27.
De igual forma se ha relacionado con los movimientos oculares espontáneos, respiratorios o el latido cardiaco en los estudios de cardio-RM. La distancia entre las falsas imágenes se relaciona con el TR y la periodicidad con la que se reproduce el movimiento.
ConclusionesLa hiperintensidad del LCR en el ESA en la secuencia FLAIR se puede encontrar en numerosas entidades con distinta repercusión clínica, unas patológicas y otras debidas a artefactos, que el radiólogo debe conocer. El contexto clínico referido, el análisis del LCR y otros hallazgos coexistentes en la exploración de RM serán de ayuda para llegar a un diagnóstico definitivo.
FinanciaciónLos autores declaran no haber recibido ningún tipo de financiación para la elaboración de este manuscrito.
Autoría- 1.
Responsable de la integridad del estudio: JMB.
- 2.
Concepción del estudio: JMB, IGM, PFG y IHH.
- 3.
Diseño del estudio: JMB e IGM.
- 4.
Obtención de los datos: JMB, IGM y PFG.
- 5.
Análisis e interpretación de los datos: NP.
- 6.
Tratamiento estadístico: NP.
- 7.
Búsqueda bibliográfica: JMB, IGM, PFG e IHH.
- 8.
Redacción del trabajo: JMB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: IGM, PFG e IHH.
- 10.
Aprobación de la versión final: JMB, IGM, PFG e IHH.
Los autores declaran no tener ningún conflicto de intereses.