Uno de los principales roles de la prescripción de actividad física para personas con diabetes tipo 2 es reducir la hiperglucemia. El efecto beneficioso que otorga el entrenamiento físico sobre el nivel glucémico es considerado como la suma de los efectos de cada sesión de ejercicio. Una mejor comprensión de las respuestas agudas al ejercicio, a través de la variabilidad glucémica a corto plazo, podría explicar las diferencias en los resultados de distintos protocolos de entrenamiento.
El objetivo del estudio fue analizar la información científica de distintos protocolos de ejercicio y su asociación con la variabilidad glucémica a corto plazo en los pacientes diabéticos tipo 2. Se realizó una revisión sistemática de estudios publicados en idioma inglés y español; los buscadores científicos utilizados fueron: PubMed, Cochrane, ScienceDirect y Medline. Solo se incluyeron estudios realizados en adultos (mayores de 18 años). Se identificaron 36 estudios, los cuales se analizaron y completaron utilizando la plataforma Covidence®, incluyendo para el análisis final 10 artículos y sumando un total de 296 pacientes. Los 10 artículos incluidos fueron divididos acorde al tipo de protocolo de intervención utilizado: grupo 1, ejercicio agudo, y grupo 2, entrenamiento. Se encontraron diferencias significativas sobre la variabilidad glucémica en el 71,4% de los artículos del grupo 1 y en el 100% de los artículos incluidos en el grupo 2. Se demuestran efectos positivos del ejercicio agudo y del entrenamiento físico sobre la variabilidad glucémica a corto plazo, siendo más contundentes los hallazgos en los protocolos de intervención que con base en entrenamiento físico.
One of the main roles of the prescription of physical activity for people with type 2 diabetes is to reduce hyperglycemia. The beneficial effect of physical training on glycemic levels is considered as the sum of the effects of each exercise session. A better understanding of acute responses to exercise, through short-term glycemic variability, could explain the differences in the results of distinct training protocols.
The objective of this study was to analyze the scientific information on different exercise protocols and their association with short-term glycemic variability in patients with type 2 diabetes. A systematic review of studies published in English and Spanish was carried out. The databases used were PubMed, Cochrane, ScienceDirect, and Medline. Only studies conducted in adults (older than 18 years) were included. A total of 36 studies were identified, which were analyzed and completed using the Covidence® platform. The final analysis included 10 articles with 296 patients. The 10 included articles were divided according to the type of intervention protocol used: group 1, acute exercise, and group 2, training. Significant differences were found in glycemic variability in 71.4% of the articles in group 1 and in 100% of the articles included in group 2. Positive effects of acute exercise and physical training on short-term glycemic variability were demonstrated. The findings were more pronounced in the intervention protocols than in physical training.
La obesidad, el síndrome metabólico y la diabetes mellitus tipo 2 (DM2) son 3 enfermedades que se relacionan íntimamente entre sí, comparten mecanismos etiopatogénicos, patrones de progresión y con frecuencia se asocian, provocando complicaciones cardiovasculares. Todas presentan una alta prevalencia e incidencia a nivel mundial, lo que ocasiona, para la mayoría de los países, gastos muy elevados en salud1.
De estas condiciones negativas de salud, la Organización Mundial de la Salud estimó en el año 2016 que la diabetes fue la séptima causa principal de mortalidad, siendo causa directa de muerte en 1,6 millones de personas a nivel mundial2.
La DM2 representa alrededor del 90% del total de los casos con diabetes mellitus. Es un trastorno metabólico con compromiso multisistémico, causado por varios factores que producen insulinorresistencia y déficit de secreción de insulina, provocando una hiperglucemia crónica, situación que al mediano o largo plazo induce principalmente un riesgo de complicaciones macro y microvasculares1. A nivel mundial la diabetes mellitus constituye un problema de salud pública para la gran mayoría de los países2,3.
Lograr y mantener un óptimo control glucémico ha sido históricamente la piedra angular en el cuidado de la diabetes mellitus1. Mantener los valores de glucemia óptimos, controlados rigurosamente dentro de rangos lo más cercanos a los normales, es determinante para disminuir el riesgo de complicaciones diabéticas3. Se demostró, hace más de 2 décadas, en el Estudio Prospectivo de Diabetes del Reino Unido, el efecto beneficioso de las prácticas intensivas del control glucémico en reducir el riesgo de complicaciones diabéticas, eventos cardiovasculares adversos y mortalidad en pacientes con DM24.
En la práctica clínica la hemoglobina glucosilada (HbA1c) se considera el examen estándar de oro para el control de la diabetes5. La HbA1c proporciona información valiosa, estandarizada, relevante para la toma de decisiones clínicas; sin embargo, interferencias analíticas, así como condiciones clínicas, limitan su precisión en reflejar el verdadero y preciso nivel de glucemia, dado que no aborda la variabilidad glucémica (VG) a corto plazo y los eventos hipoglucémicos en específico6.
Actualmente es sabido que la contribución a la patogénesis de las complicaciones diabéticas no solo está determinada por el nivel de exposición a hiperglucemia, sino también por la variabilidad glucémica propiamente, es decir, fluctuaciones diarias de la glucosa en sangre (intra e interdías)7. La VG a corto plazo en la DM2 ha demostrado estar asociada con un mayor riesgo de complicaciones, especialmente macrovasculares8, al aumentar el estrés oxidativo, los marcadores proinflamatorios y los productos finales de glicación avanzada9.
En la actualidad, gracias a avances tecnológicos recientes en el ámbito de los sistemas de monitorización continua de glucosa (SMCG), se han revelado nuevos conocimientos en la dinámica de la glucemia a corto plazo que no están reflejados por HbA1c y que son determinantes para evaluar el riesgo y evitar las complicaciones en las personas con diabetes10. Para prevenir estas complicaciones es muy importante, como parte del tratamiento no farmacológico, el «ejercicio» en este tipo de pacientes. Dentro de sus beneficios reportados está el efecto hipoglucemiante y sensibilizador a la insulina que se logra con un entrenamiento físico, y el producto final del entrenamiento físico se atribuye a la suma de los efectos agudos de cada sesión de ejercicio realizada durante todo el período del entrenamiento11,12.
Uno de los principales objetivos de la prescripción de ejercicios para individuos con DM2 es reducir la hiperglucemia, que, como mencionamos anteriormente, corresponde a un factor riesgo de complicaciones a largo plazo. Se han publicado una serie de estudios, e incluso metaanálisis, que han evidenciado que el entrenamiento físico tiene un impacto clínicamente significativo en la mejora del control glucémico, evaluado a través de HbA1c, en individuos con DM213–16.
La presente revisión sistemática tiene como objetivo principal analizar el efecto que tienen las distintas modalidades de ejercicio físico (aeróbico, combinado y ejercicio a intervalos de alta intensidad) sobre el control metabólico, evaluado a través de la VG a corto plazo en personas con DM2, tras una sesión de ejercicio o como consecuencia de un entrenamiento a largo plazo.
Variabilidad glucémicaEn lo que respecta a la investigación clínica de la DM2, la HbA1c ha sido durante años el outcome primario de eficacia17,18, ya que refleja la glucemia promedio durante meses y tiene un fuerte valor predictivo de las complicaciones propias de la diabetes17,18. Aunque en la actualidad la HbA1c sigue siendo el examen de referencia para evaluar el control glucémico y para predecir el riesgo de desarrollo de complicaciones a largo plazo, tiene varias limitaciones: 1) solo proporciona un promedio de niveles de glucosa sobre los últimos 2 o 3 meses anteriores a la toma de la muestra; 2) no detecta hipoglucemia o hiperglucemia diariamente; 3) es una medida poco confiable en pacientes con anemia, hemoglobinopatías o deficiencia de hierro, como suele ser frecuente durante el embarazo; 4) no refleja cambios rápidos en el control de glucosa (intra o interdía), y 5) no proporciona datos precisos sobre cómo ajustar el régimen de tratamiento cuando los niveles de HbA1c están elevados19,20.
La VG específicamente se define como la magnitud de las oscilaciones de glucosa en sangre por encima y por debajo del rango de normalidad20. Las cifras de glucemia normalmente fluctúan durante el día tanto en sujetos sanos como con diabetes, y a esa variación se le denomina VG. Dicha variabilidad se encuentra en estrecha relación con la funcionalidad de la célula beta pancreática en condición posprandial6. Una VG elevada puede contribuir a la generación de glicación proteica excesiva y estrés oxidativo, que son factores clave en la patogenia de las complicaciones diabéticas21. Además, se ha demostrado que una alta VG se asocia con una función endotelial reducida en pacientes con DM2, control metabólico no óptimo y mayor riesgo de hipoglucemia en pacientes con diabetes4,22. Sin embargo, hay que considerar que las excursiones de glucosa pueden diferir de paciente a paciente, ya sea por factores tales como el sexo o por los diferentes tipos de tratamientos médicos recibidos23.
Los recientes avances tecnológicos en el campo de los SMCG han revelado nuevos conocimientos sobre la dinámica de la glucosa a corto plazo que no se reflejan en la HbA1c (otorga VG a largo plazo) y parece ser relevante para evaluar el riesgo de complicaciones diabéticas y determinante para la toma de decisiones para sus pacientes por parte de su médico tratante5. Son estas métricas de fluctuaciones en la glucosa en sangre representadas las que particularmente pueden proporcionar un mejor predictor de complicaciones en DM2, así como riesgo de hipoglucemia e hiperglucemia4.
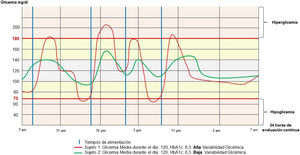
La VG es una métrica que puede ser cuantificada e interpretada a través de diferentes análisis, centrados en la evaluación de las fluctuaciones de la glucosa en el tiempo. Dentro de los principales indicadores métricos que encontramos en el análisis de la VG están: la desviación estándar, el coeficiente de variación (CV), la amplitud media de la VG, la amplitud media de excursión de glucosa, la mayor amplitud de excursión de glucosa, la media de las diferencias absolutas entre 2 medidas de 24h consecutivas del espectro glucémico y la superposición glucémica continua4,10; el tiempo en rango se define como el tiempo transcurrido en el rango glucémico objetivo de un individuo (generalmente 70-180mg/dl [3,9-10mmol/l]). El tiempo en rango ha sido asociado con riesgo de retinopatía en pacientes con DM2 y es independiente de la HbA1c18.
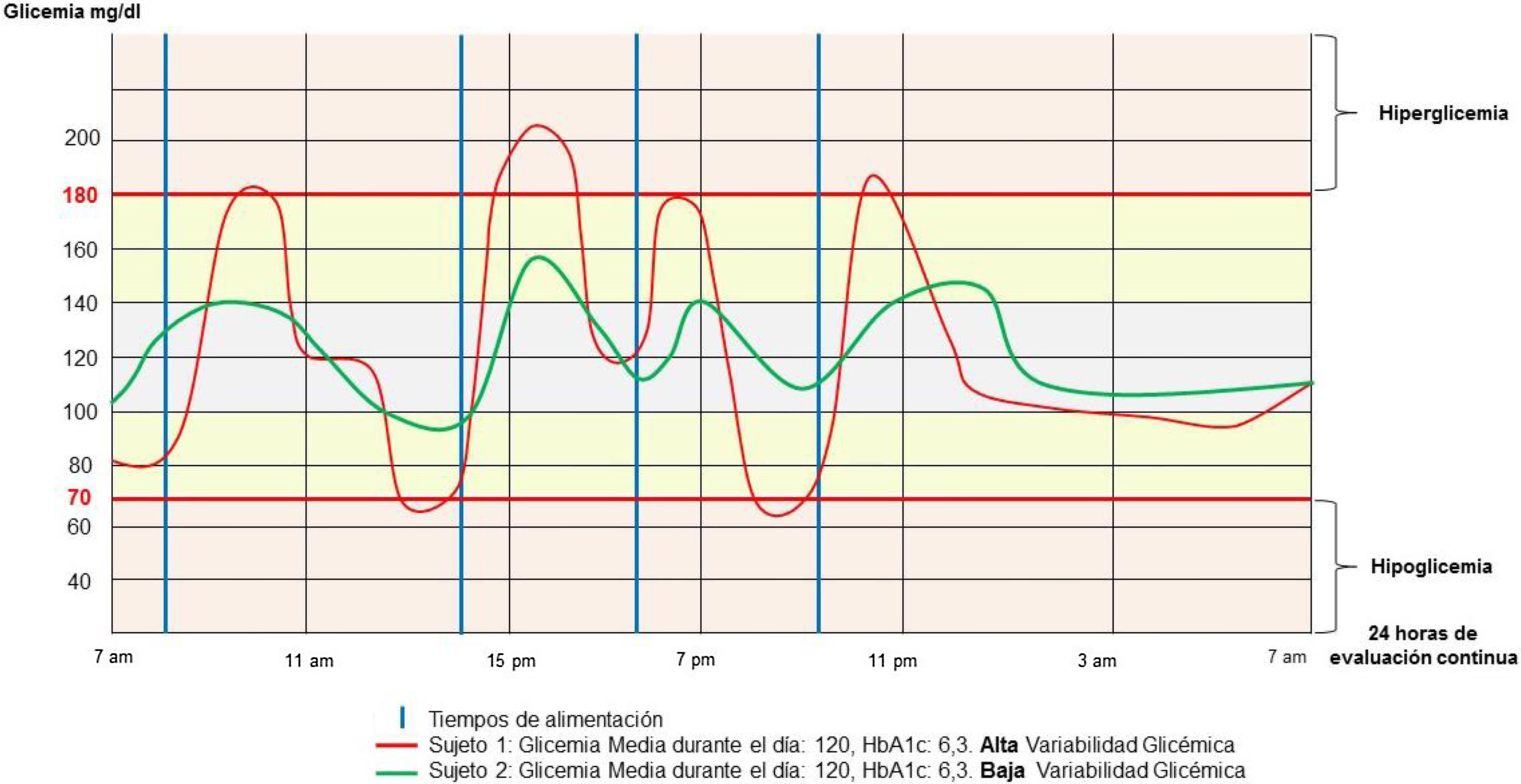
El CV debe ser considerado como la métrica principal de la VG, sin embargo, muchos clínicos revisan la desviación estándar reportada como una métrica de variabilidad secundaria24. El CV caracteriza a una persona con diabetes mellitus como estable cuando su CV es menor de un 36%, e inestable si el CV es mayor o igual al 36%11. La importancia clínica de estas métricas radica específicamente en la medida en que los pacientes permanecen dentro, sobre o bien bajo el rango de glucosa en sangre objetivo12 (fig. 1).
Material y métodoEste artículo es una revisión sistemática que incluyó como términos de búsqueda MeSH: exercise, glucose fluctuations, glycemic variability, type 2 diabetes. La búsqueda de artículos se realizó en los buscadores científicos: PubMed, ScienceDirect, Cochrane y EBSCO: Medline complete, y los límites de la búsqueda fueron: estudios publicados entre los años 2014 y 2020 (julio), realizados en humanos, mayores de 18 años. Se consideraron artículos de habla inglesa y española. Se incluyeron artículos científicos del tipo ensayos clínicos, ensayos clínicos tipo crossover y serie de casos. Los artículos de revisión bibliográfica, cartas al editor y opinión de expertos no fueron incluidos. La población incluida en el estudio es de sujetos con DM2, que fueron sometidos a exámenes de VG a corto plazo con dispositivos de medición de glucemia continua.
El protocolo para llevar a cabo la presente revisión sistemática fue guiado por la declaración Preferred Reporting Items for Systematic Reviews and Meta-Analyses ?PRISMA?, y ejecutado a través de la plataforma Covidence® (www.covidence.org). La evaluación de sesgo de los estudios incluidos en la presente revisión fue realizada por 2 revisores de forma independiente para cada estudio. Todos los conflictos fueron resueltos entre los investigadores por consenso. Se utilizó la herramienta de evaluación de calidad publicada por el National Heart, Lung, and Blood Institute en su sitio web (https://www.nhlbi.nih.gov/health-topics/study-quality-assessment-tools) y los resultados de su aplicación son presentados en la tabla 1.
Evaluación de sesgo de los artículos
| Estudio | Análisis estadístico | Objetivo | Outcomes | Población | Resultados | Reporte selectivo de resultados |
|---|---|---|---|---|---|---|
| Van Dijk et al.17 | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo |
| Zheng et al.18 | Bajo sesgo | Bajo sesgo | Bajo sesgo | Sesgo medio | Bajo sesgo | Bajo sesgo |
| Rees et al.19 | Bajo sesgo | Bajo sesgo | Sesgo medio | Bajo sesgo | Bajo sesgo | Sesgo medio |
| Metcalfe et al.26 | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo |
| Fofonka et al.28 | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo |
| Figueira et al.25 | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo |
| Gillen et al.27 | Bajo sesgo | Bajo sesgo | Bajo sesgo | Sesgo medio | Bajo sesgo | Bajo sesgo |
| Winding et al.24 | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo |
| Vijayakumar et al.30 | Bajo sesgo | Bajo sesgo | Bajo sesgo | Sesgo medio | Bajo sesgo | Bajo sesgo |
| Francois et al.29 | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo | Bajo sesgo |
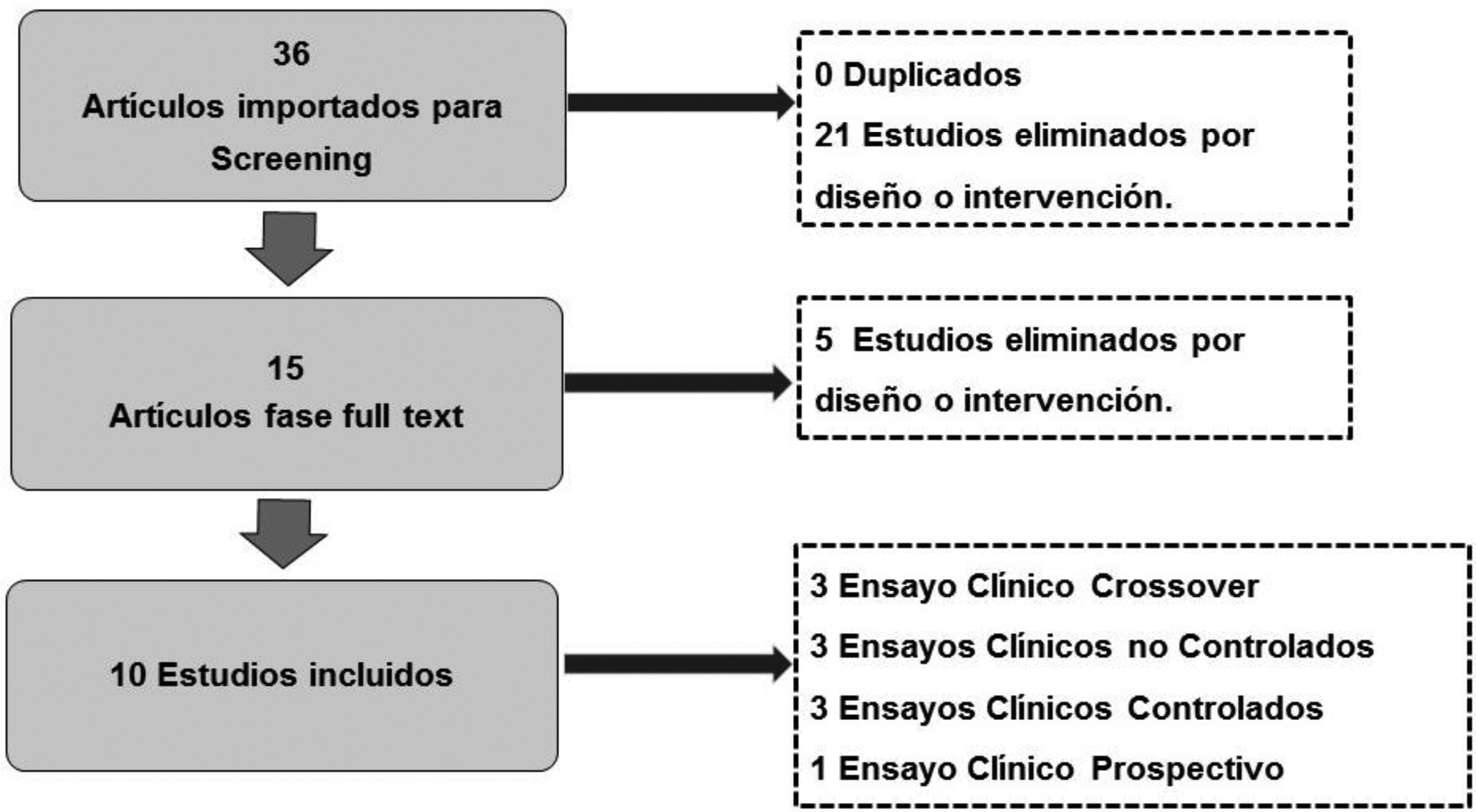
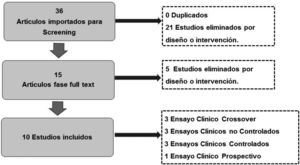
De los 36 artículos identificados en la búsqueda bibliográfica, se descartaron primariamente 21 artículos por no cumplir con los criterios de inclusión. Finalmente, en el análisis full text se descartaron 5 por diseño y temática o acorde, quedando finalmente para análisis 10 artículos, con un total de 296 pacientes. La selección de artículos se detalla en el flujograma (fig. 2).
A fin de comprender los efectos fisiológicos del ejercicio sobre la variabilidad glucémica, los estudios incluidos fueron divididos en 2 grupos:
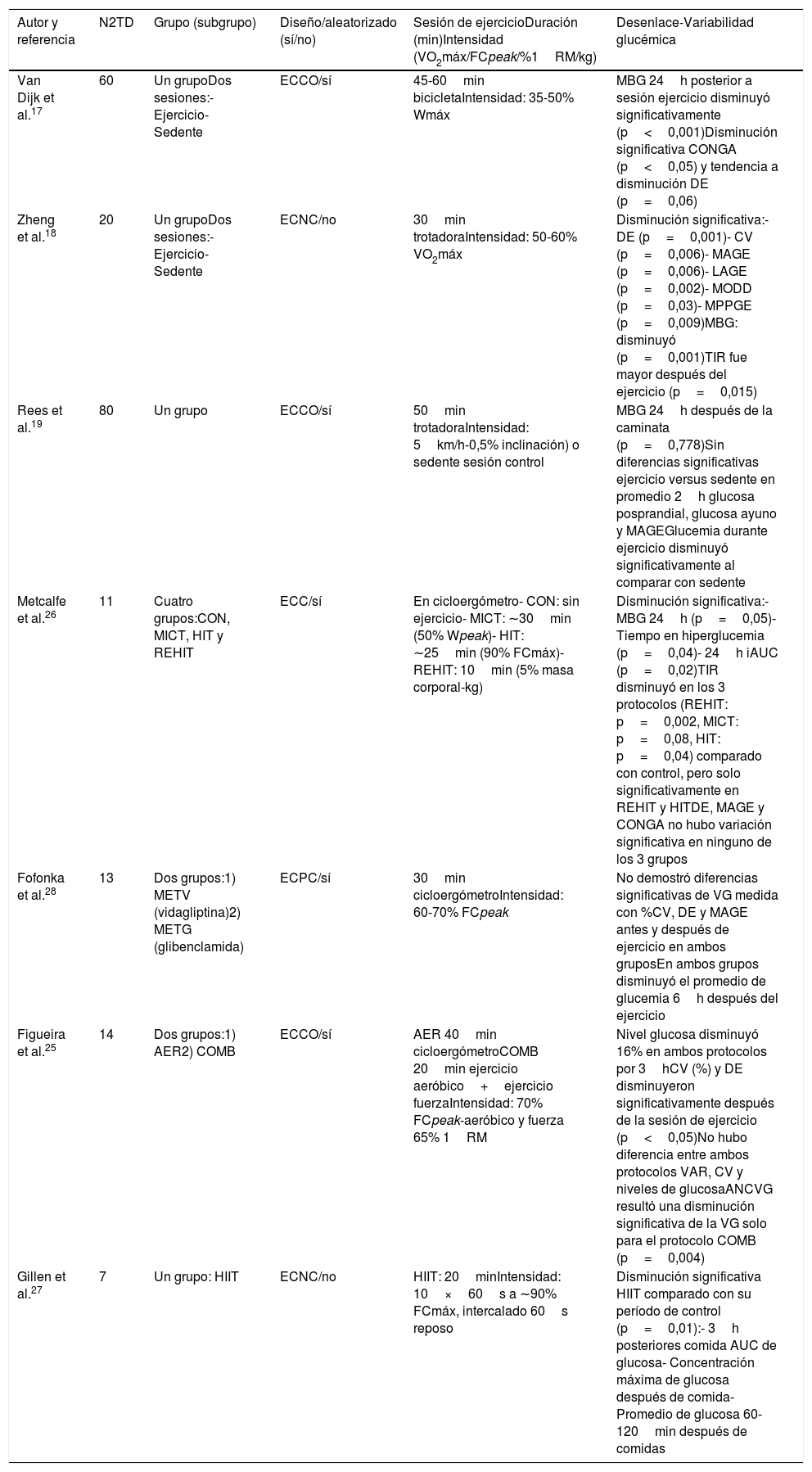
Grupo 1: 7 artículos incluidos, donde la intervención realizada fue una sesión de ejercicio (ejercicio agudo); los tiempos de intervención fluctuaron entre los 30 y los 60min. Respecto a los protocolos utilizados, estos fueron realizados en cicloergómetro (5/7) y en trotadora (2/7). Los tipos de ejercicio realizados fueron en su mayoría protocolos aeróbicos continuos, con utilización de intensidades que van desde el 35 al 70% del VO2 máx. Solo Figueira et al. sumaron al protocolo aeróbico continuo ejercicios de fuerza al 65% de una repetición máxima. Hay 2 autores, Metcalfe et al. y Gillen et. al., que en sus sesiones realizaron intervenciones de tipo interválicas de alta intensidad (HIIT). Los detalles de las intervenciones realizadas y las características de los artículos incluidos en este grupo se detallan en la tabla 217,18,19,25–28.
Resumen de las principales características de los artículos analizados que realizaban una sesión de ejercicio
| Autor y referencia | N2TD | Grupo (subgrupo) | Diseño/aleatorizado (sí/no) | Sesión de ejercicioDuración (min)Intensidad (VO2máx/FCpeak/%1RM/kg) | Desenlace-Variabilidad glucémica |
|---|---|---|---|---|---|
| Van Dijk et al.17 | 60 | Un grupoDos sesiones:- Ejercicio- Sedente | ECCO/sí | 45-60min bicicletaIntensidad: 35-50% Wmáx | MBG 24h posterior a sesión ejercicio disminuyó significativamente (p<0,001)Disminución significativa CONGA (p<0,05) y tendencia a disminución DE (p=0,06) |
| Zheng et al.18 | 20 | Un grupoDos sesiones:- Ejercicio- Sedente | ECNC/no | 30min trotadoraIntensidad: 50-60% VO2máx | Disminución significativa:- DE (p=0,001)- CV (p=0,006)- MAGE (p=0,006)- LAGE (p=0,002)- MODD (p=0,03)- MPPGE (p=0,009)MBG: disminuyó (p=0,001)TIR fue mayor después del ejercicio (p=0,015) |
| Rees et al.19 | 80 | Un grupo | ECCO/sí | 50min trotadoraIntensidad: 5km/h-0,5% inclinación) o sedente sesión control | MBG 24h después de la caminata (p=0,778)Sin diferencias significativas ejercicio versus sedente en promedio 2h glucosa posprandial, glucosa ayuno y MAGEGlucemia durante ejercicio disminuyó significativamente al comparar con sedente |
| Metcalfe et al.26 | 11 | Cuatro grupos:CON, MICT, HIT y REHIT | ECC/sí | En cicloergómetro- CON: sin ejercicio- MICT: ∼30min (50% Wpeak)- HIT: ∼25min (90% FCmáx)- REHIT: 10min (5% masa corporal-kg) | Disminución significativa:- MBG 24h (p=0,05)- Tiempo en hiperglucemia (p=0,04)- 24h iAUC (p=0,02)TIR disminuyó en los 3 protocolos (REHIT: p=0,002, MICT: p=0,08, HIT: p=0,04) comparado con control, pero solo significativamente en REHIT y HITDE, MAGE y CONGA no hubo variación significativa en ninguno de los 3 grupos |
| Fofonka et al.28 | 13 | Dos grupos:1) METV (vidagliptina)2) METG (glibenclamida) | ECPC/sí | 30min cicloergómetroIntensidad: 60-70% FCpeak | No demostró diferencias significativas de VG medida con %CV, DE y MAGE antes y después de ejercicio en ambos gruposEn ambos grupos disminuyó el promedio de glucemia 6h después del ejercicio |
| Figueira et al.25 | 14 | Dos grupos:1) AER2) COMB | ECCO/sí | AER 40min cicloergómetroCOMB 20min ejercicio aeróbico+ejercicio fuerzaIntensidad: 70% FCpeak-aeróbico y fuerza 65% 1RM | Nivel glucosa disminuyó 16% en ambos protocolos por 3hCV (%) y DE disminuyeron significativamente después de la sesión de ejercicio (p<0,05)No hubo diferencia entre ambos protocolos VAR, CV y niveles de glucosaANCVG resultó una disminución significativa de la VG solo para el protocolo COMB (p=0,004) |
| Gillen et al.27 | 7 | Un grupo: HIIT | ECNC/no | HIIT: 20minIntensidad: 10×60s a ∼90% FCmáx, intercalado 60s reposo | Disminución significativa HIIT comparado con su período de control (p=0,01):- 3h posteriores comida AUC de glucosa- Concentración máxima de glucosa después de comida- Promedio de glucosa 60-120min después de comidas |
AER: ejercicio aeróbico; ANCVG: análisis no convencional: análisis espectral y simbólico; AUC: área bajo la curva de glucosa; COMB: ejercicio combinado de tipo aeróbico+fuerza; CON: grupo sin ejercicio; CONGA: superposición glucémica continua; CV: coeficiente de variación; DE: desviación estándar; ECC: ensayo clínico controlado; ECCO: ensayo clínico tipo crossover; ECNC: ensayo clínico no controlado; ECPC: ensayo clínico prospectivo/ciego; FC: frecuencia cardíaca; HIIT: sesión única de ejercicio a intervalos de alta intensidad; iAUC: 24h área bajo la curva de glucosa incremental; LAGE: la mayor amplitud de excursión de glucosa; MAGE: amplitud de excursión de glucosa; MBG: promedio de glucosa sanguínea; METG: grupo metformina+gliblenclamida; METV: grupo metformina+vidagliptina; MICT: ejercicio aeróbico continuo; MODD: media de la diferencia absoluta entre 2 medidas 24h consecutivas del espectro glucémico; MPPGE: promedio de excursión de glucemia posprandial; REHIT: sesión única ejercicio de tiempo reducido a intervalo de alta intensidad; RM: repetición máxima; TIR: tiempo en rango; VAR: varianza de la glucosa; VG: variabilidad glucémica.
Grupo 2: 3 artículos incluidos, donde los protocolos de ejercicios utilizados incluían más de una sesión (entrenamiento físico); en este grupo los tiempos de entrenamiento fluctuaron entre una y 12 semanas, y los tipos de ejercicios fueron diferentes en los 3 estudios. Los detalles de los protocolos de entrenamiento utilizados y las características de estos estudios se detallan en la tabla 324,29,30.
Resumen de las principales características de los artículos analizados que realizaban entrenamiento físico
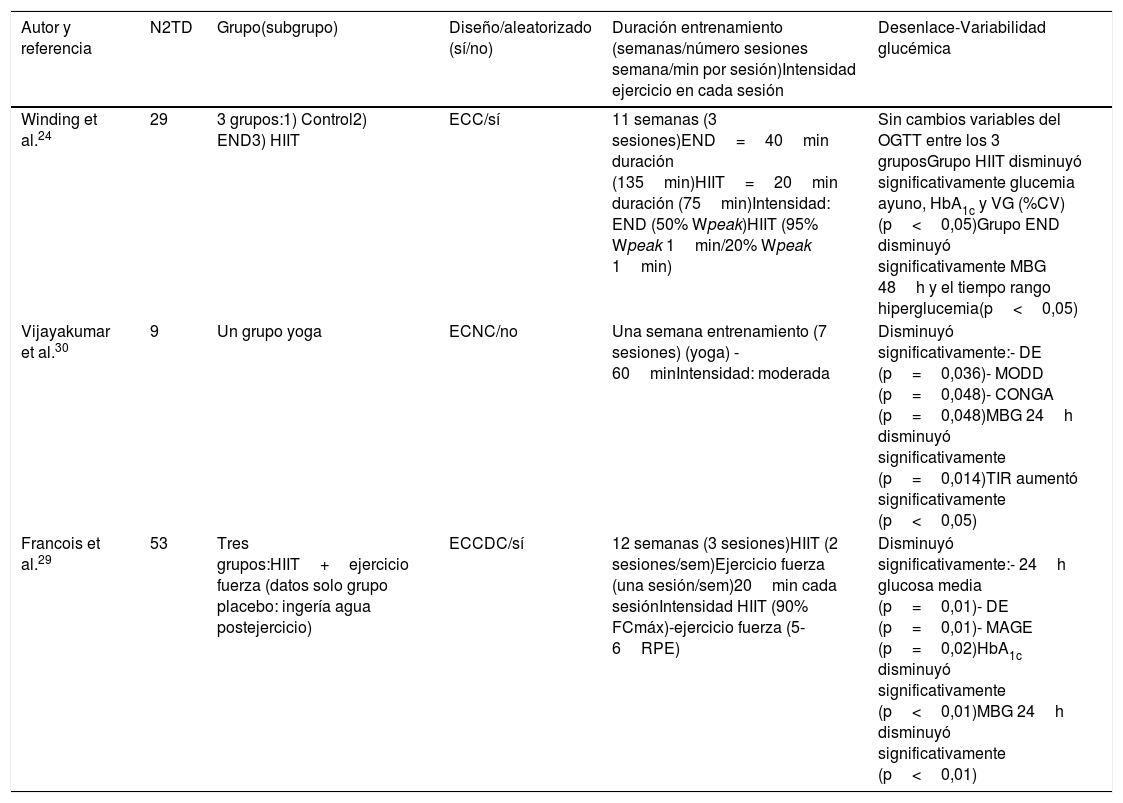
| Autor y referencia | N2TD | Grupo(subgrupo) | Diseño/aleatorizado (sí/no) | Duración entrenamiento (semanas/número sesiones semana/min por sesión)Intensidad ejercicio en cada sesión | Desenlace-Variabilidad glucémica |
|---|---|---|---|---|---|
| Winding et al.24 | 29 | 3 grupos:1) Control2) END3) HIIT | ECC/sí | 11 semanas (3 sesiones)END=40min duración (135min)HIIT=20min duración (75min)Intensidad: END (50% Wpeak)HIIT (95% Wpeak 1min/20% Wpeak 1min) | Sin cambios variables del OGTT entre los 3 gruposGrupo HIIT disminuyó significativamente glucemia ayuno, HbA1c y VG (%CV) (p<0,05)Grupo END disminuyó significativamente MBG 48h y el tiempo rango hiperglucemia(p<0,05) |
| Vijayakumar et al.30 | 9 | Un grupo yoga | ECNC/no | Una semana entrenamiento (7 sesiones) (yoga) - 60minIntensidad: moderada | Disminuyó significativamente:- DE (p=0,036)- MODD (p=0,048)- CONGA (p=0,048)MBG 24h disminuyó significativamente (p=0,014)TIR aumentó significativamente (p<0,05) |
| Francois et al.29 | 53 | Tres grupos:HIIT+ejercicio fuerza (datos solo grupo placebo: ingería agua postejercicio) | ECCDC/sí | 12 semanas (3 sesiones)HIIT (2 sesiones/sem)Ejercicio fuerza (una sesión/sem)20min cada sesiónIntensidad HIIT (90% FCmáx)-ejercicio fuerza (5-6RPE) | Disminuyó significativamente:- 24h glucosa media (p=0,01)- DE (p=0,01)- MAGE (p=0,02)HbA1c disminuyó significativamente (p<0,01)MBG 24h disminuyó significativamente (p<0,01) |
CONGA: superposición glucémica continua; CV: coeficiente de variación; DE: desviación estándar; ECC: ensayo clínico controlado; ECCDC: ensayo clínico controlado doble ciego; ECNC: ensayo clínico no controlado; END: ejercicio aeróbico continuo; FC: frecuencia cardíaca; HbA1c: hemoglobina glucosilada; HIIT: sesión única de ejercicio a intervalos de alta intensidad; MAGE: amplitud de excursión de glucosa; MBG: promedio de glucosa sanguínea; MICT: ejercicio aeróbico continuo; MODD: media de la diferencia absoluta entre 2 medidas 24h consecutivas del espectro glucémico; OGTT: test de tolerancia a la glucosa; TIR: tiempo en rango; VG: variabilidad glucémica.
Glucosa media 24h: promedio de glucosa 24h.
Respecto al grupo 1, se reportaron resultados con disminución significativa en, al menos, una métrica de VG, en 5 de los 7 artículos (71,4%). Sin embargo, al analizar los resultados obtenidos en esta variable en el grupo 2, tenemos que los 3 artículos que utilizaron entrenamiento físico demostraron disminuciones significativas (100%).
DiscusiónRespecto al análisis de los estudios que utilizaron una sesión de ejercicio (grupo 1), los protocolos de ejercicio aeróbico continuo mostraron mejores resultados en cuanto a la VG. Solo el de Rees et al.19, quienes estudiaron a 80 pacientes con DM2 que realizaban caminata durante 50min versus control en sedente, no obtuvo diferencias significativas de VG a corto plazo, medida a través de la amplitud media de excursión de glucosa. Si bien la explicación dada por los autores fue que la caminata se realizó 3-5h tras el almuerzo, hay que destacar que otras causas probables pudiesen ser la carga de trabajo, que fue baja comparativamente con la del resto de los estudios y esta fue la misma en términos absolutos (5km/h), implicando una carga distinta para cada sujeto19. Los 2 artículos restantes utilizaron como protocolo de ejercicio el de tipo HIIT, evidenciando al menos en una métrica de VG a corto plazo una disminución significativa en ambas investigaciones26,27.
En cuanto a las 3 investigaciones que utilizaron entrenamiento físico (grupo 2), sus resultados fueron muy concluyentes, ya que los 3 artículos demuestran una disminución significativa de la VG a corto plazo. En los estudios de Winding et al.24 y Francois et al.29 los resultados son aún más consistentes, al comprobar que metodológicamente se hicieron las mediciones SMCG dentro de los 3 días posteriores a la finalización del entrenamiento físico; lo anterior en fisiología es muy relevante, ya que estos resultados demostrarían el efecto mantenido en el control metabólico de la glucemia durante al menos estas 72h24,29.
De los 10 estudios analizados, 4 utilizaron protocolos de HIIT, y estos fueron muy similares en cuanto a volumen (intensidad, duración y reposo entre intervalos). De estas investigaciones es interesante destacar del estudio de Winding et al.24, que entrenaron semanalmente por 135min (incluidos calentamientos/enfriamiento) al grupo aeróbico y 75min/semana (incluidos calentamientos/enfriamiento) al grupo HIIT. El grupo aeróbico entrenó con una duración menor a las normas de la Organización Mundial de la Salud y la Asociación Americana de Diabetes propuestas para personas con diabetes. Lo anterior podría ser la causa de que las métricas principales de VG demostraran una disminución significativa solo en el grupo HIIT, que sí cumplió con las normas de la Organización Mundial de la Salud y la Asociación Americana de Diabetes. Similares resultados fueron evidenciados por Francois et al.29, quienes para ser coherentes con las recomendaciones de ejercicio de la Asociación Americana de Diabetes y el Colegio Americano de Medicina Deportiva31 no solo hicieron el protocolo HIIT, sino que también agregaron una sesión de ejercicio de fuerza, como es recomendado por dichas entidades, y tuvieron como resultados una reducción tanto en la media de glucosa ?de un 7%? como de la VG en 24h ?de un 23%? luego del entrenamiento con HIIT.
Lo que debemos destacar es que los protocolos de HIIT pueden mejorar la VG a corto plazo en individuos con DM2 y que los protocolos HIIT dan como resultado adaptaciones similares o incluso mayores en comparación con ejercicio o entrenamiento de intensidad moderada, a pesar de implicar un volumen más bajo. Lo anterior concuerda con un metaanálisis reciente que reveló una disminución de HbA1c de entre 0,5 y 0,25% mayor con HIIT al compararlo con ejercicio continuo32. Se puede destacar que este tipo de protocolos HIIT de bajo volumen, por lo tanto, parece ser una intervención de estilo de vida no solo factible, sino también eficaz, implicando un mínimo tiempo y recursos, logrando mejorar la salud en la DM2 y disminuir la VG tanto a corto como a largo plazo.
Las limitaciones de esta revisión sistemática radican principalmente en el bajo número de publicaciones incluido en el análisis, dadas las pocas investigaciones publicadas hasta la fecha, ya que claramente esto se asocia a la reciente disponibilidad tecnológica (SMCG). Por otro lado, el uso de SMCG para evaluar la VG es una fortaleza metodológica encontrada en los artículos incluidos; además, en 8 de las 10 investigaciones hubo concordancia en los equipos utilizados, tanto en marca como modelo, lo que proporciona una mayor homogeneidad a la hora de comparar los resultados obtenidos.
ConclusiónDe acuerdo con los resultados obtenidos, fue posible evidenciar las acciones fisiológicas positivas que tiene la actividad física sobre la VG a corto plazo en sujetos con DM2. En relación con el control metabólico, se demostraron los efectos positivos del ejercicio agudo y del entrenamiento físico sobre la VG a corto plazo. Los resultados más significativos se alcanzaron con los protocolos de entrenamiento físico, en los cuales la incorporación de intervalos de ejercicio de alta intensidad surge como una posibilidad interesante.
Son necesarias más investigaciones para precisar el volumen umbral para efecto esperado sobre la VG a corto plazo, la duración temporal de los efectos fisiológicos y la elección de los protocolos de ejercicios más efectivos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.