La trombosis venosa es una condición clínica en la cual un trombo se genera y ocluye la luz de un vaso venoso con el consecuente riesgo de embolia pulmonar. La fisiopatología se relaciona con estados de hipercoagulabilidad, alteraciones del flujo sanguíneo y lesiones vasculares endoteliales, conocida como la triada de Virchow. Dentro de los factores de riesgo se encuentran el cáncer, la estancia hospitalaria prolongada, la cirugía mayor, el trauma mayor y las trombofilias; sin embargo en el 25-50% de los casos es imposible identificar el factor etiológico. Presentamos el caso de un hombre con clínica y diagnóstico de trombosis venosa profunda en manejo extrainstitucional con cumínicos, que acude al Hospital Infantil Universitario de San José por incremento de los signos inflamatorios en el miembro inferior derecho. Al ingreso hay aumento de la extensión de la trombosis venosa y niveles subterapéuticos de INR, a pesar de dosis óptimas de cumínicos. La evolución trascurrió con taquicardia y episodios de diaforesis. Se documenta y realiza el diagnóstico de hipertiroidismo asociado con elevación del factor viii de coagulación.
ConclusiónSe considera que la trombosis venosa profunda está favorecida por un estado de hipercoagulación determinado por hipertiroidismo.
Venous thrombosis is a clinical condition that occurs when a thrombus forms and obstructs the lumen of a vein constituting a risk for pulmonary embolism. Pathophysiology features Virchow's triad, that is, hypercoagulability, blood flow alterations and vascular endothelial damage. Risk factors include, cancer, prolonged length of hospital stay, major surgery, major trauma and thrombophilias, although, identifying the etiological factor is impossible in 25 to 50% of all cases. A case is presented in a man with clinical presentation and diagnosis of deep venous thrombosis who had been managed with coumarin before consulting to our institution. He came to Hospital Infantil Universitario de San José for presenting an increase of the inflammatory signs on his right leg. At admission, a greater area was affected by venous thrombosis and subtherapeutic INR values were evidenced despite patient had received optimal doses of coumarin derivatives. He presented tachycardia and episodes of diaphoresis during his hospital stay. A diagnosis of hyperthyroidism associated with high concentrations of coagulation factor VIII was documented.
ConclusionIt is considered that DVT is favored by hypercoagulable states determined by hyperthyroidism.
La trombosis venosa profunda (TVP) es una enfermedad multifactorial cuya fisiopatología se ha relacionado con estados de hipercoagulabilidad, alteraciones del flujo sanguíneo y lesiones vasculares endoteliales. Se considera un problema de salud pública con un alto impacto en la morbilidad, la mortalidad y los costos en el sistema de salud1. Es una entidad frecuente en la atención en urgencias; se ha estimado cerca de 2 millones de nuevos casos en EE. UU. cada año, con una tasa de incidencia de 1 a 2 casos por mil habitantes año2.
Una de las complicaciones es que el trombo generado en las extremidades puede desprenderse y embolizar a las arterias pulmonares, lo que se conoce como embolia pulmonar (EP), conformando el espectro diagnóstico de la enfermedad tromboembólica venosa, entidad causante de entre 60.000 y 300.000 muertes anuales en EE. UU., número que excede el total de muertes por enfermedad cardiovascular o cáncer de seno. De ahí la importancia en su prevención, diagnóstico temprano y tratamiento3–5.
Los principales factores de riesgo para TVP son: cáncer, reposo en cama prolongado, cirugía ortopédica (cadera, rodilla), trauma mayor y trombofilias; sin embargo en el 25-50% de los casos no es posible identificar un factor etiológico6. Han sido descrito casos de TVP en pacientes con hipertiroidismo sintomático, cuyo mecanismo desarrollador es un estado de hipercoagulabilidad secundario a niveles elevados de factor de coagulación viii y de factor von Willebrand (FVW)7, sumado a disfunción endotelial8–10 y al incremento de adhesión plaquetaria11,12. Los pacientes con hipertiroidismo muestran una tendencia a complicaciones tromboembólicas (8-40%), que representan el 18% de las muertes asociadas con tirotoxicosis13. Lin et al.14 evaluaron el riesgo de EP entre los pacientes con hipertiroidismo durante un período de 5 años. Después del ajuste por características clínicas, demográficas y factores de riesgo, la posibilidad de tener EP fue de 2,31 veces (intervalo de confianza del 95% [IC 95%] 1,20-4,45; p=0,012) en los pacientes con hipertiroidismo. Por ello, los clínicos deben estar alerta de los riesgos tromboembólicos en los pacientes con hipertiroidismo.
Presentación de casoPaciente masculino de 51 años de edad quien consulta a un hospital de tercer nivel en la ciudad de Bogotá el día 25 de junio del 2016, por cuadro clínico de 12 días de dolor en miembro inferior derecho asociado con edema. Manifiesta que en los últimos 3 meses cursó con pérdida de peso de 9kg, hiperdefecación de características cafés y líquidas, con una frecuencia de 3 veces al día, sin sangre, no relacionadas con ingesta de alimentos. Al examen físico se evidencian signos de TVP por lo que se realiza ecografía doppler venosa de miembro inferior derecho con reporte de: TVP subaguda que compromete venas iliaca externa, femoral profunda, femoral superficial, perforantes, musculares y tibial posterior. Se hospitaliza e inicia manejo con warfarina y se solicita guayaco seriado, antígeno prostático específico, perfil hepático, función renal y colonoscopia, que reporta hemorroides grado 1 y sugieren descartar neoplasia oculta que explique el evento trombótico extenso. Tras los resultados normales de los estudios para patología neoplásica se da egreso con warfarina tableta 5mg vía oral/día e international normalized ratio (INR) en 3seg.
Consulta al Hospital Infantil Universitario de San José el 5 de agosto de 2016 por cuadro clínico de 3 días de evolución consistente en dolor tipo urente, de intensidad 8/10, localizado en miembro inferior derecho, no irradiado, asociado con edema, calor, rubor en trayecto venoso del miembro comprometido, fiebre de 39oC y limitación para la marcha. A la revisión por sistemas refiere cuadro de ansiedad, intolerancia al calor, palpitaciones, persistencia de hiperdefecación y mayor pérdida de peso. Al examen físico se encuentra paciente alerta, álgido, ansioso, cuyos signos vitales son frecuencia cardiaca 119latidos/minuto, temperatura 38,5oC, frecuencia respiratoria 19por minuto, saturación de oxígeno 99%, tensión arterial 138/75mm Hg. A la auscultación cardiopulmonar, ruidos cardiacos taquicárdicos, sin soplos. En miembro inferior derecho, cambios inflamatorios a nivel del tracto venoso de la pierna, diámetro circunferencial de 39cm, signo de Homans y Olow positivo.
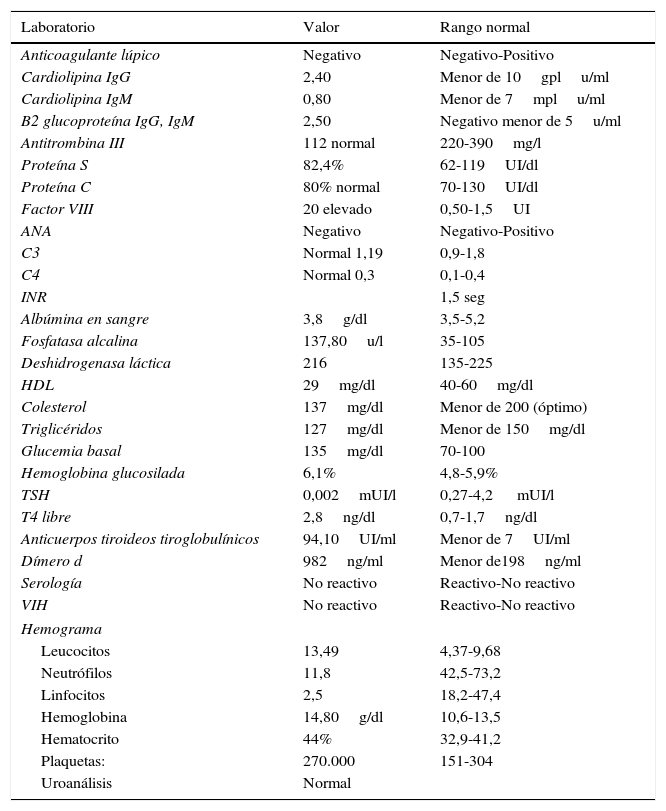
Se considera que cursa con diagnóstico de tromboflebitis en miembro inferior derecho, TVP extensa de la iliaca externa, femoral superficial y profunda, perforantes, musculares, tibial posterior derecha y se sospecha trombofilia adquirida versus congénita, neoplasia oculta e hipertiroidismo. Se solicitan estudios paraclínicos séricos inmunológicos y autoinmunes (tabla 1), que demuestran hipertiroidismo, con niveles elevados de factor viii, leucocitosis leve y estudio coproscópico sin hallazgos de infección o sangrado oculto, con INR en 1,5seg.
Estudios paraclínicos realizados dentro de la segunda hospitalización
| Laboratorio | Valor | Rango normal |
|---|---|---|
| Anticoagulante lúpico | Negativo | Negativo-Positivo |
| Cardiolipina IgG | 2,40 | Menor de 10gplu/ml |
| Cardiolipina IgM | 0,80 | Menor de 7mplu/ml |
| B2 glucoproteína IgG, IgM | 2,50 | Negativo menor de 5u/ml |
| Antitrombina III | 112 normal | 220-390mg/l |
| Proteína S | 82,4% | 62-119UI/dl |
| Proteína C | 80% normal | 70-130UI/dl |
| Factor VIII | 20 elevado | 0,50-1,5UI |
| ANA | Negativo | Negativo-Positivo |
| C3 | Normal 1,19 | 0,9-1,8 |
| C4 | Normal 0,3 | 0,1-0,4 |
| INR | 1,5 seg | |
| Albúmina en sangre | 3,8g/dl | 3,5-5,2 |
| Fosfatasa alcalina | 137,80u/l | 35-105 |
| Deshidrogenasa láctica | 216 | 135-225 |
| HDL | 29mg/dl | 40-60mg/dl |
| Colesterol | 137mg/dl | Menor de 200 (óptimo) |
| Triglicéridos | 127mg/dl | Menor de 150mg/dl |
| Glucemia basal | 135mg/dl | 70-100 |
| Hemoglobina glucosilada | 6,1% | 4,8-5,9% |
| TSH | 0,002mUI/l | 0,27-4,2 mUI/l |
| T4 libre | 2,8ng/dl | 0,7-1,7ng/dl |
| Anticuerpos tiroideos tiroglobulínicos | 94,10UI/ml | Menor de 7UI/ml |
| Dímero d | 982ng/ml | Menor de198ng/ml |
| Serología | No reactivo | Reactivo-No reactivo |
| VIH | No reactivo | Reactivo-No reactivo |
| Hemograma | ||
| Leucocitos | 13,49 | 4,37-9,68 |
| Neutrófilos | 11,8 | 42,5-73,2 |
| Linfocitos | 2,5 | 18,2-47,4 |
| Hemoglobina | 14,80g/dl | 10,6-13,5 |
| Hematocrito | 44% | 32,9-41,2 |
| Plaquetas: | 270.000 | 151-304 |
| Uroanálisis | Normal | |
Como estudios adicionales se solicitó angiotomografía computarizada de tórax, con reporte negativo para tromboembolismo pulmonar o hipertensión pulmonar, aunque se evidencia una imagen de morfología triangular y densidad de tejidos blandos compatible con nódulo subpleural adyacente a la cisura menor. Se realiza aspiración guiada por ecografía, cuyo reporte de citología fue extendido inflamatorio de predominio agudo, negativo para malignidad.
Se realizó ultrasonografía de tiroides con reporte de heterogeneidad de la glándula. Endoscopia de vías digestivas altas: pólipo sésil en cuerpo gástrico; se toman biopsias con reporte de gastritis crónica corporal con actividad severa y atrofia difusa leve, sin metaplasia ni displasia, además de pólipo antral hiperplásico.
Se indica manejo ajustado al peso de 60kg con metimazol 15mg12h (0,5mg/kg/día) y propranolol 20mg/12h. Adicionalmente cubrimiento antibiótico con oxacilina, la cual recibió por 10 días con resolución de cambios inflamatorios y del síndrome de respuesta inflamatoria sistémica. Tras instaurar manejo antitiroideo y betabloqueador se disminuyen las deposiciones diarreicas, así como la taquicardia y ansiedad, por lo que se da egreso con igual tratamiento y anticoagulación con enoxaparina 60mg/12h (1mg/kg/12h).
DiscusiónEl hipertiroidismo consiste en un incremento en la síntesis y secreción de hormona tiroidea. Se ha descrito una incidencia a nivel mundial del 0,5-2,5%. Se debe distinguir de la tirotoxicosis la cual se refiere a los cambios fisiopatológicos que se producen por el exceso de estímulo en el receptor de hormona tiroidea, independiente de su etiología (tabla 2). El diagnóstico se realiza cuando el resultado de la hormona estimulante de tiroides (TSH) se encuentra suprimido, casi siempre en cifras menores de 0,1 (valor de referencia normal 0,27-4,2mUI/l). Este examen debe complementarse con la T4 libre, la cual por lo regular se encuentra elevada (valores de referencia entre 0,7-1,7ng/dl); si está en rangos normales con TSH suprimida y ausencia de síntomas se denomina «hipertiroidismo subcli¿nico»15.
Causas de hipertiroidismo y tirotoxicosis
| Hipertiroidismo | Tirotoxicosis |
| Enfermedad de Graves | Tiroiditis subaguda |
| Bocio uninodular to¿xico | Tiroiditis posparto |
| Bocio multinodular to¿xico | Hormona tiroidea exo¿gena (iatrogénico) |
| Adenoma hipofisario productor de TSH | Inducido por litio, interfero¿n gamma, interleucina-2 |
| Inducido por yodo (Jod Basedow) | Tiroiditis infecciosa |
| Inducido por amiodarona | Exacerbacio¿n aguda de tiroiditis autoinmune |
Fuente: Rengifo15.
Los síntomas típicos de hipertiroidismo incluyen fatiga, nerviosismo, ansiedad, pérdida de peso, palpitaciones y sensibilidad al calor; en ocasiones se asocia con hiperemesis e hiperdefecación. Desde inicios del siglo xx se ha descrito también una relación entre el hipertiroidismo y la presencia de eventos tromboembólicos, en especial a nivel de las venas cerebrales16. Aunque se ha propuesto una serie de vías potenciales para explicar la asociación entre el hipertiroidismo y estados protrombóticos, los mecanismos patogénicos exactos que influyen en las anormalidades hemostáticas no han sido del todo aclaradas17. Se ha considerado que lo hace por la transcripción de genes mediada por el receptor de hormona tiroidea a nivel de célula hepática o endotelial, o de ambas. Otras hipótesis incluyen efectos indirectos mediados por la función del receptor β-adrenérgico.
Las hormonas tiroideas cumplen un papel importante en el sistema hemostático, ya que participan en la modulación de proteínas de la coagulación, como lo demostraron Homoncik et al.11 quienes observaron un aumento plasmático de FVW, factor viii e incremento en la función plaquetaria en pacientes con hipertiroidismo, en comparación con controles eutiroideos. La normalización de la función tiroidea con metimazol mostró disminución de los niveles de FVW, de la actividad de cofactor de ristocetina de FVW, del factor viii (p=0,01 frente a la línea de base) y de los tiempos de coagulación en comparación con los valores basales, los cuales se encontraban prolongados (p=0,01).
Algunos autores han planteado que el riesgo de trombosis depende de los niveles de T4L y no de los de la TSH. Debeij J et al.18 analizaron las relaciones entre los niveles de T4 libre, TSH y anticuerpos antiperoxidasa con el riesgo de TVP en 446 pacientes, encontrando un riesgo de 2,5 (IC 95%: 1,3-5) para los niveles de T4 libre por encima del percentil 98. La asociación entre los niveles de TSH con el riesgo de trombosis fue menos marcada y no se evidenció relación alguna entre los niveles de anticuerpos antiperoxidasa y el riesgo de trombosis venosa. El riesgo absoluto dentro de los 6 meses en la población con los niveles de T4 libre por encima del percentil 98 fue de 6,1/1.000 años/ persona (IC 95%: 1,7-15,7).
Van Zaane et al.12 investigaron el riesgo de TVP para los diferentes niveles plasmáticos de las hormonas tiroideas y anticuerpos antitiroideos. En ausencia de los tradicionales factores de riesgo adquiridos, los niveles de T4 libre por encima de 17pmol/l (1,32ng/ml) dieron un OR ajustada por edad y sexo de 2,2 (IC 95%: 1,2-4,2), y en aquellos con T4 libre por encima del rango de referencia, hasta un OR de 13 (IC 95%: 1,1-154,1). Los investigadores no encontraron asociación clara entre la TSH o anticuerpos antiperoxidasa y TVP.
En otro estudio realizado por Debeij et al.19 no se evidenció en los pacientes con niveles de T4L estables y aumento de TSH un efecto claro sobre los parámetros de coagulación. Mientras que en los pacientes que cambiaron de un estado de niveles elevados de TSH y T4 libre bajos a uno de niveles bajos de TSH y T4 libre ligeramente elevado, presentaron un claro aumento en los factores viii, ix, FVW y en los niveles de fibrinógeno. Estos resultados indican que los cambios en los factores de coagulación relacionados con la función tiroidea están mediados principalmente por la T4 libre y no por la TSH. Es probable que el riesgo de TVP asociado con los niveles de T4L refleje las alteraciones inducidas por hormonas tiroideas en la síntesis y secreción del factor viii. También se observó un cambio en otros factores de coagulación (FII, antitrombina iii y proteína S) sobre todo hacia una tendencia protrombótica, aunque menos marcada.
Otras investigaciones también han reportado, en comparación con los controles eutiroideos, niveles elevados de fibrinógeno en plasma, factor ix, VWF, inhibidor de la antitrombina y activador del plasminógeno (PAI-1), junto con una disminución del factor x y activador del plasminógeno tisular (t-PA), lo que indica una actividad fibrinolítica reducida17,20. Lippi et al.21 demostraron en una gran muestra de pacientes ambulatorios (n=1.329), que aquellos con hipertiroidismo tenían menor tiempo de tromboplastina parcial activada y niveles más elevados de fibrinógeno en plasma en comparación con los eutiroideos. En el estudio realizado por van Zaane et al.22 se les administró levotiroxina a voluntarios sanos en un patrón cruzado aleatorio controlado; aquellos con la dosis más alta (0,45 o 0,6mg/día durante 14 días) presentaron un aumento significativo de fibrinógeno (17%), de la actividad VWF (24%), antígeno de VWF (26%), factor viii (19%), factor ix (14%), factor x (7%) y PAI-1 (116%), mientras que el tiempo de tromboplastina parcial se redujo en un 3%. Con la dosis más baja (0,3mg/día durante 14 días), solo el aumento de la actividad VWF (7%) y del antígeno de VWF (10%) se mantuvieron significativas.
La terapia anticoagulante está indicada en todos los pacientes con TVP sea proximal, distal, superficial o profunda, ya que la EP se produce en cerca del 50% de los individuos no tratados, con mayor frecuencia en cuestión de días o semanas del evento23,24.
La warfarina, un antagonista de la vitamina K, es el anticoagulante oral más utilizado para la prevención y tratamiento de tromboembolismo venoso y arterial, actúa mediante la inhibición de la enzima epóxido reductasa, bloqueando de este modo la activación de factores de coagulación vitamina K-dependientes (factores ii, vii, ix y x). La intensidad de la anticoagulación se evalúa mediante la medición del INR25. La disponibilidad de la warfarina puede verse afectada por medicamentos, como el metimazol, mitigando su capacidad para lograr el rango terapéutico. Akin et al.26 presentaron el caso de una paciente de 22 años con TVP manejada con warfarina y metimazol que no logra rangos terapéuticos de INR luego de 6 meses de tratamiento, por lo que deciden iniciar la administración de litio, que luego de 2 semanas logra estado eutiroideo junto con un nivel de INR terapéutico al recibir 10mg/día de warfarina.
Las heparinas de bajo peso molecular y el fondaparinux son los pilares del tratamiento inicial para pacientes con TVP y EP23,24; se consideran un mejor esquema de tratamiento que los antagonistas de la vitamina K debido a su menor riesgo de sangrado y menores interacciones. No se han realizado estudios que evalúen la efectividad de la heparina de bajo peso molecular en pacientes con hipertiroidismo que presentan TVP o EP.
La duración de la terapia anticoagulante varía con el contexto clínico, así como con los valores y las preferencias del paciente. Los pacientes con un primer evento tromboembólico en el contexto de un factor de riesgo reversible (por ejemplo, trauma, cirugía), deben ser tratados por un mínimo de 3 meses. La terapia indefinida se prefiere en pacientes con 2 o más episodios tromboembólicos, en aquellos con un primer episodio tromboembólico idiopático y en enfermedades oncológicas. Después de esto, todos los pacientes deben ser evaluados para la relación riesgo/beneficio de la terapia a largo plazo23. Aquellos con hipertiroidismo se pueden considerar como pacientes con factor de riesgo reversible, por lo que se puede realizar la terapia anticoagulante por 3 meses y hacer control de los niveles de hormona tiroidea, en especial en los niveles de T4 libre también cada 3 meses.
ConclusionesLas alteraciones de la hormona tiroidea pueden conducir ya sea a un desequilibrio en la producción y el aclaramiento, o a una transcripción genética elevada o baja de los factores de coagulación, llevando a un riesgo de trombosis. Hasta este punto, no hay ninguna explicación definitiva para el mecanismo exacto, sin embargo el FVW, el factor viii y la función plaquetaria son los principales factores de coagulación asociados con este estado protrombótico. Estudios poblacionales sobre el efecto de la disfunción de la tiroides sobre la coagulación y los factores fibrinolíticos muestran que un estado procoagulante está presente en el hipertiroidismo sintomático, así como han revelado un mayor riesgo de mortalidad de enfermedades cerebrales y cardiovasculares, por eso es importante en los pacientes con hipertiroidismo evaluar el riesgo de trombosis venosa, así como en aquellos que presenten enfermedad tromboembólica evaluar la función tiroidea. Se considera importante la realización de estudios donde se evalúe cuál es la terapia anticoagulante más efectiva en este tipo de paciente, así como la duración del tratamiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.