La miocardiopatía hipertrófica obstructiva es una entidad genética que puede manifestarse en cualquier etapa de la vida. Se han descrito múltiples alteraciones genéticas responsables, la mayor parte de las cuales afectan a proteínas constituyentes del sarcómero. La clínica es igualmente heterogénea, pues a pesar de que un gran porcentaje de pacientes permanecen asintomáticos, constituye una de las principales causas de muerte súbita. La alteración de mayor importancia radica en la obstrucción del flujo sanguíneo eyectivo hacia la aorta. Existen varias estrategias terapéuticas, inicialmente farmacológicas y posteriormente invasivas. De entre estas últimas, la más realizada es la miomectomía del septo interventricular, pero en caso de contraindicación por comorbilidad, está indicada la ablación alcohólica de la rama coronaria que irriga el mismo, provocando necrosis de dicha región. En este artículo describimos el manejo anestésico de una paciente sometida a dicha técnica, considerando la sedación moderada como una alternativa válida.
Obstructive hypertrophic cardiomyopathy is a genetic entity that can occur at any stage of life. Multiple genetic alterations have been described as responsible, most of which affect constituent proteins of the sarcomere. The clinic is also heterogeneous, although a large percentage of patients are asymptomatic, is one of the leading causes of sudden death. The most important alteration lies in the obstruction of left ventricle outflow tract. Initially, treatment is started with pharmacological strategies. However, if it isn’t effective, invasived therapy are recomended. Interventricular septal myomectomy is the traditional option, but in case of contraindication for comorbidity the alcoholic ablation coronary branch is indicated, causing necrosis of this region. In this article we describe the anesthesic management of a patient undergoing this technique, considering the moderate sedation as a valid alternative.
La miocardiopatía hipertrófica obstructiva (MHO) es una de las enfermedades genéticas cardíacas más frecuente, con una prevalencia de 0,2% en la población general. Se puede desarrollar en todas las fases vitales y su transmisión sigue la pauta mendeliana autosómica dominante1. Se han descrito más de 400 mutaciones en los genes que codifican proteínas del sarcómero, destacando aquellas que afectan a la miosina, tanto en su cadena estructural como en los puntos de unión con la proteína C.
Se caracteriza por una hipertrofia del miocardio, sobre todo a nivel septal, suponiendo un aumento en los requerimientos de oxígeno y una disfunción microvascular que explica el aumento de eventos isquémicos entre esta población. Del mismo modo, la alteración estructural afecta al tejido de conducción eléctrica, siendo relativamente frecuente la aparición de taquiarritmias tanto auriculares como ventriculares.
En el segundo escalón del tratamiento, si los síntomas son refractarios a diferentes estrategias farmacológicas, se ha indicado la miomectomía quirúrgica de la región proximal del septum ventricular. No obstante, en 1994 se realizó la primera ablación septal hipertrófica transcoronaria (ASHT) y desde 2009 se ha convertido en un tratamiento alternativo para aquellos pacientes con MHO que no son subsidiarios de cirugía cardíaca2,3.
La bibliografía actual se centra en la descripción de la técnica y sus resultados desde el punto de vista cardiológico, siendo muy escasa la literatura que analiza el manejo anestésico del paciente durante ASHT4. Por ello consideramos de interés describir el caso de una paciente con MHO refractaria, propuesta para ASHT bajo sedación moderada, según la escala de American Society of Anesthesiologists (ASA), comentando los principales aspectos anestésicos a considerar.
Caso clínicoSe trata de una mujer de 64 años sin alergias medicamentosas conocidas, hipercolesterolemia, con enfermedad obstructiva crónica de grado moderado según la clasificación GOLD (FEV1 76%) y MHO con disnea grado iii según NYHA. Además, presentaba historia de angina estable a leves esfuerzos e hipertensión arterial. Se encontraba bajo tratamiento con metoprolol, ácido aceltilsalicílico, inhibidores de la enzima convertidora de angiotensina, furosemida e inhaladores. Su índice de masa corporal era de 27,18kg/m2, sin factores predictivos de vía aérea difícil, siendo catalogada como ASA IV.
Con respecto a las pruebas complementarias, destaca el estudio Holter, donde se observó un ritmo sinusal con episodios de taquicardia supraventricular de frecuencia máxima de 140 lpm. En la última ecocardiografía se describía un ventrículo izquierdo (VI) con hipertrofia concéntrica severa, función sistólica hiperdinámica y disfunción diastólica grado i. Presentaba obstrucción subvalvular del tracto de salida con un gradiente subaórtico de 58mmHg e insuficiencia mitral leve.
Las necesidades de cardiología durante el proceso incluían la inmovilidad del paciente durante la inyección alcohólica, el implante de un marcapasos transitorio por alta probabilidad de desarrollo de bradiarritmias y la realización de controles ecocardiográficos transtorácicos. Todo ello, junto al alto grado de colaboración de la paciente, fueron los parámetros para optar por unos cuidados anestésicos monitorizados basados en evitar los cambios hemodinámicos, optándose por una sedación moderada.
Se llevó a cabo monitorización estándar con electrocardiografía, saturación de oxígeno, capnografía y presión arterial (PA) no invasiva. Se canalizó una vía periférica del calibre 18 G, administrándose 4 mg de midazolam, 50 μg de fentanilo y oxigenoterapia mediante cánula nasal a 2 lpm. A continuación se canalizó, bajo control ecográfico, la vena yugular derecha y se procedió al implante de marcapasos transitorio con una frecuencia de disparo de 60 lpm y un umbral de activación a los 55 lpm. Posteriormente, se canalizó la arteria radial derecha para monitorización invasiva de la PA y se realizó ecocardiografía transtorácica basal, obteniéndose un gradiente subaórtico de 60mmHg.
Se procedió a la realización de la coronariografía a través de la arteria femoral. Tras el reconocimiento de arteria coronaria septal y el aislamiento de la rama mediante balón, se procedió a la inyección de 1,5ml de etanol.
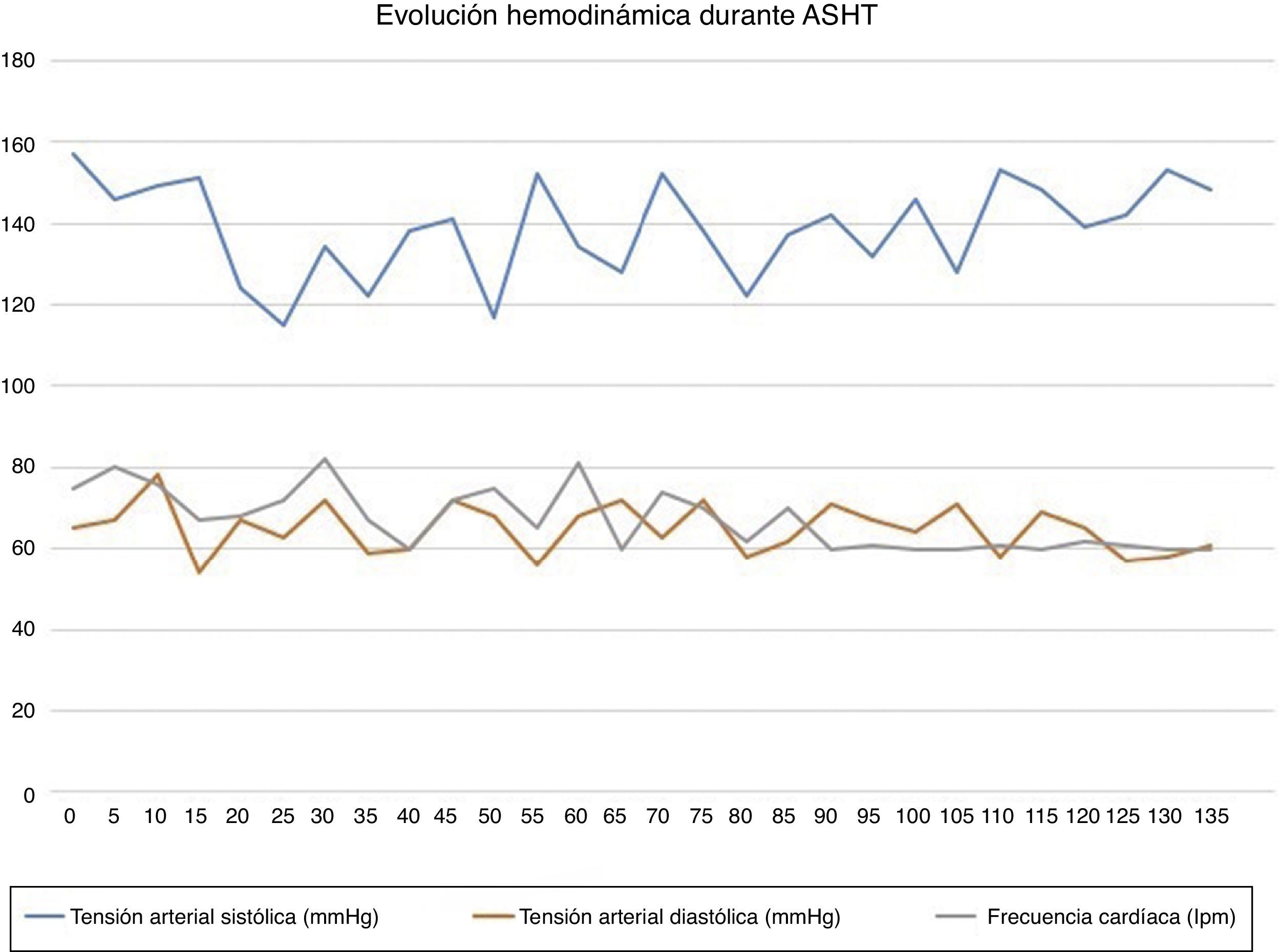
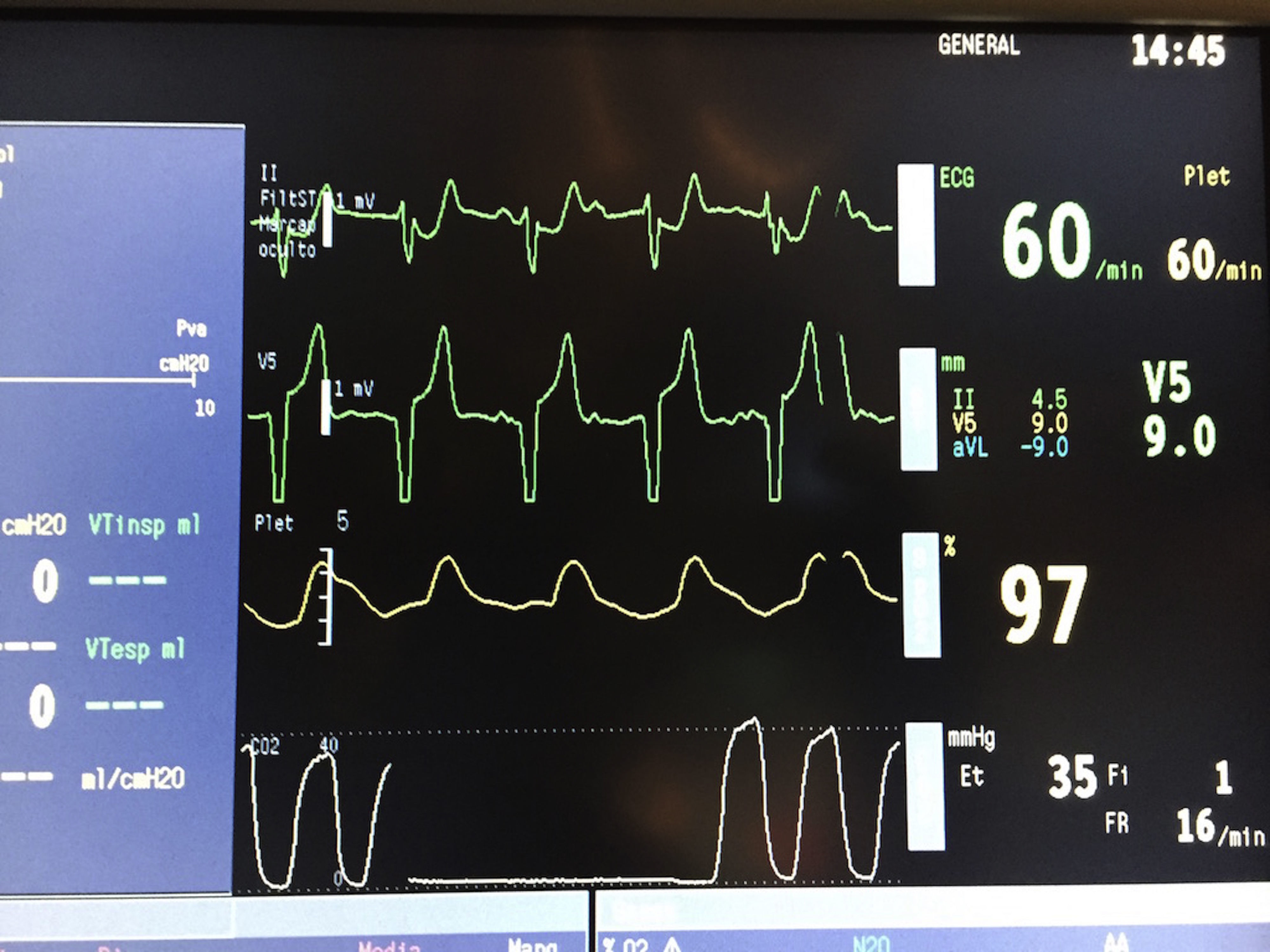
A lo largo de todo el proceso, se administraron bolos de 1 mg de clorhidrato de morfina cada 15 o 20 min hasta un total de 7 mg. La paciente permaneció asintomática, excepto durante la inyección alcohólica, cuando refirió un dolor centrotorácico leve que cedió con 2 mg adicionales de morfina. Tras la ablación se estableció un bloqueo aurículo-ventricular (BAV) completo, activándose ritmo de marcapasos, pero preservando la estabilidad (fig. 1). En la ecocardiografía postablación se objetivó un gradiente subaórtico de 8mmHg. La paciente permaneció estable hemodinámicamente durante todo el procedimiento, cuya duración se estimó en 130min (fig. 2).
Al finalizar la intervención, fue trasladada a la unidad de cuidados intensivos (UCI) consciente, sin dolor, estable y con ritmo de marcapasos. Durante las primeras horas evolucionó satisfactoriamente, reduciéndose la disnea hasta grado i según NYHA y recuperando el ritmo sinusal propio, pasando a sala de cardiología a las 24 h de su estancia en la UCI. Tras 3 días de vigilancia en planta de hospitalización, mediante telemetría y reevaluaciones clínicas periódicas, fue dada de alta.
DiscusiónEl tratamiento de la MHO mediante ASHT es una alternativa a la miomectomía clásica en pacientes con alta comorbilidad. Conocer la fisiopatología y las implicaciones clínicas de la MHO es esencial para realizar un correcto abordaje anestésico. Se caracteriza por una hipertrofia asimétrica del miocardio septal y un movimiento anterior sistólico de las valvas mitrales, que apoyan sobre dicho septum. De esta forma, se estrecha el tracto salida del VI, ocasionando un gradiente de presiones entre la aorta y el VI que progresa con la evolución de la hipertrofia, y disminuye el volumen de eyección. A ello acompaña una insuficiencia diastólica que dificulta el llenado ventricular (80% de los casos), con aumento de presiones en el lecho pulmonar y, a medida que progresa, en cavidades derechas. Por otro lado, existe diferencia entre las demandas y el aporte de oxígeno, favoreciendo la aparición de eventos isquémicos. Por último, cabe mencionar la afectación del tejido de conducción eléctrica, ocasionando todo tipo de taquiarritmias, siendo la más prevalente la fibrilación auricular (hasta en el 20% de los individuos).
Aunque un porcentaje importante de pacientes permanecen asintomáticos, hasta un 15% presenta como primera manifestación un episodio de muerte súbita. En caso de ser sintomática, prevalecen los síntomas derivados de la obstrucción ventricular: disnea y cuadros sincopales.
La ASHT localiza mediante coronariografía la arteria perforante septal donde se inyectan entre 1 a 3ml de etanol, desencadenando isquemia y necrosis, con posterior mejora de la obstrucción. No es una técnica exenta de riesgos; el principal consiste en la extensión del alcohol a otros ramos arteriales por accidente o difusión por colaterales, provocando un infarto masivo. También se pueden desarrollar tanto taquiarritmias ventriculares como bloqueos de rama y BAV. Los BAV suelen ser tipo1:1 y desaparecen en las primeras horas tras la ASHT, aunque la necesidad de marcapasos definitivo puede alcanzar el 30%5.
Varios factores influyen en la elección de la mejor estrategia anestésica durante el procedimiento, incluyendo el estado funcional del paciente, la preferencia y nivel de bienestar del cardiólogo intervencionista y del anestesiólogo. La decisión debe garantizar siempre un adecuado nivel de sedación y analgesia.
Entre las consideraciones anestésicas descritas en la literatura para el manejo general de MHO durante los procedimientos quirúrgicos, destaca la preservación del gasto cardíaco sin aumentar la contractilidad, por ello se debe evitar la descarga simpática y preservar la precarga con una adecuada fluidoterapia6-8. La respuesta simpática derivada de la manipulación de la vía aérea o de la presencia de dolor origina un incremento de la contractilidad y de la frecuencia cardíaca, con aumento de consumo de oxígeno y reducción del llenado diastólico, ocasionando una disminución en el volumen de eyección.
La necesidad de una estabilidad hemodinámica condiciona que los fármacos hipnóticos recomendados, sean las benzodiacepinas, el etomidato y los halogenados especialmente el sevoflurano por su efecto cardioprotector. En cuanto al control analgésico, los opiáceos son de elección, aunque en el caso del clorhidrato de morfina se defiende una administración lenta de pequeñas dosis para evitar una descarga brusca de histamina. En caso requerir intubación orotraqueal (IOT) se sugiere la administración profiláctica de una dosis de esmolol o metoprolol6-8.
Basándonos en estos principios, y ante una técnica mínimamente invasiva, decidimos realizar una sedación moderada, evitando la IOT. Los fármacos seleccionados debían mantener la estabilidad hemodinámica y asegurar una correcta analgesia sobre todo durante la administración de etanol. Agarwal et al.4 describió un caso clínico bajo anestesia total intravenosa sin intubación; no obstante, nosotros optamos por la administración de benzodiacepinas y clorhidrato de morfina al ser 2 fármacos con perfiles más seguros en cuanto a cambios hemodinámicos en comparación con la administración de propofol, que puede inducir a hipotensión por vasodilatación periférica y comprometer la estabilidad hemodinámica. Este autor hace referencia a la administración en otras instituciones de dexmetomidina en perfusión como fármaco de elección para las sedaciones durante la ASHT, pero considera que hay un mayor riesgo de hipotensión arterial, bradicardia y retraso en la conducción; opinión que compartimos. Otros autores solo mencionan sutilmente la administración de una analgesia pura o analgesia junto a tranquilizantes menores en el momento de la administración del alcohol8. En nuestro caso, la intervención se desarrolló de forma exitosa bajo sedoanalgesia moderada, permitiendo una reevaluación continua del estado de la paciente y una terapia dirigida en las diferentes etapas del proceso. Por tanto, es esencial conocer las implicaciones clínicas de la enfermedad así como las diferentes posibilidades para el manejo anestésico durante la ASHT, siendo la sedación moderada una alternativa válida.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores no presentan ningún conflicto de intereses.