El síndrome de Klippel-Feil es una enfermedad de herencia autosómica dominante caracterizada por la presencia de cuello corto, fusión de vértebras cervicales e implantación baja del cabello.
La cirugía de Fontan-Kreutzer es realizada como tratamiento de determinadas cardiopatías congénitas, asociadas funcional o estructuralmente a ventrículo único.
ObjetivosExponer la estrategia anestésica implementada, describiendo los cambios fisiopatológicos asociados a su condición y potenciales durante el procedimiento y el manejo hemodinámico apropiado.
Material y métodosSe presenta a un paciente de 11 años de edad, de sexo masculino, con antecedentes de síndrome de Klippel-Feil y circulación de Fontan. Se detallan el manejo anestésico perioperatorio y la monitorización empleada.
ResultadosA través del empleo de una monitorización apropiada y un manejo dirigido por metas hemodinámicas, el paciente permaneció estable durante todo el procedimiento. Evolucionó favorablemente, sin complicaciones, recibiendo el alta hospitalaria a los 6 días.
ConclusiónLa complejidad que presenta el manejo de este tipo de patologías determina la necesidad de adoptar un plan anestésico prolijo y definido a fin de evitar complicaciones potencialmente graves.
Klippel-Feil syndrome is an autosomal dominant patterned-inherited disease characterized by short neck, abnormal fusion of two or more cervical spinal bones and low hairline at the back of the head.
The Fontan-Kreutzer Procedure is a surgical technique that allows the final palliation of many congenital heart defects associated with a single ventricle physiology.
ObjectivesReport the perioperative management of the patient during the procedure, and describe pathophysiologic changes during such condition and also potential drawbacks of the chosen technique. Assess the appropriateness of hemodynamic management.
Material and methodsThe authors report the perioperative management and hemodynamic monitoring of a young child with Fontan Repair and Klippel-Feil syndrome who underwent a cervical spine surgery procedure.
ResultsThe authors adopted an integrated approach merging together hemodynamic and functional data to assess the appropriateness of hemodynamic management. The patient remained stable during the procedure and showed no complications during the hospitalization. He was discharged from hospital on day six after surgery.
ConclusionPerioperative management of patients with Fontan palliation is quite challeging. An appropiate hemodynamic monitoring and wise therapeutic choices are indispensable to avoid serious complications.
Los continuos avances en las técnicas quirúrgicas en las últimas décadas han permitido lograr un amplio aumento de la sobrevida de los pacientes con cardiopatías congénitas. Muchos logran alcanzar la vida adulta con buenas condiciones clínicas y, con cierta frecuencia, deben ser reintervenidos por otras causas. El manejo perioperatorio de este grupo de pacientes es complejo y requiere de habilidades específicas, así como también de un conocimiento exhaustivo de la fisiopatología de la cardiopatía preexistente y de los efectos de las intervenciones quirúrgicas realizadas.
Existen además múltiples asociaciones de este tipo de cardiopatías con otras enfermedades que afectan a diferentes órganos y sistemas, complejizando aún más el abordaje del acto anestésico.
En el presente artículo, exponemos el manejo anestésico de un paciente con circulación de Fontan y síndrome de Klippel-Feil sometido a una cirugía de artrodesis cervical por vía posterior en forma programada.
Presentación del casoSe trata de un paciente de sexo masculino, de 11 años de edad, programado para cirugía de artrodesis cervical por vía posterior.
Como antecedentes personales, presentaba un síndrome de Klippel-Feil asociado a un síndrome de Arnold Chiari tipo i. También, presentaba una cardiopatía congénita caracterizada por doble salida del ventrículo derecho, ventrículo izquierdo hipoplásico y doble sistema vena cava superior.
Como antecedentes quirúrgicos, el paciente fue sometido a múltiples cirugías paliativas, entre las cuales se encontraban una cirugía descompresiva occipitocervical por malformación de Arnold Chiari a los 2 años de vidas y una cirugía de Fontan definitivo a los 4 años.
En el examen físico, su peso era de 31,5kg y su talla de 1,34m. Presentaba como datos positivos una ceguera unilateral (secundaria a úlcera de córnea a los 2 años de vida) y una hipoacusia bilateral (utiliza audífonos).
Se evaluó la semiología de la vía aérea, presentando el paciente una limitada flexo-extensión cervical, una apertura bucal de 3cm y macroglosia. Otro factor que agregaba una potencial dificultad en el abordaje de la misma era la presencia de un halo de tracción cefálico-cervical.
El resto del examen no presentó hallazgos significativos.
Como exámenes complementarios, el electrocardiograma mostraba como único hallazgo una bradicardia sinusal, en tanto que el informe del ecocardiograma detallaba la presencia de un Fontan normofuncionante, con buena función sistodiastólica global. El examen de laboratorio era normal para el sexo y la edad.
La única medicación administrada diariamente al paciente era aspirina 50mg al día, la cual fue suspendida 7 días previos a la cirugía. No presentaba alergias conocidas.
Manejo anestésicoTeniendo en cuenta los múltiples antecedentes y la complejidad que impone el abordaje anestésico-quirúrgico del paciente, se consensuó un plan integral de manejo con todo el equipo tratante.
Desde el punto de vista anestésico, este incluyó una visita para evaluación preoperatoria, un plan estratégico intraoperatorio definido y un manejo conjunto en la unidad de cuidados intensivos pediátricos para el postoperatorio.
Evaluación preoperatoriaSe realizó una entrevista la semana previa a la intervención. Se explicaron los diferentes pasos a seguir desde la llegada del paciente a quirófano, la técnica de inducción y el manejo de la vía aérea planificados, señalando la posibles dificultades y complicaciones. Se dieron instrucciones en cuanto al manejo del ayuno preoperatorio, enfatizando la ingesta de líquidos claros hasta 2 h previas al procedimiento.
Procedimiento anestésicoLas prioridades de la estrategia anestésica empleada estuvieron centradas en el abordaje de la vía aérea y el manejo hemodinámico y respiratorio durante el procedimiento.
Una vez ingresado el paciente a la unidad de preanestesia junto a su madre, se procedió a administrar una sedación con midazolam 12,5mg por vía oral. A los 25 min, se trasladó al binomio al quirófano.
Respecto al manejo de la vía aérea, se planificó realizar una inducción inhalatoria con mantenimiento de la ventilación espontánea hasta la canalización de una vena periférica. Sobre la base del conocimiento de que en intervenciones previas el paciente pudo ser ventilado fácilmente con máscara facial y dispositivo supraglótico (máscara laríngea), se estableció como estrategia emplear un relajante muscular para facilitar la intubación orotraqueal. Dado que tanto la apertura bucal como la distancia tiromentoniana eran aceptables, se decidió hacer un intento único de intubación con videolaringoscopio, con disponibilidad de fiadores de ser necesarios, y ante la falla del mismo, proceder con la colocación de una máscara laríngea e intubación con fibrobroncoscopio a través de la misma.
Se intubó con el uso de un videolaringoscopio en forma atraumática en el primer intento.
Se utilizó una anestesia general balanceada con sevofluorano y remifentanilo.
Se colocó un acceso arterial radial y central femoral doble luz en forma ecoguiada. Se posicionó al paciente en decúbito prono, con estricta protección de plexos y decúbitos. No se registraron complicaciones.
Se administró ventilación mecánica invasiva bajo el modo controlado por presión, manteniendo presiones bajas para lograr un volumen corriente de entre 6 a 8ml/kg. Se tituló la presión positiva teleespiratoria, manteniendo valores no mayores a 5 cmH2O. Se utilizó una fracción inspirada de O2 0,4 o menor a fin de lograr una saturación de O2 mayor o igual al 94%.
Se monitorizó la mecánica ventilatoria mediante el cálculo de la compliance toracopulmonar y la visualización de las curvas de presión-volumen, flujo-tiempo y presión tiempo. El manejo hemodinámico fue dirigido por objetivos: la fluidoterapia fue guiada por la variación de la presión de pulso; se mantuvo una PAM mayor a 65mmHg; se efectúo una reposición adecuada de la pérdida hemática, la cual fue cuantificada en el reservorio del recuperador de sangre y mediante el conteo de gasas; se realizó una monitorización gasométrica estricta, incluyendo mediciones de lactato y saturación venosa central seriadas, además de un control de diuresis en forma horaria.
ResultadosLos parámetros ventilatorios mecánicos y gasométricos se mantuvieron en el rango normal para su edad y estatura. No hubo necesidad de realizar ajustes en el ventilador.
El balance hídrico intraoperatorio fue neutro, registrándose como ingresos 2.000ml de solución de Ringer lactato más 200ml de sangre recuperada y como egresos, una pérdida hemática aproximada de 600ml y una diuresis final de 600ml.
No hubo necesidad de recurrir al empleo continuo de vasopresores.
Las mediciones de laboratorio fueron normales. Los valores finales fueron: lactato 1,24 meq/l; saturación venosa central final del 65%; delta-gap de CO2 menor de 6mmHg.
Se estableció un plan de analgesia postoperatoria multimodal con: dexametasona 8mg, paracetamol 650mg, clonidina 35 μg y morfina 7mg. Como antiemético, se administró ondansetrón 4mg.
Se logró extubar al paciente al finalizar el procedimiento sin dificultades. Fue trasladado luego a la sala de recuperación anestésica junto a su madre, lúcido, sin dolor y con examen neurológico normal.
Manejo postoperatorioSe realizaron la monitorización y el seguimiento del paciente en la unidad de recuperación anestésica, con la presencia de sus padres. Permaneció allí por 2 h, sin presentar intercurrencia alguna. Posteriormente, fue trasladado monitorizado, acompañado por el anestesiólogo tratante a la unidad de cuidados intensivos pediátricos.
Evolucionó en forma favorable, sin presentar complicaciones. Se otorgó el alta hospitalaria a los 6 días posprocedimiento.
DiscusiónEn nuestro artículo, reportamos el manejo anestésico de un paciente pediátrico con síndrome de Klippel-Feil y circulación de Fontan.
La cirugía de Fontan está indicada en el tratamiento de determinadas cardiopatías congénitas con fisiología de ventrículo único. Consiste en realizar la anastomosis entre la vena cava superior e inferior con la arteria pulmonar, generando cambios fisiológicos que el anestesiólogo debe conocer con el objetivo de no perturbar el equilibrio hemodinámico durante la anestesia general1-3.
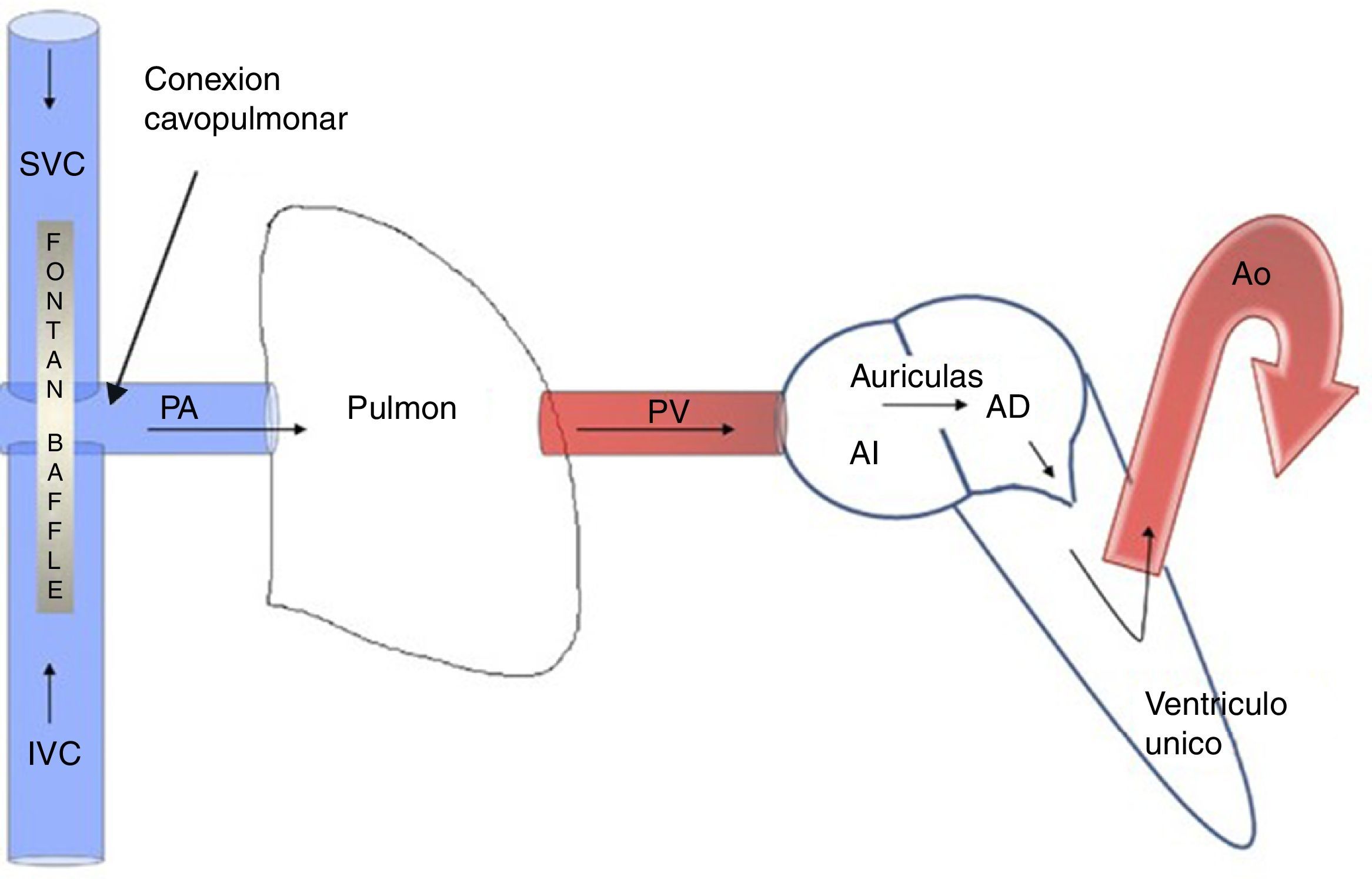
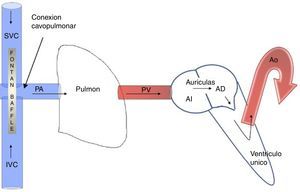
El resultado fisiológico del Fontan tiene 2 componentes: por un lado, la presencia de un ventrículo único dedicado a la expulsión de la sangre hacia la circulación sistémica, con la particularidad que este puede ser morfológicamente un ventrículo derecho o un ventrículo izquierdo dependiendo el defecto cardíaco congénito. El segundo componente, el retorno venoso, que de forma pasiva fluye hacia la arteria pulmonar de manera no pulsátil2 (fig. 1).
En un sistema circulatorio fisiológico el retorno venoso se define por:
siendo RRV las resistencias al retorno venoso.
Después de la cirugía paliativa de Fontan, la presión de la aurícula derecha incrementa su valor rápidamente debido a que no existe una actividad ventricular que mantenga las presiones bajas, equiparándose de esta manera con la presión media de la arteria pulmonar (PMAP) (15-20 mmHg).
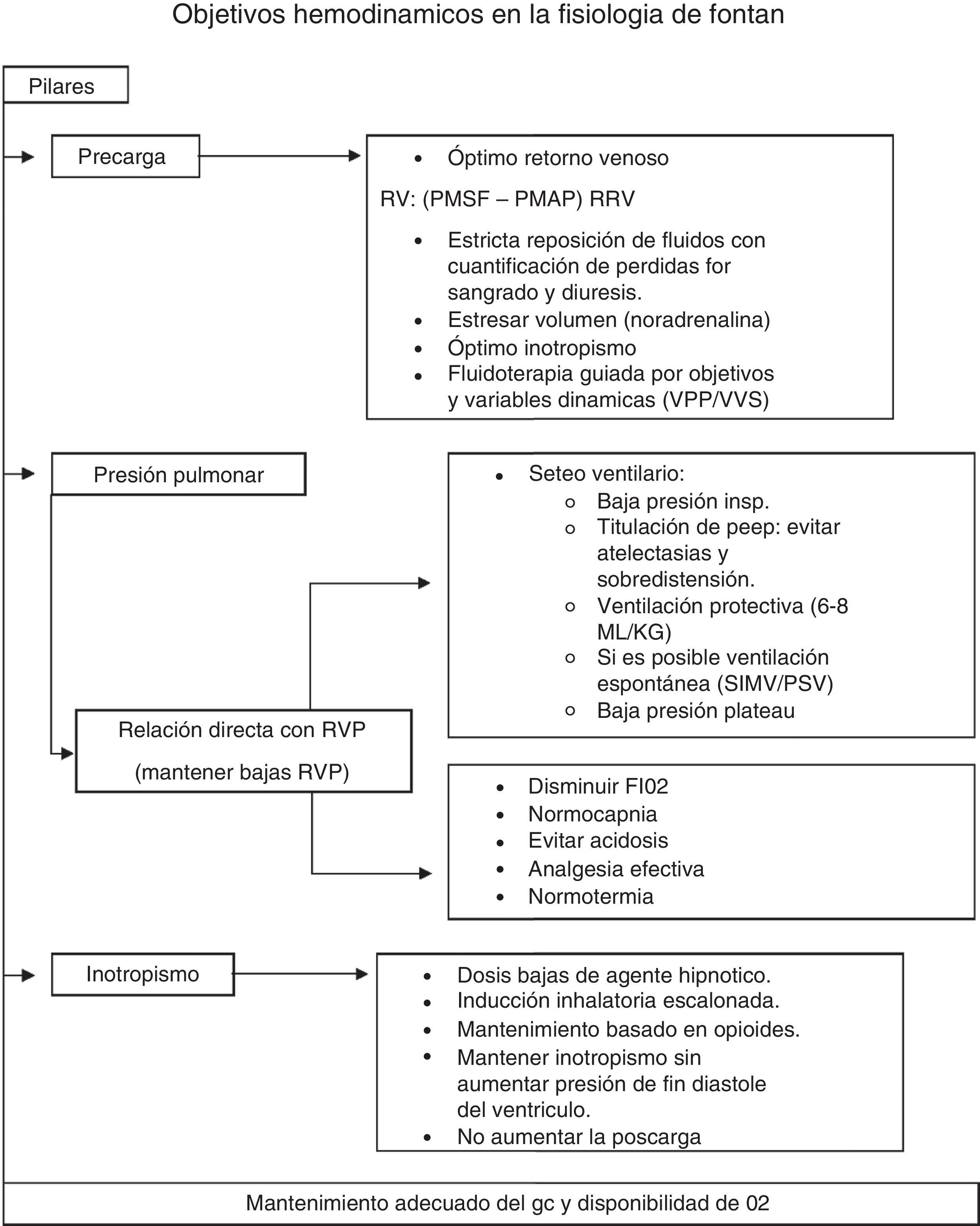
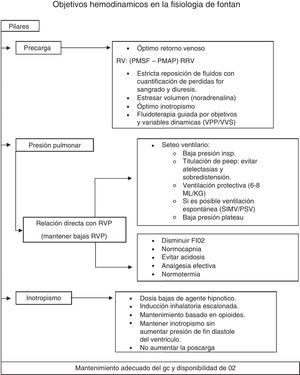
Para mantener el gradiente del retorno venoso, la presión media de llenado circulatorio (PMSF) debe aumentar para superar la PMAP.
Los agentes anestésicos suelen desencadenar disminución del volumen estresado y, en consecuencia, cierto grado de hipotensión al disminuir el retorno venoso. Existen 2 maneras de aumentar fisiológicamente el volumen estresado y, en consecuencia, la PMSF: administración de fluidos y uso de vasoconstrictores3,4.
La administración de líquidos es una estrategia rentable basada en predictores de respuesta a fluidos y ante pérdidas evidentes, buscando como objetivo mantener la normovolemia.
Mantener una adecuada contractilidad cardíaca es imprescindible en estos pacientes. Por lo tanto, la norepinefrina es el vasopresor ideal al permitir aumentar el volumen estresado por contracción de los lechos venosos esplácnicos por efecto alfa, al mismo tiempo que mantiene el gasto cardíaco por su efecto beta.
Otro punto fundamental a tener en cuenta es el manejo de la ventilación y la interacción cardiopulmonar.
Tanto el colapso como la sobredistensión alveolar son perjudiciales ya que ambos aumentan la resistencia venosa pulmonar (RVP) y disminuyen el retorno venoso. Durante la ventilación mecánica, se deben titular los valores de PEEP para prevenir cualquiera de estas 2 situaciones.
En pacientes con circulación de Fontan, la PMAP corresponde a la presión venosa central (PVC). Además, el flujo pasivo no pulsátil pulmonar genera la pérdida de la vasculatura pulmonar distal, lo cual incrementa la RVP y crónicamente eleva la PVC, con secuelas hepáticas y linfáticas por sobrecarga del sistema portal.
A modo de resumen, diremos que los objetivos en el mantenimiento del gasto cardíaco se basan en 3 pilares: adecuada precarga (PMSF) (fluidos-venoconstrictores); baja RVP (mediante normocapnia, PaO2 normal, bajo volumen tidal, PEEP titulada, mantenimiento de la ventilación espontánea si resultase posible, normotermia y óptimo control del dolor), y adecuada contractilidad cardíaca (uso titulado de anestésicos-anestesia regional-empleo juicioso de inotrópicos). Los objetivos hemodinámicos se resumen en la figura 2.
Durante la inducción anestésica, se deben evitar las altas dosis de fármacos depresores de la función miocárdica como el tiopental. El propofol es menos problemático mientras se mantenga la normovolemia y su administración sea lenta y titulada. Tampoco son recomendables las altas concentraciones de agentes volátiles.
Tanto la monitorización hemodinámica no invasiva, como el seguimiento de ciertos parámetros de laboratorio (estado ácido-base, lactato, saturación venosa central, gap arterio-venoso de CO2) son marcadores útiles para asegurar una óptima perfusión tisular y disponibilidad de O2.
La evaluación preoperatoria debe enfocarse en cambios recientes en el estado de salud del paciente, historia de hospitalizaciones y anestesias previas, medicación habitual y alergias. Solicitar un laboratorio de rutina completo, un electrocardiograma y una ecocardiografía Doppler y pruebas de capacidad pulmonar, si fueran necesarios. Considerar la indicación de profilaxis para endocarditis infecciosa5-7.
Reducir al mínimo el intervalo de ayuno, manteniendo una hidratación preoperatoria adecuada.
ConclusiónLa complejidad que presenta el manejo de este tipo de patologías determina la necesidad de adoptar un plan anestésico prolijo y definido a fin de evitar complicaciones potencialmente graves.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.