Describir las diferencias entre el síndrome de takotsubo (STT) y el síndrome coronario agudo (SCA) de modo que pueda reconocerse precozmente esta entidad.
DiscusiónEl perioperatorio supone una situación de estrés que puede favorecer el desencadenamiento de un episodio de STT, especialmente si se complica con procesos infecciosos. Se presenta el caso de una mujer de 61 años con antecedentes de cardiomiopatía isquémica crónica, que desarrolló un STT durante el postoperatorio tardío de una exenteración pélvica en el contexto de una sepsis de origen abdominal. La paciente recibió un manejo conservador y experimentó una evolución cardiológica favorable, hasta la normalización de la función sistólica del ventrículo izquierdo (VI).
ConclusiónLa incidencia del STT aumenta ante la presencia de procesos infecciosos. Aunque las pruebas complementarias permiten diferenciar entre un SCA y un STT, el diagnóstico definitivo de esta entidad STT exige la confirmación de la recuperación de la función sistólica del VI. El STT es una patología benigna sin tratamiento específico.
Describing the differences between takotsubo cardiomyopathy and acute coronary syndrome in order to allow an early recognition of this entity.
DiscussionThe perioperative period represents a stressful situation which promotes the development of a takotsubo cardiomyopathy, above all in the presence of infectious diseases. We present the case of a 61 years-old woman with medical records of chronic ischemic cardiomyopathy who developed a takotsubo cardiomyopathy during the late postoperative period of a pelvic exenteration in the context of abdominal sepsis. The patient was treated with a conservative management and experienced a favorable cardiologic evolution, until normalization of left ventricular systolic function.
ConclusionTakotsubo cardiomyopathy incidence increases with septic processes. Though complementary studies can differentiate between acute coronary syndrome and takotsubo cardiomyopathy, the definitive diagnosis of this entity implies the confirmation of left ventricular systolic function recuperation. Takotsubo cardiomyopathy is a benign pathology without any specific treatment.
El síndrome de takotsubo (STT), también conocido como miocardiopatía de estrés, se describió por primera vez en Japón hace más de 25 años. Recibe este nombre por la semejanza existente entre el ventrículo izquierdo (VI) en sístole y la vasija que utilizan los pescadores japoneses para atrapar pulpos, que se caracteriza por presentar un cuello estrecho y una base amplia. Esta enfermedad predomina en el sexo femenino1, con una edad media de presentación de 60-75 años, por lo que se piensa que la caída en la concentración de estrógenos asociada al estado hormonal posmenopáusico pueda influir en su desarrollo.
Un rasgo distintivo del STT es su aparición tras un evento desencadenante, que puede ser tanto un estrés emocional como un factor físico1,2, aunque puede estar ausente hasta en un tercio de los casos3. Las intervenciones quirúrgicas y el estrés perioperatorio se consideran posibles desencadenantes. Clínicamente, puede ser indistinguible de un síndrome coronario agudo (SCA)1,3, de modo que la realización e interpretación correcta de las pruebas complementarias adquiere un papel fundamental en la distinción entre ambas entidades.
A continuación, se presenta el caso de una mujer que desarrolló un episodio de STT durante el postoperatorio tardío de una intervención quirúrgica programada en relación con una sepsis de origen abdominal.
Caso clínicoMujer de 61 años de edad, ASA III, con antecedentes de cardiopatía isquémica por un SCA con elevación del ST (SCACEST) por oclusión de la arteria coronaria derecha, tratado mediante implante percutáneo de un stent farmacoactivo. A los 7 meses del evento coronario, la paciente fue programada para cirugía electiva tras hallarse una neoplasia de recto localmente avanzada durante el estudio de una anemia. La paciente recibía tratamiento crónico con ácido acetilsalicílico (AAS), clopidogrel, metoprolol, atorvastatina, hierro oral, pregabalina y morfina. En la valoración preoperatoria, se decidió suspender clopidogrel 5 días antes de la intervención quirúrgica y mantener el AAS. El electrocardiograma (ECG) basal mostraba ritmo sinusal con eje eléctrico normal y patrón QR en la cara inferior. La analítica sanguínea y la radiografía de tórax no presentaban alteraciones. El ecocardiograma transtorácico (ETT) mostraba una fracción de eyección del VI (FEVI) normal.
El día de la cirugía, la paciente recibió la monitorización básica intraoperatoria recomendada por la Sociedad Española de Anestesiología, Reanimación y Terapéutica del Dolor, incluyendo la monitorización de la fracción inspiratoria de oxígeno (FiO2), la saturación periférica de oxígeno (SpO2), la presión espiratoria de CO2, el trazado continuo del ECG y la temperatura corporal. Así mismo, también se realizó una monitorización de la presión arterial invasiva, de la diuresis y de la profundidad anestésica mediante el índice biespectral. Previo al inicio de la cirugía, se administró profilaxis antibiótica con 2g de cefazolina y 500mg de metronidazol, y se canalizó un acceso venoso central. En condiciones de anestesia general con intubación orotraqueal (Cormack I/IV) combinada con dosis única de anestesia intratecal (400 μg de morfina), se llevó a cabo una exenteración pélvica con administración de radioterapia intraoperatoria (RIO), reconstrucción ureteral izquierda y creación de colostomía terminal. La RIO consiste en la aplicación de radiación a altas dosis durante el propio acto quirúrgico, concentrando dicha radiación sobre el tejido tumoral expuesto y excluyendo a los tejidos sanos de recibir tal irradiación, consiguiéndose de este modo minimizar las posibilidades de que queden restos tumorales en el campo quirúrgico y, a la vez, optimizar las ventajas que aporta la radioterapia. Durante la intervención, la paciente permaneció estable en todo momento, con una frecuencia cardíaca en torno a 80-90 lpm y una presión arterial mantenida entre 100/60mmHg y 120/70mmHg. Se transfundieron 3 concentrados de hematíes debido al sangrado que se produjo durante la exposición tumoral, aunque tal hecho no tuvo repercusión sobre el estado hemodinámico de la paciente y no requirió la administración de ningún tipo de agente vasoactivo. Tras 7 h de cirugía, la paciente fue extubada sin incidencias y trasladada a la Unidad de Recuperación Postanestésica, donde permaneció 24 h bajo vigilancia.
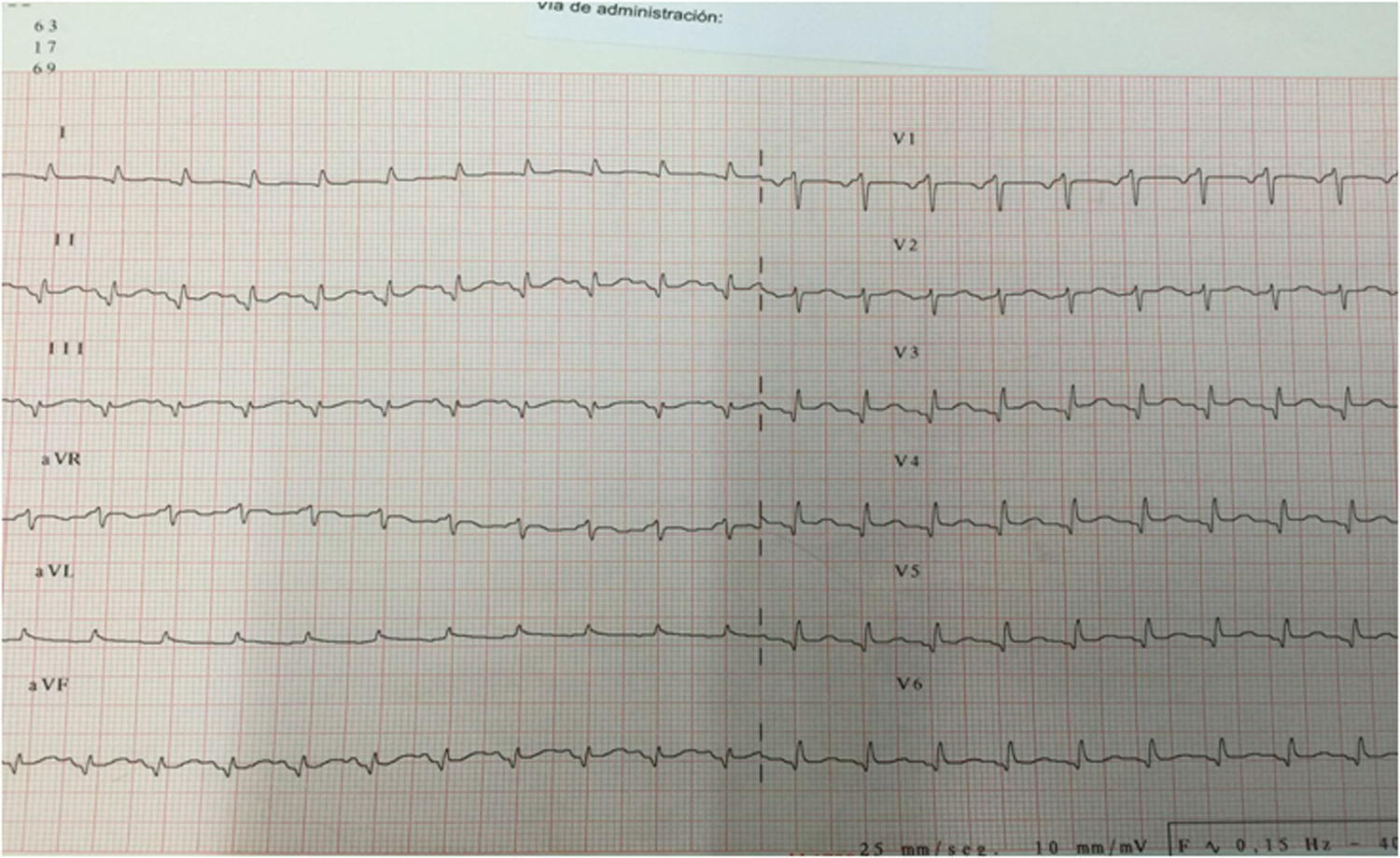
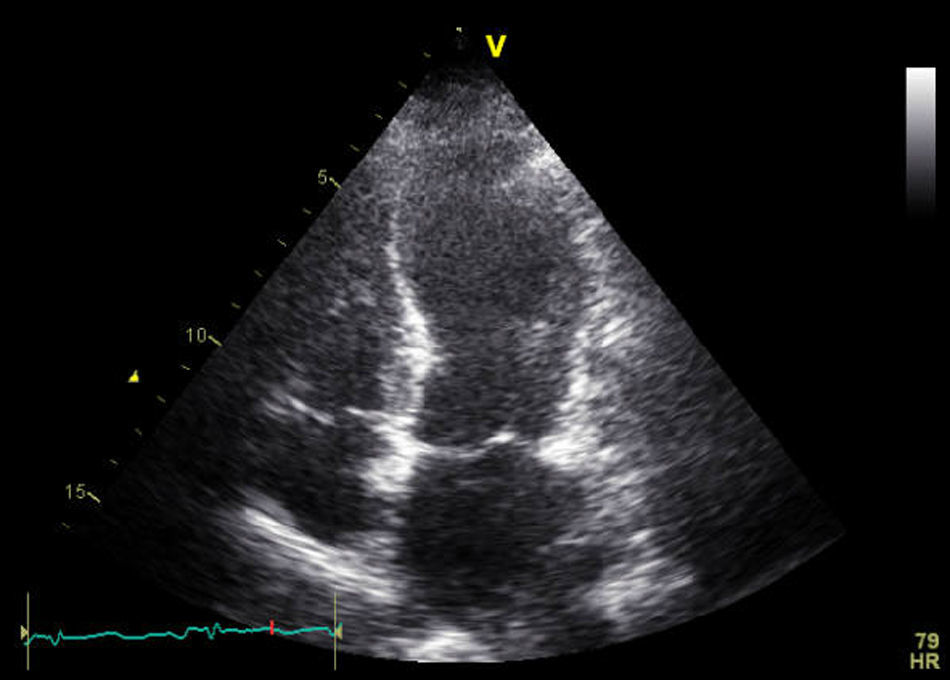
Una vez confirmada la estabilidad, la paciente fue trasladada a planta de hospitalización, donde presentó como complicaciones postoperatorias un íleo adinámico y una fuga urinaria que precisó de la realización de una nefrostomía percutánea. En el duodécimo día posquirúrgico, presentó un episodio de insuficiencia respiratoria aguda, con SpO2 del 87% a pesar de FiO2 del 100%, decidiéndose su ingreso en la Unidad de Críticos de Reanimación. En la exploración física, destacaba intensa taquipnea (> 40rpm), disnea de reposo, taquicardia sinusal a 140 lpm, crepitantes pulmonares bibasales y dolor abdominal. El ECG mostraba ritmo sinusal con QR en la cara inferior, pérdida de onda R en precordiales y elevación del segmento ST de 1-2mm en las derivaciones V3-V6 y en la cara inferior (fig. 1). La radiografía de tórax presentaba signos de congestión pulmonar y derrame pleural izquierdo. Se seriaron los marcadores bioquímicos de daño miocárdico: troponina T ultrasensible (Tn-us) con valor inicial de 378ng/l (valor de referencia de nuestro laboratorio<14ng/l) y NT-proBNP con valor inicial de 101ng/l (valor de referencia de nuestro laboratorio 0-300ng/l). En el ETT urgente se visualizó un VI ligeramente dilatado, con aquinesia de segmentos medio-distales de todas las caras e hiperquinesia de segmentos basales y función sistólica global deprimida, estimándose una FEVI del 30% (fig. 2). Ante la sospecha de un SCA, se realizó una coronariografía urgente, en la que se descartó la existencia de una estenosis coronaria y se confirmó la permeabilidad del stent previo. Posteriormente, se realizó una tomografía computarizada (TC) abdominal, donde se objetivaron múltiples abscesos intraabdominales.
La paciente fue diagnosticada de STT en el contexto de sepsis abdominal. La estrategia terapéutica se basó en medidas de soporte hemodinámico y ventilatorio, drenaje percutáneo de las colecciones abdominales y antibioterapia de amplio espectro. La máxima elevación de los marcadores cardíacos ocurrió a las 36 h del evento agudo (Tn-us 393ng/l y NT-proBNP 1278ng/l), tras las cuales ambos empezaron a descender progresivamente (tabla 1). Tras un ingreso prolongado en nuestra Unidad, la paciente recibió el alta hospitalaria a los 2 meses de la cirugía. El último ETT de control, realizado a las 8 semanas del diagnóstico, objetivó un VI no dilatado con persistencia de hipoquinesia medio-distal de cara inferolateral y función sistólica global normal con FEVI del 55%. A los 5 meses, fue evaluada cardiológicamente, apreciándose que la paciente estaba asintomática, con FEVI normal y clase funcional de i/iv.
DiscusiónLa incidencia del STT en la población general es desconocida, aunque se estima que un 2% de los pacientes con sospecha de SCA en realidad presentan un episodio de STT. El mecanismo fisiopatológico es complejo, si bien las principales teorías que intentan explicar el desarrollo del STT en el seno de un proceso séptico, como acontece en el caso previamente expuesto, pueden enumerarse en:
- –
Respuesta inflamatoria sistémica con producción de mediadores inflamatorios que provocan una depresión miocárdica.
- –
Cardiotoxicidad directa por aumento en los niveles plasmáticos de catecolaminas2,4, que ocurre tras la activación del eje hipotálamo-hipófiso-suprarrenal en respuesta a determinados estímulos2. Entre los eventos desencadenantes de una respuesta simpática que reunía nuestra paciente, cabe mencionar la infección intraabdominal, la intervención quirúrgica reciente, el mal manejo del dolor y el estrés al que se veía sometida.
- –
Cardiotoxicidad asociada a catecolaminas de administración exógena que requieren muchos pacientes sépticos.
- –
Isquemia miocárdica secundaria a un flujo coronario comprometido.
El STT se caracteriza por una disfunción sistólica del VI. Su presentación clínica más frecuente es como dolor torácico de características isquémicas (76%), seguido de disnea (47%) y síncope (8%)3. La clínica que refería nuestra paciente se caracterizaba por intensa disnea, asociada al importante trabajo respiratorio que presentaba a la exploración física, aunque en ningún momento refirió dolor torácico. Esta característica es bastante frecuente entre los pacientes que presentan un STT durante un ingreso hospitalario por otro motivo, los cuales pueden permanecer relativamente asintomáticos, diagnosticándose la enfermedad a raíz de un empeoramiento clínico o de forma incidental tras apreciar cambios ECG indicativos de isquemia o elevación de los biomarcadores5.
El principal diagnóstico diferencial del STT es el SCA, siendo fundamental distinguir entre ambas patologías, especialmente en pacientes con antecedentes coronarios como el aquí presentado. Los hallazgos ECG que hablan a favor de STT incluyen una elevación discreta del segmento ST, la ausencia de cambios recíprocos, la ausencia de ondas Q y una ratio de elevación del segmento ST en derivaciones V4-V6 respecto a derivaciones V1-V3 ≥ 16. Excepto por la presencia de ondas Q en la cara inferior, el resto de los criterios ECG se cumplían en nuestra paciente. Por su parte, la elevación de los biomarcadores suele ser modesta1, siendo dicha elevación más marcada para el NT-proBNP que para las troponinas. Una ratio alta entre el BNP y el pico de troponinas es indicativa de STT7. Pero dado que ninguno de estos criterios permite establecer el diagnóstico preciso, es necesario recurrir a pruebas de imagen.
La angiografía coronaria representa el gold standard para excluir una oclusión coronaria, si bien la presencia de enfermedad coronaria no obstructiva (< 50% estenosis luminal) no excluye el diagnóstico de STT3,7. La ventriculografía, la ETT y la resonancia magnética cardíaca permiten demostrar las alteraciones de motilidad de la pared ventricular asociadas a esta patología. La paciente aquí expuesta, al igual que la mayoría de los pacientes que presentan STT, mostraba un patrón de motilidad clásico o apical caracterizado por hipoquinesia, aquinesia o disquinesia de ápex y segmentos medios del VI, con función sistólica conservada a nivel basal7,8. Sin embargo, cada vez se están describiendo más casos de pacientes con patrón medioventricular (función conservada a nivel de ápex y base con aquinesia de segmentos medios) o con patrón invertido o basal (función conservada a nivel de ápex y segmentos medios con aquinesia de regiones basales). Las variantes del patrón clásico podrían considerarse «patognomónicas» de STT. Algunos pacientes durante la evolución de un mismo episodio de STT presentan más de un patrón de motilidad ventricular alterada.
Ante la ausencia de un test diagnóstico específico para esta entidad, se han indicado varios criterios diagnósticos7, siendo los más utilizados aquellos propuestos por la Clínica Mayo (tabla 2). Deben estar presentes los 4 criterios para que se pueda establecer el diagnóstico de STT4,8. Estos criterios no implican demostrar la reversibilidad de la disfunción sistólica del VI; sin embargo, el diagnóstico definitivo de esta entidad exige su confirmación durante el seguimiento del paciente. La persistencia de disfunción del VI tras 6-8 semanas del episodio agudo debe hacer que se plateen diagnósticos alternativos.
Criterios diagnósticos de la Clínica Mayo para el síndrome de takotsubo
| 1. Hipoquinesia, aquinesia o disquinesia transitoria de los segmentos medios del VI con o sin afectación apical. Las anormalidades en la motilidad de la pared ventricular se extienden más allá del territorio de irrigación de una única arteria coronaria epicárdica. A menudo, aunque no siempre, existe un evento estresante desencadenante |
| 2. Ausencia de enfermedad coronaria obstructiva o de evidencia angiográfica de rotura aguda de una placa |
| 3. Alteraciones ECG nuevas (elevación del segmento ST y/o inversión de la onda T) o elevación discreta de las troponinas cardíaca. |
| 4. Ausencia de feocromocitoma y miocarditis |
Tradicionalmente, se ha considerado una patología benigna para la cual no existe terapia específica. El objetivo del tratamiento es de soporte, a la vez que se tratan las complicaciones agudas (shock cardiogénico, fallo cardíaco congestivo, edema agudo de pulmón…)9. Una vez estabilizados, los pacientes reciben tratamiento con diuréticos, inhibidores de la enzima convertidora de angiotensina, β-bloqueantes y anticoagulantes al menos hasta que mejore la contractilidad del ápex del VI10. Dada la implicación de las catecolaminas en la fisiopatología del STT, la estrategia farmacológica preventiva más lógica serían los β-bloqueantes. Sin embargo, se han descrito casos de recurrencia aun estando en tratamiento con β-bloqueantes, valga mencionar el caso aquí expuesto.
ConclusiónEl período perioperatorio es una situación de estrés que provoca una activación del sistema simpático y liberación de catecolaminas. Además, en nuestra paciente se añade un postoperatorio complicado con un proceso infeccioso que hace que se incremente y se perpetúe esta situación. Se debe realizar un diagnóstico diferencial con el SCA, recordando que la isquemia cardíaca suele ser silente en el contexto de un paciente quirúrgico. Los pacientes con antecedentes de STT que precisen de futuras cirugías requieren un enfoque perioperatorio individualizado para evitar una posible recurrencia, realizar un diagnóstico precoz y prevenir la aparición de complicaciones agudas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.