El virus de la diarrea viral bovina (BVDV, por su sigla en inglés) ocasiona pérdidas económicas significativas en la industria ganadera internacional y en Argentina, donde circula con alta prevalencia. En condiciones de alta prevalencia, las infecciones causadas por el BVDV se controlan mediante vacunación una vez identificados y segregados los animales persistentemente infectados. En este estudio, se evaluó la factibilidad de controlar la circulación del BVDV en condiciones de campo combinando herramientas de diagnóstico, medidas de manejo y vacunación. La experiencia abarcó 2 tambos de la provincia de Santa Fe. Se utilizaron kits de ELISA comerciales para determinar la proteína NS3 (P80) o los anticuerpos contra esta proteína, RT-PCR anidada para detectar el genoma viral y seroneutralización viral para evaluar la eficacia vacunal. Antes de la intervención, la seroprevalencia promedio de los tambos fue del 58,4%, con una tasa de animales persistentemente infectados del 2,4%. Tras la segregación de los animales persistentemente infectados y la vacunación con una vacuna combinada comercial que contiene BVDV inactivado, los porcentajes de aborto disminuyeron significativamente (p<0,05), del 20,5 al 11,6% en el tambo 1 y del 34% al 23,4% en el tambo 2 durante el segundo año de la estrategia de control. La tasa de concepción aumentó del 29 al 33% en el tambo 1 durante el primer año; en el tambo 2, el aumento fue de 7 puntos durante el segundo año. La estrategia implementada logró condiciones en las que el BVDV dejó de circular. Este es el primer reporte sobre el manejo controlado del BVDV en tambos utilizando herramientas disponibles para los productores en Argentina.
Bovine viral diarrhea virus (BVDV) causes significant economic losses in the international livestock industry and in Argentina, where it circulates at high prevalence. Under high prevalence conditions, BVDV infections are controlled through vaccination once persistently infected animals are identified and segregated. This study evaluated the feasibility of controlling BVDV circulation under field conditions by combining diagnosis, management measures, and vaccination in 2 dairy farms in the province of Santa Fe. Commercial ELISAs were used for the detection of the NS3 (P80) protein or antibodies against this protein as well as an RT-nested PCR for the detection of the viral genome, and viral seroneutralization to assess vaccine efficacy. The average seroprevalence of the farms was 58.4%, with a persistently infected animal rate of 2.4%. After segregating the persistently infected animals and vaccinating them with a commercial combined vaccine containing inactivated BVDV, abortion rates significantly decreased (p<0.05) in farm 1 (from 20.5 to 11.6%) and in farm 2 (from 34 to 23.4%) during the second year of the control strategy. Conception rates increased from 29 to 33% in farm 1 during the first year, while in farm 2, the increase was 7 points during the second year. This methodology achieved conditions in which BVDV ceased to circulate, constituting the first controlled report on BVDV management in dairy farms using tools available to producers in Argentina.
El virus de la diarrea viral bovina (BVDV, por sus siglas en inglés) pertenece al género Pestivirus, familia Flaviviridae10, y tiene una distribución mundial46. Es un patógeno del ganado económicamente importante, con una alta prevalencia en varios países, especialmente en aquellos que no cuentan con programas de control37. Los estudios serológicos realizados en rodeos bovinos en nuestro país han demostrado que el virus circula con una seroprevalencia que varía entre el 32 y el 90%23,28,31.
El BVDV es uno de los patógenos que más afecta la eficiencia reproductiva, lo cual genera grandes pérdidas económicas1,15,16,26,44. La infección aguda por el BVDV produce una amplia variedad de signos clínicos debido a sus efectos inmunosupresores, además de tener un efecto directo sobre las enfermedades respiratorias y la fertilidad3,8.
En las hembras, el BVDV es capaz de afectar la viabilidad del ovocito, el embrión o el feto, o de inducir lesiones que provocan abortos o malformaciones fetales4,29,35,36. La infección de una madre susceptible durante el período que va de los 40 a los 160 días de la gestación puede resultar en la producción de un feto persistentemente infectado (PI), inmunotolerante a la cepa infectante, que producirá y excretará el virus en grandes cantidades a lo largo de su vida luego de nacido14,21.
La prevalencia de animales PI a nivel individual suele ser menor del 3% y se ha clasificado como baja (≤0,8%: Europa, América del Norte, Australia), media (>0,8 a 1,6%: Asia oriental) o alta (>1,6%: Asia occidental). Los países que no implementaron ningún programa de control del BVDV, incluida la vacunación, son los que muestran mayor prevalencia de animales con infecciones persistentes37. La infección persistente puede dar lugar a terneros pequeños al nacimiento, con escaso desarrollo y ganancia de peso, débiles y con cuadros recurrentes de enfermedad respiratoria y digestiva. Sin embargo, muchos terneros PI son clínicamente normales, lo que vuelve indispensable realizar ensayos específicos para poder detectarlos19,40.
El BVDV se agrupa en 3 genotipos: genotipo 1 y genotipo 2, los que pueden incluir numerosos subtipos9, y genotipo 3 o «virus HoBi-like»32. Según sus efectos en los cultivos celulares, se los divide en 2 biotipos: citopáticos y no citopáticos; este último es el biotipo predominante en la naturaleza, el que se aísla de la mayoría de las formas clínicas y el único capaz de originar infección persistente en el feto9.
En su conjunto, los reportes publicados muestran que las vacunas seguras y eficaces aplicadas después de retirar a todos los animales PI constituyen una medida de bioseguridad adicional, sobre todo en áreas con alta seroprevalencia, donde el riesgo de introducción del BVDV es alto. Varios estados miembros de la Unión Europea han trabajado en planes a gran escala22. En el caso de Alemania, debido a la elevada prevalencia de la infección (más del 80%) y la alta densidad animal, la estrategia de control consistió en la identificación y remoción de bovinos PI mediante la detección de antígeno en sangre por el ensayo inmunoabsorbente ligado a enzimas (ELISA) o la retrotranscripción seguida de la reacción en cadena de la polimerasa (RT-PCR) y la vacunación sistemática, además de medidas de higiene y testeo de todo animal que ingresa al rebaño para prevenir la reintroducción del virus13.
En Argentina no existen programas de control ni de erradicación del BVDV, a pesar de que su relevancia como causal de abortos está bien establecida. Contamos con vacunas inactivadas, en general combinadas. Son vacunas seguras y se pueden administrar en todas las categorías bovinas, incluidas hembras en gestación, pero requieren de reinmunización para mantener los niveles de anticuerpos vacunales30.
En este trabajo realizamos una prueba de principios sobre la factibilidad de establecer programas de control de la enfermedad por establecimiento. El objetivo fue determinar si, en condiciones de campo en tambos nacionales, la aplicación de medidas como la identificación de animales PI, su segregación y la vacunación sistemática del resto de la población se asocia a una mejora de los parámetros reproductivos de los tambos afectados por el BVDV.
Materiales y métodosCélulasLos stocks virales del BVDV cepa Singer 1a utilizados en la técnica de seroneutralización viral se produjeron utilizando la línea celular Madin-Darby bovine kidney (MDBK). Para el crecimiento de la línea celular, se utilizó medio de cultivo mínimo esencial de Eagle (MEM-E, Gibco, Paisley, Reino Unido) adicionado con 10% de suero fetal bovino (Internegocios S. A., Mercedes, Argentina) y antibióticos/antimicótico (100u/ml de penicilina, 100μg/ml de estreptomicina y 0,25μg/ml de anfotericina B; Gibco, Paisley, Reino Unido). Las células, procedentes del Banco Argentino de Células, y los medios de cultivo fueron provistos por la Sección de Cultivo de Tejidos del Instituto de Virología, INTA Castelar.
Para las infecciones, se utilizó una multiplicidad de infección de 0,1. Brevemente, el inóculo viral se diluyó en 1ml de medio MEM-E y luego se incubó a 37°C con movimiento orbital durante una hora para permitir la adsorción del virus a la célula. Posteriormente, se agregó de mantenimiento (MEM-E, 2% de suero fetal bovino) y se incubó a 37°C en estufa con un 5% de CO2 durante 72h. La disrupción de las células remanentes se realizó mediante un ciclo de congelamiento-descongelamiento, seguido de clarificación por centrifugación a 4.000g a 4°C por 20min. El sobrenadante se fraccionó y se almacenó a −80°C.
El título de cada stock viral se calculó por el método de Reed y Muench34. Para ello, se inocularon placas de cultivo de 96 pocillos con monocapas de MDBK, con un 70% de confluencia con el virus a titular en diluciones seriadas en base 10. Cada dilución se realizó por cuadriplicado y se incubó durante 72h a 37°C en estufa con 5% de CO2. Los títulos se expresaron como el 50% de unidades infecciosas en cultivos de tejido por mililitro (TCID50/ml).
VacunaSe utilizó una vacuna comercial producida por Agropharma Salud Animal con la siguiente composición antigénica (entre paréntesis se indica el título por dosis): herpes virus tipo 1 (3,03E+07); BVDV genotipo 1a cepa Singer (3,01E+07); virus parainfluenza 3 (2,2E+07); Moraxella bovis (2,2E+08); Histophilus somni (1,00E+08); Mannheimia haemolytica (1,10E+08) y Pasteurella multocida (1,53E+09). El cultivo del BVDV fue inactivado con propiolactona. La vacuna estaba formulada con el adyuvante acuoso Alupharm®, preparado en base a gel de hidróxido de aluminio micronizado, con un inmunopotenciador de desarrollo propio a base de polisacáridos y saponina purificada; la composición y concentraciones se hallan bajo secreto industrial (Agropharma Salud Animal S. A.).
La vacuna se aplicó por vía subcutánea en la tabla del cuello, a razón de 2ml/dosis. Todos los animales de los tambos 1 y 2 sin infección persistente fueron vacunados con 2 dosis, espaciadas por 21 días, y revacunados anualmente.
Diseño experimental y trabajo a campoEl trabajo se realizó en 2 tambos de la localidad de San Cristóbal, en la provincia de Santa Fe. Estos tambos habían detectado problemas reproductivos asociados al BVDV durante el período 2018-2022. Los 2 tambos se encontraban libres de brucelosis y tuberculosis. El acuerdo de trabajo a campo se realizó a través de la empresa productora de vacunas.
Ambos tambos utilizan un sistema de producción de pastoreo con suplementación, tenían antecedentes de problemas reproductivos (abortos) y serología positiva para BVDV por medición de anticuerpos anti-NS3. No se habían identificado otros causales infecciosos de aborto al iniciar el estudio.
Los diagnósticos anteriores al período que abarcó nuestro estudio habían sido realizados en diversos laboratorios de diagnóstico privados habilitados por la autoridad sanitaria argentina (SENASA). Los bovinos eran de raza Holstein de diferentes categorías: vacas, vaquillonas preñadas, terneros presentes y terneros nacidos durante el período del estudio criados en «guacheras» a estaca. La crianza de terneros en la guachera se basa en un conjunto de directrices de gestión que buscan alcanzar el desleche entre los 45 y 60 días de vida, proporcionando leche o sustituto lácteo en un sistema que resulta económicamente lucrativo. El tambo 1 contaba con 749 animales, el tambo 2 con 309 animales. Inicialmente fueron 92 terneros los muestreados, los que no se separaron por tambo, ya que, al nacer, todos formaban parte del mismo espacio físico, esto es, la misma guachera.
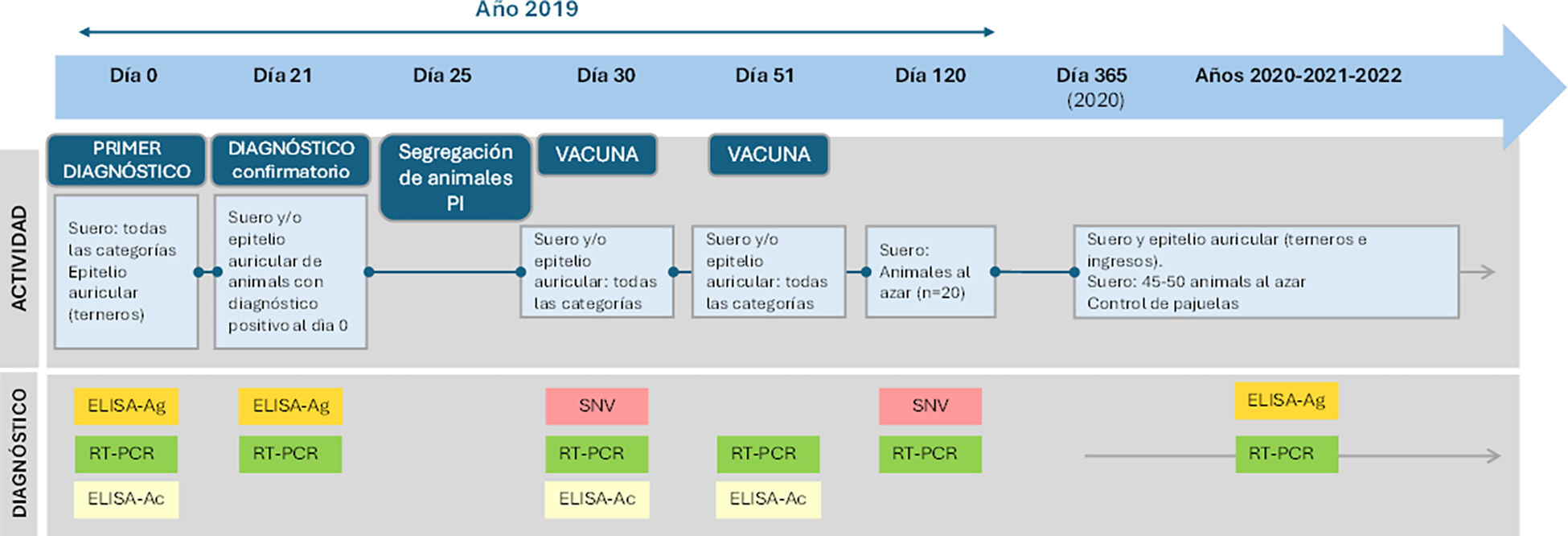
La intervención involucró a todos los animales de los 2 tambos. Se realizaron los siguientes procesos secuenciales (fig. 1): 1) evaluación de la presencia del virus y de anticuerpos contra el BVDV en la totalidad del rodeo; 2) identificación de animales con PI; 3) segregación de los animales con PI; 4) vacunación de toda la población no PI; 5) seguimiento de la respuesta inmune inducida por la vacuna, según el esquema de vacunación reproductivo habitual; 6) monitorización del estado inmunitario de los animales, parámetros reproductivos y estado de salud general, y 7) muestreo posvacunación en una muestra de 20 animales adultos, escogidos al azar, a los 21 días de concluido el primer esquema de vacunación. En todas las tomas de muestra se corroboró la ausencia de genoma viral (fig. 1).
Representación esquemática de la cronología del estudio, basado en el diagnóstico y la identificación de bovinos persistentemente infectados (PI), con su posterior segregación y la vacunación de toda la población no PI. En el panel superior («Actividad») se detallan las intervenciones, y en el panel inferior («Diagnóstico»), las técnicas diagnósticas aplicadas. ELISA-Ag: inmunoensayo para la detección de la proteína NS3; ELISA-Ac: inmunoanálisis para la detección de anticuerpos reactivos a la proteína NS3; RT-PCR: retrotranscripción seguida de amplificación mediante reacción en cadena de la polimerasa anidada; SNV: ensayo de seroneutralización viral utilizando la cepa vacunal.
Durante el tiempo del estudio y desde entonces a la fecha, todo animal que ingresa (por movimientos o nacimientos) se somete a la detección de antígenos virales y anticuerpos anti-NS3. Asimismo, toda pajuela que se adquiere se analiza mediante RT-PCR anidada45 para detectar el genoma del BVDV. Desde 2020, una vez al año se toman alrededor de 50 muestras al azar (según disponibilidad del personal del campo) y se realiza el chequeo para la detección del genoma viral.
Toma de muestras y estrategia de diagnósticoLas tomas de muestras de sangre entera sin anticoagulante se realizaron por venopunción yugular, siguiendo lineamientos estándar del Comité de Bienestar Animal del INTA (TÉCNICA Bo 1, CICUAE INTA, «Extracción de sangre por vena yugular»). Las muestras fueron colectadas en tubos de 5ml, incubadas durante 30min a 37°C y luego centrifugadas (3.000rpm, 10min). El suero se separó y se expuso a 56°C para inactivar el sistema del complemento; se fraccionaron alícuotas de 500μl, las que se mantuvieron a −20°C hasta su análisis.
Al iniciar el estudio, de 1.150 bovinos (incluidos los 92 terneros presentes en la guachera compartida por los tambos; tablas 1 y 2) se tomaron 3ml de sangre sin anticoagulante. Se realizó la detección de anticuerpos anti-NS3 y de antígeno NS3 por ELISA; además, se investigó la presencia de genoma viral mediante RT-PCR anidada, como se detalló. También se tomaron muestras del epitelio auricular en terneros menores de 6 meses para la detección de antígeno por ELISA, a fin de evitar la posible interferencia de los anticuerpos maternos específicos contra el VDVB, si los hubiera. Aquellos animales que dieron un resultado positivo a la presencia del virus fueron sangrados nuevamente a las 2 semanas del primer muestreo para confirmar este resultado y detectar un resultado falso positivo, ya que podría tratarse de un animal con infección aguda. Una vez identificados los animales PI, estos fueron enviados a un tercer tambo, alejado varios kilómetros de los tambos incluidos en este estudio.
Prevalencia de anticuerpos contra el BVDV y de animales con infección persistente
| Categoría | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Vacas y vaquillonas (no preñadas) | Vaquillonas preñadas | Total | |||||||
| N | SP | PI | N | SP | PI | N | SP | PI | |
| Tambo 1 | 649 | 322 (49,7%) | 16 (2,4%) | 100 | 62 (62%) | 3 (3%) | 749 | 422 (56%) | 19 (2,5%) |
| Tambo 2 | 262 | 154 (58,7%) | 5 (1,9%) | 47 | 41 (87%) | 1 (1,8%) | 309 | 196 (63,4%) | 7 (2,2%) |
| Total | 1.058 | 618 (58,4%) | 26(2,4%) | ||||||
BVDV: virus de la diarrea viral bovina; SP: número de animales con serología positiva; PI: número de animales persistentemente infectados.
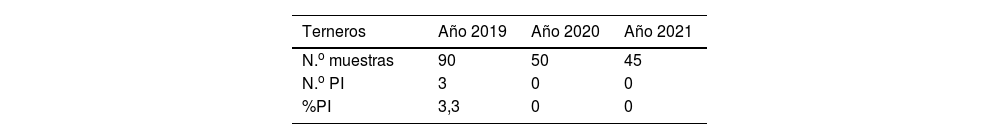
Identificación de terneros con infección persistente a lo largo del tiempo
| Terneros | Año 2019 | Año 2020 | Año 2021 |
|---|---|---|---|
| N.o muestras | 90 | 50 | 45 |
| N.o PI | 3 | 0 | 0 |
| %PI | 3,3 | 0 | 0 |
Luego de segregar a los animales persistentemente infectados (PI) detectados en el muestreo de 2019 (que no discriminó por sexo), se vacunó a toda la población no PI, y en 2020 se muestrearon 50 nuevos terneros nacidos. El muestreo de 2021 fue aleatorio y no discriminó por categoría.
A los 90 días de la vacunación, se tomaron muestras de sangre de 20 bovinos vacunados para titular anticuerpos neutralizantes contra la cepa vacunal. A los 12 meses de iniciado el protocolo de identificación de animales PI, la segregación de estos y la vacunación, se tomaron muestras de sangre de 50 terneros, 25 terneros por tambo, lo que representó aproximadamente la mitad del total de terneros de cada tambo, por lo que se consideraron muestras representativas.
En todas las muestras obtenidas de los bovinos incluidos en este estudio se analizó la presencia de anticuerpos contra NS3 y se realizó la identificación de animales con infección persistente (fig. 1). La interpretación de los resultados del análisis del BVDV en lo referente a la presencia de anticuerpos específicos y de antígenos virales que se detallan en la tabla 1 se presenta en el material suplementario.
Detección de anticuerpos anti-BVDVLa detección en muestras de suero de anticuerpos específicos contra la proteína no estructural NS331, altamente conservada entre diferentes cepas del BVDV, se realizó por ELISA con el kit PrioCHECK™ Bovine BVDV Ab Plate Kit (ThermoFisher Animal Health, ThermoFisher Scientific, Waltham, Massachusetts, EE. UU.), siguiendo las indicaciones del fabricante.
Para la titulación de anticuerpos con capacidad neutralizante, se utilizó la técnica tradicional de seroneutralización viral en microplacas. En placas de 96 pocillos, células MDBK en monocapa fueron enfrentadas a una concentración fija de virus y diluciones de cada suero, tal como se ha descrito12. Brevemente, una alícuota de los sueros a evaluar se inactivó a 56°C durante 30min y con estos se realizaron diluciones en base 4, desde 1:2 hasta 1:512. De cada dilución se empleó un volumen de 50μl, que se mezcló con 100TCID50 de la cepa BVDV 1a Singer. Adicionalmente, se incluyeron controles negativos y positivos de sueros contra el BVDV, control de células MDBK y de las TCID50 incluidas en la prueba. A cada pocillo que contenía la mezcla de suero/virus se le adicionaron 50μl de la suspensión de células en medio de cultivo a una concentración de 150.000cél/ml de medio. Las microplacas se incubaron durante 60min en estufa a 37°C y con 5% de CO2 durante 3 días, para posteriormente realizar la observación directa de la monocapa en un microscopio óptico, facilitado por tinción con cristal violeta. El título de anticuerpos neutralizantes de los sueros se determinó empleando el método de Reed y Muench34 como log base 2 de la dilución más alta que no mostró efecto citopático.
Detección de antígeno viralPara la detección de la proteína viral no estructural NS3 (también llamada p80), se utilizó el kit PrioCHECK™ (ThermoFisher Scientific, Waltham, Massachusetts, EE. UU.), siguiendo las instrucciones del fabricante. El kit está indicado para evaluar muestras de epitelio auricular. En este trabajo se evaluó, además, la posibilidad de detectar antígeno en suero. El suero fue diluido 1:2 en tampón de dilución (componente 5 del kit).
Detección del genoma viralSe realizó un ensayo de retrotranscripción seguido de PCR-anidada. Brevemente, se extrajo ARN a partir del suero o semen con Trizol Reagent® Sigma-Aldrich, siguiendo las indicaciones del fabricante. Para la retrotranscripción, se incubaron 300ng de ARN con una premezcla que contenía transcriptasa reversa M-MLV (Promega, Promega Corporation, Madison, Wisconsin, EE. UU.) y el cebador 326-reverse Pan Pestivirus42 (400nM). El ADNc obtenido se utilizó como molde para la primera ronda de la PCR con los cebadores 326-forward y 324-reverse Pan Pestivirus42 (667nM ambos). El tamaño del producto amplificado en esta etapa fue de 288pb. En la segunda ronda de PCR se mezclaron 2μl de este producto con 500μM de los cebadores Pesti-3 y Pesti-418, la enzima GoTaq®, nucleótidos y cofactores, en un volumen final de 20μl. El producto de reacción esperado, de 171pb, se detectó por corrida electroforética en un gel de agarosa al 1,5% (material suplementario 2). Si bien en este trabajo se hicieron evaluaciones individuales, pudimos comprobar que también podríamos trabajar con pools de hasta 30 muestras, como se demostró previamente39.
Análisis de los datosSe estimó el valor Kappa de Cohen (κ) para la concordancia entre los resultados de los ensayos serológicos y moleculares7. El grado de concordancia fue interpretado según McHugh25 como concordancia nula (0,0-0,2), mínima (0,21-0,39), débil (0,40-0,59), moderada (0,60-0,79), fuerte (0,80-0,90) o casi perfecta (>0,91). Los niveles de anticuerpos pre- y posvacunación se compararon usando la prueba de Mann-Whitney.
La tasa de abortos se estimó como el número de abortos sobre el total de hembras preñadas multiplicado por 100. La tasa de concepción se estimó como el número de hembras preñadas dividido por la suma del número de hembras preñadas y vacías. Los valores fueron calculados en forma mensual en el período prevacunación, que comprendió los 12 meses anteriores al inicio de la búsqueda sistemática de animales PI (de junio de 2018 a julio de 2019), en el período comprendido hasta completar el esquema de vacunación (agosto-septiembre de 2019), en el primer año posvacunación (de octubre de 2019 a octubre de 2020) y en el segundo año posvacunación (de noviembre de 2020 a diciembre de 2021). El análisis estadístico comprendió ANOVA de una vía, seguido de la prueba de Dunnett para comparaciones múltiples.
El intervalo de confianza fue del 95% para todas las evaluaciones. Para estos análisis, se utilizaron los softwares GraphPad Prism 5.0 y SigmaSTAT.
ResultadosPresencia del BVDVComo se indicó, el trabajo se realizó en 2 tambos del departamento de San Cristóbal, provincia de Santa Fe, que habían tenido casos confirmados de infección por el BVDV y presentaban problemas reproductivos asociados. Los tambos, denominados aquí «tambo 1» y «tambo 2», albergaban una población de 749 y 309 animales, respectivamente. Esta población incluía vacas, vaquillonas y terneros (tabla 1).
Se determinó la presencia de anticuerpos contra la proteína NS3 y del antígeno NS3 en suero y epitelio auricular utilizando kits comerciales. Las muestras de suero también fueron evaluadas para revelar la presencia de genoma viral mediante RT-PCR anidada42 (fig. 1). Notamos que la presencia de anticuerpos en el suero de los animales que arrojaron resultados positivos a la RT-PCR estaba interfiriendo con la identificación de antígeno en el ELISA, ya que los resultados obtenidos utilizando epitelio auricular (como indica el fabricante) eran coincidentes con los obtenidos mediante RT-PCR. La concordancia entre las mediciones realizadas por RT-PCR anidada y ELISA de antígeno en epitelio auricular fue fuerte (κ=0,89); para suero, la concordancia fue débil cuando el suero tenía anticuerpos anti-BVDV (κ=0,47) y casi perfecta con los sueros sin anticuerpos específicos contra el BVDV (κ=0,95). Considerando únicamente las muestras sin anticuerpos detectables o con niveles cercanos al punto de corte, volvimos a estimar la certeza diagnóstica del ELISA. De esa manera, la certeza diagnóstica se elevó al 98%; la concordancia entre el ELISA de antígeno utilizando suero y la RT-PCR anidada resultó casi perfecta (κ=0,96), y se alcanzaron altos niveles de sensibilidad y especificidad diagnósticas (96 y 100%, respectivamente).
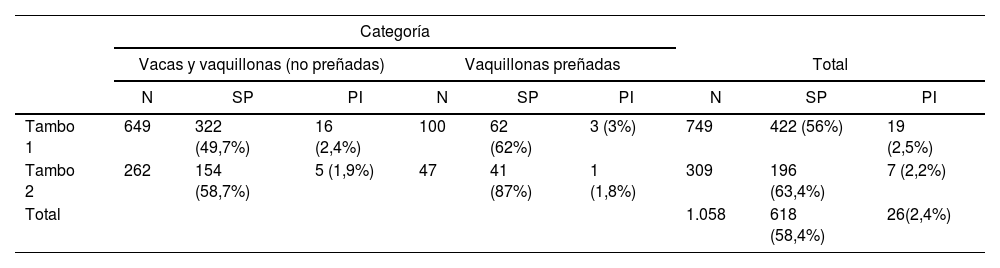
El análisis de anticuerpos contra la proteína no estructural NS3 realizado mediante ELISA en el tambo 1 arrojó una seroprevalencia del 49,7% en vacas y vaquillonas no preñadas y del 62% en vaquillonas preñadas. La prevalencia de PI fue del 2,4% en vacas no preñadas y del 3% en vaquillonas preñadas. La seroprevalencia total del tambo 1 fue del 56% y la prevalencia de PI del 2,5% (tabla 1).
En el tambo 2, la seroprevalencia total fue del 58,7% en vacas y vaquillonas no preñadas y del 87% en vaquillonas preñadas. La prevalencia de PI fue del 1,9% en vacas y vaquillonas no preñadas y del 1,8% en vaquillonas preñadas. En ambos tambos, la mayor proporción de animales seropositivos se encontró en el grupo de vaquillonas preñadas.
El porcentaje de animales PI considerando todos los animales de todas las categorías de los 2 tambos fue del 2,4%, y la seroprevalencia promedio de BVDV fue del 58,4% (tabla 1). La seroprevalencia en terneros fue del 2%; se encontraron 3 terneros con infección persistente, lo que supone una prevalencia del 3,3% (tabla 2). Todos los animales PI fueron segregados de los tambos en estudio y enviados a un tercer tambo situado a varios kilómetros de los tambos 1 y 2 a fin de evitar el contagio.
Aplicación de medidas de controlTodos los animales diagnosticados como sin infección persistente fueron inmunizados con 2 dosis de la vacuna comercial aplicadas con 21 días de intervalo. Luego de aplicada cada dosis, se observó una merma del 2% en la producción de leche, que se recuperó a niveles normales a las 24h (datos no mostrados).
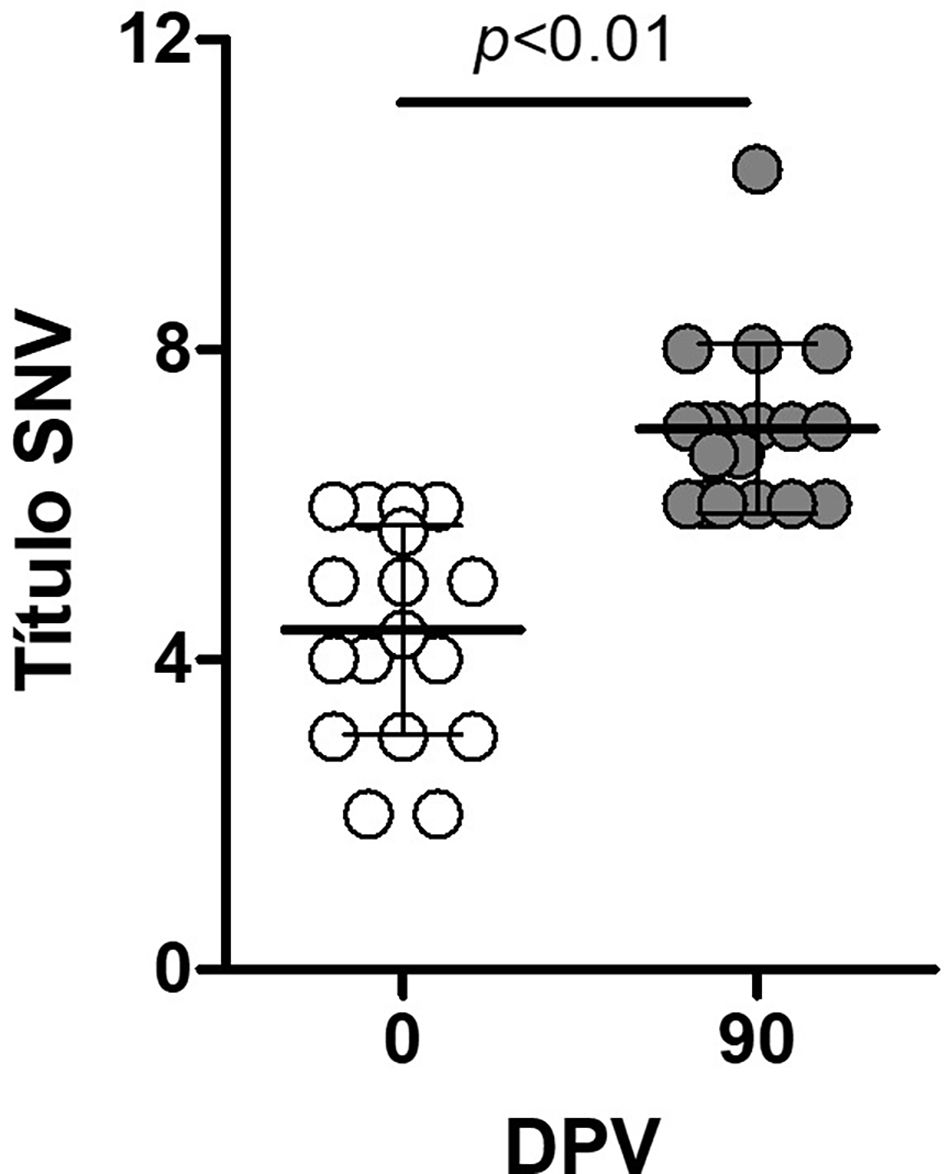
A los 90 días posvacunación (dpv), se tomaron al azar 20 muestras para medir los niveles de anticuerpos neutralizantes utilizando la cepa vacunal BVDV 1a Singer (fig. 2). Los niveles de anticuerpos específicos neutralizantes se incrementaron significativamente en todos los animales evaluados entre los 0 y los 90dpv (p<0,05). El título promedio de anticuerpos neutralizantes alcanzado a los 90dpv fue de Log10Tit−1=2,02, con un desvío estándar de 0,32, frente a un valor promedio de 1,5±0,31 en el momento de la vacunación (0dpv).
Inducción de anticuerpos neutralizantes anti-BVDV cepa Singer 1a (cepa vacunal) posvacunación. Cada círculo representa el resultado de una muestra individual; las líneas indican los valores promedio±desviación estándar. La técnica utilizada fue la titulación en microplacas sobre células MDBK. SNV: seroneutralización viral; DPV: días posvacunación.
Los análisis de presencia de genoma viral arrojaron resultados negativos. Todos los animales fueron revacunados en 2019 y 2020 (y luego siguieron siendo revacunados anualmente). En 2020, se continuó con el análisis de detección del genoma del BVDV en muestras de terneros de madres que habían sido vacunadas. No se detectaron abortos asociados a BVDV ni terneros PI en 2020 (tabla 2).
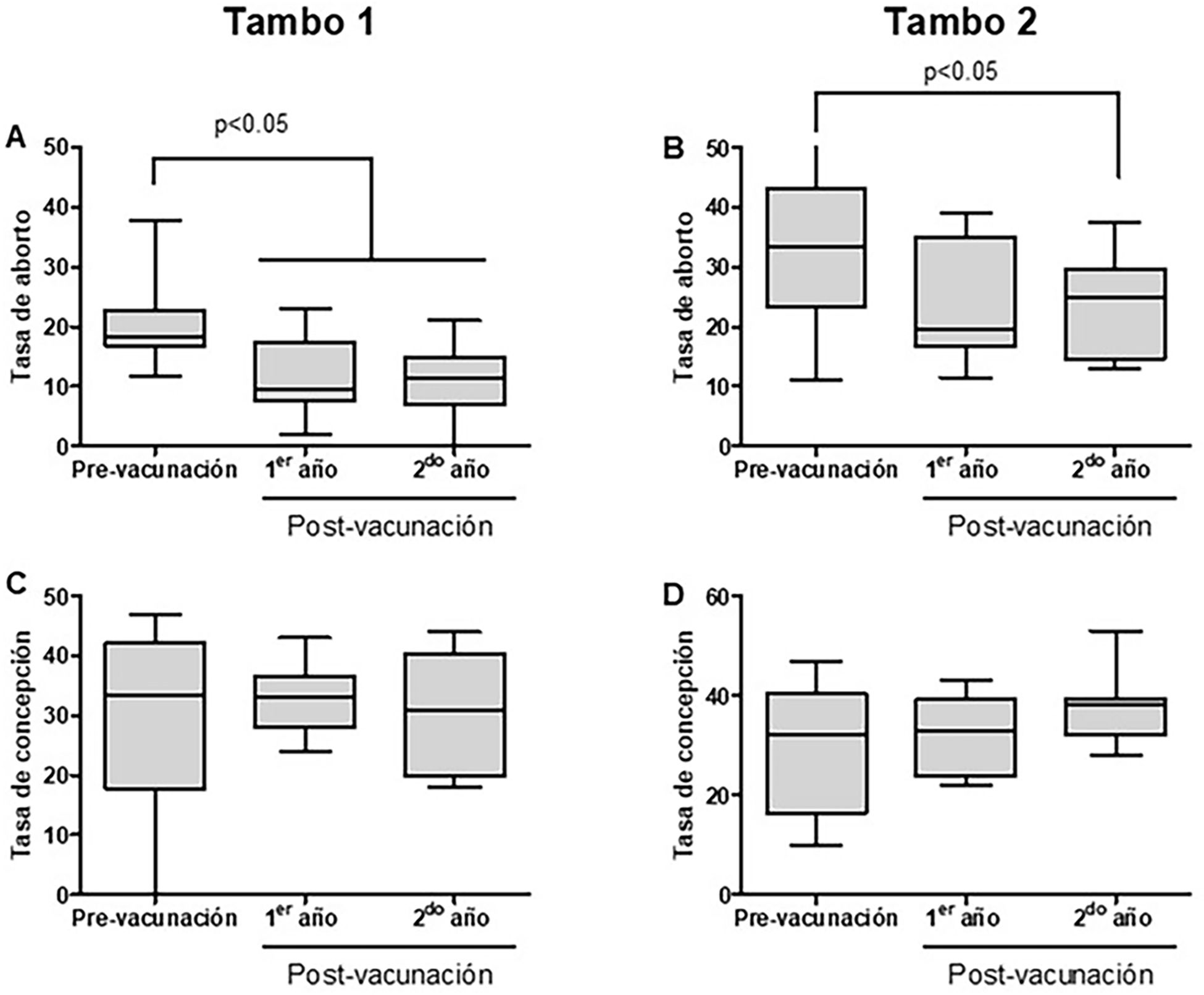
El porcentaje de abortos disminuyó de forma progresiva en ambos tambos luego de la segregación de los bovinos PI y la vacunación (fig. 3). La tasa de aborto promedio antes de iniciar el trabajo era del 20,5% en el tambo 1 y del 34% en el tambo 2. Los porcentajes de aborto disminuyeron de forma significativa en el primer año posvacunación en el tambo 1 (p<0,05), manteniéndose en valores cercanos al 11% también durante el segundo año (p<0,05). En el tambo 2, donde la seroprevalencia era mayor, la disminución en la tasa de abortos resultó significativa (p<0,05) en el segundo año de iniciada la estrategia de control. En ambos tambos se observó un aumento de los casos de neosporosis y abortos debidos a esta infección parasitaria (datos no mostrados).
Mejoras reproductivas resultantes del programa de control aplicado. La tasa de concepción se calculó como número de vacas preñadas/vacas preñadas+vacías. Los valores se presentan en formato de caja (líneas horizontales, valor promedio; líneas verticales, valores mínimos y máximos). Se aplicó ANOVA de una vía seguido del test de Dunnett para comparaciones múltiples. Se indican diferencias significativas con una confianza del 95%.
La tasa de concepción aumentó del 29 al 33% en el tambo 1 durante el primer año y se mantuvo en torno al 30% de promedio durante el segundo año. En el tambo 2, el aumento de la tasa de concepción fue más notable: pasó del 30% al iniciar el trabajo al 37% durante el segundo año (fig. 3). No obstante, debido a la alta dispersión de los valores, estas diferencias no fueron significativas. La tasa de concepción sigue en aumento desde entonces (comunicación personal).
DiscusiónEn estudios realizados en diferentes lugares del mundo, se observó que en los países donde se aplican programas de control, la seroprevalencia del BVDV a nivel individual y por rodeo se reduce hasta 1,5 veces en comparación con la de países que no implementan medidas de intervención37. Las prácticas sistemáticas y los programas de control bien coordinados tienen un claro potencial de éxito en la salud de los animales y su productividad41.
En regiones de baja seroprevalencia y baja densidad poblacional no se emplean vacunas2, que sí han sido utilizadas en zonas con alto riesgo de reintroducción viral20. Estos antecedentes nos motivaron a evaluar la factibilidad de establecer medidas de control en condiciones de campo en 2 tambos representativos del sistema productivo nacional ubicados en la provincia de Santa Fe. Para el caso de este estudio y debido a la alta seroprevalencia que tenían ambos tambos (superiores al 50% y porcentajes de animales PI mayores del 2%), se optó por sumar al plan de control la vacunación sistemática, similar al modelo alemán17,20. La estrategia de mitigación del impacto del BVDV a campo consistió, entonces, en combinar medidas de manejo, diagnóstico y vacunación para reducir la circulación del BVDV (fig. 4) y reducir el impacto de esta enfermedad viral en la tasa de abortos y la tasa de concepción, disminuyendo así la merma productiva.
Resumen de la estrategia implementada para controlar la circulación del BVDV. Se establecieron pautas que combinan medidas de mitigación, diagnóstico y vacunación. La identificación y segregación de animales persistentemente infectados (PI) y la aplicación de la vacunación sistemática de toda la población no PI constituye la base de la estrategia.
Las pruebas diagnósticas son fundamentales para todas las campañas de control y erradicación. En este trabajo utilizamos las pruebas de diagnóstico para clasificar el estado del rebaño (ELISA de anticuerpos anti-NS3), para identificar animales infectados con el BVDV y para la monitorización continua a fin de confirmar el estado libre de BVDV (ELISA de antígeno y RT-PCR anidada). Los ELISA comerciales utilizados resultaron ser eficientes en la detección de antígeno viral y anticuerpos con la finalidad de identificar bovinos PI y segregarlos. No hubo diferencias en el diagnóstico individual mediante ELISA de antígeno o RT-PCR anidada, aunque esta última técnica nos permitió trabajar con pools de muestras, combinando hasta 30 muestras de suero, según datos previos39 adaptados en nuestro laboratorio. Para detectar antígenos en muestras de suero, recomendamos constatar antes la ausencia de anticuerpos. No observamos interferencia de anticuerpos en muestras de epitelio auricular.
El 51% de los animales del tambo 1 presentaron serología positiva al BVDV, mientras que este valor fue del 74% en el tambo 2. Los valores de seropositividad encontrados son similares a los reportados en otros países en los que no se aplican medidas de control15. El porcentaje de animales PI en ambos tambos se considera «alto» (>1,6%) según la categorización propuesta en el metaanálisis de Scharnböck et al.37, lo cual es esperable en regiones en las que circula el virus y no se aplican medidas de mitigación.
Es importante que la vacunación confiera altos niveles de protección20, sobre todo para prevenir las infecciones transplacentarias que dan origen a terneros con infección persistente y para brindar protección ante posibles reintroducciones del virus en el campo5. En este estudio se utilizó una vacuna comercial que contiene una alta concentración antigénica de BVDV inactivado por métodos químicos30, formulada con un hidróxido de aluminio micronizado combinado con un inmunomodulador, para alcanzar mayor respuesta inmune. Los niveles de anticuerpos específicos neutralizantes en una muestra tomada al azar se incrementaron significativamente en todos los animales evaluados entre los 0 y los 90dpv, luego de aplicar 2 dosis espaciadas por 21 días a toda la población no PI. El título promedio de anticuerpos neutralizantes alcanzado a los 90dpv fue de Log2Tit−1=8 (desvío estándar 0,32), frente a un valor promedio de 2 (desvío estándar 0,31) a los 0dpv. O sea que, según la clasificación de Downey-Slinker11, los títulos seroneutralizantes prevacunales eran «bajos» (≤2 y <4) y la vacunación indujo títulos en la categoría de «altos» (≥6). En el citado estudio se evaluó la respuesta inducida por 2 dosis aplicadas con 21 días de intervalo y se obtuvieron títulos similares a los medidos en este trabajo. El valor alcanzado a los 90dpv es similar al informado en un trabajo tras la infección experimental con cepas BVDV-239 y al documentado en la respuesta establecida frente a vacunas inactivadas combinadas en vacas preñadas a los 37dpv38.
El número de abortos al inicio del estudio era comparable con el de explotaciones productivas con infección endémica4,35,36. Pudimos constatar una notoria disminución en el porcentaje de abortos, que resultó estadísticamente significativa en ambos tambos al mantener al menos durante 2 años las medidas de mitigación. Dado que este trabajo fue realizado a campo y en condiciones productivas, no experimentales, no podemos descartar la presencia de otros agentes etiológicos que también son causales de abortos en nuestro país6. Datos de nuestro laboratorio indican que en los casos en los que pudo analizarse tejido del feto abortado o placenta, nunca se detectó genoma del BVDV, pero sí se identificó la presencia de Neospora caninum, otro agente etiológico de abortos muy prevalente en nuestro país33. Es importante tener en cuenta otras causas que producen abortos en el ganado bovino, infecciosas y no infecciosas, como los problemas carenciales, que no fueron considerados en este estudio. Teniendo en cuenta esta posibilidad, resulta notable que, al mitigar la incidencia de las infecciones por un solo virus, se produjo una fuerte disminución en la tasa de abortos, que se verificó ya en el primer año postintervención en el campo con menor seroprevalencia de BVDV, y en el segundo año en el campo con mayor seroprevalencia. Esto destaca una vez más la relevancia de este virus en las pérdidas reproductivas en tambos. Los resultados también evidencian que, en los casos de alta prevalencia, sería necesario sostener el programa de control durante al menos 2 años para mitigar los efectos del BVDV sobre las pérdidas reproductivas.
La tasa de concepción aumentó en los tambos al aplicar las medidas de control, con valores similares a los obtenidos en estudios publicados anteriormente. La reducción en la fertilidad fue documentada a campo en un rebaño infectado con BVDV, en el que se hallaron tasas de concepción del 78,6% en las vacas inmunes y de apenas el 22% en animales infectados43. En otro estudio se demostró que la infección por el BVDV en el momento de la concepción redujo las tasas de preñez a los 77 días: mientras que la tasa de preñez fue del 79% en los animales control, fue del 33% en el grupo expuesto al virus24.
La vacuna aplicada es una vacuna comercial cuya formulación combina antígenos de otros patógenos virales y bacterianos que se formulan juntamente con el BVDV (llamadas «vacunas reproductivas»). Esta vacuna comercial logró aumentar los niveles poblacionales de anticuerpos seroneutralizantes del rodeo, como se mencionó antes. Un metaanálisis realizado en 201527 proporcionó apoyo cuantitativo al beneficio de la vacunación en la prevención de enfermedades reproductivas asociadas al BVDV. Este estudio muestra que la vacunación con vacuna de virus vivo modificado, inactivado, en formulaciones combinadas o monovalentes, homóloga, heteróloga a las cepas de campo, logra disminuir los abortos hasta en un 45% en comparación con cohortes no vacunadas. Los datos presentados confirman que la aplicación de una vacuna reproductiva comercializada en Argentina brinda inmunidad suficiente para ser utilizada en programas de control en condiciones de campo.
En conjunto, nuestros resultados indican que el trabajo coordinado de identificación de animales PI con su posterior segregación, sumado a la vacunación sistemática de toda la población susceptible en condiciones de campo con alta seroprevalencia de BVDV, se asocia a una mejora en los parámetros reproductivos, con una disminución en la tasa de abortos, un aumento en la tasa de concepción y la ausencia de BVDV circulante. A la fecha, los tambos 1 y 2 mantienen la aplicación de este protocolo de trabajo, continúan libres de animales PI y tienen toda su población animal vacunada, condiciones en las que el BVDV ya no circula.
Se presentan por primera vez los resultados de un estudio controlado para el manejo de las infecciones por el BVDV en la República Argentina utilizando las herramientas diagnósticas y las vacunas disponibles en el mercado. Verificamos la factibilidad de reducir el impacto de las infecciones por el BVDV en tambos aplicando diagnóstico, manejo y vacunación. La identificación de animales infectados persistentemente con el BVDV, su segregación del rodeo y la vacunación sistemática de toda la población susceptible se asoció a una mejora en los parámetros reproductivos y a la eliminación de la circulación viral en condiciones de campo.
FinanciaciónEste trabajo fue financiado por Agropharma Salud Animal.
Conflicto de interesesCP y LJB suscriben al trabajo en su carácter de personal empleado por Agropharma Salud Animal.
Los autores agradecen a ThermoFisher división Salud Animal por aportar los kits de diagnóstico por ELISA utilizados en este trabajo.