A utilização crescente do implante transcateter de prótese valvar aórtica (TAVI) em pacientes de alto risco, em especial naqueles com disfunção ventricular, justifica uma avaliação mais profunda da seleção e dos resultados do procedimento. Utilizamos nosso banco de dados para caracterizar o perfil dos pacientes e avaliar os resultados do TAVI de acordo com o grau de disfunção ventricular.
MétodosEstudo observacional longitudinal no qual foram incluídos todos os pacientes com estenose aórtica (EAo) grave, submetidos ao TAVI entre 2009 e 2014, e comparados àqueles com fração de ejeção do ventrículo esquerdo (FEVE) ≤ 40% vs. > 40%. Foram avaliados os desfechos de segurança e eficácia em 30 dias e 1 ano.
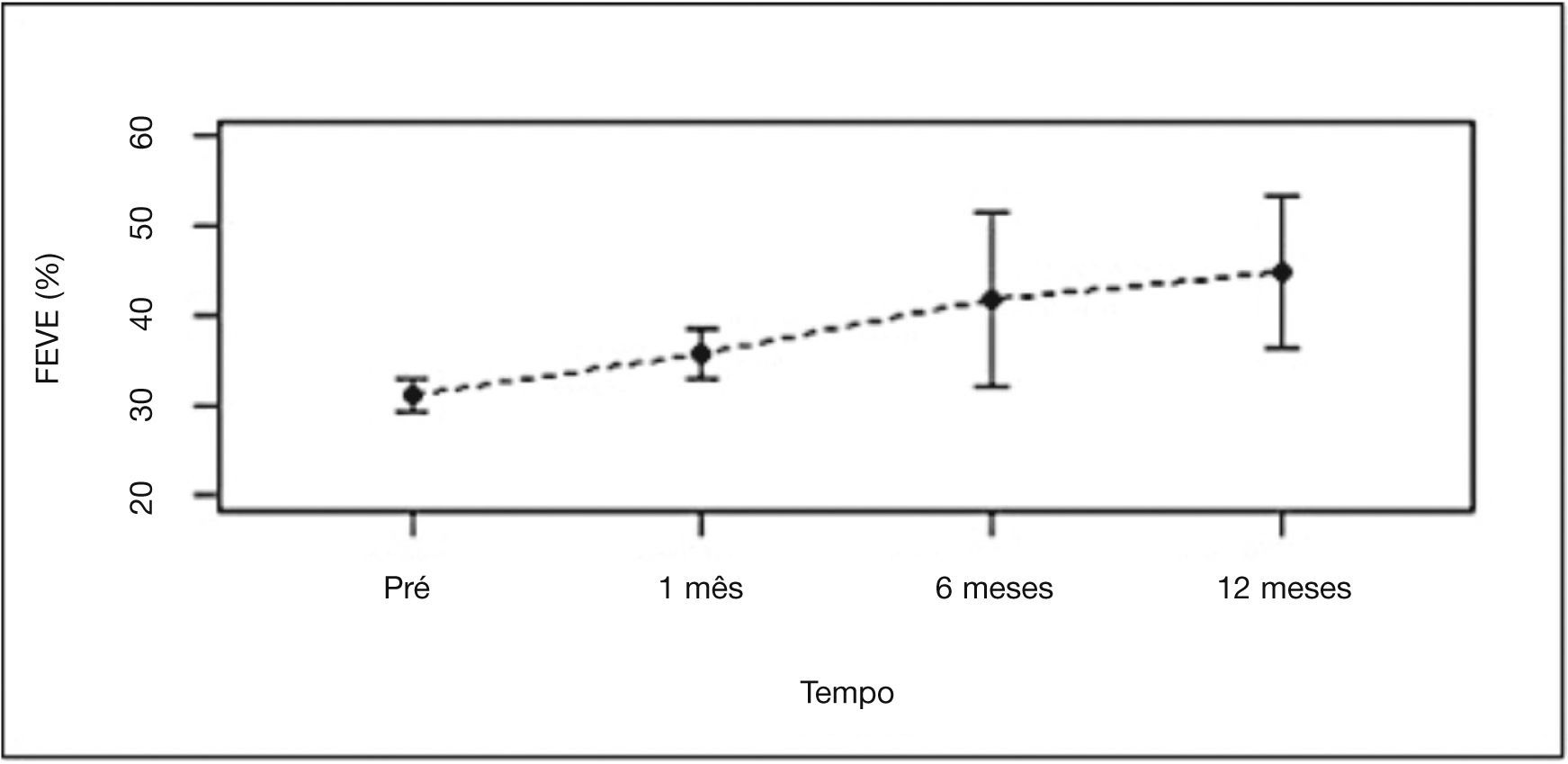
ResultadosDentre os 172 pacientes, 20 (11,6%) apresentavam FEVE ≤ 40%. Esses pacientes eram mais jovens, com maior prevalência de tabagismo, infarto agudo do miocárdio prévio, cirurgia de revascularização miocárdica, marca‐passo definitivo e hipertensão arterial pulmonar. Também se observou, nesse grupo, maior frequência de classes funcionais mais elevadas. O grupo com FEVE ≤ 40% apresentou menor gradiente valvar aórtico médio para área valvar equivalente. As taxas de sucesso do procedimento não diferiram entre os grupos. Não foram observadas diferenças na mortalidade, nos eventos coronarianos, cerebrovasculares, sangramentos, complicações vasculares e disfunção renal aguda no acompanhamento de 30 dias e 1 ano. No grupo FEVE ≤ 40%, a média da FEVE elevou‐se de 31,5 para 45,1% 1 ano após o procedimento (p = 0,002).
ConclusõesO TAVI em pacientes com EAo grave e FEVE ≤ 40% não aumenta o risco de complicações e está associado à melhora da FEVE.
The increasing use of transcatheter aortic valve implantation (TAVI) in high‐risk patients, especially those with ventricular dysfunction, justifies further evaluation of the selection and the results of the procedure. A database was used to characterize the profile of patients and evaluate TAVI results according to the degree of ventricular dysfunction.
MethodsThis was a longitudinal observational study that included all patients with severe aortic stenosis (AoS) submitted to TAVI between 2009 and 2014, comparing those with left ventricular ejection fraction (LVEF) ≤ 40% vs. > 40%. The safety and efficacy outcomes were evaluated at 30 days and 1 year.
ResultsOf the 172 patients, 20 (11.6%) had LVEF ≤ 40%. These patients were younger, with a higher prevalence of smoking, previous acute myocardial infarction, coronary artery bypass graft surgery, permanent pacemaker, and pulmonary artery hypertension. Higher functional classes were also more often observed in this group. The group with LVEF ≤ 40% had lower mean aortic valve gradient for an equivalent valve area. The procedure success did not differ between groups. There were no differences in mortality in coronary and cerebrovascular events, bleeding, vascular complications, and acute renal failure in the 30 day and 1 year follow‐up. In the LVEF ≤ 40% group, the mean LVEF increased from 31.5 to 45.1% 1 year after the procedure (p = 0.002).
ConclusionsTAVI in patients with severe AoS and LVEF ≤ 40% does not increase the risk of complications and is associated with LVEF improvement.
Estenose aórtica (EAo) degenerativa é a valvopatia mais frequente em adultos, cuja prevalência aumenta com a idade, acometendo cerca de 4% dos indivíduos com idade superior a 80 anos. Dados do Instituto Brasileiro de Geografia e Estatística (IBGE) estimam que, em 20 anos, o país terá 14,5 milhões de idosos com mais de 75 anos, dos quais 400 a 650 mil poderão ter EAo degenerativa.1,2
Pacientes com EAo grave têm indicação formal para a troca valvar, devido ao prognóstico desfavorável com o tratamento clínico.3,4 No entanto, cerca de 30% dos pacientes com EAo e indicação cirúrgica não são submetidos à troca valvar, em razão da idade avançada, comorbidades associadas, receio do médico ou recusa do paciente em se submeter ao tratamento cirúrgico convencional.5
No contexto de pacientes com EAo grave sintomática e de alto risco cirúrgico ou inoperáveis, surgiu o implante transcateter de prótese aórtica (TAVI), tendo sido o PARTNER (Placement of AoRtic TraNscathetER Valves) o primeiro estudo randomizado a demonstrar que o TAVI era uma alternativa não inferior ao tratamento cirúrgico em pacientes de alto risco (coorte A) e uma opção superior ao tratamento clínico naqueles considerados inoperáveis (coorte B).6 Mais recentemente, o CoreValve US Pivotal Trial demonstrou que o TAVI pode ser superior à cirurgia de troca valvar, em termos de redução da mortalidade, em pacientes com risco cirúrgico elevado (Society of Thoracic Surgeons Predicted Risk of Mortality ‐ STS PROM ≥ 15%).7
O uso crescente do TAVI em pacientes de alto risco, em especial naqueles com disfunção ventricular, justifica uma avaliação mais aprofundada da seleção e dos resultados do procedimento. Utilizamos nosso banco de dados para caracterizar o perfil dos pacientes e avaliar os resultados do TAVI de acordo com o grau de disfunção ventricular. Comparamos pacientes com disfunção sistólica do ventrículo esquerdo (VE) moderada a grave, definida como fração de ejeção do ventrículo esquerdo (FEVE) ≤ 40%, com aqueles com FEVE > 40%.
MétodosFoi realizado um estudo observacional e longitudinal, que incluiu todos os pacientes com EAo grave, sintomáticos, submetidos ao TAVI, no período de janeiro de 2009 a junho de 2014, no Instituto Dante Pazzanese de Cardiologia e no Hospital do Coração (HCor), ambos situados em São Paulo (SP), sendo o projeto aprovado pelo Comitê de Ética institucional.
Obtivemos dados clínicos por meio de exame clínico e realização de exames complementares (eletrocardiografia de repouso; radiografia de tórax; Doppler‐ecocardiografia transtorácica com protocolo para medidas do complexo aórtico; angiotomografia computadorizada de coração e aorta total; e cateterismo cardíaco com cineangiocoronariografia). A ecocardiografia transesofágica foi utilizada para guiar o procedimento e detectar possíveis complicações decorrentes do implante da prótese.
Os dados foram registrados em formulários apropriados, desenvolvidos para o estudo, armazenados em planilhas eletrônicas.
Preparo do paciente e próteses utilizadasTodos os pacientes foram pré‐tratados com aspirina 100mg e clopidogrel 300mg no dia anterior ao implante. Em indivíduos com disfunção renal, hidratação venosa, com solução salina 0,9%, na dose de 0,3 a 0,5mL/kg/hora, foi iniciada 12 horas antes do procedimento. Visando ainda à prevenção de nefropatia induzida por contraste, as angiografias requeridas durante o procedimento foram obtidas com contraste de baixa osmolaridade, com diluição de 50%.
Foram utilizadas as próteses autoexpansíveis CoreValve (Medtronic, Minneapolis, EUA) e Acurate (Symetis, Ecublens, Suíça), e a prótese balão‐expansível Edwards Sapien (Edwards Lifesciences, Irvine, EUA). A escolha da prótese foi baseada na disponibilidade do dispositivo e na escolha do operador.
Os pacientes foram admitidos em unidade de terapia intensiva logo após a intervenção e, no primeiro dia pós‐procedimento, realizaram exames laboratoriais, eletrocardiograma e ecocardiograma.
Desfechos e definiçõesOs desfechos e complicações foram detalhados conforme as definições padronizadas e atualizadas no Valve Academic Research Consortium‐2 (VARC2).8 O sucesso do dispositivo foi considerado como o implante de uma única prótese em local adequado, com ausência de desproporção prótese‐paciente, obtenção de gradiente transvalvar aórtico médio < 20mmHg ou velocidade de pico < 3 m/s, e ausência de regurgitação aórtica maior ou igual a moderada conforme definições do ecocardiograma transesofágico ou transtorácico.
O sucesso do procedimento e os desfechos de segurança (30 dias) e eficácia clínica (1 ano) foram avaliados. O acidente vascular cerebral foi determinado pelo surgimento de défice neurológico focal ou global com duração > 24 horas, ou pela presença de nova área de infarto cerebral, ou sangramento em métodos de neuroimagem, independentemente da duração dos sintomas. As complicações hemorrágicas foram divididas em: (1) sangramento com risco de morte: quando ocorresse sangramento fatal ou evidente em um órgão vital (intracraniano, intraocular e pericárdico) ou sangramento que resultasse em choque hipovolêmico ou hipotensão grave, com necessidade de vasopressores ou cirurgia; ou ainda sangramento evidente com queda na hemoglobina ≥ 5g/dL ou necessidade de transfusão de quatro ou mais concentrados de hemácias; (2) sangramento maior: sangramento evidente com queda na hemoglobina ≥ 3g/dL ou necessidade de transfusão de dois ou três concentrados de hemácias, ou ainda aquele sangramento que demandasse hospitalização ou cirurgia; (3) sangramento menor: qualquer sangramento digno de menção (por exemplo: hematoma em sítio de punção), que não preenchesse critérios para sangramentos com risco de morte ou maior.
As complicações vasculares foram categorizadas como maiores, de acordo com os seguintes critérios: ocorrência de dissecção de aorta, ruptura de aorta ou de anel aórtico ou perfuração do VE; diagnóstico de injúria vascular no sítio de punção femoral, que resultasse em óbito, sangramento maior ou sangramento com risco de morte; injúria vascular que ocasionasse isquemia visceral ou prejuízo neurológico; embolização distal não cerebral que requeresse cirurgia; necessidade de intervenção cirúrgica ou percutânea, que levasse à morte, sangramento maior, isquemia visceral, ou prejuízo neurológico; ou qualquer isquemia ipsilateral documentada.
A insuficiência renal crônica foi determinada pela presença de clearance de creatinina < 50mL/minuto. A injúria renal aguda ocorrida pós‐procedimento foi classificada conforme o escore Acute Kidney Injury (AKIN), sendo avaliada até o sétimo dia pós‐implante. A injúria renal foi categorizada como: (a) estágio 1: aumento de 0,3mg/dL ou aumento de 150 a 200% do valor basal da creatinina sérica ou diurese < 0,5mL/kg/hora por 6 horas pós‐procedimento; (b) estágio 2: aumento > 200 a 300% do valor basal da creatinina sérica ou diurese < 0,5mL/kg/hora por > 12 horas; (c) estágio 3: aumento > 300% do valor basal da creatinina sérica ou creatinina sérica ≥ 4,0mg/dL, associado a aumento de pelo menos 0,5mg/dL do valor basal; diurese < 0,3mL/kg/hora por 24 horas ou anúria por mais de 12 horas. A presença de hipertensão arterial pulmonar foi determinada por pressão sistólica de artéria pulmonar (medida pelo ecocardiograma transtorácico) > 55mmHg.
Análise estatísticaAs variáveis contínuas foram descritas como média e desvio padrão, e as categóricas, como números absolutos e porcentuais. Para a comparação das variáveis contínuas, utilizou‐se o teste t de Student (ou Mann‐Whitney) para amostras independentes e, para as variáveis categóricas, o teste qui quadrado ou teste exato de Fisher, quando apropriado. As comparações da FEVE ao longo do seguimento foram realizadas por meio do teste de Friedman para medidas repetidas. Todas as análises foram realizadas com os programas Statistical Package for the Social Science (SPSS) 19 e R versão 3.1.2. O nível de significância estatística adotado foi igual a 5%.
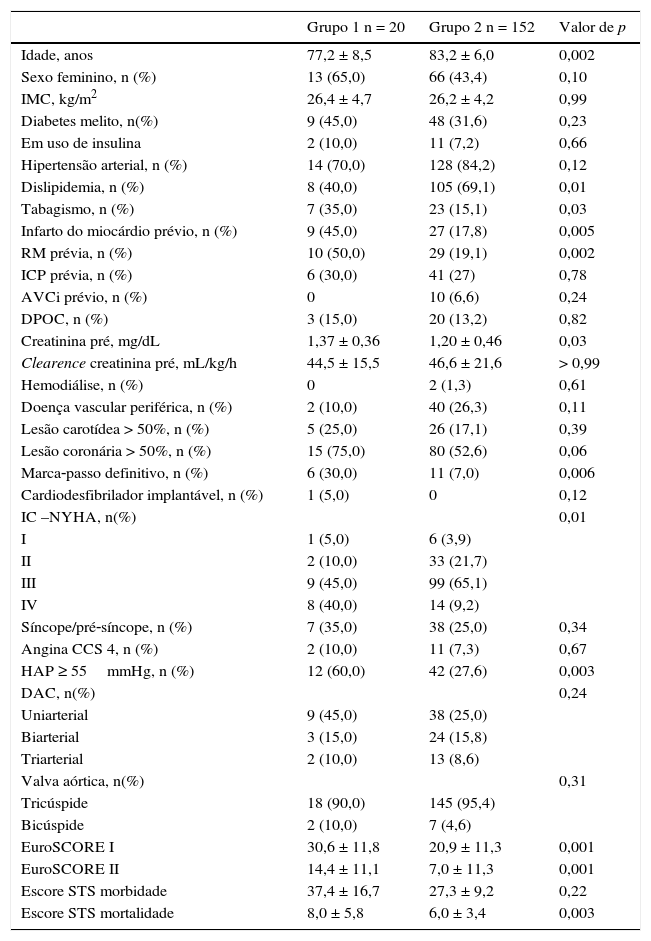
ResultadosNo período entre janeiro de 2009 a junho de 2014, 172 pacientes foram submetidos ao TAVI, sendo distribuídos em Grupo 1, com pacientes com FEVE ≤ 40% (n = 20; 11,6%), e Grupo 2, com pacientes com FEVE > 40% (n = 152). Os pacientes com FEVE ≤ 40% eram mais jovens (77,2 ± 8,5 vs. 83,2 ± 6,0 anos; p = 0,002), com maior prevalência de tabagismo (35,0% vs. 15,1%; p = 0,03), infarto agudo do miocárdio prévio (45,0% vs. 17,8%; p = 0,005), cirurgia de revascularização miocárdica (50,0% vs. 19,1%; p = 0,002), marca‐passo definitivo (30,0% vs. 7,0%; p = 0,006) e hipertensão arterial pulmonar (60,0% vs. 27,6%; p = 0,003). Também observaram‐se, no Grupo 1, maior frequência de classes funcionais mais elevadas e maiores níveis de creatinina sérica (1,37 ± 0,36 vs. 1,20 ± 0,46mg/dL; p = 0,03). Na avaliação pré‐TAVI, o EuroSCORE I (30,6% ± 11,8% vs. 20,9% ± 11,3%; p < 0,001), o EuroSCORE II (14,4% ± 11,1% vs. 7,0% ± 11,3%; p < 0,001) e escore STS para mortalidade (8,0 ± 5,8 vs. 6,0 ± 3,4; p = 0,003) foram mais elevados para o grupo FEVE ≤ 40% (tabela 1).
Dados clínicos basais
| Grupo 1 n = 20 | Grupo 2 n = 152 | Valor de p | |
|---|---|---|---|
| Idade, anos | 77,2 ± 8,5 | 83,2 ± 6,0 | 0,002 |
| Sexo feminino, n (%) | 13 (65,0) | 66 (43,4) | 0,10 |
| IMC, kg/m2 | 26,4 ± 4,7 | 26,2 ± 4,2 | 0,99 |
| Diabetes melito, n(%) | 9 (45,0) | 48 (31,6) | 0,23 |
| Em uso de insulina | 2 (10,0) | 11 (7,2) | 0,66 |
| Hipertensão arterial, n (%) | 14 (70,0) | 128 (84,2) | 0,12 |
| Dislipidemia, n (%) | 8 (40,0) | 105 (69,1) | 0,01 |
| Tabagismo, n (%) | 7 (35,0) | 23 (15,1) | 0,03 |
| Infarto do miocárdio prévio, n (%) | 9 (45,0) | 27 (17,8) | 0,005 |
| RM prévia, n (%) | 10 (50,0) | 29 (19,1) | 0,002 |
| ICP prévia, n (%) | 6 (30,0) | 41 (27) | 0,78 |
| AVCi prévio, n (%) | 0 | 10 (6,6) | 0,24 |
| DPOC, n (%) | 3 (15,0) | 20 (13,2) | 0,82 |
| Creatinina pré, mg/dL | 1,37 ± 0,36 | 1,20 ± 0,46 | 0,03 |
| Clearence creatinina pré, mL/kg/h | 44,5 ± 15,5 | 46,6 ± 21,6 | > 0,99 |
| Hemodiálise, n (%) | 0 | 2 (1,3) | 0,61 |
| Doença vascular periférica, n (%) | 2 (10,0) | 40 (26,3) | 0,11 |
| Lesão carotídea > 50%, n (%) | 5 (25,0) | 26 (17,1) | 0,39 |
| Lesão coronária > 50%, n (%) | 15 (75,0) | 80 (52,6) | 0,06 |
| Marca‐passo definitivo, n (%) | 6 (30,0) | 11 (7,0) | 0,006 |
| Cardiodesfibrilador implantável, n (%) | 1 (5,0) | 0 | 0,12 |
| IC –NYHA, n(%) | 0,01 | ||
| I | 1 (5,0) | 6 (3,9) | |
| II | 2 (10,0) | 33 (21,7) | |
| III | 9 (45,0) | 99 (65,1) | |
| IV | 8 (40,0) | 14 (9,2) | |
| Síncope/pré‐síncope, n (%) | 7 (35,0) | 38 (25,0) | 0,34 |
| Angina CCS 4, n (%) | 2 (10,0) | 11 (7,3) | 0,67 |
| HAP ≥ 55mmHg, n (%) | 12 (60,0) | 42 (27,6) | 0,003 |
| DAC, n(%) | 0,24 | ||
| Uniarterial | 9 (45,0) | 38 (25,0) | |
| Biarterial | 3 (15,0) | 24 (15,8) | |
| Triarterial | 2 (10,0) | 13 (8,6) | |
| Valva aórtica, n(%) | 0,31 | ||
| Tricúspide | 18 (90,0) | 145 (95,4) | |
| Bicúspide | 2 (10,0) | 7 (4,6) | |
| EuroSCORE I | 30,6 ± 11,8 | 20,9 ± 11,3 | 0,001 |
| EuroSCORE II | 14,4 ± 11,1 | 7,0 ± 11,3 | 0,001 |
| Escore STS morbidade | 37,4 ± 16,7 | 27,3 ± 9,2 | 0,22 |
| Escore STS mortalidade | 8,0 ± 5,8 | 6,0 ± 3,4 | 0,003 |
Grupo 1: fração de ejeção do ventrículo esquerdo ≤ 40%; Grupo 2: fração de ejeção do ventrículo esquerdo > 40%. IMC: índice de massa corporal; RM: revascularização miocárdica; ICP: intervenção coronária percutânea; AVCi: acidente vascular cerebral isquêmico; DPOC: doença pulmonar obstrutiva crônica; IC: insuficiência cardíaca; NYHA: New York Heart Association; HAP: hipertensão arterial pulmonar; DAC: doença arterial coronariana; STS: Society of Thoracic Surgeons.
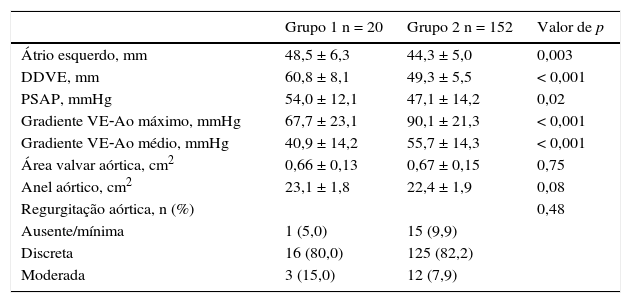
O ecocardiograma pré‐procedimento demonstrou FEVE média de 31,5 ± 3,9% no Grupo 1 e de 61,5 ± 8,4% no Grupo 2. No Grupo 1, observaram‐se maior diâmetro do átrio esquerdo (48,5 ± 6,3 vs. 44,3 ± 5,0mm; p = 0,003) e maior diâmetro diastólico final do VE (60,8 ± 8,1 vs. 49,3 ± 5,5mm; p < 0,001). A avaliação da área valvar pela equação de continuidade demonstrou área equivalente em ambos os grupos (0,66 ± 0,13 vs. 0,67 ± 0,15cm2; p = 0,75), mas menores gradientes sistólicos transaórticos máximo (67,7 ± 23,0 vs. 90,1 ± 21,3mmHg; p < 0,001) e médio (40,9 ± 14,2 vs. 55,7 ± 14,3mmHg; p < 0,001) para o grupo FEVE ≤ 40%. A medida do anel valvar aórtico e a avaliação da regurgitação aórtica pré‐procedimento não mostraram diferenças entre os grupos (tabela 2).
Dados ecocardiográficos pré‐procedimento
| Grupo 1 n = 20 | Grupo 2 n = 152 | Valor de p | |
|---|---|---|---|
| Átrio esquerdo, mm | 48,5 ± 6,3 | 44,3 ± 5,0 | 0,003 |
| DDVE, mm | 60,8 ± 8,1 | 49,3 ± 5,5 | < 0,001 |
| PSAP, mmHg | 54,0 ± 12,1 | 47,1 ± 14,2 | 0,02 |
| Gradiente VE‐Ao máximo, mmHg | 67,7 ± 23,1 | 90,1 ± 21,3 | < 0,001 |
| Gradiente VE‐Ao médio, mmHg | 40,9 ± 14,2 | 55,7 ± 14,3 | < 0,001 |
| Área valvar aórtica, cm2 | 0,66 ± 0,13 | 0,67 ± 0,15 | 0,75 |
| Anel aórtico, cm2 | 23,1 ± 1,8 | 22,4 ± 1,9 | 0,08 |
| Regurgitação aórtica, n (%) | 0,48 | ||
| Ausente/mínima | 1 (5,0) | 15 (9,9) | |
| Discreta | 16 (80,0) | 125 (82,2) | |
| Moderada | 3 (15,0) | 12 (7,9) |
Grupo 1: fração de ejeção do ventrículo esquerdo ≤ 40%; Grupo 2: fração de ejeção do ventrículo esquerdo > 40%. DDVE: diâmetro diastólico do ventrículo esquerdo; PSAP: pressão sistólica da artéria pulmonar; VE: ventrículo esquerdo; Ao: aorta.
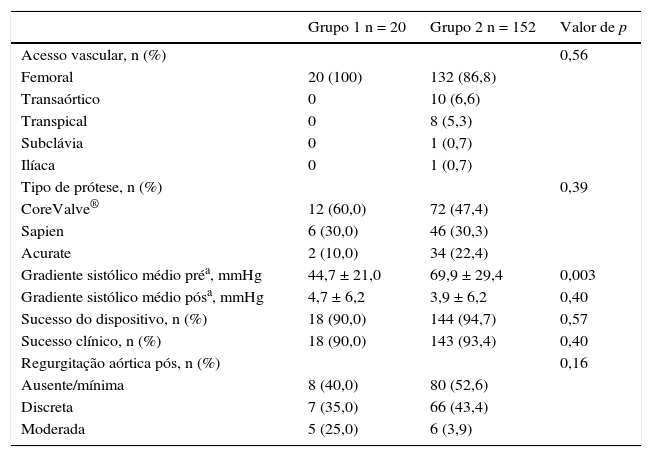
Foi implantado um total de 84 próteses CoreValve, 52 próteses Edwards Sapien e 36 próteses Acurate. Houve uma redução significativa nos gradientes transvalvares nos dois grupos. O sucesso do procedimento foi semelhante em ambos os grupos (90,0% vs. 93,4%; p = 0,57). No Grupo 1, todos os casos foram realizados pelo acesso femoral, enquanto que, no Grupo 2, utilizaram‐se os acessos femoral (86,8%), transaórtico (6,6%), transapical (5,3%), artéria subclávia (0,7%) e artéria ilíaca (0,7%) (tabela 3).
Dados do procedimento
| Grupo 1 n = 20 | Grupo 2 n = 152 | Valor de p | |
|---|---|---|---|
| Acesso vascular, n (%) | 0,56 | ||
| Femoral | 20 (100) | 132 (86,8) | |
| Transaórtico | 0 | 10 (6,6) | |
| Transpical | 0 | 8 (5,3) | |
| Subclávia | 0 | 1 (0,7) | |
| Ilíaca | 0 | 1 (0,7) | |
| Tipo de prótese, n (%) | 0,39 | ||
| CoreValve® | 12 (60,0) | 72 (47,4) | |
| Sapien | 6 (30,0) | 46 (30,3) | |
| Acurate | 2 (10,0) | 34 (22,4) | |
| Gradiente sistólico médio préa, mmHg | 44,7 ± 21,0 | 69,9 ± 29,4 | 0,003 |
| Gradiente sistólico médio pósa, mmHg | 4,7 ± 6,2 | 3,9 ± 6,2 | 0,40 |
| Sucesso do dispositivo, n (%) | 18 (90,0) | 144 (94,7) | 0,57 |
| Sucesso clínico, n (%) | 18 (90,0) | 143 (93,4) | 0,40 |
| Regurgitação aórtica pós, n (%) | 0,16 | ||
| Ausente/mínima | 8 (40,0) | 80 (52,6) | |
| Discreta | 7 (35,0) | 66 (43,4) | |
| Moderada | 5 (25,0) | 6 (3,9) |
Grupo 1: fração de ejeção do ventrículo esquerdo ≤ 40%; Grupo 2: fração de ejeção do ventrículo esquerdo > 40%.
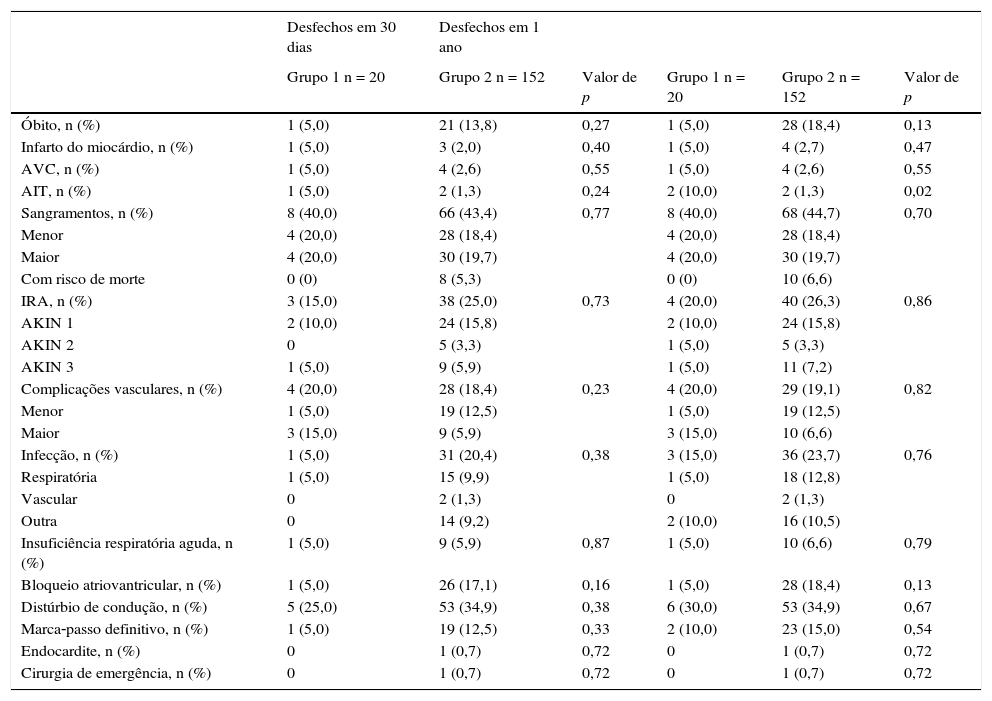
Aos 30 dias e 1 ano, as taxas globais acumuladas de mortalidade foram de 12,8 e 16,9%, respectivamente; as de acidente vascular cerebral foram de 2,9 e 2,9%; as de complicações vasculares maiores de 7,0 e 7,6%; e as de sangramentos maiores ou com risco de óbito foram de 24,4 e 25,6%, não mostrando diferenças entre os dois grupos. Os desfechos de cirurgia de emergência, insuficiência renal aguda, insuficiência respiratória aguda, bloqueio atrioventricular, distúrbios de condução, marca‐passo definitivo, infecções e endocardite, em 30 dias e 1 ano, também foram semelhantes entre os grupos (tabela 4).
Desfechos acumulados em 30 dias e 1 ano após o procedimento
| Desfechos em 30 dias | Desfechos em 1 ano | |||||
|---|---|---|---|---|---|---|
| Grupo 1 n = 20 | Grupo 2 n = 152 | Valor de p | Grupo 1 n = 20 | Grupo 2 n = 152 | Valor de p | |
| Óbito, n (%) | 1 (5,0) | 21 (13,8) | 0,27 | 1 (5,0) | 28 (18,4) | 0,13 |
| Infarto do miocárdio, n (%) | 1 (5,0) | 3 (2,0) | 0,40 | 1 (5,0) | 4 (2,7) | 0,47 |
| AVC, n (%) | 1 (5,0) | 4 (2,6) | 0,55 | 1 (5,0) | 4 (2,6) | 0,55 |
| AIT, n (%) | 1 (5,0) | 2 (1,3) | 0,24 | 2 (10,0) | 2 (1,3) | 0,02 |
| Sangramentos, n (%) | 8 (40,0) | 66 (43,4) | 0,77 | 8 (40,0) | 68 (44,7) | 0,70 |
| Menor | 4 (20,0) | 28 (18,4) | 4 (20,0) | 28 (18,4) | ||
| Maior | 4 (20,0) | 30 (19,7) | 4 (20,0) | 30 (19,7) | ||
| Com risco de morte | 0 (0) | 8 (5,3) | 0 (0) | 10 (6,6) | ||
| IRA, n (%) | 3 (15,0) | 38 (25,0) | 0,73 | 4 (20,0) | 40 (26,3) | 0,86 |
| AKIN 1 | 2 (10,0) | 24 (15,8) | 2 (10,0) | 24 (15,8) | ||
| AKIN 2 | 0 | 5 (3,3) | 1 (5,0) | 5 (3,3) | ||
| AKIN 3 | 1 (5,0) | 9 (5,9) | 1 (5,0) | 11 (7,2) | ||
| Complicações vasculares, n (%) | 4 (20,0) | 28 (18,4) | 0,23 | 4 (20,0) | 29 (19,1) | 0,82 |
| Menor | 1 (5,0) | 19 (12,5) | 1 (5,0) | 19 (12,5) | ||
| Maior | 3 (15,0) | 9 (5,9) | 3 (15,0) | 10 (6,6) | ||
| Infecção, n (%) | 1 (5,0) | 31 (20,4) | 0,38 | 3 (15,0) | 36 (23,7) | 0,76 |
| Respiratória | 1 (5,0) | 15 (9,9) | 1 (5,0) | 18 (12,8) | ||
| Vascular | 0 | 2 (1,3) | 0 | 2 (1,3) | ||
| Outra | 0 | 14 (9,2) | 2 (10,0) | 16 (10,5) | ||
| Insuficiência respiratória aguda, n (%) | 1 (5,0) | 9 (5,9) | 0,87 | 1 (5,0) | 10 (6,6) | 0,79 |
| Bloqueio atriovantricular, n (%) | 1 (5,0) | 26 (17,1) | 0,16 | 1 (5,0) | 28 (18,4) | 0,13 |
| Distúrbio de condução, n (%) | 5 (25,0) | 53 (34,9) | 0,38 | 6 (30,0) | 53 (34,9) | 0,67 |
| Marca‐passo definitivo, n (%) | 1 (5,0) | 19 (12,5) | 0,33 | 2 (10,0) | 23 (15,0) | 0,54 |
| Endocardite, n (%) | 0 | 1 (0,7) | 0,72 | 0 | 1 (0,7) | 0,72 |
| Cirurgia de emergência, n (%) | 0 | 1 (0,7) | 0,72 | 0 | 1 (0,7) | 0,72 |
AVC: acidente vascular cerebral; AIT: acidente isquêmico transitório; IRA: insuficiência renal aguda; AKIN: Acute Kidney Injury Network.
A FEVE do Grupo 1 melhorou significativamente, passando de 31,5% pré‐procedimento para 35,8; 41,8 e 45,1%, em 1, 6 e 12 meses, respectivamente (p = 0,002) (fig. 1).
DiscussãoNosso estudo mostrou que a disfunção ventricular esquerda não teve efeito significativo no sucesso do procedimento e nem nos desfechos de 30 dias e 1 ano pós‐TAVI. Dados de um registro canadense (n = 339) também não conseguiram demonstrar um impacto adverso da disfunção ventricular esquerda nos resultados clínicos de curto e longo prazos pós‐procedimento.9 Já o registro britânico, com número maior de pacientes (n = 2.535), mostrou que nem a FEVE baixa nem um gradiente baixo afetaram o sucesso da TAVI ou a mortalidade em 30 dias. A sobrevida em longo prazo, no entanto, foi reduzida em pacientes com FEVE baixa e gradiente baixo, mas não naqueles com FEVE baixa e gradiente alto, ou FEVE normal e gradiente paradoxalmente baixo.10 Por outro lado, um registro alemão (n = 1.302) encontrou risco aumentado de óbito aos 30 dias e 1 ano para pacientes com FEVE baixa associada a baixo fluxo e baixo gradiente pós‐TAVI.11
Em nosso estudo, pacientes com FEVE ≤ 40% tiveram resultados favoráveis no curto e médio prazos, o que pode ser reflexo da escolha de pacientes com preservação da reserva cardíaca e consequente recuperação da FEVE pós‐TAVI um efeito que foi relatado previamente.12 De fato, o dado mais relevante deste estudo foi a apreciação da melhora significativa da FEVE, no decorrer de 1 ano. Em publicação recente, foi demonstrado que pacientes com redução importante da função ventricular (FEVE ≤ 30%), submetidos ao TAVI, apresentaram rápida melhora da função ventricular esquerda, bem como melhora da classe funcional.13 Da mesma forma, o estudo de Zhao et al. demonstrou que, após a retirada da obstrução da via de saída do VE, os pacientes submetidos ao TAVI evoluíram com recuperação precoce dos parâmetros que avaliavam as funções sistólica e diastólica do VE, particularmente naqueles com disfunção ventricular esquerda. Dentre os pacientes com FEVE < 50%, a FEVE elevou‐se de 46 ± 5,7% para 57 ± 4,5% (p = 0,02). Observou‐se, também, o melhor desempenho septal, que pode ser crucial para aqueles pacientes com doença arterial coronária, nos quais o septo exerce papel importante na manutenção do volume ejetivo.14
Dados extraídos de estudos com pacientes de população cirúrgica e disfunção de VE (FEVE ≤ 30% ou NYHA III ou IV) demonstram que os fatores preditores de recuperação da função sistólica, definida como ganho de mais de 10% na FEVE no sétimo dia pós‐intervenção, foram o índice cardiotorácico e o gradiente sistólico médio transaórtico, sendo que esse último pode ser considerado indicador indireto de aferição da função ventricular nesses pacientes. De forma complementar, os pacientes com disfunção de VE secundária à valvopatia (afterload mismatch) beneficiaram‐se mais do que aqueles com disfunção miocárdica primária, não relacionada à EAo.15
Estudo publicado em 2012 sugere situação semelhante, em que a função sistólica do VE melhora precocemente após o TAVI, inclusive em pacientes com FEVE preservada. Essa evolução favorável é demonstrada pela ecocardiografia por meio de métodos mais sensíveis, como a análise da deformação miocárdica (strain e speckle tracking). A melhora ocorre de forma predominante nos segmentos basais e mediais do VE.16
Resultados cirúrgicos atuais demonstram que os pacientes com EAo com baixo‐fluxo e baixo‐gradiente apresentam melhor evolução quando submetidos à troca valvar aórtica cirúrgica, em comparação àqueles manejados clinicamente, após adequada seleção. A mortalidade encontrada em série recente foi estimada em 10%, e o prognóstico a longo prazo foi muito melhor naqueles que trocaram a valva aórtica. Nesses pacientes, a estratégia de troca valvar percutânea poderia ter resultados equivalentes, ou até superiores ao evitar a circulação extracorpórea e ventilação prolongada.17 Nesse sentido, Bauer et al. demonstraram que, em comparação ao tratamento cirúrgico, o TAVI apresentou melhor recuperação da FEVE no sétimo dia de pós‐operatório, em pacientes com disfunção ventricular (FEVE < 45%).18 Além da melhora nos parâmetros de função sistólica, também pode ser observada a melhora na função diastólica após TAVI.19
Limitações do estudoPrimeiramente, este estudo reflete a experiência de um número limitado de pacientes tratados em dois centros. Em segundo lugar, a ausência de medidas de volume sistólico, dimensões do VE e impedância da válvula aórtica impediu a categorização dos pacientes com baixo fluxo. Por último, nossos resultados se limitam a relatar seguimento em 30 dias e 1 ano.
ConclusõesO implante transcateter de prótese aórtica mostrou ser efetivo e seguro em pacientes com disfunção ventricular esquerda moderada a grave, o que pode refletir na escolha de pacientes com preservação da reserva cardíaca e recuperação da fração de ejeção pós‐procedimento. Estudos maiores são necessários para confirmação dos resultados encontrados nesse grupo desafiador de pacientes, com estenose aórtica grave e disfunção de ventrículo esquerdo.
Fonte de financiamentoNão há.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A revisão por pares é da responsabilidade Sociedade Brasileira de Hemodinâmica e Cardiologia Intervencionista.