O ecocardiograma transesofágico (ECO‐TE) é o método mais utilizado para guiar o tratamento percutâneo da comunicação interatrial (CIA) e do forame oval (FOP), mas a necessidade de um outro profissional para realizá‐lo e de anestesia geral constituem inconvenientes para seu emprego. O ecocardiograma intracardíaco (ECO‐IC) apresenta‐se como alternativa ao ECO‐TE, pois pode ser realizado pelo próprio operador e demanda apenas anestesia local, com leve ou nenhuma sedação. Nosso objetivo foi relatar a experiência do serviço com a oclusão de CIA/FOP guiada por ECO‐IC.
MétodosO ECO‐IC utiliza cateter de ultrassom, que é introduzido por via venosa em câmaras cardíacas direitas e, por meio de posicionamento variável do transdutor, obtém as imagens adequadas para a intervenção. Foram avaliadas as taxas de sucesso do procedimento e as complicações.
ResultadosDe 2011 a 2015, foram realizados 201 procedimentos guiados pelo ECO‐IC, sendo 139 em pacientes com CIA e 62 com FOP. A maioria dos pacientes era do sexo feminino (64,2%), as idades variaram de 7 a 78 anos (36,6±19,3 anos) e o peso variou de 28 a 92kg (62,5±13,0kg). Foram utilizadas próteses Occlutech Figulla®, e todas as intervenções tiveram sucesso, com tempos de fluoroscopia de 5,7±2,4 minutos e tempo de procedimento de 21,5±6,4 minutos. Dois pacientes (2,0%) apresentaram taquicardia supraventricular transitória e outros dois pacientes evoluíram com fístula arteriovenosa na via de acesso, com resolução espontânea no primeiro mês.
ConclusõesO ECO‐IC forneceu informações anatômicas precisas para guiar o fechamento da CIA/FOP com sucesso e eliminou as principais desvantagens do ECO‐TE.
Transesophageal echocardiography (TEE) is the most widely used method to guide the percutaneous treatment of atrial septal defect (ASD) and patent foramen ovale (PFO), but the necessity of another professional to perform it and the need for general anesthesia are potential disadvantages. Intracardiac echocardiography (ICE) is seen as an alternative to TEE, as it can be performed by the interventionist and requires only local anesthesia with mild or no sedation. The aim of this study was to report our experience with ASD/PFO occlusion guided by ICE.
MethodsThe ICE uses an ultrasound catheter, which is intravenously inserted in the right heart chambers and acquires images for the intervention through variable positioning of the transducer. Success and complication rates of the procedure were evaluated.
ResultsFrom 2011 to 2015, 201 procedures guided by ICE were performed, comprising 139 in patients with ASD and 62 in those with PFO. Most patients were female (64.2%), ages ranged from 7 to 78 years (36.6±19.3 years), and weight ranged from 28 to 92kg (62.5±13.0kg). Occlutech Figulla® prostheses were used and all interventions were successful, with fluoroscopy time of 5.7±2.4minutes and procedure time of 21.5±6.4minutes. Two patients (2.0%) had transient supraventricular tachycardia and two others had arteriovenous fistula at the access site, with spontaneous resolution in the first month of follow‐up.
ConclusionsICE provided accurate anatomical information to guide the closure of the ASD/PFO and successfully eliminated the main drawbacks of TEE.
O fechamento percutâneo dos defeitos septais intracardíacos tem sido realizado com sucesso e baixa morbimortalidade, constituindo procedimento de escolha para o tratamento das comunicações interatriais (CIA) e do forame oval patente (FOP). A obtenção de boas imagens é fundamental e indispensável para a segurança e o sucesso dos procedimentos. Classicamente, o ecocardiograma transesofágico (ECO‐TE) é o método mais utilizado, pois permite, por exemplo, a análise do tamanho e da morfologia da CIA, das bordas do septo, da posição da prótese e de sua relação com as estruturas vizinhas. No entanto, apresenta algumas desvantagens, como necessidade de um profissional exclusivo para sua realização, sedação ou anestesia geral com intubação endotraqueal, além de ser pouco tolerado nos procedimentos demorados. Por sua vez, o ecocardiograma intracardíaco (ECO‐IC) oferece as mesmas segurança e acurácia que o ECO‐TE, mas pode ser realizado apenas com anestesia local, ou leve sedação, e pelo mesmo profissional responsável pela intervenção, o que permite maior liberdade da agenda médica. Este artigo teve por objetivo relatar a experiência do nosso serviço no tratamento dos defeitos interatriais em adultos guiada por ECO‐IC.
MétodosEstudo retrospectivo de pacientes submetidos ao fechamento percutâneo de CIA/FOP guiado por ECO‐IC entre abril de 2011 e janeiro de 2015, por um único operador, em dois hospitais de Belo Horizonte (MG), respeitando‐se os critérios para a indicação dos procedimentos. Todos os pacientes assinaram o Termo de Consentimento Livre e Esclarecido após terem sido informados do procedimento e da técnica utilizada para a realização do ECO‐IC.
Os pacientes foram avaliados com ECO‐TE pré‐intervenção, para confirmar o diagnóstico; definir o tamanho, a localização e o número de defeitos do septo interatrial; e descartar outras anormalidades associadas. Doppler transcraniano, com teste de microbolhas, associado à manobra de Valsava, foi realizado nos pacientes referidos para o fechamento de FOP.
Os procedimentos foram realizados sob sedação leve ou apenas com anestesia local. Cefalotina foi empregada em dose única de 30mg/kg pré‐procedimento. A veia femoral direita foi puncionada abaixo do ligamento inguinal em dois pontos distintos, utilizando‐se agulha convencional para punção vascular, com distância entre as punções em torno de 1 a 2cm. As punções poderiam ser realizadas, se necessário, em veia femoral esquerda ou em ambas as veias femorais. Um dos acessos foi utilizado para a realização do cateterismo cardíaco e para o implante da prótese, e o outro, para a introdução do cateter do ECO‐IC. Após as punções, administrava‐se heparina, na dose de 100 unidades/kg.
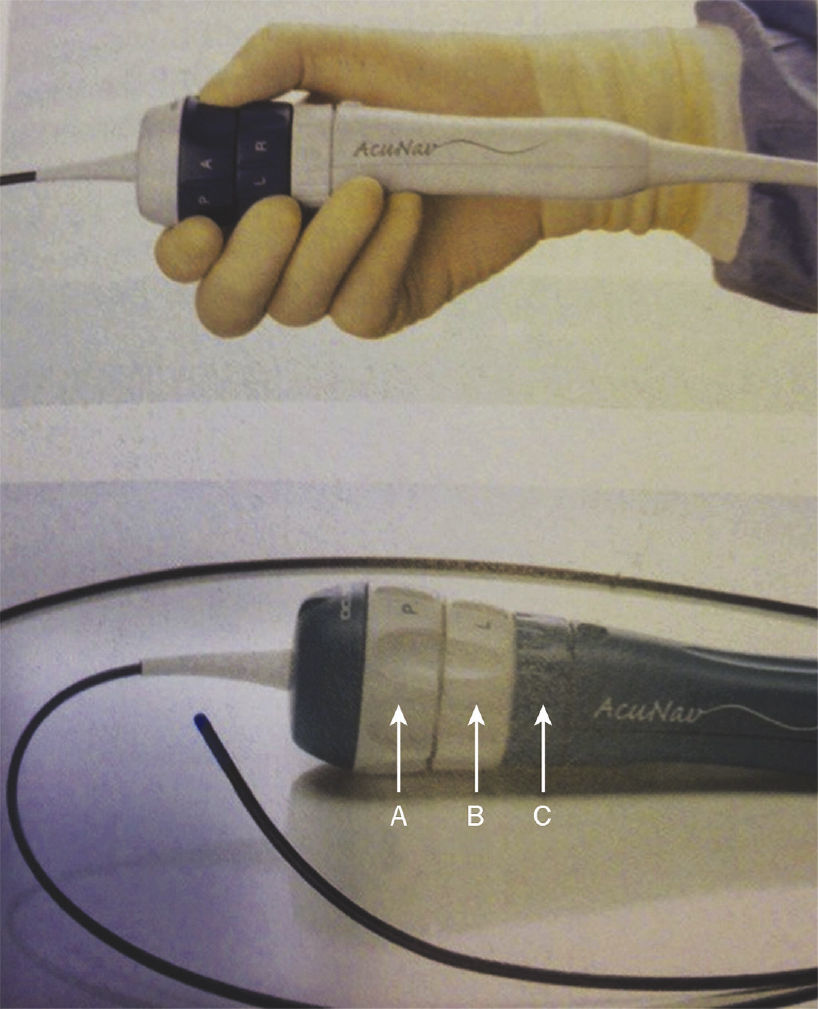
Foi utilizado o sistema AcuNav® (Siemens‐Acuson, Inc., Mountain View, Estados Unidos) (fig. 1). As intervenções foram realizados com introdutor 11 F ou 9 F, quando utilizou‐se a sonda do ECO‐IC 10 F ou 8 F, respectivamente. O outro acesso venoso foi usado para a realização do cateterismo cardíaco e implantes das próteses. A sonda foi introduzida usando‐se um cateter diagnóstico inserido no segundo orifício como guia. Na presença de qualquer resistência, procedeu‐se à injeção manual de contraste na bainha e, quando necessário, foi feita pequena rotação do cateter de ultrassom. O cateter foi avançado suavemente, em posição neutra, até a porção média do átrio direito. Cateteres e introdutores foram lavados com solução de soro fisiológico/heparina, na concentração de 2 unidades/mL.
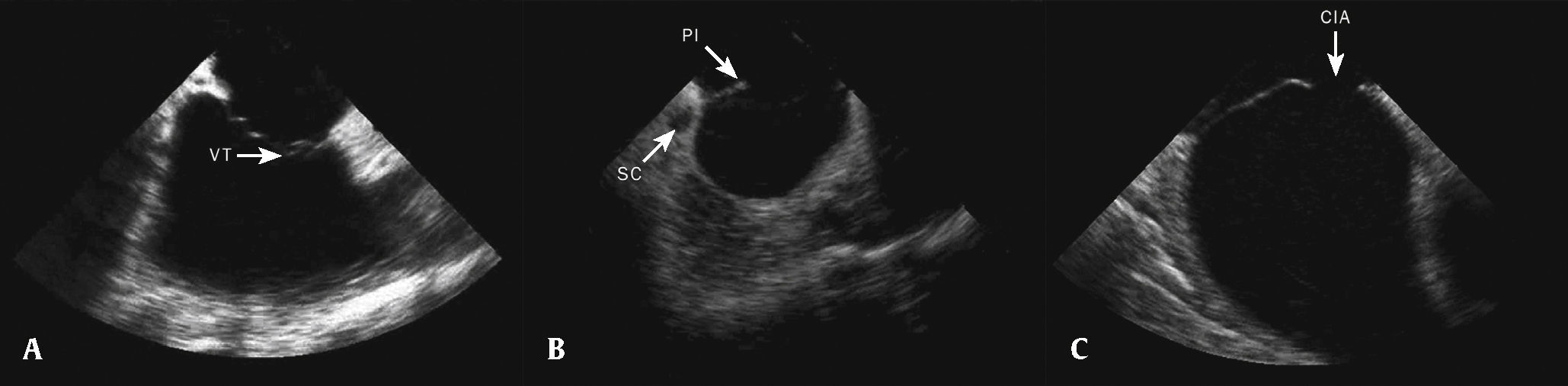
Após a sonda ser posicionada no átrio direito, pequenos ajustes foram realizados, com movimentos cranial ou caudal, até se obter a imagem da valva tricúspide, da via de saída de VD e da aorta longitudinal, a chamada home view, ou corte neutro (fig. 2A). A obtenção dessa imagem é ponto de referência para os outros cortes ecocardiográficos e, se ela não puder ser obtida claramente, são feitos novos ajustes do cateter, com leve rotação horária/anti‐horária, caudal/cranial e, quando necessário, movimentação posterior. Quando ocorria dificuldade para obter outros cortes ou quando se obtinham cortes intermediários não desejados, retornava‐se ao corte inicial, e as manobras eram reiniciadas. Após a visualização da via de entrada e saída do ventrículo direito, realizava‐se rotação horária da sonda, até se obter uma clara imagem do seio coronário, do septo interatrial e, principalmente, da borda posteroinferior (fig. 2B). Prosseguia‐se, então, com a rotação horária do cateter para se obter o eixo curto, com a visualização da aorta em corte transversal e da porção anterior do septo interatrial. A partir desse ponto, acentuava‐se o movimento horário do cateter e, quando necessário, medial/lateral, para se obter a visualização da veia cava superior, do septo interatrial no eixo longo e das veias pulmonares (fig. 2C).
Posicionamento da sonda para a obtenção de imagem das estruturas cardíacas. (A) Corte neutro, com a sonda situada na porção média do átrio direito, mostrando a válva tricúspide (VT) e a via de entrada do ventrículo direito. (B) Rotação horária da sonda para obter imagens do seio coronário (SC), da borda posteroinferior do septo (PI) e da comunicação interatrial (CIA). (C) Corte longitudinal, mostrando a CIA.
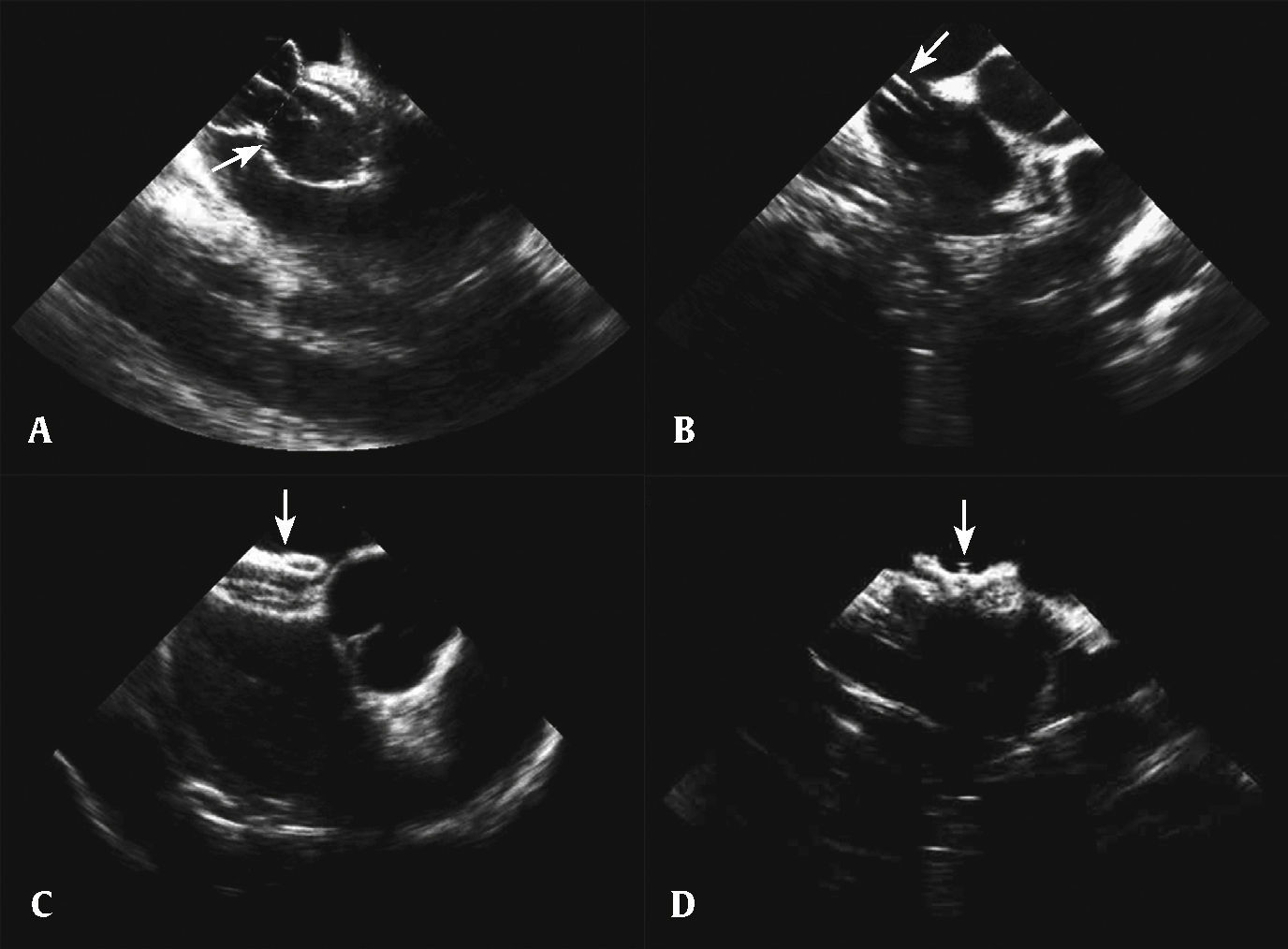
Posteriormente à análise da morfologia e do tamanho do defeito do septo interatrial, de sua relação com as estruturas vizinhas, da função cardíaca e da exclusão de trombo intracardíaco, procedeu‐se às etapas para a oclusão percutânea: medida do diâmetro com balão, introdução da bainha longa, preparação e inserção da prótese e liberação do disco esquerdo, do colo e do disco à direita. Após a certificação de seu bom posicionamento, sem interferência de estruturas vizinhas, a prótese foi liberada (fig. 3). Foram utilizadas próteses Occlutech Figulla® (Oclutech GmbH, Jena, Alemanha). Terminado o procedimento, os introdutores foram retirados e foi feita compressão manual até a cessação do sangramento.
Oclusão percutânea da comunicação interatrial. (A) Visualização do balão para medida do diâmetro distendido da comunicação interatrial. (B) Bainha longa visualizada dentro do átrio esquerdo. (C) Visualização da prótese em eixo curto. (D) Visualização da prótese liberada no corte das cavas.
Os pacientes permaneciam em observação no hospital até o dia seguinte ao procedimento, sendo a deambulação no quarto liberada após 6 horas de sua realização. O exame do local da punção foi realizado antes da alta e 1 semana após o procedimento. Na presença de sopro, solicitava‐se Doppler dos vasos femorais. Eletrocardiograma e ecocardiograma transtorácico foram planejados para 1, 6 e 12 meses após o tratamento percutâneo. Ácido acetilsalicílico 200mg/dia e profilaxia para endocardite foram prescritas por 6 meses.
As variáveis quantitativas e as qualitativas foram descritas, respectivamente, como média e desvio padrão, e frequência absoluta e porcentagem.
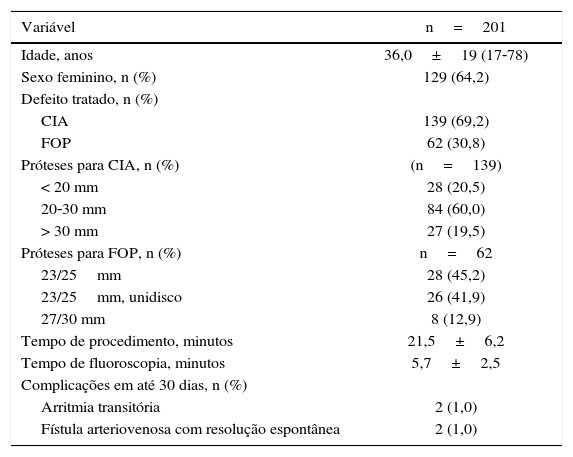
ResultadosForam tratados 201 casos, sendo 139 com CIA e 62 com FOP. A punção da veia femoral direita foi realizada em 196 pacientes (97,5%), em ambas as veias femorais em 4 (2,0%) deles e, em 1 (0,5%) paciente, foi utilizada a veia femoral esquerda. Em todos os casos, foram realizadas punções em dois pontos distintos do mesmo vaso, com exceção daqueles em que ambas as femorais foram abordadas e de dois casos tratados por via femoral direita, tendo sido inseridos dois introdutores em um mesmo orifício (tabela 1).
Dados dos pacientes
| Variável | n=201 |
|---|---|
| Idade, anos | 36,0±19 (17‐78) |
| Sexo feminino, n (%) | 129 (64,2) |
| Defeito tratado, n (%) | |
| CIA | 139 (69,2) |
| FOP | 62 (30,8) |
| Próteses para CIA, n (%) | (n=139) |
| < 20 mm | 28 (20,5) |
| 20‐30 mm | 84 (60,0) |
| > 30 mm | 27 (19,5) |
| Próteses para FOP, n (%) | n=62 |
| 23/25mm | 28 (45,2) |
| 23/25mm, unidisco | 26 (41,9) |
| 27/30 mm | 8 (12,9) |
| Tempo de procedimento, minutos | 21,5±6,2 |
| Tempo de fluoroscopia, minutos | 5,7±2,5 |
| Complicações em até 30 dias, n (%) | |
| Arritmia transitória | 2 (1,0) |
| Fístula arteriovenosa com resolução espontânea | 2 (1,0) |
CIA: comunicação interatrial; FOP: forame oval patente.
Nos 139 casos de fechamento de CIA, foram implantadas 28 (20,5%) próteses menores que 20mm; 84 (60,0%) entre 20 e 30mm; e 27 (19,5%) maiores que 30mm. Nos 62 casos de oclusão de FOP, foram implantadas próteses 23/25mm em 28 pacientes (45,2%), 23/25mm unidisco em 26 (41,9%) e 27/30mm em 8 (12,9%). O sucesso do procedimento foi verificado em todos os casos.
Duas pacientes apresentaram taquicardia supraventricular transitória com resolução espontânea, sendo que, em uma delas, a arritmia foi atribuída à posição da sonda do ECO‐IC. Outros dois pacientes apresentaram sopro contínuo na região da via de acesso, tendo sido diagnosticadas fístulas arteriovenosas pelo Doppler, que ocluíram espontaneamente dentro do primeiro mês após o procedimento.
DiscussãoA oclusão percutânea dos defeitos septais interatriais, sob a visão do ecocardiograma, tem sido realizada com segurança e acurácia. Ela corresponde ao método de escolha para guiar o procedimento na maior parte dos serviços. Ainda que seja o mais usado, devido à qualidade das imagens e à possibilidade de utilização do modo tridimensional, o ECO‐TE apresenta como desvantagens a necessidade de sedação ou anestesia geral para a tolerância da sonda endoesofágica, e a necessidade de outro profissional para sua realização. Por sua vez, o ECO‐IC pode ser realizado pelo próprio operador, apenas com anestesia local ou leve sedação, facilitando o agendamento dos procedimentos.1,2 Ele é realizado de maneira simples e tem curva de aprendizado curta. A técnica consiste em conduzir a sonda por um acesso venoso, sendo a veia femoral a mais utilizada. A utilização do cateter diagnóstico como guia ou para injeção de contraste na parte lateral da bainha permite que a sonda seja conduzida facilmente. Uma vez no átrio direito, as imagens podem ser obtidas de forma clara e segura, por meio da movimentação da sonda, como rotação horária/anti‐horária, anterior/posterior e lateral/medial, além de movimentos cranial e caudal, quando necessários.3,4
Na literatura, publicações mostram a eficácia e a segurança das imagens obtidas pelo ECO‐IC quando comparadas às obtidas pelo ECO‐TE.1,5 Com base em nossa experiência, observa‐se que uma segunda punção venosa apresenta risco pequeno e tempo de compressão manual semelhante ao empregado quando se faz apenas uma punção. Ainda que alguns autores recomendem a realização da sutura “figura de oito”6 para encurtar o tempo de compressão do local da punção, esses resultados não foram reproduzidos em nossos casos.
Há publicações que relatam o emprego do ECO‐IC para intervenções em crianças,7,8 o que pode ser feito com segurança, principalmente naquelas com peso acima de 15kg, por meio da punção das duas veias femorais e da utilização da sonda 8 F. Entretanto, em nossa série, o ECO‐IC não foi utilizado em crianças, uma vez que a necessidade de anestesia geral afastava uma de suas vantagens, preferindo‐se, nesses casos, o ECO‐TE com sonda pediátrica.
Quando iniciamos os procedimentos guiados pelo ECO‐IC, já tínhamos experiência com mais de 600 casos realizados com o ECO‐TE, fato que nos permite analisar criticamente os dois métodos. Verificamos que a qualidade das imagens obtidas pelo ECO‐IC oferece a mesma segurança que o ECO‐TE. De acordo com os resultados deste estudo e de outras publicações, o ECO‐IC é seguro, de fácil execução e eficaz para guiar as intervenções percutâneas em defeitos do septo interatrial.9,10 No entanto, estudos randomizados multicêntricos, que comparem as duas modalidades de imagem, ainda não foram realizados e se fazem necessários para confrontar a acurácia, a reprodutibilidade e os desfechos clínicos.
LimitaçõesUma limitação atual do ECO‐IC é o tamanho considerável dos introdutores (11 e 9 F). Riscos potenciais incluem a formação de fístulas arteriovenosas, ou de sangramentos perivasculares, trombose e embolia, os quais não foram observados neste estudo. Outra limitação esteve relacionada ao alto custo das sondas, que deve ser pesada em relação a procedimentos mais simples, sem a necessidade de anestesia geral. A reesterilização e a reutilização das sondas são permitidas na Alemanha e em outros países do leste europeu, o que contribui para reduzir os custos. Por último, é necessário treinamento suplementar dos intervencionistas, sendo que a curva de aprendizado é mais rápida para aqueles com treinamento prévio em ecocardiografia.
ConclusõesO ecocardiograma intracardíaco forneceu informações anatômicas precisas para guiar o fechamento de defeitos do septo interatrial com sucesso, eliminando as principais desvantagens do ecocardiograma transesofágico e dando ao intervencionista o controle do procedimento, sem necessitar de suporte ecocardiográfico adicional.
Fonte de financiamentoNão há.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A revisão por pares é de responsabilidade da Sociedade Brasileira de Hemodinâmica e Cardiologia Intervencionista.