O implante de stents para manter o ducto arterial patente na cardiopatia congênita cianótica é uma alternativa à cirurgia de Blalock‐Taussig modificada (BTm) em pacientes de alto risco. Descrevemos os resultados imediatos e de médio prazo do implante de stent em neonatos e lactentes com circulação pulmonar ducto‐dependente.
MétodosTrata‐se de estudo descritivo e prospectivo, que incluiu diferentes cardiopatias congênitas cianóticas tratadas entre 2014 e 2015.
ResultadosAvaliamos 14 pacientes, com média de idade de 46 dias e pesando 4,5kg, sendo a atresia pulmonar associada à comunicação interventricular a cardiopatia mais tratada. A abordagem pela artéria femoral ocorreu em 70% dos procedimentos e, nos demais, por via carotídea. Stents de 3,5 12mm foram usados na maioria dos casos, e o sucesso do implante foi obtido em 78% das intervenções (11/14). Os casos de insucesso foram encaminhados para cirurgia uma delas em situação de urgência, que resultou em óbito. Ocorreu espasmo ductal < 48 horas em três pacientes que necessitaram de BTm, com evolução favorável. Complicações após a alta e nos primeiros 30 dias incluíram trombose de stent (2/11), uma delas controlada com redilatação e outra que evoluiu para óbito, e uma morte súbita (1/11). A mortalidade total foi de 21,4% (3/14). A patência do ducto arterial nos primeiros 6 meses foi obtida em 5 casos que foram submetidos à cirurgia paliativa.
ConclusõesA experiência inicial de implante de stent ductal mostrou resultados imediatos favoráveis, e, em médio prazo, mais de um terço dos pacientes com circulação pulmonar ducto‐dependente manteve seus canais patentes.
The implantation of stents to keep the ductus arteriosus patent in cyanotic congenital heart disease is an alternative to the modified Blalock‐Taussig surgery (mBT) in high‐risk patients. This study describes the immediate and medium‐term outcomes of stent implantation in neonates and infants with duct‐dependent pulmonary circulation.
MethodsThis was a descriptive and prospective study including different cyanotic congenital heart diseases treated between 2014 and 2015.
ResultsFourteen patients with a mean age of 46 days, and mean weight of 4.5kg were assessed, and pulmonary artresia with interventricular communication was the most treated condition. The femoral artery approach was used in 70% of procedures; carotid approach was used in the remaining cases. Stents of 3.5 x 12mm were used in most cases, and implant success was achieved in 78% of interventions (11/14). The failed cases were referred to surgery – one of them was an emergency, which resulted in death. Ductal spasm occurred in < 48hours in three patients who required mBT, with favorable outcome. Complications after discharge and within the first 30 days included stent thrombosis (2/11), one of which was controlled with redilation, another progressed to death, and one sudden death (1/11). The overall mortality was 21.4% (3/14). A patent ductus arteriosus in the first 6 months was present in five cases, which underwent palliative surgery.
ConclusionsThe initial experience of ductal stenting showed favorable immediate outcomes, but in the medium term, little more than a third of the cases maintained a patent ductus arteriosus within 6 months.
Os pacientes com cardiopatias congênitas com circulação pulmonar ducto‐dependente exigem tratamento urgente nos primeiros dias de vida, para garantir o fluxo sanguíneo pulmonar antes do fechamento do ducto. A infusão de prostaglandina E1 geralmente é eficaz na manutenção da permeabilidade do ducto arterioso.1 Entre as principais cardiopatias estão a atresia pulmonar com septo íntegro, a tetralogia de Fallot extrema, a atresia tricúspide com atresia pulmonar e a estenose pulmonar crítica, entre outras.
Tradicionalmente, a primeira opção é a cirurgia de Blalock‐Taussig modificada (BTm); no entanto, ela pode ser limitada pela experiência do centro ou por fatores relacionados com o paciente, como doença muito grave ou muito baixo peso ao nascer.2 A cirurgia de BTm consiste em um shunt sistêmico pulmonar e é realizada principalmente como cirurgia paliativa para melhorar o fluxo sanguíneo pulmonar antes da cirurgia definitiva. Apesar de uma experiência de mais de 50 anos com esta cirurgia, ainda há altos índices de morbidade e mortalidade, especialmente em recém‐nascidos e na primeira infância.3,4
Em 1992, Gibbs et al. descreveram pela primeira vez a manutenção da permeabilidade do ducto arterioso com o implante de stent durante cateterismo cardíaco.5 Desde então, o implante de stent tem sido amplamente aceito como alternativa confiável, sendo considerado tão seguro e eficaz quanto a cirurgia de BTm em pacientes de alto risco. Além disso, apresenta outras potenciais vantagens, como reduzir o número de cirurgias paliativas e otimizar o tempo para a correção cirúrgica definitiva.6,7
Apresentamos a experiência inicial com esta técnica em recém‐nascidos e lactentes com cardiopatias cianóticas com circulação pulmonar ducto‐dependente, submetidos a implante de stent ductal como alternativa ao tratamento cirúrgico convencional. Demonstramos os resultados imediatos e em médio prazo, e suas complicações.
MétodosRecém‐nascidos e lactentes portadores de cardiopatias congênitas ducto‐dependentes foram submetidos a procedimento intervencionista de implante de stent ductal de janeiro de 2014 a março de 2015, no Instituto Nacional de Salud del Niño de Lima e no Hospital Nacional Dos de Mayo, Lima, Peru, com prévio consentimento informado.
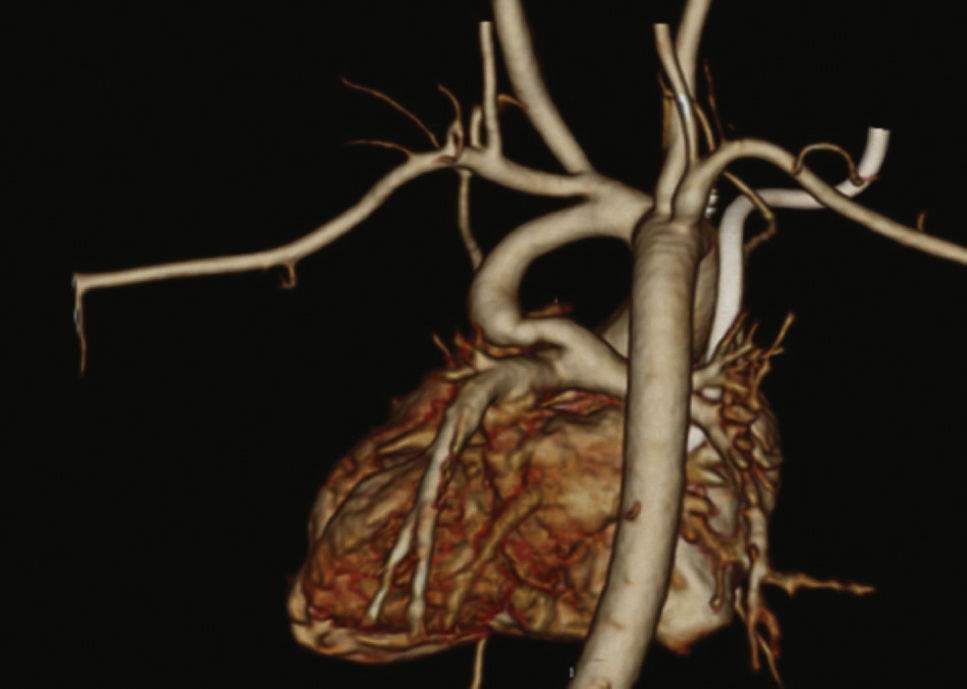
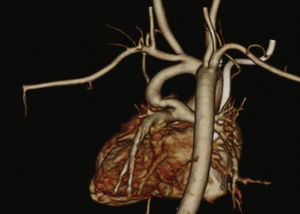
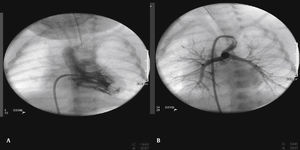
Os pacientes foram selecionados por uma junta médica, apresentando‐se com ecocardiograma e, na maioria dos casos, angiotomografia (fig. 1). Por serem considerados de alto risco cirúrgico, esses pacientes foram encaminhados para intervenção percutânea.
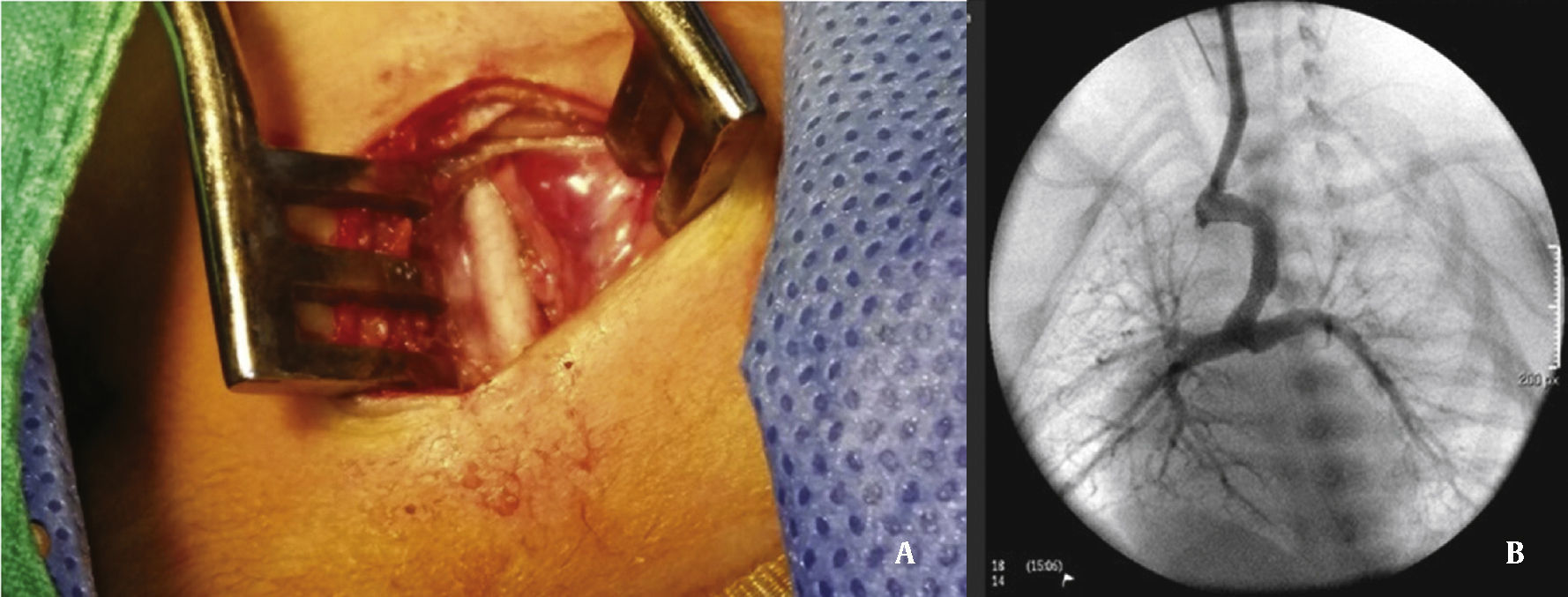
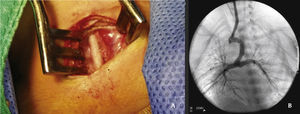
Sob anestesia geral e intubação endotraqueal, a abordagem foi realizada considerando‐se a via mais favorável para acesso ao ducto, de acordo com a origem no arco aórtico ou aorta descendente8 (previamente definido na angiotomografia ou, na sua falta, por ecocardiograma). Um introdutor 5 F foi colocado no acesso femoral (venoso ou arterial) por meio da técnica de Seldinger ou por dissecção‐punção direta, no caso da artéria carótida.
Todos os pacientes iniciaram infusão de prostaglandina E1, e a dose foi gradualmente diminuída ou suspensa no momento em que se conseguiu abordar o ducto e passar a guia pela área mais estreita; isso permitiu uma definição clara da constrição, minimizando o risco de crise hipóxica.
A angiografia foi realizada com cateter pigtail ou, em outras ocasiões, por meio de cateter guia próximo ao ducto.
Cateter guia foi utilizado para abordar o ducto e em seguida atravessar a área mais estreita com guia de angioplastia de 0,014. Foram utilizados stents de 3,0 12mm, 3,5 16mm ou 4,0 12mm.
No início do procedimento, administrou‐se heparina 100 U/kg por via intravenosa e, ao final, iniciou‐se terapia antiplaquetária com ácido acetilsalicílico 5mg/kg e clopidrogrel 2mg/kg.
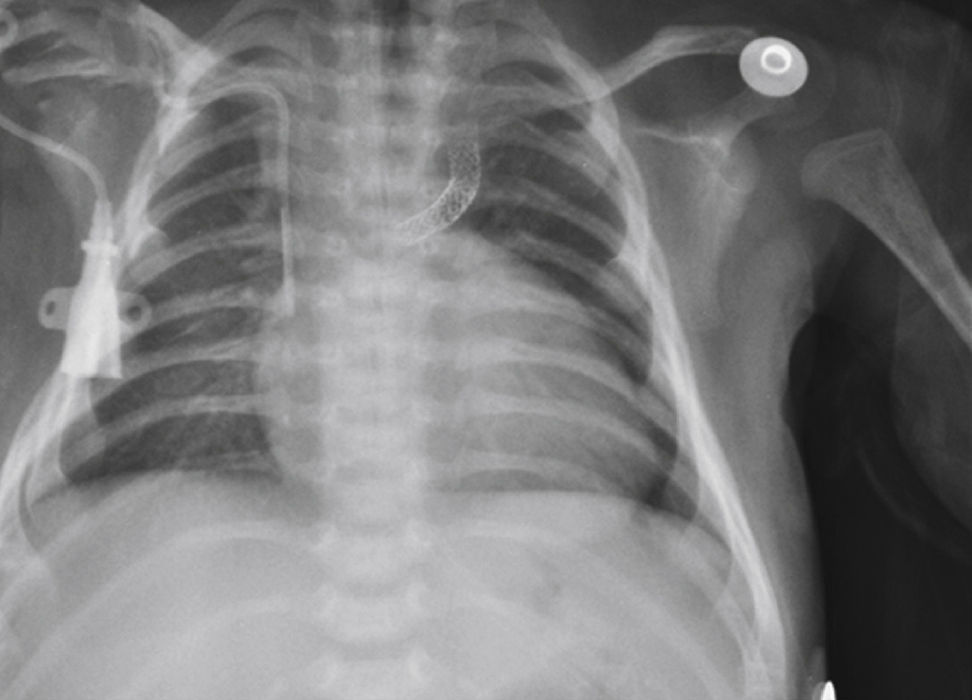
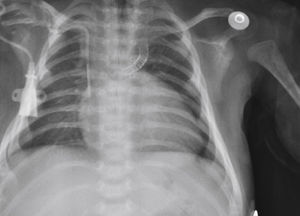
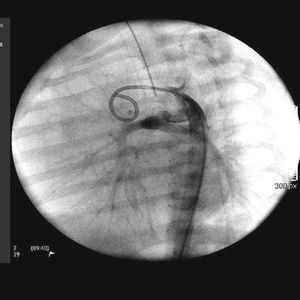
Considerou‐se o implante bem‐sucedido quando a saturação de oxigênio alcançou valores acima de 75% e quando permeabilidade completa do ducto com fluxo adequado até os ramos pulmonares foi obtida. No seguimento clínico, realizou‐se ecocardiograma de controle 24 horas após o procedimento e controles radiológicos, conforme necessário (fig. 2).
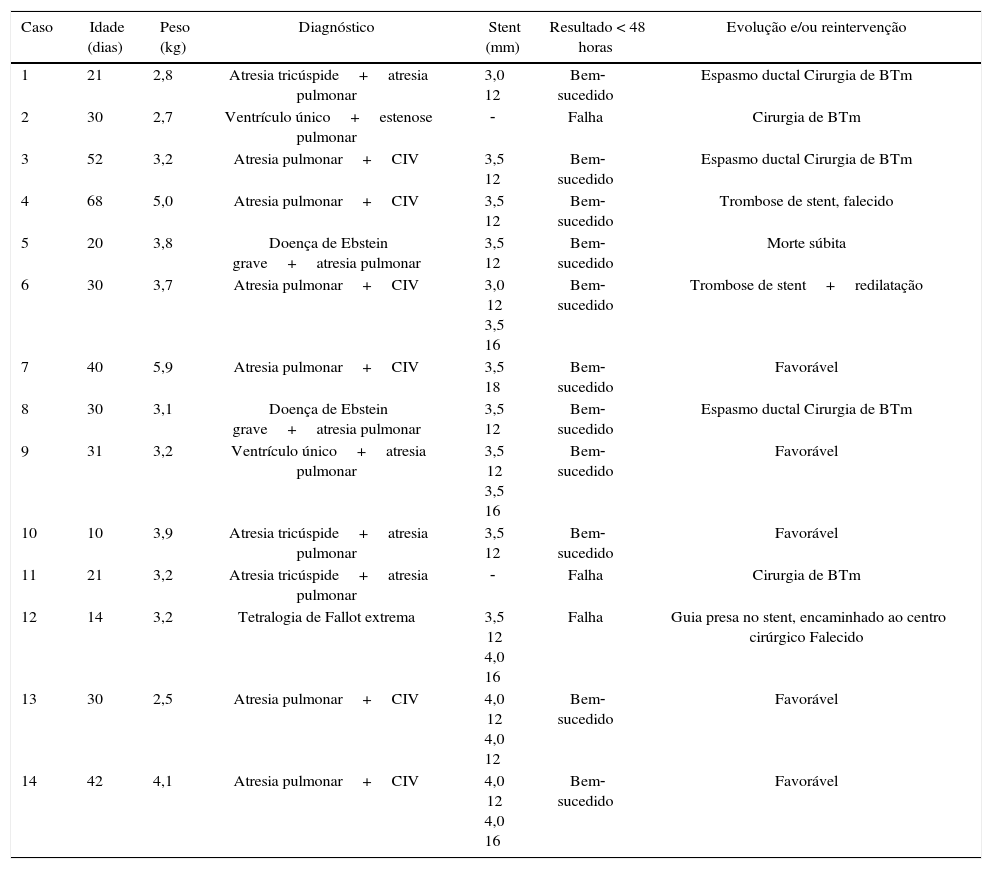
ResultadosForam estudados 14 pacientes portadores de diversas cardiopatias congênitas cianóticas, com idade média de 46 dias de vida (10 e 68 dias) e peso de 4,5kg (2,5 e 5,9kg). Os tipos de cardiopatias foram: atresia tricúspide tipo I‐A (3/14); atresia pulmonar e comunicação interventricular (7/14); doença de Ebstein e atresia pulmonar (2/14); e ventrículo único e atresia pulmonar (2/14) (tabela 1).
Dados clínicos e complicações
| Caso | Idade (dias) | Peso (kg) | Diagnóstico | Stent (mm) | Resultado < 48 horas | Evolução e/ou reintervenção |
|---|---|---|---|---|---|---|
| 1 | 21 | 2,8 | Atresia tricúspide+atresia pulmonar | 3,0 12 | Bem‐sucedido | Espasmo ductal Cirurgia de BTm |
| 2 | 30 | 2,7 | Ventrículo único+estenose pulmonar | ‐ | Falha | Cirurgia de BTm |
| 3 | 52 | 3,2 | Atresia pulmonar+CIV | 3,5 12 | Bem‐sucedido | Espasmo ductal Cirurgia de BTm |
| 4 | 68 | 5,0 | Atresia pulmonar+CIV | 3,5 12 | Bem‐sucedido | Trombose de stent, falecido |
| 5 | 20 | 3,8 | Doença de Ebstein grave+atresia pulmonar | 3,5 12 | Bem‐sucedido | Morte súbita |
| 6 | 30 | 3,7 | Atresia pulmonar+CIV | 3,0 12 3,5 16 | Bem‐sucedido | Trombose de stent+redilatação |
| 7 | 40 | 5,9 | Atresia pulmonar+CIV | 3,5 18 | Bem‐sucedido | Favorável |
| 8 | 30 | 3,1 | Doença de Ebstein grave+atresia pulmonar | 3,5 12 | Bem‐sucedido | Espasmo ductal Cirurgia de BTm |
| 9 | 31 | 3,2 | Ventrículo único+atresia pulmonar | 3,5 12 3,5 16 | Bem‐sucedido | Favorável |
| 10 | 10 | 3,9 | Atresia tricúspide+atresia pulmonar | 3,5 12 | Bem‐sucedido | Favorável |
| 11 | 21 | 3,2 | Atresia tricúspide+atresia pulmonar | ‐ | Falha | Cirurgia de BTm |
| 12 | 14 | 3,2 | Tetralogia de Fallot extrema | 3,5 12 4,0 16 | Falha | Guia presa no stent, encaminhado ao centro cirúrgico Falecido |
| 13 | 30 | 2,5 | Atresia pulmonar+CIV | 4,0 12 4,0 12 | Bem‐sucedido | Favorável |
| 14 | 42 | 4,1 | Atresia pulmonar+CIV | 4,0 12 4,0 16 | Bem‐sucedido | Favorável |
BTm: cirurgia de Blalock‐Taussig modificada; CIV: comunicação interventricular.
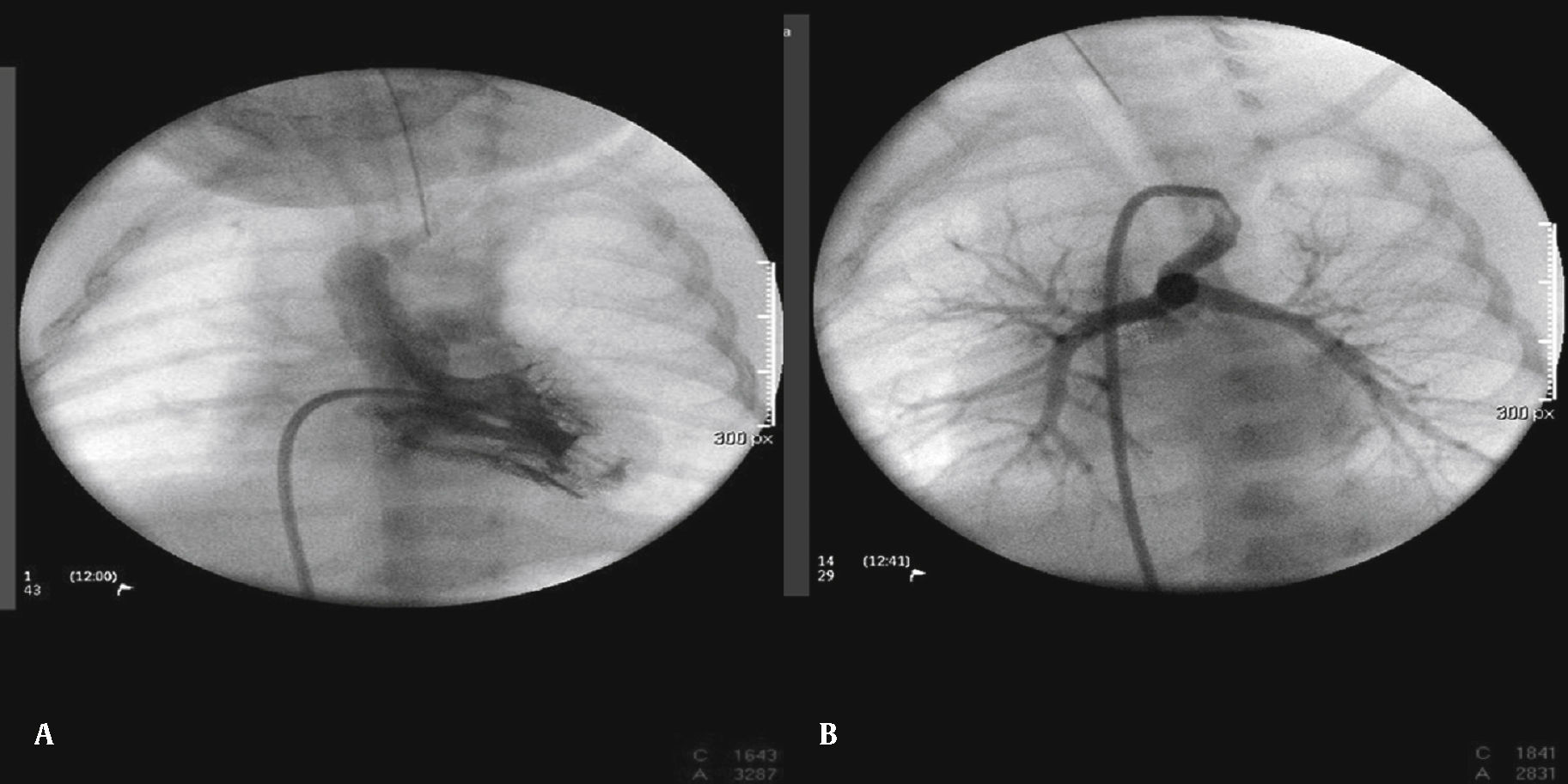
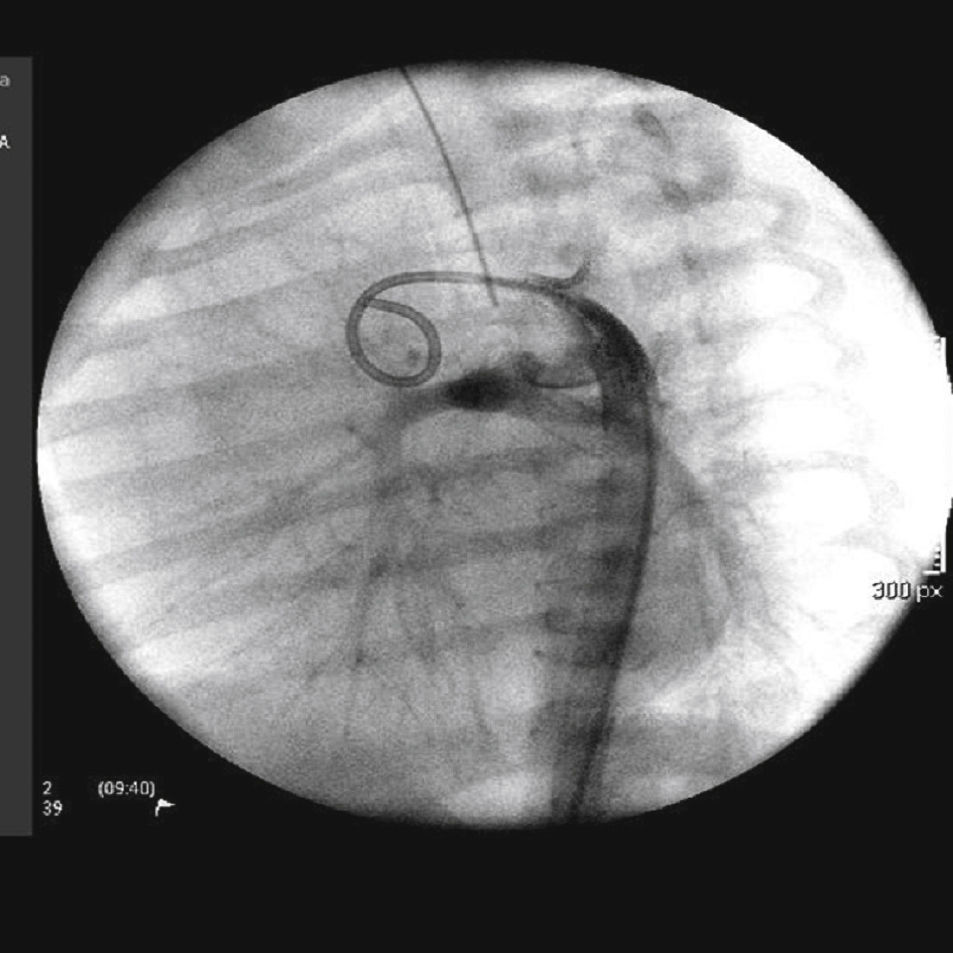
A abordagem foi realizada por via femoral em 71% dos casos (figs. 3 e 4) e, no restante, por via arterial carotídea com apoio de cirurgião cardiovascular (fig. 5).
Foram utilizados acesso anterógrado por veia femoral (5/14), retrógrado por artéria femoral (5/14) e por artéria carotídea (4/14). Em relação ao tipo de ducto, encontramos os tipos: alongado, com origem na aorta descendente; curvado, com origem no arco aórtico; e tortuoso, com origem no arco aórtico vertical.
Os tempos médios do procedimento e de fluoroscopia foram de 95±18 minutos e 36±12 minutos, respectivamente. Foram utilizados stents de 3,5 12mm em 75% dos casos e stents de 3,0 16mm e de 4,0 12mm no restante; dependendo do comprimento do ducto, foram colocados até dois stents por procedimento.
A taxa de sucesso do implante foi de 79% (11/14). Em dois casos não foi possível implantar o stent e foi necessária cirurgia de BTm. No terceiro caso, houve uma complicação maior durante o procedimento, o que exigiu cirurgia de urgência e cujo resultado foi fatal. Com relação a outras complicações relacionadas com o procedimento, houve espasmo ductal antes de 48 horas em três pacientes, que necessitaram de cirurgia de BTm, com evolução favorável.
As complicações extra‐hospitalares nos primeiros 30 dias incluíram trombose do stent, sendo que um paciente melhorou após redilatação do stent e outro faleceu; e houve uma morte súbita. A mortalidade global foi de 21,4% (3/14).
A evolução em médio prazo foi favorável, com presença de ducto patente por mais de 4 a 6 meses em cinco pacientes, que se submeteram à cirurgia paliativa.
DiscussãoEm nossa instituição, a cirurgia paliativa de BTm é realizada rotineiramente há mais de 25 anos; no entanto, como em outros centros, ainda apresenta taxas consideráveis de morbimortalidade devido às possíveis complicações do procedimento, como distorção e estenose da artéria pulmonar, derrame pleural, quilotórax, paralisia do nervo frênico e do vago, e diferença de crescimento das artérias pulmonares, como também ao perfil clínico complexo dos pacientes (hipoxemia grave, baixo peso ao nascimento, prematuridade, entre outros).9
Por outro lado, existem diversas limitações de infraestrutura e recursos humanos insuficientes para atender à demanda crescente de cirurgias cardíacas em pacientes cada vez mais complexos. Nestas circunstâncias, o implante percutâneo de stent ductal possibilita tratar pacientes com cardiopatias cianóticas com fluxo dependente do ducto, estabelecendo‐se como abordagem paliativa alternativa.
O implante de stent ductal e a realização de shunts cirúrgicos são os procedimentos mais realizados em pacientes que não têm outra fonte efetiva arterial pulmonar além do ducto arterioso. A manutenção da permeabilidade do ducto pelo stent é tão efetiva quanto a cirurgia de BTm na promoção do crescimento global da artéria pulmonar nas cardiopatias congênitas ducto‐dependentes.10,11
Neste estudo, nossos resultados imediatos foram favoráveis na maioria dos casos, apesar de serem ductos com anatomia não ideal (70% deles eram ductos grandes e tortuosos). Ao comparar nossa experiência com outras séries,12,13 encontramos semelhanças nas características clínicas dos pacientes em relação aos diagnósticos, idade e peso; a taxa de sucesso do implante foi de 79%, muito próxima das taxas médias relatadas (80 a 100%).
Em relação às complicações relacionadas ao procedimento, em geral são pouco frequentes, e incluem complicações maiores, como migração do stent (relatamos um caso, 9%) e trombose aguda do stent (relatamos dois casos, 18%), semelhantemente a outras séries.14 Além disso, ocorreu insuficiência cardíaca congestiva em quatro pacientes, relacionada a um fluxo pulmonar excessivo, que melhorou com diuréticos e restrição hídrica; e um dos pacientes também apresentou derrame pericárdico moderado. Estas complicações, em geral, não são observadas. Nossa mortalidade imediata foi de 7,1%, em consequência de cirurgia de urgência, devido à complicação técnica, na qual a guia de angioplastia ficou retida sob o segundo stent no nível ductal, com posterior migração do stent para o ramo pulmonar esquerdo.
No entanto, a patência do stent no nosso grupo no médio prazo foi diferente daquele relatado em outros trabalhos. Pouco mais de um terço dos casos manteve seus stents patentes, circunstância associada, em geral, ao uso de stent de 3 e 3,5mm, e à cobertura incompleta do ducto. À medida que o procedimento se consolidou, stents de maior calibre (4mm) foram implantados, múltiplos stents foram utilizados, cobrindo, assim, toda a extensão do ducto, aumentando as chances de manter a patência do stent. Além disso, a abordagem dos últimos casos foi realizada por dissecção e punção direta da artéria carótida, o que possibilita o uso de stent de tamanho maior e facilita a acessibilidade ao ducto.
Encontramos na literatura que as estenoses geralmente se desenvolvem em um período de 6 meses a 1 ano do procedimento.16 Por isso, as intervenções cirúrgicas, como a cirurgia de Glenn para coração univentricular ou a correção total em corações biventriculares, devem ser realizadas assim que possível. Contudo, é possível dilatar o stent com sucesso em alguns desses pacientes, para se ganhar mais tempo antes da cirurgia. Em nossa experiência, um paciente precisou de redilatação do stent e também da colocação de um stent de maior calibre para aumentar o fluxo para os ramos pulmonares e melhorar a saturação de oxigênio.
Nos últimos anos, o implante de stent no ducto arterioso obteve ampla aceitação como alternativa confiável para a cirurgia sistêmico‐pulmonar em pacientes com cardiopatias congênitas cianóticas ducto‐dependentes. Em pacientes de alto risco, esta opção é considerada mais segura e eficaz que a cirurgia paliativa, pois é possível adaptar o stent ao tamanho do paciente e à anatomia pulmonar.17 No entanto, ainda não se avaliou especificamente a capacidade do ducto arterioso patente promover um aumento significativo da artéria pulmonar e ramos. Teoricamente, com o stent adaptado para o tamanho e as angulações da artéria pulmonar, é possível obter uma distribuição uniforme do fluxo sanguíneo pulmonar e, dessa maneira, promover um desenvolvimento vascular uniforme.18 Por enquanto, esta hipótese está sendo avaliada, com poucos dados até agora disponíveis quanto ao crescimento global da árvore vascular pulmonar.
ConclusõesA experiência inicial de implante de stent ductal apresentou resultados imediatos favoráveis e, em médio prazo, mais de um terço dos pacientes com circulação pulmonar ducto‐dependente manteve seus canais patentes.
O resultado ideal requer que o ducto não seja demasiadamente grande nem muito tortuoso, condição encontrada na maioria de nossos pacientes. Acreditamos que, no futuro, ao selecionar melhor os casos (ductos de anatomia mais favorável) e implantar stent de maior calibre (4 a 4,5mm), nossa taxa de sucesso imediato deve melhorar, tornando possível alcançar maior patência e otimizar os resultados em benefício dos pacientes.
Fonte de financiamentoNão há.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A revisão por pares é de responsabilidade da Sociedade Brasileira de Hemodinâmica e Cardiologia Intervencionista.