Introducción
La periodontitis es una enfermedad inflamatoria iniciada por la acción de microorganismos presentes en el biofilm dentogingival y que lleva a la destrucción del aparato de inserción periodontal1. Uno de los principales factores de riesgo para el desarrollo de periodontitis es el hábito de fumar2-4.
El tabaquismo no solo incrementa el riesgo de desarrollo de periodontitis, sino que también afecta de manera muy significativa a la respuesta a la terapia periodontal tanto quirúrgica como no quirúrgica5,6.
El consumo de tabaco es el principal factor de riesgo prevenible de múltiples enfermedades y muertes en el mundo actual. Representa uno de los mayores problemas para la salud pública debido a un alto costo social y económico para el país y su población. El tabaquismo está relacionado con cerca de 6 millones de muertes anuales6.
En una perspectiva, para el año 2030 fallecerán cerca de 8 millones de personas por año a causa del cigarro, preferentemente en países de bajo y mediano desarrollo6.
En el siglo XXI habrán fallecido cerca de un billón de personas asociadas a este hábito en todo el mundo6.
El tabaquismo guarda relación con más de 25 enfermedades tales como cáncer de lengua, labio, faringe, esófago, laringe, tráquea, bronquios, páncreas, vejiga, riñón, enfermedades cerebrovasculares, enfermedades hipertensivas, enfermedad isquémica, bronquitis crónica y aguda, síndrome de dificultad respiratoria, etc.6.
La evidencia científica indica que 1 de cada 2 fumadores que se mantienen fumando va a morir de alguna enfermedad relacionada con este factor de riesgo y que su expectativa de vida se reduce alrededor de 13 a 15 años7,8.
La situación en Chile no se aleja de esta realidad, según datos del Ministerio de Salud (Consejo Nacional de Acreditación de la Ciencia Económica, 2004); la prevalencia de tabaquismo en la población de entre 12 y 64 años es del 42,5%, distribuyéndose en 40,4% para las mujeres y 44,8% para los hombres, con un consumo promedio de 6-7 cigarrillos/día, siendo la población mayor de 45 años la que presenta un mayor consumo promedio alcanzando los 9 cigarrillos/día.
Si lo comparamos con Dinamarca, según el reporte global de la Organización Mundial de Salud tienen un 26% de fumadores en su último estudio entregado el 20106. Si vemos las cifras del Congo, según el mismo informe, presentan un 6,6% de fumadores respecto a su población6. En la presente revisión bibliográfica se resume la evidencia científica que demuestra el efecto del tabaquismo sobre los tejidos periodontales.
Material y método
Se realizó una búsqueda en la base de datos MEDLINE y SciELO desde el año 1960 hasta febrero de 2013. Se complementó con una búsqueda manual en las revistas Journal of Periodontal Research, Periodontology 2000 y Journal of Clinical Periodontology, y en las referencias de los artículos seleccionados para esta revisión narrativa.
La estrategia de búsqueda fue la siguiente:
(smok*[TIAB] OR "tobacco"[TIAB] OR "cigarette"[TIAB]) AND ("periodontal disease"[TIAB] OR "periodontitis"[MeSH Terms] OR "gingivitis"[MeSH Terms] )
Se buscaron artículos que estuvieran publicados en revistas científicas, pudiendo ser ensayos clínicos, revisiones o revisiones sistemáticas.
Se incluyeron aquellos artículos que trataran sobre el efecto del cigarrillo en el ámbito molecular o celular del tejido periodontal, su efecto sobre la respuesta inflamatoria, la pérdida de tejido de soporte periodontal, su efecto en la terapia periodontal y la microbiota gingival como también su efecto en pacientes diabéticos. Se excluyeron aquellos artículos que discutieran el efecto del cigarrillo en el ámbito sistémico, sobre el embarazo o en pacientes inmunosuprimidos.
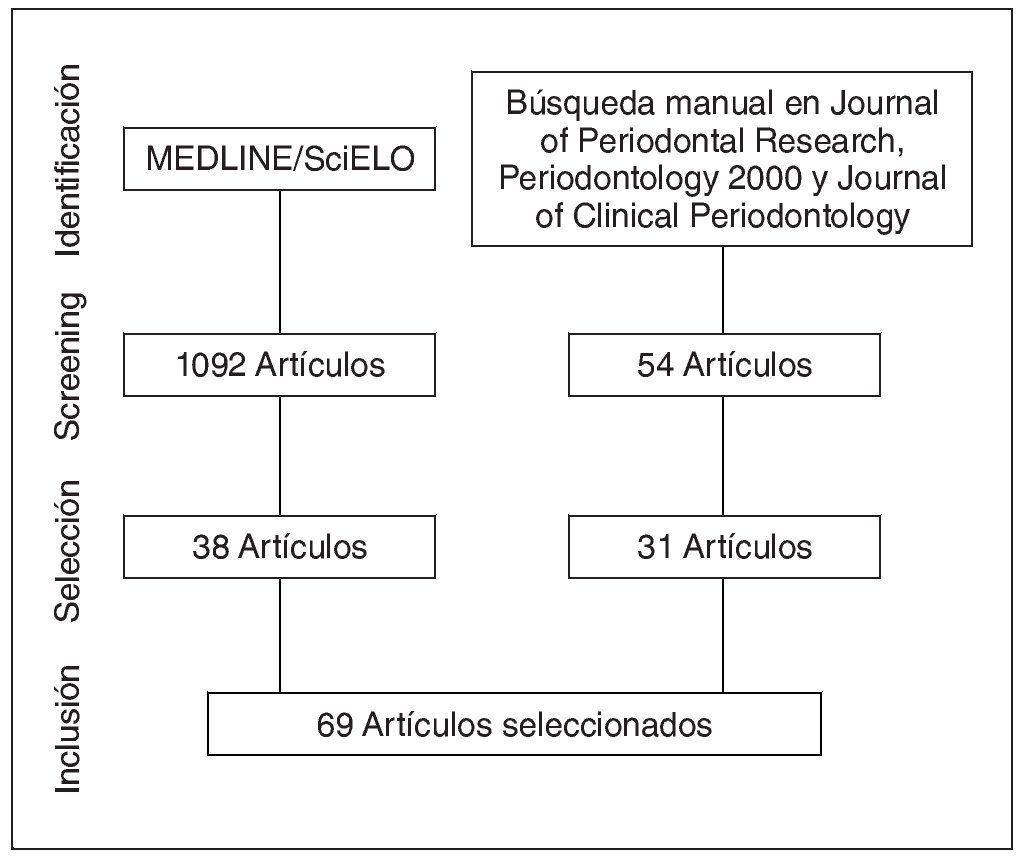
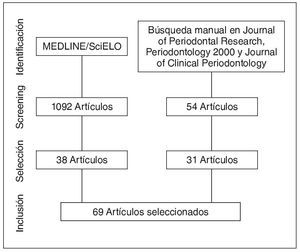
Mediante la búsqueda en MEDLINE y SciELO se encontraron 1.902 artículos, de los cuales se utilizaron 38. Mediante la búsqueda manual en revistas y referencias se añadieron 31 artículos. El proceso de selección y exclusión de artículos se resume en la figura 1. Un total de 69 artículos fueron incluidos.
Figura 1. Flujograma de selección de estudios.
Humo de cigarro
El humo de cigarrillo es una compleja mezcla de cerca de 4.000 componentes con propiedades citotóxicas, mutagénicas y carcinogénicas dentro de los cuales se encuentran acetaldehído y acroleína (irritantes de la vía aérea), naftamalina, pireno, cadmio, benzopireno, dibenzacridina, uretano y toluidina (sustancias cancerígenas) y muchas otras sustancias tóxicas para el organismo, siendo de las más estudiadas la nicotina, debido a su relación con la adicción de los pacientes9.
La inhalación pasiva o activa produce una disolución de los productos de la combustión en el epitelio oral y la vía aérea. Estos productos de combustión pueden dividirse en gaseosos y particulados, siendo este último tipo de partícula la que concentra la mayor toxicidad10.
El humo de cigarro como tal daña directamente las células epiteliales orales induciendo producción de quimiocinas y liberación de mediadores inflamatorios11.
Palmer ha concluido que los efectos deletéreos del tabaco en el ámbito sistémico son por exposición y absorción en los pulmones, más que por la absorción en la cavidad oral12.
Efecto sobre los tejidos periodontales
Una de las primeras alteraciones periodontales es la recesión gingival y la hiperplasia epitelial. Entre el 25-30% de los fumadores presenta recesión gingival. Por otro lado, en fumadores se han detectado niveles altos de mediadores inflamatorios como interleucina-1 y prostaglandina E2 que pueden inducir leucoplasias, llamada hiperplasia gingival13.
Cuando el individuo cesa de fumar, la mayoría de las zonas con estas lesiones blancas de la mucosa tienden a revertirse. Estudios en militares indican que este tipo de lesiones producidas por tabaco se revierten en 6 semanas en el 97% de los fumadores13.
Por otro lado, la recesión gingival se asocia al proceso de vasoconstricción14. Estudios cuya metodología ha utilizado flujometría por láser doppler han concluido que tras el consumo de cigarrillos se disminuye un 25% el flujo de sangre, pero que luego de 5 minutos se restablece a niveles normales. Otros estudios de Morozumi et al. han demostrado que pacientes que dejan de fumar, a las 4-8 semanas aumenta progresivamente el flujo de sangre, lo que podría estar relacionado con que la encía puede recuperar parcialmente su estado, al menos en el período de estudio15.
Bergström comparó los vasos sanguíneos entre pacientes no fumadores y fumadores concluyendo que en los fumadores había menos vasos visibles16. Adicionalmente, Mirhod et al. concluyeron que la densidad era similar, pero que la proporción de los vasos era más pequeña en los fumadores17.
Resultados del United States National Health and Nutrition Examination Survey demuestran después de ajustar por edad, género, raza, educación e ingresos, que los pacientes fumadores tienen 4 veces más riesgo de desarrollar periodontitis que los no fumadores, mientras que los pacientes que son exfumadores presentan 1,68 más riesgo de desarrollar la misma enfermedad periodontal18.
Con respecto al nivel de inserción clínico (NIC), los pacientes fumadores ligeros (≤ 10 cigarrillos/día) tienen 2,05 más riesgo de perder NIC, mientras que los fumadores pesados (≥ 10 cigarrillos/día) presentan 4,75 veces más riesgo que los individuos no fumadores19.
Este mismo estudio de Grossi el al. examinó la perdida de tejido óseo en 1.361 pacientes. El riesgo de pérdida ósea en los pacientes fumadores ligeros fue de 3,25, mientras que en los fumadores pesados fue de 7,28 veces mayor que los individuos no fumadores19.
Finalmente, se concluyó que existe una fuerte relación dosis respuesta entre el tabaquismo y la perdida ósea de los pacientes20.
Los pacientes fumadores tienen mayor prevalencia de compromisos de furcación identificada mediante radiografías21, y clínicamente presentan mayor severidad de la enfermedad que los pacientes no fumadores22.
Otro estudio encontró que los fumadores tenían de entre 2 a 4 veces más molares con compromiso de furcación23.
Con respecto a la pérdida dentaria, los pacientes que fuman pipa tienen un riesgo 1,6 veces mayor que los no fumadores, mientras que los que fuman cigarrillos tienen 1,3 veces más riesgo de perder dientes24.
Se encontró que lo fumadores también tenían mayor cantidad de recesiones y adicionalmente sacos periodontales mas profundos comparado con los pacientes no fumadores25, además de tener mayor reabsorción ósea alveolar26 y mayor prevalencia de defectos óseos verticales27. La evidencia indica que existe una respuesta inflamatoria diferente entre fumadores que presentan una evidente apariencia clínica fibrótica de los tejidos y menor cantidad de sitios con sangramiento al sondaje28.
Resultados del United States National Health and Nutrition Examination Survey indican que los pacientes no fumadores pero que están sometidos a un ambiente con humo de cigarro, llamados fumadores pasivos, presentan inmediatamente efectos cardiovasculares y tienen 1,6 veces más riesgo de desarrollar periodontitis respecto a los que no estan expuestos al ambiente con humo. Al asociar variables como paciente diabético y fumadores pesados mayores de 45 años, los pacientes poseían 31 veces más riesgo de tener pérdida de inserción periodontal, señalando que estas variables combinadas se comportan de manera sinérgica19.
El tabaquismo produce un efecto de enmascaramiento de los signos clínicos de inflamación, lo que influye en la detección de la enfermedad y posterior derivación a especialista29.
Efecto sobre la terapia periodontal
Algunas investigaciones han propuesto que el cigarrillo influye negativamente en el proceso de cicatrización después de terapias quirúrgicas y no quirúrgicas. Adicionalmente, los resultados clínicos han sido menores en paciente fumadores después del pulido y alisado radicular, terapia adjunta antimicrobiana, cirugías periodontales y terapia de mantención periodontal30-32.
Estudios de Ah et al. demuestran la influencia negativa del tabaquismo sobre la terapia periodontal quirúrgica, puesto que los sitios enfermos de pacientes fumadores que recibieron cirugías óseas periodontales o pulido y alisado radicular con colgajos de acceso demostraron en la profundidad de sondaje un 50% menos de reducción (aproximadamente -0,5 mm) respecto de los pacientes no fumadores33.
En la revisión sistemática de Labriola et al., se ha evaluado el impacto del tabaquismo sobre la terapia periodontal no quirúrgica y se ha encontrado que en sitios con profundidad de ≥ 5mm, la reducción de profundidad al sondaje fue 0,4 mm menor en pacientes fumadores, lo que se concluyó a partir de 8 estudios clínicos34.
Los cambios sobre el NIC al revisar 6 estudios reportaron una ganancia de NIC favorable a los pacientes no fumadores (0,116 mm), aunque la diferencia entre los pacientes fumadores y no fumadores no fue estadísticamente significativa34.
Hay investigaciones que indican que el hábito de fumar influye negativamente en procedimientos de cirugía de cobertura radicular medido en cambios como NIC y ubicación del margen gingival al final del procedimiento35.
Adicionalmente, en el estudio de Silva et al., señalan que los pacientes fumadores intervenidos con cirugías de injertos gingivales libres tenían un retraso en la repitealización y un menor sangrado en el sitio dador. De forma paralela, se observó una mayor contracción del injerto gingival libre en el sitio receptor, siendo este último no estadísticamente significativo36.
Investigaciones de Patel et al. concluyen que los pacientes fumadores presentan menor ganancia ósea periodontal posterior a tratamientos de regeneración de defectos intraóseos37.
En pacientes no fumadores se ha encontrado que posterior a la terapia periodontal presentan 0,9 mm mayor reducción de profundidad al sondaje y 0,6 mm mayor ganancia de inserción clínica que los pacientes fumadores en sitios ≥ 5 mm38.
Varios estudios han demostrado que hasta el 90% de los pacientes fumadores presenta sitios refractarios a la terapia periodontal39-41.
Con respecto a la fase de mantención periodontal, se ha encontrado que los factores pronósticos de mayor influencia en pérdida dental y pérdida de inserción son el hábito tabáquico de manera dosis-dependiente, mala higiene, compromisos de furcación y cumplimiento de las fases de mantención. Por lo que se sugiere, considerando que los fumadores tienen más riesgo de tener sitios refractarios a la terapia periodontal, que sean vistos con mayor regularidad que un paciente no fumador42.
Efectos del tabaquismo en el ámbito celular y molecular
Estudios de Yiyn et al. han demostrado en cultivos de fibroblastos de ligamento periodontal que las células control cubrieron la herida en un 19% las primeras 48 h, mientras que las células tratadas con nicotina lo hicieron un 10%, y esto se mantuvo en todos los tiempos de examinación (12, 24, 36, 48 h)43.
Investigaciones de Wong y Martins indican que la nicotina disminuye la migración celular de fibroblastos gingivales humanos en un 50% en condiciones libres de suero. También se han propuesto modelos de estudios in vitro de administración de humo de cigarrillo en una herida periodontal en ausencia de placa bacteriana y se ha concluido que el humo por sí solo retarda el proceso de cicatrización y lo merma en calidad en términos de relleno óseo, densidad ósea y nuevo hueso formado44.
En el ámbito epitelial se produce una lesión hiperplásica debido a la liberación aumentada de prostaglandina E2 y citocinas proinflamatorias como la IL-113.
En el ámbito vascular produce una retraso en la revascularización de las tejidos tanto blandos como duros45.
Los neutrófilos son la primera línea de defensa contra la invasión bacteriana. A pesar de que en fumadores se pueden encontrar mayores niveles de neutrófilos en la circulación periférica, su función está alterada46,47.
En pacientes fumadores los neutrófilos muestran una disminución en la quimiotaxis, fagocitosis y adherencia a las superficies tisulares47-49.
La estimulación del humo del tabaco sobre neutrófilos puede causar un aumento en el estallido oxidativo, que está relacionado con la destrucción directa del tejido periodontal50.
El tabaquismo produce una menor capacidad proliferativa de linfocitos Th2, además de una menor producción de anticuerpo inmunoglobulina G contra algunos patógenos periodontales51.
Muchos de los componentes del humo de cigarrillo son tóxicos para las células. Algunas investigaciones han demostrado que superficies de raíces tratadas con nicotina afectan a la adherencia de los fibroblastos52.
Se ha descrito que el humo de cigarro suprime la síntesis de betadefensina 2, un péptido antimicrobiano endógeno producido por las células del epitelio gingival53.
Se sugiere que componentes volátiles como la acroleína y el acetaldehído afectan a la proliferación y la adherencia de los fibroblastos a una superficie54.
Los efectos del cigarrillo tienen consecuencias también sobre los macrófagos, que liberan mayores cantidades de interleucina-1 y prostaglandina E2. Se sugiere que la citocina factor de necrosis tumoral a que se encuentra elevada en pacientes fumadores estimularía la adherencia epitelial, producción de especies reactivas de oxígeno y fagocitosis del macrófago55.
Existe evidencia contradictoria respecto a los niveles de citocinas, por lo que es importante considerar los problemas inherentes a los modelos de estudio, en los que se deben evaluar numerosas variables; por ejemplo, el tiempo de consumo de tabaco, el número de cigarrillos/día, la severidad y extensión de la enfermedad, la extracción del humo de cigarrillo (filtrado o no filtrado, solubilización del material filtrado del humo), la exposición nasal/oral al humo de cigarrillo, la toma de muestras a nivel surco gingivodentario/salival/sanguíneo47.
Efecto del tabaco en la microbiota
Investigaciones de Van der Velden et al. indican que los pacientes fumadores presentan características clínicas diferentes en la gingivitis respecto a los no fumadores, y que no existiría relación microbiológica que explique esa manifestación diferente56.
La mayor severidad y prevalencia de periodontitis en los fumadores no es posible de explicar solo por la cantidad de placa bacteriana18.
De hecho, no existe suficiente evidencia que indique diferencias en la cantidad de placa bacteriana entre fumadores y no fumadores, pero sí en la cantidad de depósitos duros a favor de los fumadores57-59.
A favor de lo anterior, Bergström et al. señalan que el tabaco podría afectar a la mineralización del cálculo60.
Autores como Hanioka et al. indican que el tabaco podría alterar la microflora subgingival, debido a que existiría una menor tensión de oxígeno en el saco periodontal que podría favorecer el desarrollo de especies anaeróbicas61.
Renvert et al. señalan que también es más difícil erradicar los patógenos periodontales en los pacientes fumadores, sobre todo Aggregatibacter actinomycetemcomitans31.
Cesar de fumar: sus efectos
Actualmente, se desconoce cuánto tiempo de abstención del hábito es requerido para obtener el beneficio de disminuir las complicaciones posoperatorias62. Sin embargo, un estudio experimental indica que dejar de fumar 4 semanas antes de la cirugía reduciría la frecuencia de infecciones hasta niveles de un paciente no fumador63.
Por lo tanto, de lo anterior es posible interpretar que las intervenciones que fomentan la disminución del hábito por un período de tiempo podrían influir incluso en el cese del hábito tabáquico, beneficiando la salud del paciente64.
Resulta importante destacar que en los estudios donde se realizan intervenciones para cesar el hábito tabáquico, el número de pacientes que renuncian al estudio es mayor mientras más intensa sea la intervención para que dejen de fumar. Según Thomsen et al., en general, las intervenciones intensas que fomentan disminuir el consumo de tabaco dan un beneficio al paciente logrando una razón de riesgo relativo de 0,56 (intervalo de confianza de 0,4-0,78) en las complicaciones posoperatorias65.
Por otro lado, las intervenciones moderadas o poco intensas no darían un beneficio estadísticamente significativo sobre la frecuencia de complicaciones posoperatorias y el cese de fumar. Aun así, estas intervenciones no deberían ser excluidas debido a la gran desviación estándar y baja cantidad de pacientes que existe en aquellos estudios58,59,66-68.
Una reciente publicación señala que los estudiantes de odontología no son motivados ni entrenados en técnicas para enseñar a sus pacientes a dejar el hábito de fumar. Concluye que un programa educativo y motivacional asociado a técnicas docentes para integrar el conocimiento podría tener favorables resultados, logrando hasta un 20% de pacientes que disminuyen el consumo de cigarro o lo dejan definitivamente69.
Conclusión
Con base en la literatura registrada, se concluye que el tabaquismo influye en el ámbito celular, molecular, microbiológico, procedimientos quirúrgicos periodontales, mantención periodontal y la reparación de tejido periodontal posterapia.
Aún se desconoce el mecanismo de acción exacto del tabaco sobre la reparación de tejidos, por lo que deberían desarrollarse líneas de investigación enfocadas en vislumbrar el rol de los componentes del cigarro sobre los tejidos.
Desde el punto de vista clínico, el odontólogo debería influir más en el paciente para que deje el hábito tabáquico, puesto que la relación que se desarrolla en la consulta repercute directamente en los resultados del tratamiento, por lo que deberían conformarse equipos multidiciplinarios que trabajen para lograr que la mayor cantidad de pacientes cesen el hábito.
En el ámbito universitario, deberían desarrollarse cursos para promover el cese de hábitos a través de manuales informativos, técnicas motivacionales y educativas para que desde un nivel de pregrado el alumno sea capaz de cambiar hábitos que perjudican la salud del paciente.
Las investigaciones deberían estar también enfocadas en protocolos y fármacos para ayudar a que los pacientes disminuyan o cesen el hábito del tabaquismo que causa un gasto social incalculable y por el que fallecen millones de personas anualmente.
Recibido el 14 de marzo de 2013
y aceptado el 4 de septiembre de 2013
* Autor para correspondencia.
Correo electrónico:dr.javierrojasc@gmail.com (F. J. Rojas).