El Cryptococcus neoformans es el principal agente causal de infecciones fúngicas invasivas en pacientes con lupus eritematoso sistémico que con frecuencia comprometen el sistema nervioso central y el pulmón. La infección se desarrolla durante los 2 primeros años tras el diagnóstico en pacientes con enfermedad activa, y los principales factores de riesgo son los glucocorticoides, especialmente la dosis acumulada, y la linfopenia. La mortalidad es alta, superior al 50%. Presentamos el caso de un hombre con lupus eritematoso sistémico activo que ingresó por fiebre, artritis, tenosinovitis y púrpura, en quien se documentó infección diseminada por C. neoformans mediante aislamiento inicial en sangre y líquido sinovial. Posteriormente, desarrolló síntomas del sistema nervioso central como cefalea y rigidez de nuca que respondieron al tratamiento de inducción con anfotericina y flucitosina, y las manifestaciones se resolvieron completamente. Aunque la afectación articular y periarticular por C. neoformans es infrecuente, estos son focos para considerar en el abordaje de pacientes con lupus y sospecha de infección fúngica invasiva.
Cryptococcus neoformans is the leading causal agent of invasive fungal infections in patients with systemic lupus erythematosus, frequently compromising the central nervous system and the lung. The infection develops during the first two years after diagnosis in patients with active disease, and the main risk factors are glucocorticoids, especially the cumulative dose, and lymphopenia. Mortality is high, exceeding 50%. We present the case of a man with active systemic lupus erythematosus who was admitted due to fever, arthritis, tenosynovitis, and purpura in whom disseminated C. neoformans infection was documented by initial isolation in blood and synovial fluid. Subsequently, he developed central nervous system symptoms like headache and nuchal rigidity that responded to induction treatment with amphotericin and flucytosine, and the manifestations resolved. Although joint and periarticular involvement by C. neoformans is infrequent, these are foci to consider in the approach to patients with lupus and suspected invasive fungal infection.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune heterogénea con un curso alternante de recaídas-remisión. Aunque los hombres representan una minoría de los casos (4-22%), desarrollan una enfermedad más grave, con mayor frecuencia de compromiso renal, de las serosas e inmunológico1. Los principales factores de riesgo asociados con las recaídas del LES son las infecciones (OR 31,3) y la suspensión de la terapia de mantenimiento (OR 10,4)2. Las infecciones son responsables del 20-55% de su mortalidad, principalmente durante el primer año de la enfermedad. Si bien los hongos son un agente etiológico inusual, las infecciones fúngicas tienen implicaciones serias en el pronóstico3. En Colombia el 7% de las infecciones micóticas en pacientes con LES corresponde a infecciones por Cryptococcus neoformans4. Las principales herramientas para el diagnóstico de las criptococosis incluyen la visualización directa en líquido cefalorraquídeo con tinta china, detección del antígeno capsular en sangre periférica por aglutinación con látex, o aislamiento del hongo en cultivos de tejidos comprometidos o hemocultivos5. Presentamos el caso de un hombre con recaída grave del LES y criptococosis diseminada con afección articular.
Presentación del casoPaciente varón de 34 años, con historia de exposición a aves y diagnóstico de LES en julio de 2018 por la presencia de anticuerpos antinucleares positivos, hipocomplementemia C3 y C4 y las siguientes manifestaciones clínicas: síndrome de Evans, endocarditis de Libman Sacks, poliartritis y síndrome nefrótico. El tratamiento del LES consistió en prednisolona, cloroquina, terapia de inducción con ciclofosfamida y de mantenimiento con azatioprina, esta última reemplazada por micofenolato cuando se documentó el compromiso renal. Así mismo, tenía antecedente de trombosis de vena renal derecha con anticuerpos antifosfolípidos negativos, sífilis secundaria, condilomatosis anogenital e infección asintomática por SARS-CoV-2.
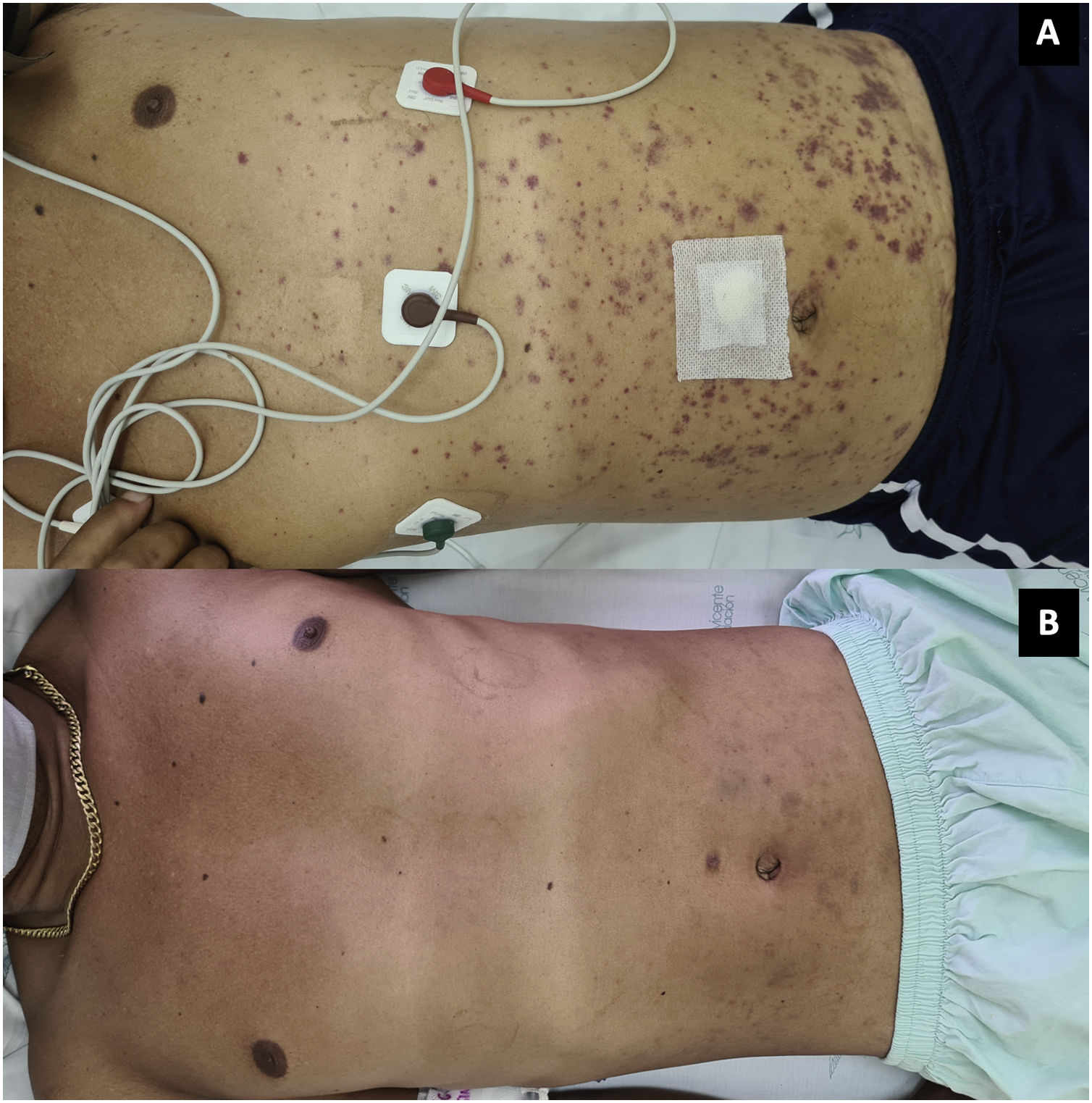
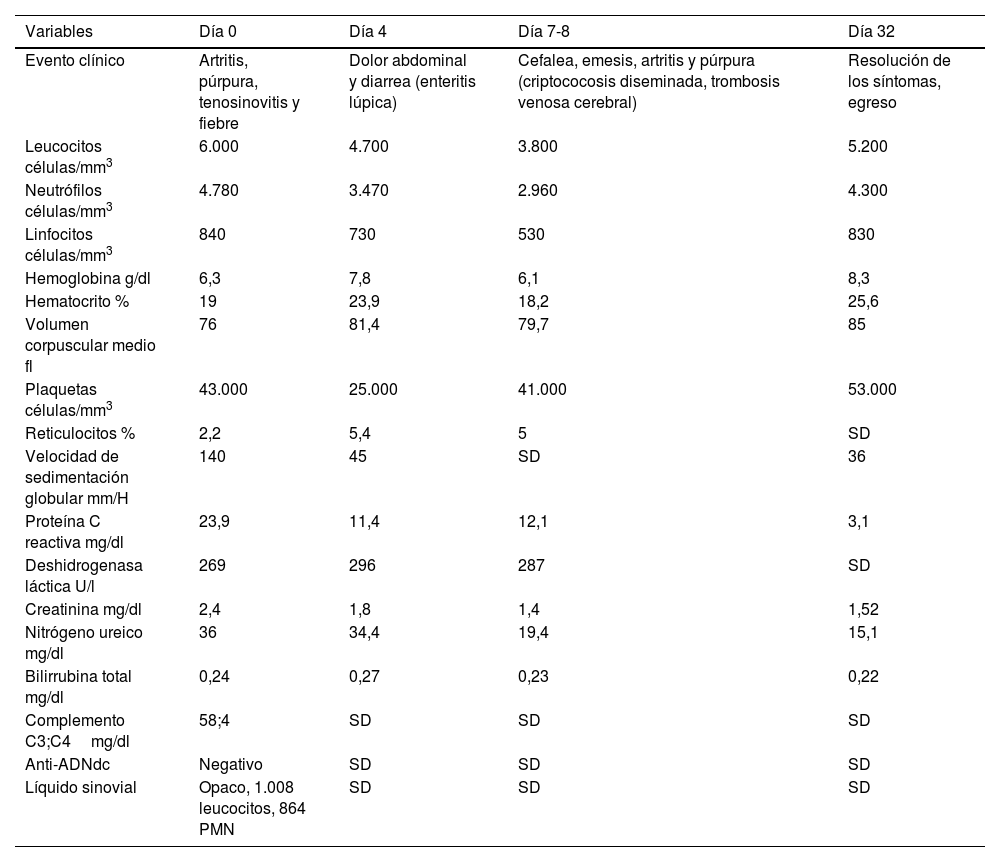
En julio de 2021 consultó en urgencias por fiebre, escalofríos, diaforesis y poliartritis de una semana de evolución. En ese momento no tenía adherencia al micofenolato por intolerancia gastrointestinal. Al examen físico se encontró tenosinovitis extensora de la mano derecha y de los dorsiflexores del pie izquierdo, artritis de la rodilla izquierda y púrpura palpable en los miembros inferiores. Los exámenes de laboratorio revelaron anemia, linfopenia, trombocitopenia, persistencia del compromiso renal (150mg de proteínas, 23 hematíes y 24 leucocitos por campo de alto poder en uroanálisis), hipocomplementemia, elevación de reactantes de fase aguda (tabla 1) y prueba de inmunoabsorción ligada a enzimas (ELISA) para detección del virus de inmunodeficiencia humana (VIH) negativa. Inicialmente, se sospechó infección gonocócica diseminada por el antecedente de enfermedades de trasmisión sexual, artritis, tenosinovitis y púrpura. En consecuencia, se redujo la dosis de prednisolona a 20mg/d y se realizó artrocentesis de rodilla izquierda para estudios microbiológicos del líquido sinovial y hemocultivos. Además, se inició tratamiento empírico con ceftriaxona 1g/día intravenoso y azitromicina 1g oral dosis única.
Resultados de laboratorios
| Variables | Día 0 | Día 4 | Día 7-8 | Día 32 |
|---|---|---|---|---|
| Evento clínico | Artritis, púrpura, tenosinovitis y fiebre | Dolor abdominal y diarrea (enteritis lúpica) | Cefalea, emesis, artritis y púrpura (criptococosis diseminada, trombosis venosa cerebral) | Resolución de los síntomas, egreso |
| Leucocitos células/mm3 | 6.000 | 4.700 | 3.800 | 5.200 |
| Neutrófilos células/mm3 | 4.780 | 3.470 | 2.960 | 4.300 |
| Linfocitos células/mm3 | 840 | 730 | 530 | 830 |
| Hemoglobina g/dl | 6,3 | 7,8 | 6,1 | 8,3 |
| Hematocrito % | 19 | 23,9 | 18,2 | 25,6 |
| Volumen corpuscular medio fl | 76 | 81,4 | 79,7 | 85 |
| Plaquetas células/mm3 | 43.000 | 25.000 | 41.000 | 53.000 |
| Reticulocitos % | 2,2 | 5,4 | 5 | SD |
| Velocidad de sedimentación globular mm/H | 140 | 45 | SD | 36 |
| Proteína C reactiva mg/dl | 23,9 | 11,4 | 12,1 | 3,1 |
| Deshidrogenasa láctica U/l | 269 | 296 | 287 | SD |
| Creatinina mg/dl | 2,4 | 1,8 | 1,4 | 1,52 |
| Nitrógeno ureico mg/dl | 36 | 34,4 | 19,4 | 15,1 |
| Bilirrubina total mg/dl | 0,24 | 0,27 | 0,23 | 0,22 |
| Complemento C3;C4mg/dl | 58;4 | SD | SD | SD |
| Anti-ADNdc | Negativo | SD | SD | SD |
| Líquido sinovial | Opaco, 1.008 leucocitos, 864 PMN | SD | SD | SD |
Anti-ADNdc: anti-ADN de doble cadena, PMN: polimorfonucleares; SD: sin dato.
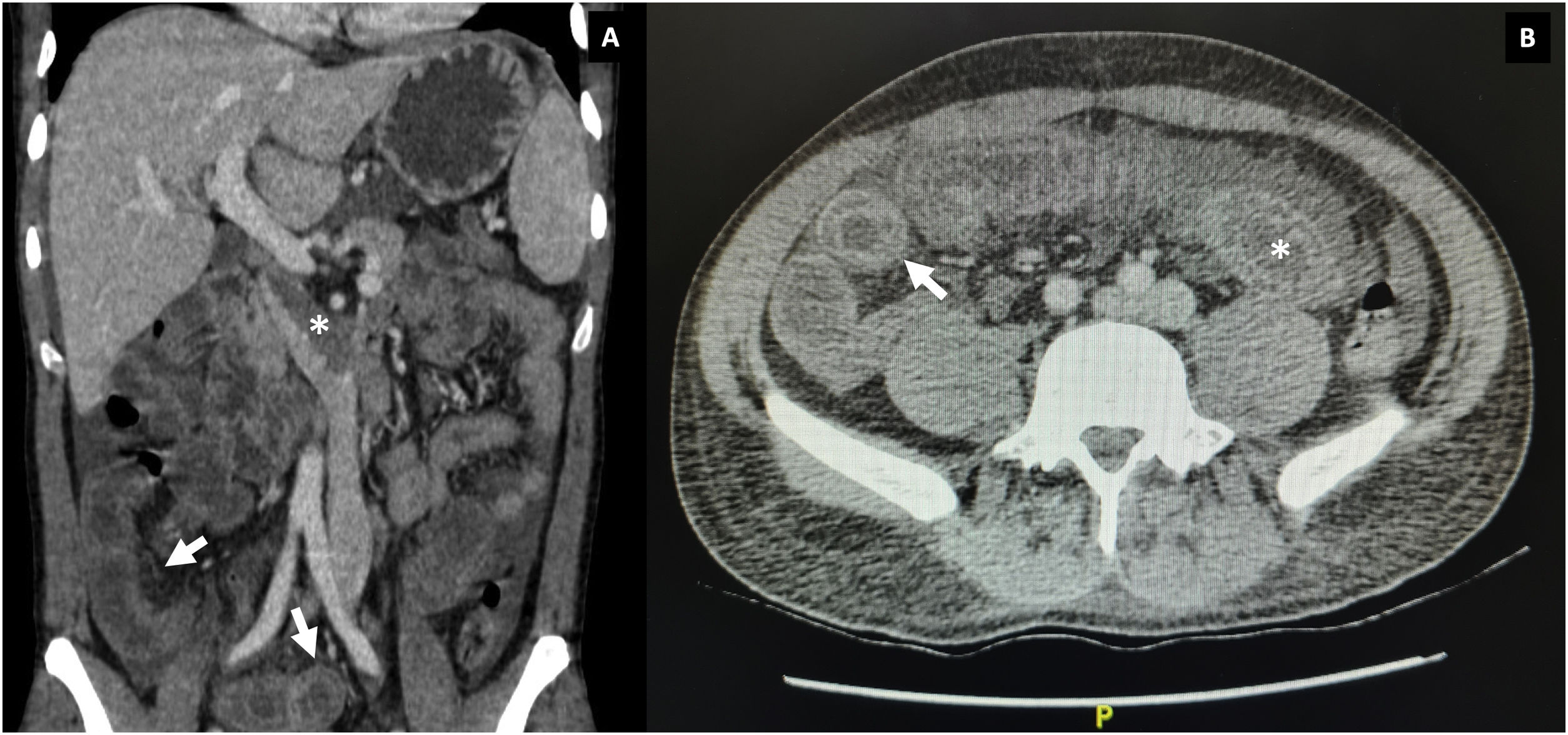
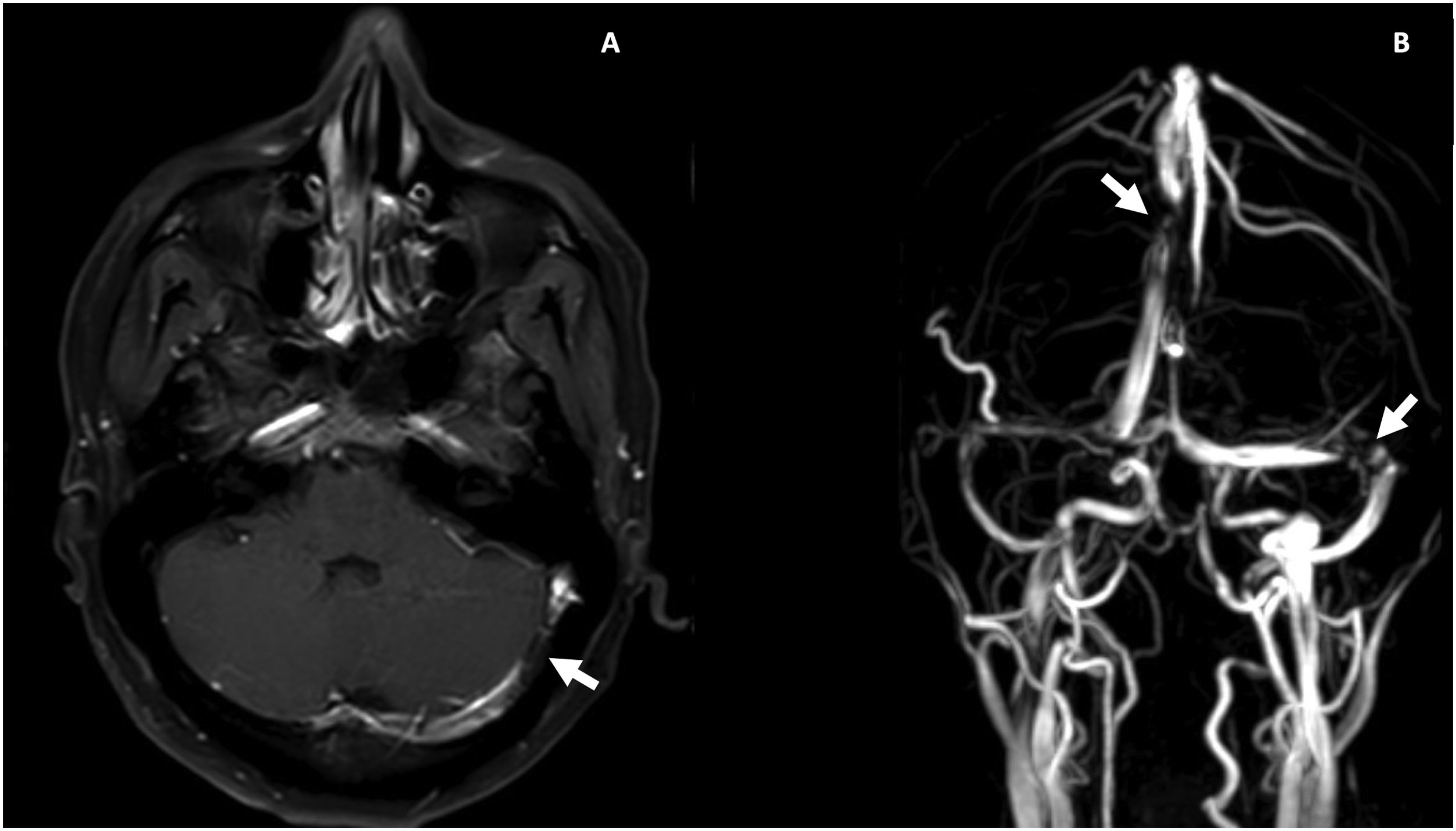
Durante la hospitalización, el día 4 se diagnosticó enteritis lúpica por la presencia de dolor abdominal, diarrea y tomografía de abdomen contrastada con signo de la diana en el íleon distal (fig. 1). Adicionalmente, por episodio de cefalea en trueno (día 7) se realizó angiorresonancia cerebral que detectó trombosis en la confluencia del seno venoso transverso, sigmoideo izquierdo y sagital superior (fig. 2; tabla 1). Por estos hallazgos se inició infusión de inmunoglobulina y anticoagulación.
Resonancia magnética contrastada cerebral. A) T1 posgadolinio, trombosis venosa parcialmente recanalizada en la confluencia del seno trasverso y sigmoideo izquierdo (flecha blanca). B) Venorresonancia, defecto de flujo central en la unión del seno transverso y sigmoideo izquierdo y en el aspecto posterior del seno sagital superior (flechas blancas).
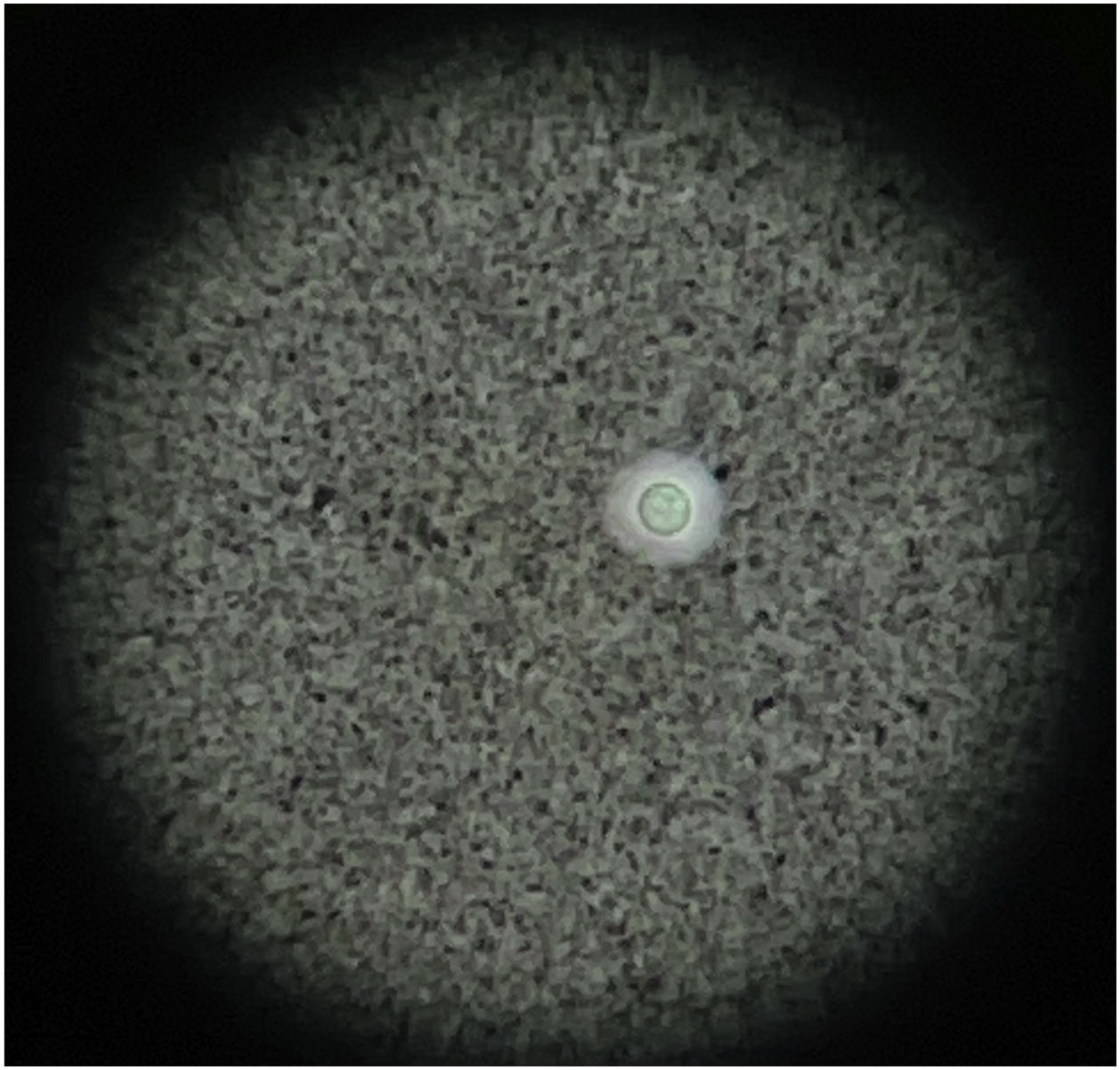
Al día siguiente presentó empeoramiento de las manifestaciones, con artritis de rodillas y extensión de la púrpura palpable al tronco y las extremidades (fig. 3; tabla 1), pese a completar 7 días de tratamiento antibiótico, por lo que se cuestionó la infección gonocócica. Finalmente, el cultivo de líquido sinovial y los hemocultivos reportaron crecimiento de C. neoformans. Teniendo en cuenta el neurotropismo de este agente, la persistencia de la cefalea y el hallazgo al examen físico de rigidez nucal se ampliaron los estudios. En la punción lumbar se identificó una presión de apertura (PA) de 47cmH2O y en el líquido cefalorraquídeo (LCR) se encontró proteínas 60mg/dl, glucosa 31mg/dl, leucocitos 65células/mm3 (90% polimorfonucleares), blastoconidias en KOH, levaduras encapsuladas en tinta china (fig. 4) y cultivo para hongos positivo para C. neoformans. Lo anterior confirmó la infección criptocóccica diseminada, por lo que se inició anfotericina B liposomal 300mg/día intravenoso cada 6horas más flucitosina 2g vía oral cada 6horas como tratamiento de inducción. Se realizó biopsia de piel, sin embargo, las tinciones de metenamina de plata, PAS y mucicarmín fueron negativas. La respuesta al tratamiento antifúngico fue rápida, lográndose la resolución de la cefalea, la púrpura y la artritis. A los 17 días de tratamiento de inducción se cambió a terapia de consolidación con fluconazol 800mg vía oral cada día, luego de confirmar que el cultivo de hongos de control en el líquido cefalorraquídeo era negativo y que la PA se había normalizado. Ante la mejoría y la ausencia de reacciones adversas al tratamiento el paciente fue dado de alta con formulación de fluconazol y seguimiento ambulatorio por reumatología e infectología.
Uno de los grandes retos en el manejo de pacientes con LES consiste en diferenciar la actividad de la enfermedad de la infección, lo que resulta aún más complejo cuando ambas situaciones se presentan en un mismo paciente y deben tomarse decisiones terapéuticas. La inducción de actividad lúpica por procesos infecciosos es secundaria a varios mecanismos patogénicos, entre ellos la similitud molecular, la diseminación de epítopos, la producción de superantígenos, la apoptosis alterada y la deficiente depuración de detritus. Asimismo, en el LES hay un aumento del riesgo de infección debido a la disminución de la fagocitosis, menor producción de citoquinas (IL2, IL8, IL12), quimiotaxis defectuosa y deficiencia del complemento6. El abordaje inicial debe enfocarse en descartar infección por las graves implicaciones de la inmunosupresión, para lo cual los reactantes de fase aguda pueden ser útiles. La elevación de la PCR>60mg/l es un parámetro moderadamente específico para infección (84%), e igualmente lo es la relación VSG/PCR inferior a 27. Sin embargo, estos hallazgos pueden ser insuficientes, sobre todo cuando hay manifestaciones de LES que elevan los reactantes de fase aguda, como la sinovitis crónica y la serositis8.
En el LES las infecciones bacterianas son las más frecuentes, seguidas por las virales, y en menor proporción las infecciones micóticas3,9. La infección fúngica invasiva (IFI) es una condición poco común (0,6-3%)10, usualmente infradiagnosticada (30%), que influye en desenlaces fatales. Una revisión sistemática de 461 IFI en 393 pacientes con LES encontró que el principal agente etiológico fue Cryptococcus sp. (35%), seguido por Aspergillus10. Sin embargo, en Colombia la epidemiología es diferente; en un estudio de 200 pacientes con LES la IFI se presentó en un mayor porcentaje de pacientes (7,5%), siendo Candida sp. el agente de principal (60%) y C. neoformans el de menor aislamiento4. El Cryptococcus sp. es un hongo encapsulado, adquirido por inhalación de aerosoles, que causa infección en individuos inmunocomprometidos (con o sin infección por VIH) en quienes es frecuente la diseminación hematógena a otros órganos diferentes al pulmón, especialmente al sistema nervioso central (SNC)11. En el LES es común que la infección ocurra dentro de los 2 primeros años de evolución de la enfermedad, principalmente en aquellos sujetos con actividad hematológica, renal y en tratamiento con glucocorticoides (89%). Los sitios de mayor aislamiento en esta población son el SNC (73%) y la sangre (26%), mientras que la piel y las articulaciones son focos poco descritos10.
La criptococosis articular es inusual; en la actualidad hay 28 casos reportados en la literatura, de los cuales el 57% eran hombres, el 65% monoartritis, de predominio en la rodilla seguido por el tobillo, y el 75% con aislamiento en sitios adicionales (piel, SNC, hueso o sangre). El líquido sinovial reportaba características inflamatorias o no inflamatorias (leucocitos 200 a 19.700 células/mm3), con predominio de monocitos. La principal condición asociada fue el trasplante de órgano sólido, y solo un paciente tuvo diagnóstico de LES. En cuanto a la inmunosupresión, un tercio recibió glucocorticoides y el inmunosupresor adicional más usado fue azatioprina. El 25% requirió intervenciones quirúrgicas y se obtuvo curación en el 71% de los casos12–17. Aunque excepcional, los tejidos blandos periarticulares también son un potencial foco de infección por Cryptococcus sp. con tenosinovitis de predominio de los extensores de la mano12.
La infección primaria en la piel es rara, usualmente es consecuencia de la diseminación hematógena y se observa en el 15% de los pacientes no VIH con criptococosis, entre los cuales el 37% tiene enfermedades reumatológicas, entre las que destaca el LES (30%)18. Las lesiones características son pápulas ulceradas en el centro, de apariencia acneiforme o de molusco contagioso, pero también se presentan en forma de úlceras, celulitis, nódulos subcutáneos y púrpura5,19. El diagnóstico requiere su identificación con tinciones especiales como PAS, metenamina de plata, mucicarmín, el cultivo o la evidencia histológica18. En el caso presentado, aunque las tinciones de la biopsia de piel fueron negativas, la ausencia de respuesta a la inmunoglobulina y la resolución completa de la púrpura con el inicio del antifúngico sugirieron que las lesiones cutáneas eran secundarias a la criptococosis.
El riesgo de infecciones oportunistas en el LES está dado por factores intrínsecos como disrupción de la inmunidad celular, la deficiencia de lectina de unión a la manosa, el déficit de receptores del complemento o del receptor FcγIII20. Además, varios factores extrínsecos se han asociado a las IFI en LES, siendo 2 los más relevantes. Primero, el uso de glucocorticoides, debido a sus efectos en la inmunidad celular, con mayor riesgo en dosis intermedias o dosis acumuladas altas (OR 1,58; p=0,01). El segundo factor es la linfopenia, frecuente hallazgo en el LES (56%) por actividad de la enfermedad o los glucocorticoides, con un incremento del riesgo de 2,65 veces9. Específicamente, los defectos cuantitativos y cualitativos de los linfocitos T tienen mayor relación con este tipo de infección. Quin et al.21 identificaron que los pacientes con lupus e infección oportunista tenían recuentos de linfocitos TCD4+ menores que aquellos sin infección (173 vs. 485 células/mm3). Asimismo, en un estudio con modelos murinos de LES se demostró que los linfocitos T tienen un defecto intrínseco que conduce a una disminución en la producción de interferón y, lo cual afecta la capacidad para controlar los patógenos intracelulares22. En la IFI por Cryptococcus sp. el esquema de tratamiento de inducción está compuesto por anfotericina y flucitosina, seguido de tratamiento de consolidación con fluconazol, similar a los pacientes con infección por VIH23. Finalmente, la mortalidad de pacientes con LES y criptococosis es alta (53-86%)3,10, y entre los factores de mal pronóstico, el uso de glucocorticoides con dosis equivalentes de prednisolona≥30mg/d ha demostrado un aumento del riesgo de muerte de 10 veces (OR 9,68)24.
La principal fortaleza del presente reporte de caso es destacar el tropismo de C. neoformans por diversos tejidos como un hallazgo para tener en cuenta en el abordaje diagnóstico de IFI por este agente en pacientes con LES. En cuanto a las limitaciones se encuentra la ausencia de datos del seguimiento ambulatorio y la no detección del agente etiológico en las lesiones cutáneas, a pesar de resolver con el tratamiento instaurado.
ConclusiónLas infecciones oportunistas en pacientes con LES implican mayor morbimortalidad, pese a ser infrecuentes. El Cryptococcus es el principal agente fúngico asociado y los principales factores de riesgo son la actividad del LES, la linfopenia y la dosis acumulada de esteroides. El compromiso articular y periarticular son también focos de posible infección que no se deben olvidar. Es importante tener un alto índice de sospecha e iniciar el tratamiento de forma oportuna para evitar los desenlaces fatales, que comúnmente se presentan en más de la mitad de los casos.
Conflicto de interesesNinguno de los autores declara conflicto de intereses para la elaboración de este artículo.