El síndrome de Sjögren es una enfermedad autoinmune sistémica que afecta principalmente a las glándulas exocrinas, particularmente a las glándulas salivales y lagrimales, pero también puede afectar a otros órganos como la piel, y a regiones extraglandulares como el corazón, los riñones, el cerebro, el sistema hematopoyético y el pulmón. Presentamos el caso de un paciente con síndrome de Sjögren primario cuya primera manifestación de la enfermedad fue hipertensión pulmonar y enfermedad pulmonar intersticial no especificada, con ausencia de síntomas secos. El paciente recibió tratamiento con esteroides y azatioprina, con una respuesta adecuada. Además, se presenta una revisión de la literatura de las principales manifestaciones pulmonares en el síndrome de Sjögren.
Sjögren's syndrome is a systemic autoimmune disease that mainly affects the exocrine glands, particularly the salivary and the lacrimal glands, but which can also affect other organs such as the skin, and extra-glandular regions such as the heart, kidney, brain, the haematopoietic system and the lung. The case is presented of a patient with primary Sjögren's syndrome, whose first manifestation of the disease was pulmonary hypertension and a non-specific interstitial lung disease, with an absence of sicca symptoms. The patient received treatment with steroids and azathioprine, with an appropriate response. A literature review is also presented on the main pulmonary manifestations in Sjögren's syndrome.
Paciente de sexo femenino, de 40años de edad, con antecedente de hipotiroidismo, sin manejo, previamente asintomática. La paciente consultó debido a cuadro clínico de un año de evolución, consistente en disnea progresiva hasta clase funcionalIV, asociada con tos, sin expectoración y ortopnea. En otra institución la paciente fue diagnosticada inicialmente con un cuadro de falla cardiaca y se inició manejo con losartán 50mg cada 24h y metoprolol 25mg cada 12h.
Al examen físico de ingreso a nuestra institución se evidenció cianosis perioral, taquicardia (FC: 108), con hipoxemia (SATO2 71%) sin soporte de oxígeno suplementario; ingurgitación yugular a 90grados; presencia de soplo holosistólico gradoIII/IV en foco mitral; ruidos respiratorios con estertores bibasales; hipocratismo digital y edema gradoII de los miembros inferiores.
Los laboratorios de admisión mostraron hemograma, función renal y hepática normales; C3: 91,9mg/dl (VN: 90-180mg/dl), NT pro BNP elevado en 1.594pg/ml, y TSH alta en 76,49mUI/ml), con una T4 libre disminuida: 0,34 (VN: 0,93-1,7ng/dl).
Ante estos hallazgos, se inicia manejo con levotiroxina 50μg/día, y se toma ecocardiograma transtorácico que muestra una fracción de eyección del ventrículo izquierdo (FEVI) normal del 63%, con elevación de PSAP en 50mmHg, paredes del ventrículo izquierdo normales, paredes del ventrículo derecho con marcada dilatación y engrosamiento, así como disminución de la contractilidad. Ante estos hallazgos, se realiza un cateterismo cardiaco derecho por el cual se descartan alteraciones septales y se evidencia una PSAP de 55mmHg, con prueba de reactividad pulmonar con epoprostenol positiva.
Debido a los hallazgos anteriores se realizaron pruebas de función pulmonar para demostrar el origen de los hallazgos, obteniendo una espirometría con curva flujo-volumen con alteración restrictiva severa (VEF1: 1,29; FVC: 1,37, VEF1/FCV: 94%), sin respuesta a la administración de broncodilatador, capacidad de difusión para el monóxido de carbono (DLCO) con disminución severa en 12%; caminata de 6minutos con resultado de 210metros (33% del valor predicho, 632metros) 2METS (se espera mínimo 3METS para realizar actividades básicas de la vida diaria), y finalmente una gammagrafía V/Q que muestra perfusión pulmonar con múltiples defectos segmentarios con patrón gammagráfico sugestivo de tromboembolismo pulmonar (TEP) crónico o recidivante.
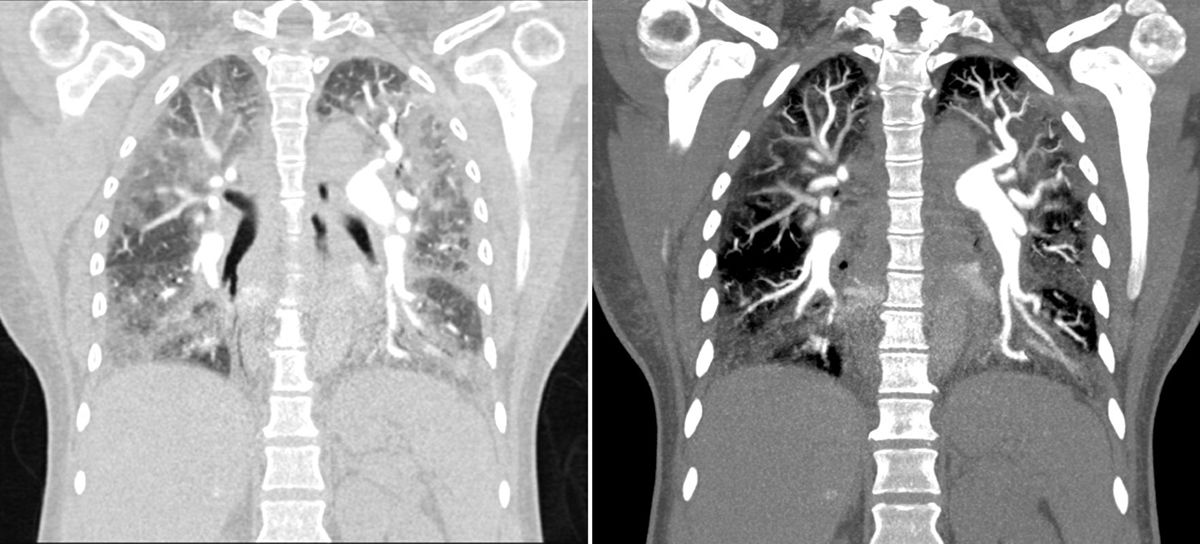
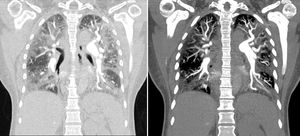
Para confirmar el diagnóstico se realizó angiotac de tórax, que evidenció imágenes compatibles con trombos en la arteria segmentaria y subsegmentaria de los lóbulos inferiores de manera bilateral, que corresponden a trombos crónicos; adicionalmente se evidenciaron signos de hipertensión pulmonar y cardiomegalia a expensas de cavidades derechas, con importante alteración del parénquima pulmonar con patrón de vidrio esmerilado (fig. 1).
Angiotac de tórax que mostró imágenes compatibles con un trombo en la arteria segmentaria y subsegmentaria de los lóbulos inferiores, de manera bilateral, lo que corresponde a trombos crónicos. Hubo, además, signos de hipertensión pulmonar y cardiomegalia a expensas de las cavidades derechas, con importante alteración del parénquima pulmonar con patrón de vidrio esmerilado.
Se inicia manejo con sildenafilo 25mg cada 8h y anticoagulación con HBPM, así como espironolactona, metoprolol y losartán. Ante la mejoría de la disnea, la paciente es dada de alta 15días luego del ingreso.
La paciente reingresa 2meses después por cuadro de disnea progresiva (clase funcional NYHA2) y lipotimias frecuentes. Al examen físico presenta ingurgitación yugular y edema de miembros inferiores; se considera que la paciente cursa con hipertensión pulmonar descompensada y se hospitaliza en UCI para manejo vasodilatador con epoprostenol.
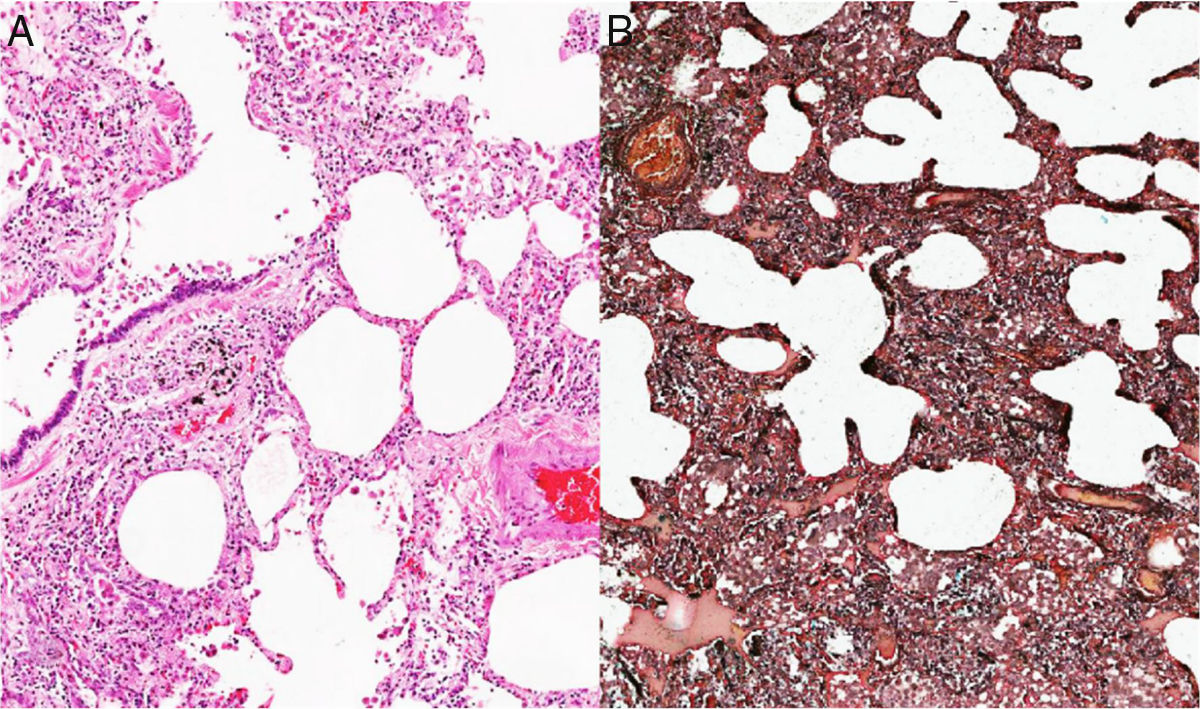
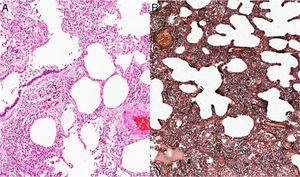
Ante la complejidad del caso y sin una etiología clara del proceso pulmonar, considerando que el TEP no era la única causa de la hipertensión pulmonar, se decidió en una junta la realización de biopsia de pulmón. Esta patología mostró como resultado la presencia de una neumonía intersticial no específica subtipo predominante celular (figs. 2 y 3), por lo que se inició manejo con prednisolona a dosis de 1mg/kg/día, por 10días. Con el fin de determinar causas secundarias, se ordenaron pruebas autoinmunes, las cuales mostraron positividad para anticuerpos antinucleares con una dilución de 1:640, patrón moteado fino. La medición de autoanticuerpos específicos mostró AntiSSA >200U/ml (VN: <15U/ml), y AntiSSB >200 (VN: <15U/ml). El resto de perfiles autoinmunes, incluyendo anticuerpos anti-Sm 2,6U/ml (VN: <15U/ml), AntiRNP 0,8U/ml (VN: <15U/ml), anticardiolipinas IgG 4,3GPL-U/ml (VN: <10GPL-U/ml) e IgM0,5MPL-U/ml (VN: <7MPL-U/ml), fueron todos negativos.
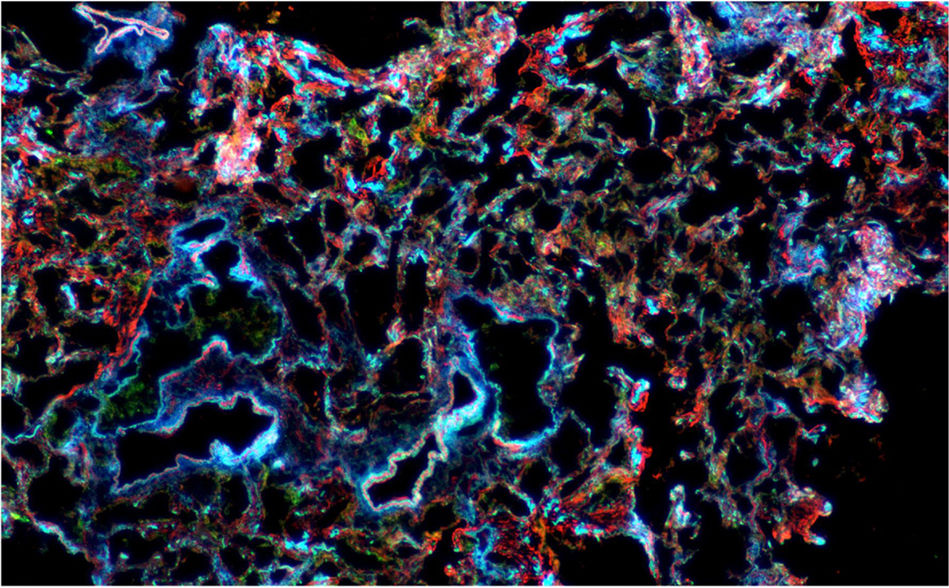
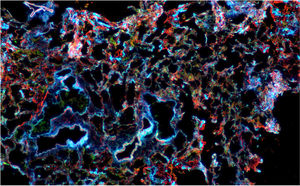
Microscopía confocal de tejido pulmonar con inmunofluorescencia para actina (roja), citoqueratina (verde) y núcleo (azul). Potencia de 2,5×. Se observa expansión del intersticio y engrosamiento de los septos alveolares que compromete el parénquima pulmonar de manera difusa y uniforme.
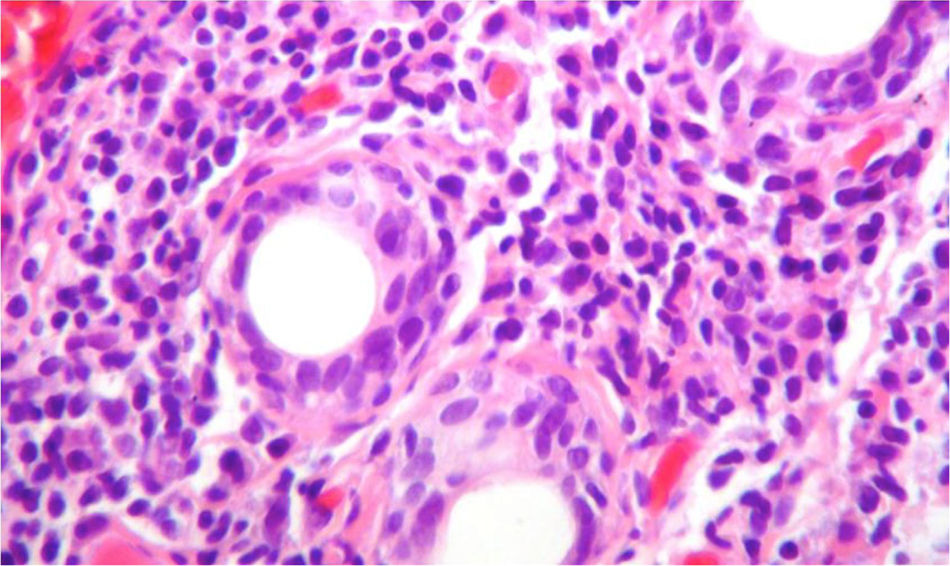
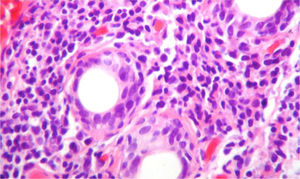
Debido a las posibilidades diagnósticas entre lupus eritematoso sistémico (LES) y síndrome de Sjögren primario (SSp) se realizó una biopsia de glándula salival que mostró un denso infiltrado inflamatorio linfoplasmocitario alrededor de los ductos (más de 5 focos de 50 células inflamatorias periductales) (fig. 4), por lo que se realizó el diagnóstico de SSp. Por esta razón se adicionó al manejo azatioprina 50mg cada día y se disminuyó la dosis de esteroide de manera progresiva. La paciente presenta una mejoría sintomática ostensible y es dada de alta con anticoagulación con enoxaparina y esquema de inmunosupresión: prednisolona 10mg cada día y azatioprina 2mg/kg/día. La evolución en el periodo posthospitalización fue favorable. Desafortunadamente, debido a dificultades administrativas no se logró un seguimiento regular en nuestra institución, para obtención de pruebas pulmonares de control.
Biopsia de la glándula salival con tinción de H & E, 40×. Se observa un denso infiltrado inflamatorio linfoplasmocitario alrededor de los conductos, más de 5focos de 50células periductales inflamatorias, que son compatibles con el síndrome de Sjögren (escala Score 4.2 de Chisholm y Masson modificada por Daniel y Whitcher).
El síndrome de Sjögren (SS) es una enfermedad autoinmune sistémica caracterizada por infiltración linfocítica de las glándulas exocrinas, particularmente las glándulas salivares y lacrimales, que lleva a un síndrome seco debido a la disminución de secreciones de estas glándulas, secundario a la infiltración de células inflamatorias y mecanismos neuroendocrinos1. La enfermedad se clasifica como primaria, si no está relacionada con otras enfermedades autoinmunes, o secundaria, si surge como complicación de otra enfermedad autoinmune, siendo primaria en el caso presentado. El SS puede afectar órganos y sistemas extraglandulares que incluyen la piel, el pulmón, el corazón, el riñón, el sistema neurológico y el hematopoyético2.
En cuanto a la enfermedad pulmonar en SS, definida como sintomatología y alteración en pruebas pulmonares estructurales o funcionales, esta tiene una prevalencia que oscila entre el 9 y el 22% de los pacientes. Sin embargo, la enfermedad subclínica tiene prevalencias mayores, cercanas al 50%3. El 10% de los pacientes con SS tienen como primera manifestación de la enfermedad compromiso pulmonar, tal como lo presentó nuestra paciente, donde las manifestaciones secas no estaban presentes4.
Las manifestaciones pulmonares del SSp abarcan 3 grupos: 1.Anormalidades de la vía aérea, como bronquiolitis (12 a 24% de los pacientes), hiperreactividad bronquial (42 a 60% de los pacientes) y bronquiectasias (7 a 54% de los pacientes). 2.Enfermedad pulmonar intersticial, tal como la neumonía intersticial no específica (45% de los pacientes), neumonía intersticial usual (45% de los pacientes), neumonitis intersticial linfocítica (15% de los pacientes) y neumonitis organizada (11% de los pacientes). 3.Miscelánea, como linfoma pulmonar (2% de los pacientes), amiloidosis pulmonar, hipertensión pulmonar y TEP, que se consideran manifestaciones raras y cuya frecuencia no está definida dentro del SS5.
La hipertensión pulmonar puede ser multifactorial, aunque se clasifica como tipo5, y no se sabe su incidencia como primera manifestación de la enfermedad en pacientes con SSp5. La paciente del caso presentó hipertensión pulmonar que inicialmente se atribuyó a TEP crónico; posteriormente, con el diagnóstico de neumonía intersticial no especificada, se pudo orientar el caso.
Dentro de los síntomas más comunes de la enfermedad pulmonar intersticial en SS se destacan la disnea (94%), la tos seca (67%) y el dolor torácico (22%). Al examen físico los hallazgos más comunes son estertores (67%), sibilancias (17%) e hipocratismo digital (6%); la auscultación es totalmente normal en el 28% de los pacientes4.
Las pruebas de laboratorio no aportan un diagnóstico específico, pero se ha evidenciado en algunos estudios que pacientes con SS e hipertensión pulmonar tienen más frecuentemente anti-Ro/SSA, ANA y factor reumatoide positivos, así como hipergammaglobulinemia6.
Las imágenes diagnósticas tienen un rol importante en la identificación del SSp, especialmente la TAC, que permite ver los cambios de las vías aéreas (engrosamiento de pared bronquial, bronquiectasias, atrapamiento de aire) y cambios en el parénquima (anormalidades basales bilaterales con tracción de bronquiectasias y patrón de vidrio esmerilado)7.
En cuanto a las pruebas de función pulmonar, la espirometría muestra un patrón de predominio restrictivo en la mayoría de los casos, con una baja DLCO, especialmente si el compromiso pulmonar es de predominio a nivel del parénquima8; este fue precisamente el caso de nuestra paciente, donde, debido al compromiso del parénquima pulmonar, la DLCO se encontraba severamente disminuida (12%). Por el contrario, si el compromiso es de predominio de vías aéreas, el patrón de la espirometría puede ser de tipo obstructivo9.
El papel del lavado broncoalveolar no es claro. En un estudio de Dalavanga et al.10 se evidenció que el 52% de los pacientes con SS y enfermedad pulmonar presentaban alveolitis, caracterizada por un incremento en el conteo celular con predominio de linfocitos.
El tratamiento depende de cada tipo de manifestación. La neumonía intersticial no específica puede ser tratada con esteroides, azatioprina, rituximab y ciclofosfamida5. La hipertensión pulmonar recibe el manejo usual, con calcioantagonistas y vasodilatadores pulmonares6, aunque estas terapias tienen poca evidencia en este grupo particular de pacientes, por lo que es necesario realizar estudios de agentes inmunosupresores para determinar cuál es el mejor manejo para la hipertensión pulmonar en este grupo específico.
Este caso es bastante inusual, dado que el paciente presentó enfermedad pulmonar intersticial junto a la presencia de TEP y que derivó finalmente en el desarrollo de hipertensión pulmonar, todo esto secundario a SS. La relación entre TEP y enfermedad intersticial pulmonar no es clara y se han planteado múltiples hipótesis, entre las que se destaca la presencia de un estado procoagulante debido a la inmovilidad del paciente secundaria a la disnea o inmovilidad debido al dolor articular o muscular, secundario a varias enfermedades autoinmunes11. Sin embargo, esto no está comprobado, y el manejo del tromboembolismo en este caso es igual al tratamiento usual.
En conclusión, el compromiso pulmonar en el SS es una manifestación relativamente frecuente. Sin embargo, la hipertensión pulmonar como primer signo de la enfermedad, como en este caso, es una expresión atípica de la enfermedad. Adicionalmente, el caso fue un reto diagnóstico dado que la paciente presentaba TEP crónico, por lo que se pensó inicialmente que esta era la única causa de la hipertensión pulmonar. La principal conclusión de este caso es que las enfermedades reumatológicas autoinmunes se deben sospechar en todo paciente con hipertensión pulmonar y hallazgos de compromiso intersticial pulmonar de etiología no clara.
Mensajes clave- 1.
El compromiso pulmonar en SS es frecuente; sin embargo, no es usual que este compromiso sea el primer signo de la enfermedad.
- 2.
Se debe sospechar la presencia de enfermedades autoinmunes en pacientes con compromiso intersticial pulmonar cuya causa no sea clara.
- 3.
Los síntomas clínicos son inespecíficos y abarcan tos, dolor torácico y disnea.
- 4.
Las imágenes tienen un rol importante en el diagnóstico, principalmente la tomografía axial computarizada de tórax de alta resolución.
- 5.
La espirometría muestra un patrón de predominio restrictivo en la mayoría de los casos, con una baja DLCO, especialmente si el compromiso pulmonar es de predominio a nivel del parénquima.
- 6.
La neumonía intersticial no específica puede ser tratada con esteroides, azatioprina, rituximab y ciclofosfamida. La hipertensión pulmonar recibe el manejo usual, con calcioantagonistas y vasodilatadores pulmonares.
Los autores declaran no tener ningún conflicto de intereses.