Un riesgo potencialmente mortal es el hábito de consumo de bebidas energizantes, porque puede producir un síndrome caracterizado por la necrosis muscular que promueve la liberación de enzimas y mioglobina proveniente del interior del miocito hacia la circulación, creando una peroxidación lipídica llegando a generar lesión renal aguda e hiperkalemia; conocido como rabdomiólisis. La rabdomiólisis la esperaríamos encontrar entre 24 y 48h después de actividades extenuantes, aún más con un índice de Borg modificado mayor o igual a 5 puntos; sin embargo, las bebidas energizantes por su alto contenido de cafeína y otros componentes pueden generar este evento adverso poco conocido.
Caso clínicoPaciente de 37años, obeso, que ingresó al servicio de urgencias por cuadro clínico de mialgia y orina oscura que apareció 24h después de 4días de ejercicio muscular de baja intensidad, asociado a consumo diario de bebida energizante por 2años. El diagnóstico de rabdomiólisis se confirmó por hiperCKemia e hipertrasaminemia; no fue posible medir los niveles de mioglobina. El paciente fue tratado con fluidoterapia agresiva. Nunca presentó complicaciones renales ni hidroelectrolíticas.
ConclusiónNuestro caso destaca la aparición de rabdomiólisis aguda en pacientes sometidos a ejercicios de baja intensidad no descartando como causa principal el consumo crónico de bebidas energizantes. Son pocos casos actualmente reportados en la literatura. Gracias al tratamiento oportuno se evitó la progresión a lesión renal aguda.
The habit of consuming energy drinks is a life-threatening risk, because it can produce a syndrome characterised by a muscle necrosis. This promotes the release of enzymes and myoglobin from inside the myocyte into the circulation, creating lipid peroxidation and leading to acute kidney injury, and hyperCKemia, together producing rhabdomyolysis. Rhabdomyolysis can be expected to be found within 24 to 48h after strenuous activities, even more so with a modified Borg index greater than or equal to 5 points. However, energy drinks, due to their high content of caffeine and other components, can generate this little known adverse event.
Clinical caseA 37-year-old patient admitted to the emergency department due to clinical symptoms of myalgia, and dark urine that appeared 24h after four days of low-intensity muscular exercises, and was associated with daily consumption of an energizing drink for 2 years. The diagnosis of rhabdomyolysis was confirmed by increased creatine kinase and transaminases. It was not possible to measure myoglobin levels. The patient was treated with aggressive fluid therapy. He never presented with any renal or electrolyte complications.
ConclusionThis case highlights the appearance of acute rhabdomyolysis in patients taking low intensity exercises, and not ruling out long-term consumption of energy drinks as the main cause. There are few cases currently reported in the literature. Owing to the timely treatment, progression to acute kidney injury was avoided.
Por su alto contenido de cafeína y otros componentes, el hábito de consumo de bebidas energizantes puede generar un evento adverso potencialmente mortal conocido como rabdomiólisis. Este se define como un síndrome constituido por necrosis muscular y liberación de sus componentes intracelulares en la circulación1–7, caracterizado por niveles de creatina cinasa (CK) elevados, mialgia y mioglobinuria8. La gravedad de la enfermedad varía desde asintomática hasta llegar a ser mortal por trastornos hidroelectrolíticos y lesión renal aguda9. El dolor muscular se presenta en más del 50% de los pacientes, así como debilidad y edema de los músculos afectados, y la orina color té o negra (mioglobinuria) se presenta en más del 90% de los pacientes10–12.
Los grupos musculares que más se afectan son los gastrocnemios y la espalda baja13–15.
El mecanismo por el cual se produce la sintomatología se debe a la depleción en la producción de adenosín trifosfato (ATP), y al rompimiento del sarcolema por estrés oxidativo, que aumentan el calcio intracelular y como consecuencia originan la liberación de sustancias tóxicas intracelulares en el líquido extracelular16–20. Existe una variedad de factores de riesgo para la producción del síndrome21,22. Los datos sobre rabdomiólisis por bebidas energizantes no se han resumido a cabalidad en los ensayos clínicos para guiar la terapia óptima en esta población, existiendo muy pocos estudios y se cree que es secundario a su alto contenido de cafeína23–25. Ante la sospecha clínica de rabdomiólisis debemos realizar paraclínicos como nivel sérico de CK, mioglobina, lactato deshidrogenasa (LDH), ácido úrico (AU), pruebas de función renal e ionograma, tira reactiva de orina para detectar mioglobinuria y explorar el sedimento urinario; considerar prueba de detección de drogas en la orina que puedan causar rabdomiólisis y electrocardiograma (EKG) ante sospecha de complicación de hiperkalemia26–30. La biopsia muscular se puede realizar en rabdomiólisis aguda si hay alta sospecha de miopatía genética o inflamatoria idiopática31–33. Actualmente el tratamiento inicial implica el tratamiento de la causa desencadenante; no hay consenso de tratamiento médico, solo se propone fluidoterapia agresiva con solución salina isotónica para mantener un gasto urinario entre 1-3cm3/kg/h y la terapia dialítica cuando la situación lo requiera34–37.
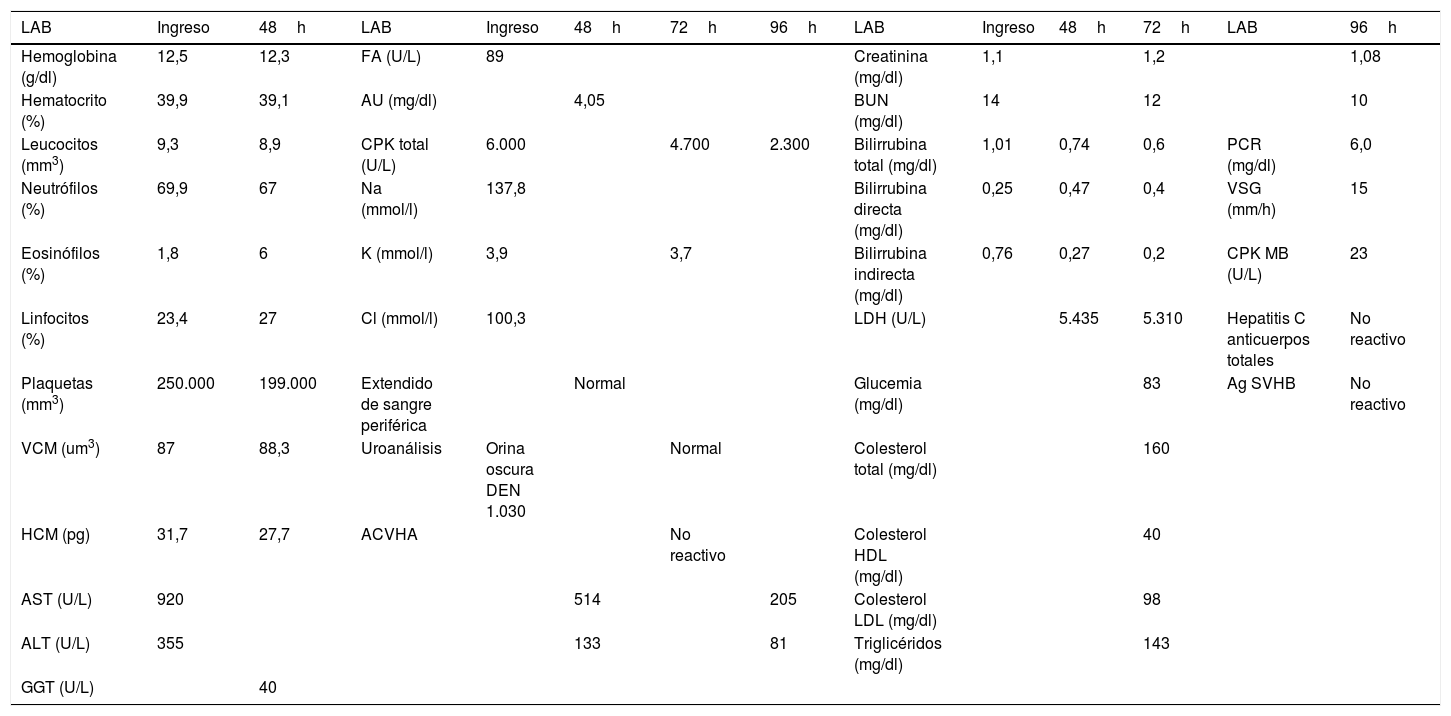
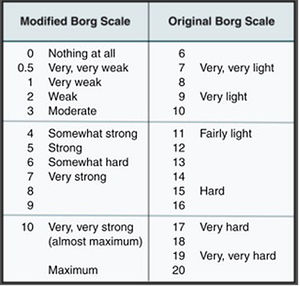
Caso clínicoPaciente masculino de 37años, de raza negra, administrador de empresas, procedente de la ciudad de Cartagena, Colombia; con antecedente patológico de rinitis alérgica desde la infancia sin tratamiento actual, obesidad grado II según la OMS, consumidor crónico de bebida energizante de 2 frascos diarios de 400ml, por alrededor de 24 meses (refirió que lo consumía por gusto), lo que nos da una ingesta promedio de 240mg/L de cafeína al día, no tenía el hábito de ir al gimnasio, sin actividad física rutinaria desde hacía 2años, negó consumo de alcohol y tabaco. Consultó por clínica de mialgias posterior a 4días de actividad física. Clasificado según la escala de percepción subjetiva del esfuerzo (Borg modificado) de 2 puntos (fig. 1)38; acompañado de orina oscura. Al examen físico se encontró dolor a la prensión de gastrocnemios, bíceps y tríceps braquial bilateral sin signos clínicos de síndrome compartimental, no se observaron hematomas, signos vitales dentro de la normalidad, afebril. En paraclínicos se observó hipertransaminasemia AST 920U/L y ALT 355U/L, hemograma, pruebas de función renal y bilirrubinas normales, uroanálisis que reportó color oscuro, aspecto turbio; densidad: 1.030 (elevada), pH5, nitritos, cetonas, bilirrubinas, leucos y hematíes negativos. Debidp a lo anterior se consideró ordenar los siguientes paraclínicos por presentar signos y síntomas compatibles con rabdomiólisis secundaria a ejercicio de leve intensidad, sumado como causa probable el consumo crónico de bebidas energizantes. Se decidió además ordenar paraclínicos para investigar otras causas de hipertransaminasemia, dolor muscular y orina oscura, con pruebas serológicas de virus hepatotropos, se ordenó imagenología: ecografía de abdomen total con énfasis en hepatobiliar para observar la morfología hepática, descartar esteatosis o masas obstructivas, así como el resto de paraclínicos complementarios: perfil lipídico, glucemia en ayunas, para documentar síndrome metabólico y se solicitó electrocardiograma y radiografía de tórax, pruebas de función renal, ácido úrico e ionograma para descartar complicaciones por rabdomiólisis, reportando: creatina-fosfocinasa (CPK) 6.000U/L, creatinina 1,1mg/dl, BUN 14mg/dl, ácido úrico 4,05mg/dl, Na 137,8mmol/l, K 3,9mmol/l, Cl 100,3mmol/l, Ca iónico 1,07mmol/l, LDH 5.435U/L, gases arteriales normales. Control en 24 y 96h dependiendo de la vida media (tabla 1) (tomado de la historia clínica). Ecografía abdominal total y electrocardiograma normal.
Paraclínicos solicitados en hospitalización
| LAB | Ingreso | 48h | LAB | Ingreso | 48h | 72h | 96h | LAB | Ingreso | 48h | 72h | LAB | 96h |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemoglobina (g/dl) | 12,5 | 12,3 | FA (U/L) | 89 | Creatinina (mg/dl) | 1,1 | 1,2 | 1,08 | |||||
| Hematocrito (%) | 39,9 | 39,1 | AU (mg/dl) | 4,05 | BUN (mg/dl) | 14 | 12 | 10 | |||||
| Leucocitos (mm3) | 9,3 | 8,9 | CPK total (U/L) | 6.000 | 4.700 | 2.300 | Bilirrubina total (mg/dl) | 1,01 | 0,74 | 0,6 | PCR (mg/dl) | 6,0 | |
| Neutrófilos (%) | 69,9 | 67 | Na (mmol/l) | 137,8 | Bilirrubina directa (mg/dl) | 0,25 | 0,47 | 0,4 | VSG (mm/h) | 15 | |||
| Eosinófilos (%) | 1,8 | 6 | K (mmol/l) | 3,9 | 3,7 | Bilirrubina indirecta (mg/dl) | 0,76 | 0,27 | 0,2 | CPK MB (U/L) | 23 | ||
| Linfocitos (%) | 23,4 | 27 | Cl (mmol/l) | 100,3 | LDH (U/L) | 5.435 | 5.310 | Hepatitis C anticuerpos totales | No reactivo | ||||
| Plaquetas (mm3) | 250.000 | 199.000 | Extendido de sangre periférica | Normal | Glucemia (mg/dl) | 83 | Ag SVHB | No reactivo | |||||
| VCM (um3) | 87 | 88,3 | Uroanálisis | Orina oscura DEN 1.030 | Normal | Colesterol total (mg/dl) | 160 | ||||||
| HCM (pg) | 31,7 | 27,7 | ACVHA | No reactivo | Colesterol HDL (mg/dl) | 40 | |||||||
| AST (U/L) | 920 | 514 | 205 | Colesterol LDL (mg/dl) | 98 | ||||||||
| ALT (U/L) | 355 | 133 | 81 | Triglicéridos (mg/dl) | 143 | ||||||||
| GGT (U/L) | 40 |
Valores de referencia: laboratorio (LAB), hemoglobina (12-16g/dl), hematocrito (36-50%), leucocitos (5.000-10.000mm3), neutrófilos (50-70%), eosinófilos (0-3%), linfocitos (25-40%), plaquetas (150.000-400.000mm3), volumen corpuscular medio (VCM) (80-100um3), hemoglobina corpuscular media (HCM) (26-34pg), aspartato aminotransferasa (AST) (10-41U/L), alanina aminotransferasa (ALT) (5-37U/L), gammaglutamiltransferasa (GGT) (5-85U/L), FA (U/L), ácido úrico (AU) (<7,5mg/dl), creatina-fosfocinasa (CPK) total (70-110U/L), sodio (Na) (135-145mmol/l), potasio (K) (3,5-5,0mmol/l), cloro (Cl) (96-106mmol/l), uroanálisis densidad urinaria (DEN) (1.010-1.020), anticuerpos virus hepatitis A (ACVHA), creatinina (0,7-1,2mg/dl), nitrógeno ureico (BUN) (6-20mg/dl), bilirrubina total (0,1-1,2mg/dl), bilirrubina directa (0,1-0,6mg/dl), bilirrubina indirecta (0,1-1,2mg/dl), lactato deshidrogenasa (LDH) (115-225U/L), glucemia (60-100mg/dl), colesterol total (<200mg/dl), colesterol alta densidad (HDL) (>40mg/dl), colesterol baja densidad LDL (<100mg/dl), triglicéridos (<150mg/dl), proteína C reactiva (PCR) (<10mg/dl), velocidad de sedimentación globular (VSG) (0-15mm/h), creatina-fosfocinasa fracción MB (CPK MB) (0-25U/L), hepatitis C anticuerpos totales, antígeno de superficie de hepatitis B (AgSVHB).
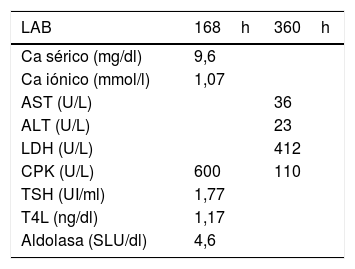
Se indicó tratamiento con fluidoterapia agresiva con solución salina isotónica 1.000cm3/h por 2h y se continuó a 100cm3/h por 72h, se mantuvo un gasto urinario de 1-2ml/kg/h; no se realizó alcalinización de la orina, ni corrección electrolítica. Se administró tratamiento con analgésicos tipo acetaminofén (1g cada 8h por dolor). Los controles de paraclínicos nunca evidenciaron progresión de rabdomiólisis a lesión renal aguda ni complicación de hiperkalemia (tabla 1) durante su estancia hospitalaria. Por adecuada evolución clínica y paraclínica se dio egreso al quinto día de hospitalización, haciendo énfasis en el cambio de estilo de vida, hábitos alimentarios y sobre el ejercicio. A los 7 y 15días del alta se realizaron paraclínicos de control que no mostraron evidencia de alteraciones (tabla 2) (proporcionado por el paciente en consulta externa).
Paraclínicos de control después del alta hospitalaria
| LAB | 168h | 360h |
|---|---|---|
| Ca sérico (mg/dl) | 9,6 | |
| Ca iónico (mmol/l) | 1,07 | |
| AST (U/L) | 36 | |
| ALT (U/L) | 23 | |
| LDH (U/L) | 412 | |
| CPK (U/L) | 600 | 110 |
| TSH (UI/ml) | 1,77 | |
| T4L (ng/dl) | 1,17 | |
| Aldolasa (SLU/dl) | 4,6 |
Valores de referencia: calcio (Ca) sérico (9,1-10,2mg/dl), calcio (Ca) iónico (1,0-1,3mmol/l), hormona estimulante del tiroides (TSH) (0,4-4,7UI/ml), tiroxina libre (T4L) (0,72-1,46ng/dl), aldolasa (3-8,2SLU/dl).
La definición de rabdomiólisis se basa en el examen físico y la historia clínica, donde identificamos el/los factores de riesgo desencadenantes. En el caso presentado nuestro paciente tenía sintomatología de orina oscura y mialgias. Con factores de riesgo: obesidad, consumo crónico de bebidas energizantes e inactividad física. El consumo de bebidas energizantes es muy común en los adultos jóvenes con edades comprendidas entre 11 y 35años, con el objetivo de mejorar la tolerancia al estado físico, presentándose hasta en un 57% de esta población la dependencia por su consumo y síntomas de abstinencia39. Nuestro paciente era consumidor crónico por más de 2años de una bebida energizante la cual contiene 18 ingredientes: taurina, cafeína, té verde, aditivos artificiales y naturales, vitaminas. La acción farmacológica de la cafeína se debe a la capacidad de antagonizar de forma competitiva los receptores de adenosina A1, A2A, A2B y A340,41, lo que induce la liberación de numerosos neurotransmisores42,43. Cantidades de cafeína superiores a los 200mg se han asociado a efectos adversos44,45, y dosis fatales entre 10 y 20g46 al inhibir la actividad enzimática de las fosfodiesterasas, aumentando la concentración intracelular de adenosina monofosfato, excitando los músculos esqueléticos, potenciando la liberación de calcio del retículo sarcoplásmico y produciendo contracciones tetánicas47,48. Teniendo en cuenta lo anterior, nuestro paciente consumía 240mg al día de cafeína.
Existen pocos reportes de casos de rabdomiólisis asociada al consumo de cafeína; uno de ellos es descrito por Chiang et al., en el cual una mujer de 44años presentó náuseas, vómitos, palpitaciones y orina del color del té, 6h después de beber un litro de café negro, asociado a un nivel de CK en plasma elevado (7.315U/L)25. Nuestro paciente presentó valores de CK (6.000U/L) muy cercanos al caso expuesto, asociado a mialgias y orina oscura. Otro de los componentes de esta bebida energizante es la taurina, un compuesto azufrado derivado de la cisteína, que se comporta como un neurotransmisor al disminuir el calcio intracelular inducido por glutamato, inhibiendo la liberación de citocromo C y la cascada de la apoptosis, por lo cual se cree que puede mejorar la disfunción endotelial vascular y producir necrosis muscular y rabdomiólisis3,49,50.
Se esperaría que la rabdomiólisis sea causada por ejercicio extenuante; esto es debido a mayor agotamiento de ATP que conlleva la liberación de contenidos intracelulares del miocito dañado, que a su vez puede provocar insuficiencia renal y otras complicaciones sistémicas como arritmias y coagulación intravascular diseminada51–53. En cambio, nuestro paciente refirió un índice Borg modificado de 2 puntos (ejercicio de baja intensidad). No existen paraclínicos que puedan confirmar la relación causal entre la tríada expuesta de consumo crónico de bebidas energizantes, ejercicio físico y rabdomiólisis. Los factores de riesgo que podrían explicar esta condición en nuestro paciente incluyen: personas sin entrenamiento físico, ejercicio realizado en situaciones extremas de calor y humedad (ciudad de Cartagena), obesidad grado II y consumo crónico de bebidas energizantes, como ya se documentó52,54. La rabdomiólisis por ejercicio se puede dar en individuos con miopatías metabólicas y deben ser sospechadas en pacientes con síntomas musculares recurrentes en relación con el ejercicio55.
Hay 3 grupos principales de miopatías metabólicas: trastornos de la β-oxidación de ácidos grasos, deben considerarse glucogenosis musculares y enfermedades mitocondriales56. Se resalta además que se presenta hipertransaminemia, con aumento del LDH y AU que está dado por lisis a nivel celular que produce la liberación de estas enzimas, electrólitos, contenido sarcoplásmico y mioglobina57. Además, un valor de LDH ≥2.000 unidades y/o AU≥6mg/dl, independientemente del nivel de creatinina en suero, tiene alto riesgo de desarrollar lesión renal aguda debido a rabdomiólisis58. Nuestro paciente tenía alto riesgo de lesión renal aguda por valor de LDH.
Un reporte de caso de Gagliano et al., de un hombre de 30años que ingresó por debilidad e hinchazón dolorosa de los músculos, así como por la orina oscura que aparece 24h después de realizar ejercicios de baja intensidad con CPK (70.962UI/L), y que fue tratado con cloruro de sodio intravenoso y bicarbonato de sodio, finalmente generó lesión renal aguda sin mortalidad59. En nuestro caso, el paciente elevó menos el valor de CPK, no desarrolló lesión renal aguda y no requirió alcalinización de la orina. Se debe resaltar que el valor de CPK de ingreso es predictor de lesión renal60.
El consumo de bebidas energizantes es, sin duda alguna, una causa de morbimortalidad silenciosa; al ser rico en azúcar lleva a mayor riesgo de síndrome metabólico, al ser rico en cafeína lleva a un mayor riesgo de alteraciones cardiovasculares; y quizás los efectos negativos más graves sean falla renal aguda y desequilibrio hidroelectrolítico si ocurre un síndrome por rabdomiólisis. Teniendo en cuenta que este síndrome es más prevalente en personas que realizan ejercicio físico extenuante, no hay que olvidar esta relación causal con la que quisimos ilustrar este caso, además por considerarse un hábito frecuente en personas deportistas y que no es considerado como factor de riesgo, generando de esta manera una alerta, por lo que sugerimos una adecuada hidratación, la realización de calentamiento muscular previo al ejercicio y evitar el consumo de bebidas energizantes.
ConclusiónLa rabdomiólisis es un síndrome clínico con una mortalidad de más del 70% si se asocia a hiperkalemia, acidosis y lesión renal aguda. Existen muchos factores de riesgo y condiciones clínicas desencadenantes de la enfermedad, por lo que las causas de hiperCKemia son heterogéneas y la progresión de la enfermedad es predecible por los valores iniciales de CPK. Es raro que esta condición aparezca con el ejercicio de baja intensidad y se observó que el consumo de bebidas energizantes es un factor de riesgo asociado. El tratamiento oportuno con fluidoterapia agresiva conduce a un pronóstico más favorable; no siempre es necesaria la alcalinización de la orina y en nuestro caso no se presentó complicación de hiperkalemia ni de lesión renal aguda.
FinanciaciónNinguna.
Conflicto de interesesNinguno.