Evaluar la eficacia de las terapias biológicas en inducir la remisión de la artritis reumatoide temprana.
MétodosTipo de estudio: revisión sistemática de la literatura. Se realizó una búsqueda sistemática de la literatura en bases de datos electrónicas especializadas en ciencias de la salud: PubMed, Embase, Cochrane, LILACS, literatura gris (tesis doctorales, intervenciones en congresos, informes de entidades, trabajos no publicados) y búsqueda manual (búsquedas secundarias de los estudios citados en los artículos seleccionados). Criterios de inclusión: pacientes mayores de 18 años con artritis reumatoide temprana (curso clínico menor de 12 meses) según criterios del Colegio Americano de Reumatología/Liga Europea contra el Reumatismo (ACR 1987, ACR/EULAR 2010), que recibieron terapia biológica en monoterapia o combinada con otros fármacos antirreumáticos modificadores de la enfermedad (FARME) y fueron incluidos en estudios clínicos controlados aleatorizados.
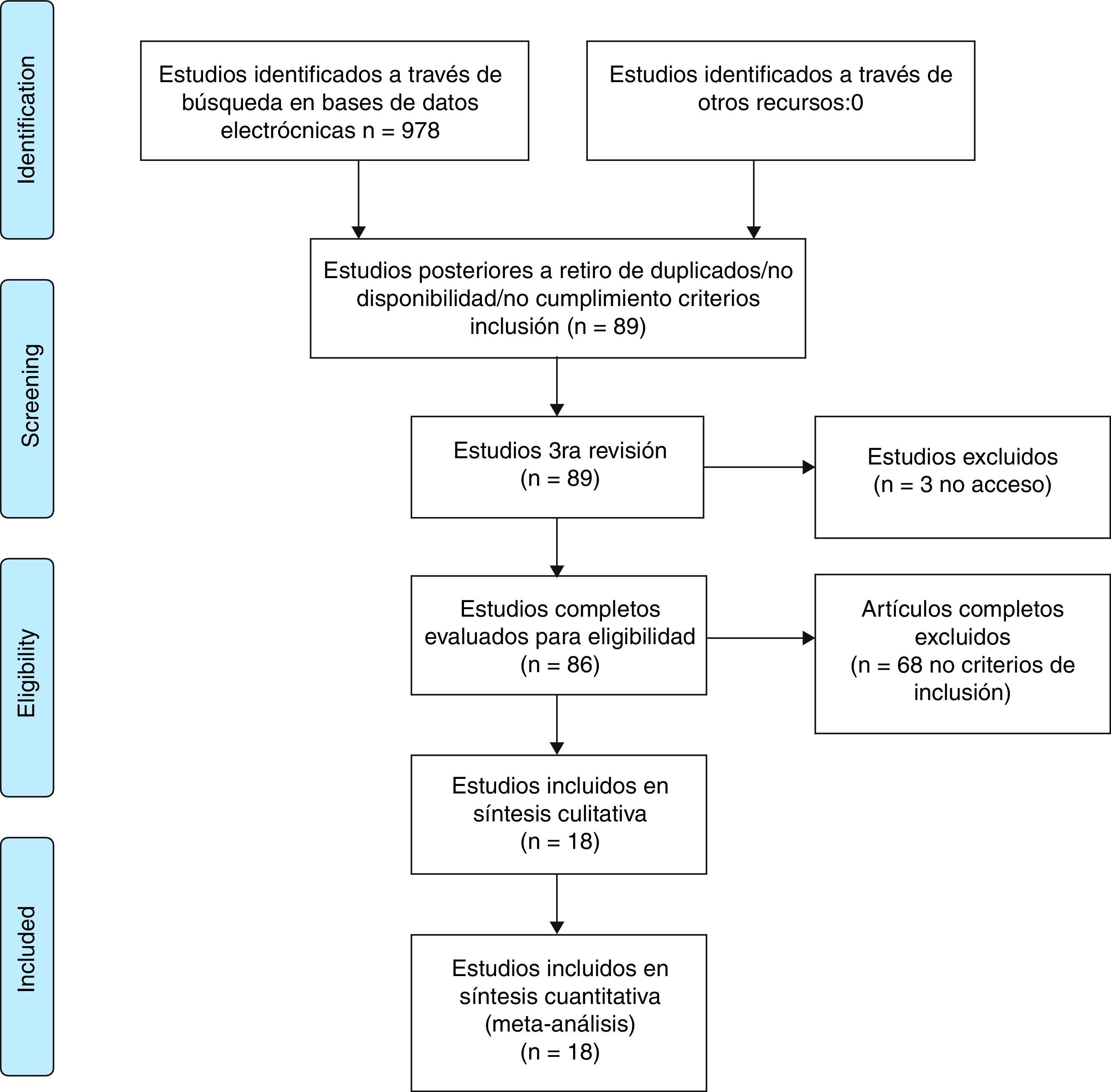
ResultadosLa revisión sistemática de la literatura identificó 978 estudios potencialmente relevantes; 86 fueron escogidos para la evaluación completa. Se excluyeron 68 artículos por no cumplir los criterios de inclusión, principalmente relacionados con el tiempo de duración de la enfermedad al diagnóstico de la artritis reumatoide temprana y con la metodología del estudio. Se realizó la síntesis cualitativa y cuantitativa de 18 estudios.
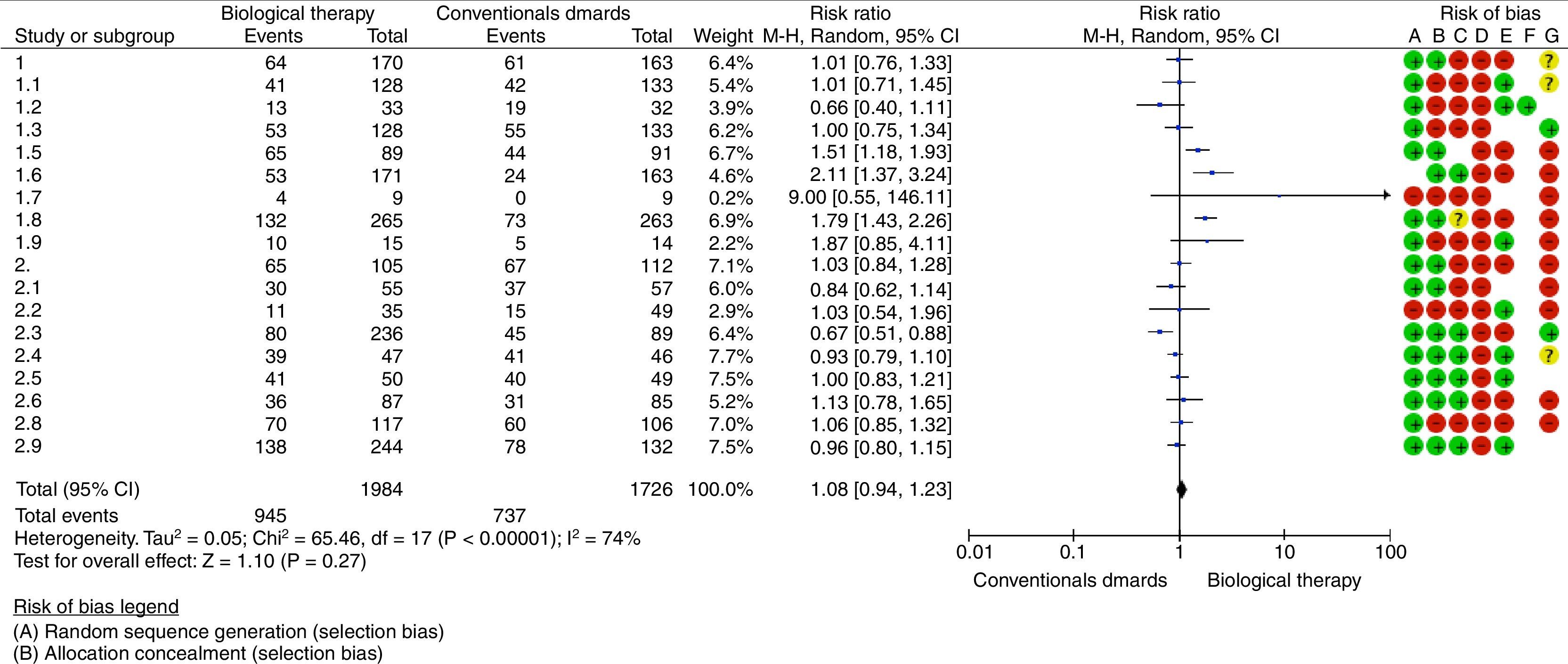
Se identificó alto riesgo de sesgos en los estudios evaluados, y la síntesis de la evidencia, a través del metaanálisis, no evidenció diferencias con relación al desenlace remisión de la enfermedad al utilizar terapia biológica en monoterapia o combinada con FARME convencionales versus el uso de FARME (RR: 1,08; IC 95%: 0,94-1,23).
ConclusionesNo hay diferencias en el desenlace de remisión de la enfermedad en pacientes con artritis reumatoide temprana que reciben terapia biológica versus pacientes tratados con FARME convencionales.
Rheumatoid arthritis is a chronic, systemic inflammatory disease, with a world prevalence of around 1%. The course of the disease may be changed by using synthetic and/or biological disease-modifying antirheumatic drugs alone or in combination. This review assessed whether the use of biological agents in early rheumatoid arthritis can lead to disease remission.
ObjectiveTo evaluate the efficacy of biological therapies in inducing remission in patients with early rheumatoid arthritis.
MethodsType of study: systematic review of the literature. A systematic search of the literature was made in specialized electronic health databases: PubMed, Embase, Cochrane, LILACS, gray literature (doctoral theses, congresses, entity reports, unpublished works) and manual search (Secondary searches of the studies cited in the selected articles). Inclusion criteria: Patients older than 18 years with early rheumatoid arthritis (clinical course less than 12 months) according to criteria of the American College of Rheumatology / European League against Rheumatism (ACR 1987, ACR / EULAR 2010), who received biological therapy Monotherapy or combined with other disease modifying antirheumatic drugs (DMARDs) and were included in randomized controlled trials.
ResultsThe systematic review of the literature identified 978 potentially relevant studies. Of the 86 that were chosen for a thorough evaluation, 68 articles were excluded. A qualitative and quantitative analysis of the remaining 18 studies was performed. A high risk of bias was identified in the studies evaluated and synthesis of the evidence did not show differences in the outcome of remission using biological therapy alone or combined with conventional DMARDs versus synthetic DMARDs (RR 1.08, 95% CI: 0.94-1.23).
ConclusionsThere is no difference in the outcome of remission in patients with early rheumatoid arthritis receiving biological therapy versus patients treated with conventional disease modifying antirheumatic drugs.
La artritis reumatoide (AR) es una enfermedad inflamatoria sistémica, crónica, de causa desconocida (existen hipótesis respecto a la exposición a un desencadenante externo como el cigarrillo, la infección, etc., con consecuente reactivación autoinmune, inflamación articular crónica e hipertrofia sinovial en un paciente genéticamente predispuesto), con una prevalencia cercana al 1% en el mundo, relacionada con desenlaces adversos mayores como destrucción articular, incapacidad física y mortalidad prematura. El curso de la enfermedad puede modificarse y se puede enlentecer e incluso prevenir el daño estructural por medio de tratamientos antirreumáticos modificadores de la enfermedad sintéticos, glucocorticoides y agentes biológicos, además de proporcionarle al paciente una mejor calidad de vida cuando se emplean de forma concomitante medicamentos como los antiinflamatorios no esteroideos y la terapia física. Un escenario especial lo constituye la AR temprana, en la cual el uso temprano de fármacos antirreumáticos modificadores de la enfermedad (FARME o DMARD por sus siglas en inglés de disease-modifying antirheumatic drugs) y agentes biológicos podría generar un control sintomático y una reducción de la actividad de la enfermedad hasta la remisión de la misma. El presente artículo evalúa, mediante revisión sistemática de la literatura y metaanálisis, si el uso de agentes biológicos en la AR temprana favorece la remisión de esta entidad medida a través del Disease Activity Score 28 (DAS28)1-6.
Materiales y métodosTipo de estudio: revisión sistemática de la literatura.
Población:
- •
Pacientes mayores de 18 años con AR temprana según criterios del Colegio Americano de Reumatología/Liga Europea contra el Reumatismo (ACR 1987, ACR/EULAR 2010) que recibieron terapia biológica en monoterapia o combinada con otros FARME y fueron incluidos en estudios clínicos, controlados, aleatorizados.
- •
Criterios de inclusión:
- •
- •
Ensayos clínicos, estudios comparativos, controlados, aleatorizados, que evaluaron las siguientes intervenciones: uso de terapia biológica anti-TNF (infliximab, adalimumab, certolizumab, etanercept, golimumab) y no anti-TNF (rituximab, anakinra, tocilizumab, abatacept, ocrelizumab), sola o en combinación con FARME convencionales (metotrexato [MTX], hidroxicloroquina, cloroquina, leflunomida o sulfasalazina) en pacientes con AR temprana, definida como aquella con un curso clínico menor de 12 meses. Los estudios clínicos debían evaluar en los objetivos primarios o secundarios la eficacia de la terapia biológica en inducir remisión de la enfermedad, determinada por un puntaje en la escala DAS28 menor de 2,6 o DAS44 menor de 1,6.
Criterios de exclusión:
- •
Artículos que incluyen pacientes con AR establecida.
- •
Uso previo de agentes biológicos.
- •
Artículos sin acceso a texto completo.
- •
Artículos duplicados.
- •
Estudios que no evaluaban la actividad de la enfermedad utilizando la escala DAS28 o equivalente.
- •
Pacientes embarazadas o en etapa de lactancia.
- •
Pacientes en terapia biológica por enfermedades reumatológicas diferentes a la AR.
Se describen las variables correspondientes a la población en estudio y aquellas que determinan la eficacia de la terapia biológica en inducir la remisión de la AR temprana (tabla 1).
Matriz de variables
| Nombre | Definición conceptual de variable | Indicador | Escala de medición |
|---|---|---|---|
| Edad | Años de vida del paciente | Día del último cumpleaños | Cuantitativa, continua por años |
| Sexo | Género al que pertenece el paciente | 0. Femenino 1. Masculino | Cualitativa, nominal por género |
| Antecedente personal de AR temprana | Diagnóstico establecido de AR con un tiempo de evolución de máximo un año | 0. Ausente 1. Presente | Cualitativa, nominal |
| Tratamiento | Medicamentos utilizados en el manejo de la enfermedad | 0. Terapia biológica 1. FARME 2. Terapia biológica+FARME | Cualitativa, nominal |
| Actividad de la enfermedad posterior a tratamiento | Aspectos relacionados con la intensidad de los síntomas de AR posterior al tratamiento | Sistema de clasificación según presencia de síntomas y signos clínicos DAS28 | Cualitativa, nominal |
AR: artritis reumatoide; DAS28: Disease Activity Score; FARME: fármacos antirreumáticos modificadores de la enfermedad.
La recolección de la información se realizó mediante la búsqueda sistemática de la literatura en bases de datos electrónicas especializadas en ciencias de la salud: PubMed, Embase, Cochrane, LILACS, literatura gris (tesis doctorales, intervenciones en congresos, informes de entidades, trabajos no publicados) y búsqueda manual (búsquedas secundarias de los estudios citados en los artículos seleccionados).
Se utilizaron los siguientes términos Mesh y de texto libre: («early diagnosis»[ti] AND «arthritis»[ti] AND «rheumatoid»[ti]) AND («antirheumatic agents» OR «biological therapy» OR «biologics») AND («treatment outcome» OR «remission induction»). Se manejaron los siguientes filtros en la búsqueda de la información: estudios clínicos, estudios comparativos, estudios clínicos controlados y estudios clínicos controlados aleatorizados. La búsqueda se realizó entre los meses de abril a junio de 2014 e incluyó artículos publicados hasta el 30 de junio de 2014, sin restricción de idioma.
Dos investigadores trabajaron en la evaluación de cada título y resumen para excluir informes irrelevantes; en caso de desacuerdo sobre la inclusión de un estudio específico se evaluó en forma conjunta, y de no lograrse un acuerdo se consultó a un tercero (experto en el área de contenido). De forma independiente, los investigadores determinaron si el texto completo de cada artículo cumplía los criterios de elegibilidad. Al evaluar la relevancia de los estudios se tenía conocimiento sobre los autores, instituciones, revista de publicación y resultados.
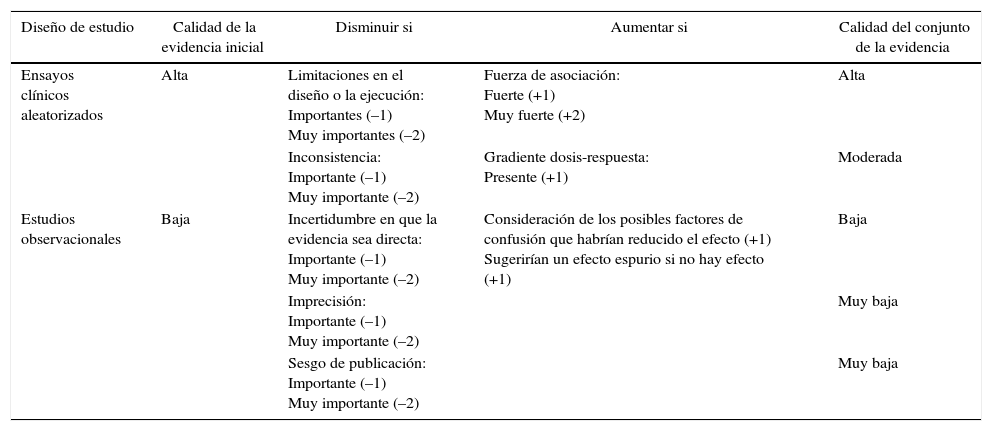
La calidad de los estudios incluidos en la presente revisión sistemática fue evaluada mediante las recomendaciones del sistema Grading of Recommendations, Assessment, Development and Evaluation (GRADE), en el cual se tienen en cuenta aspectos como el riesgo de sesgos, las imprecisiones, las inconsistencias y los sesgos de publicación para realizar una estimación más confiable sobre la eficacia de la terapia biológica en inducir la remisión clínica de la AR temprana. Mediante este sistema se clasificaron los estudios según su nivel de evidencia en alta, moderada, baja o muy baja6 (tabla 2).
Evaluación de la calidad de la evidencia según el tipo de diseño de los estudios
| Diseño de estudio | Calidad de la evidencia inicial | Disminuir si | Aumentar si | Calidad del conjunto de la evidencia |
|---|---|---|---|---|
| Ensayos clínicos aleatorizados | Alta | Limitaciones en el diseño o la ejecución: Importantes (–1) Muy importantes (–2) | Fuerza de asociación: Fuerte (+1) Muy fuerte (+2) | Alta |
| Inconsistencia: Importante (–1) Muy importante (–2) | Gradiente dosis-respuesta: Presente (+1) | Moderada | ||
| Estudios observacionales | Baja | Incertidumbre en que la evidencia sea directa: Importante (–1) Muy importante (–2) | Consideración de los posibles factores de confusión que habrían reducido el efecto (+1) Sugerirían un efecto espurio si no hay efecto (+1) | Baja |
| Imprecisión: Importante (–1) Muy importante (–2) | Muy baja | |||
| Sesgo de publicación: Importante (–1) Muy importante (–2) | Muy baja |
Fuente: adaptado de Guyatt et al.34.
La metodología es reportada de acuerdo con las guías PRISMA para la realización de revisiones sistemáticas y metaanálisis. El grado de heterogeneidad de los estudios se evaluó mediante las pruebas Chi2 e I2.
ResultadosLa revisión sistemática de la literatura identificó 978 estudios potencialmente relevantes (Pubmed: 211; Embase: 580; Cochrane: 185; LILACS: 2) de los cuales 86 fueron escogidos para la evaluación completa en pro de evaluar la elegibilidad.
Se excluyeron 68 artículos; la mayoría de estos fueron excluidos debido a que la población no cumplía con el criterio establecido para el tiempo de duración de la enfermedad, correspondiente a menos de un año en AR temprana o, adicionalmente, a que la metodología del estudio no correspondía a ensayos clínicos o estudios (comparativos, controlados o aleatorizados). En la evaluación para realizar la síntesis cualitativa y cuantitativa se incluyeron un total de 18 estudios (fig. 1, tabla 3). Las características de los estudios incluidos son descritas de forma completa en la tabla 3 de la presente revisión.
Características de los estudios
| Título, autores y año | PICO | Diseño | Duración del estudio | Número total participantes | Nombre biológicoa | Biológico monoterapia vs. biológico + FARMEb | Dosis medicamento |
|---|---|---|---|---|---|---|---|
| Recovery of clinical but not radiographic outcomes by the delayed addition of adalimumab to methotrexate-treated Japanese patients with early rheumatoid arthritis: 52-week results of the HOPEFUL-1 trial. Yamanaka et al., 2014 | P: pacientes AR temprana con alta actividad. I: ADA + MTX. C: ADA, 26 sem: MTX. O: eficacia | Multicéntrico, aleatorizado, controlado con placebo | 52 semanas | 333 (278 completaron 52 sem) | 2 | 1 | 40mg ADA cada 2 sem + MTX inicial 6mg/sem o placebo cada 15 días + MTX/sem por 26 sem. La dosis MTX se podía incrementar 8mg/sem a la sem 8 |
| Clinical and radiographic outcomes of four different treatment strategies in patients with early rheumatoid arthritis (the BeSt study): A randomized, controlled trial. Goekoop-Ruiterman et al., 2008 | P: AR temprana. I: infliximab. C: metotrexato, leflunomida, sulfasalazina, prednisona. O: funcionalidad, HAQ, cambio radiológico, remisión DAS44 <1,6 | Multicéntrico, aleatorizado | 28 meses | 508 | 1 | 1 | Rangos de dosis: MTX 15-30mg/sem. INF 3-10mg/kg cada 8 sem, SSZ 2.000-3.000mg/día. Leflunomida 20mg/día. HCQ 400mg/día, prednisona 7,5mg/día. CSA 2,5mg/kg/día. Sales de oro 50mg/sem. MP 120mg/sem. ADA 2-3mg/kg/día |
| Evaluation of two strategies (initial methotrexate monotherapy vs its combination with adalimumab) in management of early active rheumatoid arthritis: Data from the GUEPARD trial. Martin Soubrie et al., 2009 | P: pacientes AR temprana con actividad alta. I: MTX, ADA. C: MTX. O: evaluar si 3 meses de ADA + MTX logra actividad baja vs. MTX monoterapia | Multicéntrico, prospectivo, aleatorizado, no controlado | 1 año | 65 | 2 | 1 | MTX 0,3mg/kg/sem (máximo 20mg/sem) y ADA 40mg cada 2 sem vs. MTX 0,3mg/kg/sem (máximo 20mg/sem) |
| Comparison of Treatment Strategies in Early Rheumatoid Arthritis. Yvonne et al., 2007 | P: AR temprana. I: INF. C: MTX, SSZ, leflunomida, sal de oro + MP, CSA, prednisona, azatioprina. O: habilidad funcional, ACR20, ACR70 y remisión clínica | Controlado, aleatorizado | 28 meses | 508 | 1 | 1 | No descritos en el texto. Remiten a BeSt study |
| Adalimumab added to a treat-to-target strategy with methotrexate and intra-articular triamcinolone in early rheumatoid arthritis increased remission rates function and quality of life. The OPERA Study: an investigator-initiated, randomised, double-blind, parallel-group, placebo-controlled trial. Hørslev-Petersen et al., 2013 | P: AR temprana. I: ADA + MTX. C: MTX + placebo. O: proporción de pacientes con actividad baja (DAS28 CRP<3,2) a 12 meses. Secundario: pacientes con remisión (DAS28 CRP<2,6) | Aleatorizado, doble ciego, controlado con placebo | 12 meses | 180 | 2 | 1 | ADA 40mg cada 2 sem. MTX 7,5-20mg/sem |
| Adalimumab, a human anti-TNF monoclonal antibody, outcome study for the prevention of joint damage in Japanese patients with early rheumatoid arthritis: the HOPEFUL 1 study. Takeuchi et al., 2014 | P: pacientes con AR. I: ADA. C: MTX. O: inhibición progresión radiográfica y cambios en mTSS. Secundario: remisión DAS28-ESR<2,6 a la sem 26<2,6 a la sem 26 | Multicéntrico, aleatorizado, doble ciego, controlado con placebo | 26 meses | 406 | 2 | 1 | ADA 40mg cada 2 sem +MTX 6-8mg/sem vs. MTX 6-8mg/sem solo por 26 sem |
| Benefits 8 years after a remission induction regime with an infliximab and methotrexate combination in early rheumatoid arthritis. Bejarano et al., 2010 | P: AR<1 año duración. I: INF (3mg/kg) o placebo 1 año INF o placebo. C: placebo. O: puntaje HAQ y RAQoL a 8 años | Prospectivo de cohorte de un estudio previo aleatorizado, doble ciego, controlado con placebo | 8 años | 18 | 1 | 1 | INF (3mg/kg) o placebo |
| Comparison of methotrexate monotherapy with a combination of methotrexate and etanercept in active, early, moderate to severe rheumatoid arthritis (COMET): A randomized, double-blind, parallel treatment trial. Breedveld et al., 2008 | P: AR I: MTX. I: etanercept. C: MTX. O: remisión enfermedad y no progresión radiológica | Multicéntrico, aleatorizado, doble ciego | 2 años | 542 | 4 | 1 | MTX: hasta 20mg/sem, según necesidad bajas dosis esteroides etanercept 50mg/sem |
| Treatment of early rheumatoid arthritis: a randomized magnetic resonance imaging study comparing the effects of methotrexate alone, methotrexate in combination with infliximab, and methotrexate in combination with intravenous pulse methylprednisolone. Durez P et al., 2007 | P: AR, 1 año duración con enfermedad activa, no tratados con MTX. I: MTX. C: MTX + iv MP o MTX + INF. O: efecto en sinovitis detectada por RM, cambios erosivos | Ensayo clínico aleatorizado | 2 años | 44 | 1 | 1 | MTX 7,5-20mg/sem. MP (1 g) o INF (3mg/kg) |
| Adjustment of therapy in rheumatoid arthritis on the basis of achievement of stable low disease activity with adalimumab plus methotrexate or methotrexate alone: The randomised controlled OPTIMA trial. Smolen et al., 2014 | P: AR<1 año. I: ADA. C: MTX. O: pacientes con baja actividad a la sem 78 y no progresión radiológica | Doble ciego, aleatorizado | 78 semanas | 1.032 | 2 | 1 | ADA (40mg/2 sem + MTX 7,5mg/sem a 20mg o placebo + MTX |
| Remission induction comparing infliximab and high-dose intravenous steroid, followed by treat-to-target: A double-blind, randomized, controlled trial in new-onset, treatment-naive, rheumatoid arthritis (the IDEA study). Nam et al., 2014 | P: AR 3-12 meses de síntomas y sin FARME previo. Con enfermedad activa. I: infliximab. C: MTX. O: puntaje Van der Heijde modificado (mTSS) 21 a la sem 50. Secundarios: remisión | Multicéntrico, aleatorizado, doble ciego, controlado | 78 semanas | 112 | 1 | 1 | INF (3mg/kg) o infusiones de placebo. MTX 10-20mg/sem |
| Clinical and radiological dissociation of anti-TNF plus methotrexate treatment in early rheumatoid arthritis in routine care: Results from the ABRAB study. Juhász et al., 2014 | P: pacientes con AR temprana. I: anti-TNF + MTX. C: MTX. O: eficacia clínica y radiológica de anti-TNF + MTX vs. MTX monoterapia | Análisis retrospectivo de una cohorte observacional | 12 meses | 84 | 11 | 1 | MTX 10-20mg/sem. Dosis de anti-TNF no descrita |
| Validation of the methotrexate-first strategy in patients with early, poor-prognosis rheumatoid arthritis: Results from a two-year randomized, double-blind trial. O’Dell et al., 2013 | P: pacientes AR temprana de mal pronóstico. I: etanercept + MTX o MTX + SSZ o MTX + HCQ. C: MTX. O: DAS28-ESR entre sem 48 a 102 | Aleatorizado, doble ciego | 102 semanas | 755 | 4 | 1 | MTX 20mg/sem. Etanercept 50mg/sem sc, SSZ 500mg-100mg BID, HCQ 200mg BID |
| Targeted treatment with a combination of traditional DMARDs produces excellent clinical and radiographic long-term outcomes in early rheumatoid arthritis regardless of initial infliximab. The 5-year follow-up results of a randomised clinical trial, the NEO-RACo trial. Rantalaiho et al., 2014 | P: pacientes con AR temprana, sin FARME previo. I:MTX, SSZ, HCQ, prednisolona + INF. C: MTX, SSZ, HCQ + prednisolona + placebo. O: ACR remisión, remisión en daño radiológico. Secundarios: DAS28 remisión y puntaje<2,6 a la sem 26 | Multicéntrico, aleatorizado, controlado con placebo | 5 años | 99 | 1 | 1 | MTX 10mg hasta 25mg/sem. SSZ hasta 2g/día, HCQ 35mg/kg/sem y prednisolona 7,5mg/día. INF (3mg/kg) o infusión placebo |
| Infliximab for 6 months added on combination therapy in early rheumatoid arthritis: 2-year results from an investigator-initiated, randomised, double-blind, placebo-controlled study (the NEO-RACo Study). Leirisalo-Repo et al., 2013 | P: pacientes AR síntomas ≤12 meses, sin previo FARME con enf. activa. I: INF + MTX + SSZ HCQ + prednisolona. C: MTX, SASP, HCQ + prednisolona + placebo. O: remisión y progresión radiológica posterior a INF+ terapia intensificada FIN-RACo vs. FIN-RACo como único régimen<2,6 a la sem 26 | Multicéntrico, aleatorizado, placebo controlado | 2 años | 99 | 1 | 1 | MTX 20-25mg/sem, SSZ 1-2g/día, HCQ 35mg/kg/sem, INF 3mg/kg o infusión placebo sem 4,6,10,18,26 |
| Induction therapy with adalimumab plus methotrexate for 24 weeks followed by methotrexate monotherapy up to week 48 versus methotrexate therapy alone for DMARD-naïve patients with early rheumatoid arthritis: HIT HARD, an investigator-initiated study. Detert et al., 2013 | P: pacientes con AR de 1 año. I: MTX + ADA. C: MTX + placebo. O: evaluación DAS28 sem 48. Otros: porcentaje pacientes con remisión (DAS28 <2,6) y respuesta ACR20, 50 o 70 | Aleatorizado, controlado, doble ciego | 1 año | 172 | 2 | 1 | ADA 40mg cada 2 sem. MTX 15mg/sem |
| Disease activity, physical function, and radiographic progression after longterm therapy with adalimumab plus methotrexate: 5-Year results of PREMIER. Van der Heijde et al., 2010 | P: pacientes con AR <3 años. I: ADA + MTX. C: ADA o MTX. O: ventaja terapia combinada inicial vs. monoterapia | 2 años iniciales: Multicéntrico, aleatorizado controlado con comparador activo, doble ciego Después de 2 años: fase open-label | 5 años | 799 (388 completaron 5 años) | 2 | 1 | MTX 7,5-20mg/sem. ADA 40mg/cada 2 sem |
| A randomized comparative effectiveness study of oral triple therapy versus etanercept plus methotrexatein early aggressive rheumatoid arthritis. Moreland et al., 2012 | P: AR activa. I: MTX + etanercept. C: MTX + SSZ + HCQ, o MTX monoterapia escalonada a terapia combinada (MTX + etanercept o MTX + SSZ + HCQ). O: DAS28-ESR sem 48-102. Otros: mejoría actividad ACR20, 50, 70 | Aleatorizado doble ciego | 2 años | 755 | 4 | 1 | MTX 20mg/sem. SSZ 500-1.000mg BID. HCQ 200mg BID. Etanercept 50mg/sem sc |
ACR: Colegio Americano de Reumatología; ADA: adalimumab; AR: artritis reumatoide; BID: dos veces al día; CSA: ciclosporina A; DAS: Disease Activity Score; DAS28-CRP: puntaje de actividad de la enfermedad que incluye solo proteína C reactiva), items: TJC28: número de articulaciones dolorosas (0-28); SJC28: número de articulaciones inflamadas (0-28); CRP: PCR (en mg/l); GH: evaluación global de la salud (de 0=mejor a 100=peor); DAS28-ESR: puntaje de actividad de la enfermedad que incluye solo ESR (VSG: velocidad de sedimentación globular); FARME: fármacos antirreumáticos modificadores de la enfermedad; FIN-RACo: The Finnish Rheumatoid Arthritis Combination Therapy; HCQ: hidroxicloroquina; INF: infliximab; MP: metilprednisolona; mTSS: puntaje total modificado de Sharp; MTX: metotrexato; SSZ: sulfasalazina.
Los resultados relacionados con el desenlace remisión clínica fueron reportados en la mayoría de estudios según el puntaje en la escala DAS28 y en menor proporción utilizando la escala DAS44, considerándose remisión un puntaje menor de 2,6 y 1,6, respectivamente.
Nueve estudios reportaron como desenlace la remisión de la enfermedad en un período igual o menor que un año de seguimiento; 3 de estos lograron demostrar diferencias estadísticamente significativas al comparar terapia biológica versus medicamentos antirreumáticos convencionales. Hørslev-Petersen et al. encontraron una mayor proporción de pacientes con DAS28<2,6 a los 12 meses en el grupo de adalimumab/MTX/corticoide intraarticular comparado con MTX/corticoide intraarticular, siendo esta del 74 y 49%, respectivamente, con un RR=1,51 (IC 95%: 1,18-1,93; p=0,001). En el grupo estudiado por Takeuchi et al., se evidenció que los pacientes tratados con adalimumab más MTX tuvieron mayor probabilidad de alcanzar remisión clínica (31%) comparados con el grupo asignado a MTX en monoterapia (14,5%) a la semana 26 de tratamiento, con un RR=2,11 (IC 95%: 1,37-3,24; p=0,007). Adicionalmente, el estudio conducido por Emery et al. mostró un mayor número de pacientes con remisión clínica a las 52 semanas en el grupo tratado con etanercept/MTX (50%) con relación a pacientes tratados con MTX en monoterapia (28%), con un RR=1,79 (IC 95%: 1,43-2,26; p=0,00001).
Seis estudios evaluaron remisión de la AR temprana en pacientes que tuvieron seguimiento durante 13 y 24 meses posteriores al inicio de tratamiento, mostrando diferencias significativas el estudio realizado por O’Dell et al., el cual sustenta el uso de MTX en monoterapia como manejo inicial de pacientes con AR temprana con factores de mal pronóstico, logrando remisión en el 50,6% de los pacientes tratados con MTX comparado con el 34,2% de pacientes que recibieron terapia combinada progresiva (MTX+etanercept o MTX+sulfasalazina+hidroxicloroquina) (RR=0,67 [IC 95%: 0,51-0,88]; p=0,004).
El desenlace remisión de la enfermedad por un período mayor de 2 años fue descrito en 3 estudios sin encontrarse diferencias al comparar terapia biológica con FARME.
Se realizó una evaluación del riesgo de sesgos teniendo en cuenta los siguientes aspectos: la presencia de sesgo de selección medida por la generación de la secuencia y el ocultamiento de la asignación, presencia de sesgo de realización evaluando el cegamiento de los participantes y del personal, existencia de sesgo de detección si no presentaban cegamiento de evaluadores del resultado y sesgo de desgate relacionado con datos de resultados incompletos (pérdida de datos/pacientes mayor del 10% de los incluidos al inicio del estudio). En forma general, se encontró un alto riesgo de sesgos (fig. 2).
La síntesis de la evidencia a través del metaanálisis no evidenció diferencias con relación al desenlace remisión de la enfermedad, al utilizar terapia biológica en monoterapia o combinada con FARME convencionales versus el uso de FARME (RR=1,08; IC 95%: 0,94-1,23). El análisis de datos fue realizado mediante el programa RevMan 5.3 suministrado por Cochrane (http://tech.cochrane.org/revman/download).
DiscusiónLa AR es una enfermedad crónica, destructiva y persistente, de predominio articular, cuya causa no se conoce con claridad hasta el momento, afecta a múltiples sistemas aunque su principal órgano blanco es la membrana sinovial; se caracteriza por poliartritis simétrica (sinovitis) inflamatoria autoinmune, en el contexto de pruebas serológicas de autorreactividad positivas; aunque no existe una prueba de laboratorio patognomónica para el diagnóstico de la AR, la presencia del factor reumatoide y anticuerpos anticitrulina son muy sugestivos de esta afección. En la enfermedad extraarticular puede existir compromiso cardiopulmonar, cutáneo, renal, ocular, gastrointestinal, neurológico, vascular y los pacientes sin tratamiento pueden progresar a deformidad articular marcada, destrucción articular severa, limitación funcional y aumento de la mortalidad en relación con enfermedad cardiovascular acelerada1,2.
La AR es la enfermedad articular inflamatoria, crónica, más frecuente y grave en el mundo, con una incidencia anual que se aproxima a 3 casos por cada 10.000 habitantes, una prevalencia cercana al 1%, que incrementa con la edad y tiene su mayor pico en las edades de 35 a 50 años. Esta entidad afecta a todas las poblaciones, aunque su prevalencia es mayor en algunos grupos. En Latinoamérica, entre el 0,4 y el 1% de la población puede padecerla, siendo más frecuente en pacientes de género femenino, con una relación de 6-8:1 en esta región1-5,7.
Como ocurre con otras enfermedades, la AR requiere un abordaje integral que debe contener intervenciones no farmacológicas, como modificaciones en el estilo de vida, con ejercicios dinámicos, terapia ocupacional, hidroterapia y cese del hábito del tabaco; clásicamente se han utilizado en el manejo de la AR los medicamentos FARME convencionales, los cuales incluyen el MTX, antimaláricos (hidroxicloroquina, cloroquina), leflunomida, sulfasalazina y particularmente en las últimas décadas se han empezado a utilizar, cada vez con mayor frecuencia, nuevos grupos de medicamentos que como la terapia biológica o FARME biológicos (anti-TNF y no anti-TNF) han empezado a demostrar un papel importante como modificadores del curso clínico de la AR y la remisión de la misma. Las estrategias de manejo en AR han cambiado significativamente en los últimos años en pro de disminuir la carga sintomática de la enfermedad, la progresión del daño articular y la discapacidad funcional. Existe evidencia de que el inicio temprano de medidas farmacológicas se traduce en mejores desenlaces, basado en el concepto «ventana de oportunidad», el cual indica que en la fase inicial de la enfermedad existe una mayor respuesta al tratamiento, logrando alterar su evolución natural y en algunos casos retornar a la normalidad8.
Los FARME biológicos se han estudiado en diferentes escenarios, los inhibidores de TNF (etanercept, infliximab, adalimumab) e IL-1 (anakinra) han demostrado su eficacia y seguridad en AR de larga evolución, pero los estudios en AR temprana son escasos.
El estudio ATTRACT (AntiTNF Therapy in RA with Concomitant Therapy) muestra cómo la terapia combinada de infliximab y MTX aumenta el beneficio clínico y radiográfico en pacientes con AR activa a pesar de haber recibido terapia con MTX (estudio no dirigido a pacientes con AR temprana aunque cerca del 20% tenían una evolución menor de 3 años); se incluyeron más de 400 pacientes y en el análisis a las 52 y 102 semanas se evidenció que los pacientes tratados con cualquiera de los regímenes de infliximab (3 o 10mg/kg cada 4 u 8 semanas) más MTX tenían una mejoría significativa en los índices radiográficos, índices de erosión y pinzamiento del espacio articular frente al grupo de MTX solo; en el subanálisis del grupo de pacientes con AR temprana se documentó que aquellos que recibieron infliximab presentaron mayor inhibición de la progresión del daño estructural en un período de tratamiento de 2 años, por lo que se concluyó que el uso temprano de agentes anti-TNF podría dar beneficios a largo plazo en cuanto a progresión de la enfermedad y la preservación de la integridad articular9,10. Estudios posteriores como el ASPIRE (Active-Controlled Study of Patients Receiving Infliximab for the Treatment of Rheumatoid Arthritis of Early Onset) con más de 1.000 pacientes evaluados mostraron resultados similares en cuanto a tasas de respuesta clínica al utilizar combinaciones de dosis de infliximab con MTX. En el estudio de Quinn et al., en el que se evaluaron 20 pacientes con AR de duración menor de un año de evolución, con factores de mal pronóstico, se aleatorizaron los pacientes a recibir MTX más infliximab 3mg/kg o MTX más placebo, observándose que todos los índices radiológicos valorados por resonancia magnética fueron significativamente mejores, sin nuevas erosiones y con mejoría de la capacidad funcional en el grupo de infliximab más MTX; como hallazgo relevante un año después de la suspensión de la terapia de inducción, la respuesta fue sostenida en el 70% de los pacientes en el grupo de infliximab más MTX, con una media de DAS28 de 2,05 (rango de remisión)11,12.
El estudio ERA (Early RA study) evaluó la eficacia y seguridad del etanercept en el manejo de la AR temprana comparado con MTX; en él fueron aleatorizados más de 600 pacientes con AR de duración menor de 3 años, no tratados previamente con MTX, los cuales fueron asignados a 3 grupos de tratamiento: MTX oral (media, 19mg/semana); etanercept, 10mg/2 veces por semana, y etanercept, 25mg/2 veces por semana. Comparado con MTX, el grupo de etanercept-25mg tuvo una más rápida mejoría a los 3, 6, 9 y 12 meses. En este estudio se evidencia también que etanercept y MTX en monoterapia demostraron ser eficaces en el tratamiento de la AR de menos de 3 años de evolución, aunque la combinación de anti-TNF y MTX es superior a ambos en monoterapia, tanto para los desenlaces clínicos como para los radiológicos; información adicional documentada por el estudio TEMPO (Trial of Etanercept and MTX with Radiographic Patient Outcomes), estudio no exclusivo de pacientes con AR temprana, muestra que dicha combinación es mejor en la reducción de la actividad de la enfermedad, mejoría de la capacidad funcional y el retraso de la progresión radiográfica con significación estadística13-15.
Otro agente anti-TNF, adalimumab, ha demostrado eficacia en el tratamiento de la AR establecida en el estudio ARMADA (The Anti–Tumor Necrosis Factor Research Study Program of the Monoclonal Antibody Adalimumab [D2E7] in Rheumatoid Arthritis), y los resultados de un subanálisis del estudio DEO19 indican que el tratamiento temprano con adalimumab puede ser más eficaz que su uso tardío en el curso de la AR. En el reciente estudio PREMIER se comparó la seguridad y la eficacia de adalimumab (40mg/cada 15 días) más MTX (en escalada rápida a 20mg semanales) con MTX o adalimumab en monoterapia en 799 pacientes con AR de menos de 3 años de evolución y no tratados anteriormente con MTX. La respuesta ACR50 en la semana 52 fue significativamente mayor en el brazo de la combinación que con MTX o adalimumab en monoterapia (el 62 frente al 46 y al 42%, respectivamente) (p<0,001); esta diferencia se mantuvo durante los 2 años de duración del estudio. En el 50% de los pacientes en el brazo de combinación se indujo una remisión sostenida de la enfermedad medida por el índice DAS28<2,6 y también se objetivó una respuesta clínica mayor. Con el tratamiento en combinación también se obtuvo una inhibición de la progresión radiográfica significativamente mayor que con cualquiera de los tratamientos en monoterapia. De acuerdo con lo observado en la figura 2, Diagrama de Bosque, los fármacos que tienen mayor probabilidad estadísticamente significativa de inducir respuesta y remisión serían adalimumab y etanercept, aunque los estudios que los soportan tienen limitaciones metodológicas16-18.
El desenlace final esperado al instaurar el manejo médico en los pacientes con AR es lograr la remisión total, aunque lograr una actividad baja de la enfermedad puede ser una meta aceptable en determinados casos. Para llegar a este objetivo se han planteado diversas estrategias: en 2013 la EULAR planteó las recomendaciones en las que se describe una intervención por fases; la fase I incluye pacientes con diagnóstico clínico de AR en los que de acuerdo con la severidad del cuadro se debería iniciar manejo con MTX o combinación de terapia FARME convencional más esteroide a bajas dosis y, en caso de contraindicación para MTX, utilizar terapia FARME en monoterapia o combinación excluyendo este fármaco; la fase II incluye pacientes que han tenido falla en la fase I o presencia de toxicidad, en estos se evalúa la presencia de factores de pronóstico no favorable (altos niveles de factor reumatoide o anticuerpos anticitrulina, actividad muy alta de la enfermedad, daño articular temprano), en ausencia de factores de riesgo se indica cambio a un segundo agente FARME solo o combinado y en presencia de factores de riesgo de mal pronóstico es el escenario donde tendría aplicación la adición de terapia con agentes biológicos; la fase III está constituida por pacientes en los que ha fallado la fase II, en este grupo de pacientes se indica cambiar a un segundo agente biológico en combinación con terapia FARME convencional. De acuerdo con estas recomendaciones, los agentes biológicos estarían reservados para pacientes en los que ha fallado el manejo con terapia convencional, sin embargo, cada vez más estudios (entre los que se destaca el estudio BeSt con más de 500 pacientes) empiezan a mostrar un nuevo espacio en el que los FARME biológicos tendrían lugar en etapas más tempranas de la enfermedad para alcanzar tasas mayores de remisión de la AR. Una estrategia que se plantea para definir qué pacientes se benefician más del inicio temprano del uso de agentes biológicos es la determinación de factores de mal pronóstico, la identificación de pacientes con AR tempana que tendrán enfermedad persistente y predecir la respuesta a los biológicos; además, se debe tener en consideración el costo y los posibles efectos adversos (infecciones severas, malignidad) derivados de la utilización de estos medicamentos. El presente estudio evalúa la capacidad de los agentes biológicos para lograr dicha remisión de la enfermedad, particularmente en pacientes con AR temprana, sin encontrarse diferencias en remisión de la enfermedad entre el uso de terapia biológica versus FARME convencionales4,19-31.
LimitacionesDestaca la heterogeneidad de los estudios analizados principalmente por diferencias clínicas y métodos epidemiológicos. En el presente estudio se demostró que existe una heterogeneidad significativa (I2=74%) entre los estudios metaanalizados, así como un alto riesgo de sesgos demostrado a través del sistema GRADE. Esta heterogeneidad radicó en diferencias en el diseño de los estudios analizados, destacando aquellas en el comparador (por ej., en algunos estudios fue MTX monoterapia mientras que en otros fueron terapias combinadas); de igual manera en el tiempo de medición de desenlace, el cual fue variable entre todos los estudios (proporción en remisión a los 6, 12, 24 o 60 meses), entre otras.
Existen limitaciones al evaluar la remisión de la enfermedad mediante el DAS28 debido a que un importante grupo de pacientes, que son clasificados en remisión por medio de esta herramienta, presentan signos inflamatorios como edema o dolor correspondiente a un bajo nivel de actividad de la AR. Con lo anterior se incluiría una proporción mayor de pacientes en remisión por DAS28 comparado con los criterios mACR, SDAI y CDAI32,33. Dado que la efectividad de la terapia biológica en inducir respuestas ACR20, ACR50 y ACR70 no fueron definidos como criterios de inclusión ni de desenlace en los diferentes estudios, estas variables no se incluyeron, lo cual limita su análisis.
Todas estas limitaciones invitan al lector a analizar con cautela los resultados del estudio en el momento de llevarlos a la práctica clínica.
ConclusionesAl evaluar esta revisión sistemática no se encuentran diferencias estadísticamente significativas en cuanto al desenlace de remisión de la enfermedad entre pacientes con AR temprana que reciben terapia biológica versus FARME convencionales.
Se requiere la realización de estudios clínicos de mejor calidad para poder determinar la eficacia de la terapia biológica en inducir remisión de la enfermedad en pacientes con AR temprana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.