Desde 1976 existe en cada una de las tres sociedades científicas que suscriben este documento una comisión de calidad. A partir de entonces y hasta la actualidad, han evolucionando tanto en su actuación como en sus objetivos, pasando del clásico control a la evaluación y la gestión total de la calidad.
Las comisiones inician sus actividades como organizadores de programas de control de calidad hacia el año 1980 y difunden su campo de actuación a las diferentes especialidades del laboratorio clínico. Sus características comunes han sido y son las siguientes:
- –
Confidencialidad como criterio ético esencial.
- –
Utilización de materiales de control sin valor asignado, utilizando los valores centrales remitidos por los participantes como puntos de comparación.
- –
Cobertura de un amplio rango de concentración de las magnitudes que se controlan, incluyendo valores críticos para la toma de decisiones clínicas.
- –
Independencia de empresas comerciales.
Además, las tres sociedades promueven la implantación de sistemas de gestión de la calidad en los laboratorios, definen especificaciones de la calidad dentro de sus organizaciones y organizan acciones formativas sobre temas relacionados con la calidad.
Otra característica común de estos programas es su amplia distribución geográfica, con participantes procedentes de todas las comunidades autonómicas y con los mismos tipo y variedad de laboratorios (hospital, asistencia primaria, públicos y privados), representando de forma completa y real la prestación sanitaria de los laboratorios clínicos españoles.
Recientemente, se ha creado un comité de expertos interdisciplinario formado por representantes de las tres sociedades de ámbito nacional con programas de garantía externa de la calidad. El propósito de dicho comité, en una primera fase, es definir las especificaciones de las magnitudes bioquímicas básicas propuestas y, posteriormente, revisar periódicamente dichas especificaciones para su permanente actualización y estudiar la ampliación de otras magnitudes analíticas.
Para la elaboración de este documento, se ha utilizado el criterio procedente de la Conferencia de Consenso Internacional de Estocolmo de 1999, que definió las especificaciones de la calidad analítica en el laboratorio clínico según un modelo jerárquico con cinco alternativas relacionadas con la satisfacción de las necesidades de los médicos en su uso de los datos del laboratorio1,2:
- –
Acotar la variación analítica con efecto en los resultados clínicos. Están descritos únicamente para detección del hipotiroidismo3, evaluación del riesgo de enfermedad cardíaca y del cáncer de próstata3, diabetes mellitus4, infarto agudo de miocardio5 y seguimiento de pacientes diabéticos6 y de pacientes con tumor testicular7.
- –
Acotar la variación analítica con efecto en las decisiones clínicas generales, que suelen ser el diagnóstico y cribado, así como el seguimiento de pacientes y el pronóstico y la evaluación del efecto del tratamiento. En el primer caso, se compara el resultado de un paciente con un valor cut-off o un intervalo de referencia poblacional, lo que requiere acotar la desviación analítica. En el segundo caso, se comparan varios resultados consecutivos del mismo paciente, para lo que se debe minimizar la imprecisión analítica. En ambos casos, las especificaciones de la calidad se derivan de los valores de variación biológica individual e interindividual, descritos para 287 magnitudes8,9.
- –
Recomendaciones de grupos de profesionales, como el National Colesterol Education Program Laboratory Standardization Panel10 y las Guías propuestas para el control interno de la calidad analítica en el laboratorio clínico11-14.
- –
Especificaciones propuestas por ley, como CLIA en EE.UU.15 y Richtlinie en Alemania16 o por organizadores de programas de evaluación externa de la calidad.
- –
Estado de la técnica (recomendaciones de programas de intercomparación y fabricantes)17,18.
En el cuarto nivel se encuentra el criterio seguido en este documento, cuyo punto de partida serían los datos disponibles en los dos programas de garantía externa de la calidad de alcance en todo el territorio español (programa de supervisión externa de la calidad [PSEC] de AEFA-AEBM y programa de garantía externa de la calidad [PGCLC] de la SEQC).
El desarrollo de este trabajo conjunto ha sido posible, entre otras cosas, porque las características de los programas son parecidas:
- –
Periodicidad mensual, siguiendo el año natural.
- –
Elaboración de certificados de inscripción y participación.
- –
Proceso informatizado de los resultados emitidos por los laboratorios participantes.
- –
Cálculos globales y desglosados por método analítico, por instrumento o por sistema analítico.
- –
Evaluación individual de cada laboratorio participante.
El propósito de este documento es establecer unos requisitos mínimos de la calidad analítica que promuevan la consecución de una prestación analítica homogénea entre los laboratorios participantes en los programas de las tres sociedades. Este objetivo llevaría implícita la idea de que por debajo de estas especificaciones mínimas un laboratorio no puede garantizar unas prestaciones analíticas de utilidad clínica.
Material y métodoEl material utilizado son los datos aportados por los participantes en los Programas de Garantía Externa de la Calidad de los ciclos 2005 y 2006, que se acumula informáticamente y constituye el datum. Éste es el punto de partida para conocer o completar el conocimiento exacto sobre especificaciones de la calidad extraídas del estado de la técnica, y es una referencia actualizable periódicamente, que está construida en forma de bases de datos.
El método utilizado consiste en:
ArmonizaciónSe utilizan los elementos comunes entre los programas, para que la información sea compatible. Éstos son:
- –
Identificación numérica del laboratorio.
- –
Ciclo anual.
- –
Período mensual.
- –
Magnitud.
- –
Resultado numérico informado por el laboratorio, correspondiente al análisis efectuado en una muestra control de un ciclo y período dados para una determinada magnitud.
- –
Valor de comparación que se utiliza para confeccionar la evaluación del resultado numérico informado por el laboratorio.
- –
Definición del valor de comparación.
La identificación numérica del laboratorio permite equiparar de forma inequívoca la procedencia de cada resultado numérico remitido por el laboratorio. Hay un resultado de cada laboratorio por magnitud, período (mes) y ciclo (año), proveniente del análisis de la muestra control.
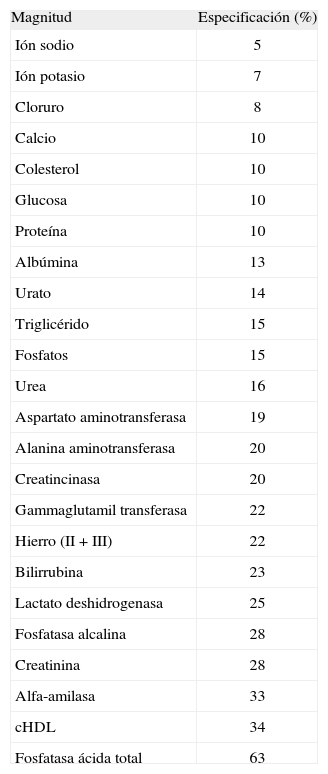
Las magnitudes incluidas en el datum son las 24 comunes a los programas de garantía externa de la calidad estudiados (tabla 1).
Magnitudes estudiadas y especificación de la calidad, expresada en porcentaje de desviación respecto al valor diana
| Magnitud | Especificación (%) |
| Ión sodio | 5 |
| Ión potasio | 7 |
| Cloruro | 8 |
| Calcio | 10 |
| Colesterol | 10 |
| Glucosa | 10 |
| Proteína | 10 |
| Albúmina | 13 |
| Urato | 14 |
| Triglicérido | 15 |
| Fosfatos | 15 |
| Urea | 16 |
| Aspartato aminotransferasa | 19 |
| Alanina aminotransferasa | 20 |
| Creatincinasa | 20 |
| Gammaglutamil transferasa | 22 |
| Hierro (II + III) | 22 |
| Bilirrubina | 23 |
| Lactato deshidrogenasa | 25 |
| Fosfatasa alcalina | 28 |
| Creatinina | 28 |
| Alfa-amilasa | 33 |
| cHDL | 34 |
| Fosfatasa ácida total | 63 |
cHDL: colesterol unido a lipoproteínas de alta densidad.
El valor de comparación es el valor resultante del consenso, empleando los resultados de los laboratorios que se obtienen al analizar una misma muestra.
Forma de cálculo de la especificaciónPor cada magnitud y para cada resultado se realiza lo siguiente:
- –
Se calcula el error como diferencia absoluta entre el resultado y el valor de comparación, expresado en porcentaje.
- –
Se confecciona una distribución de los errores obtenidos.
- –
Se segrega el 5% de la distribución con el mayor valor de error para descartar los valores discrepantes.
- –
Se elige del percentil 95 de la distribución de errores restante como valor de la especificación.
- –
Se redondea la especificación a valores enteros.
La descripción más detallada de la metodología de cálculo se expone en el Anexo 1.
Metodología de cálculo
|
El valor de comparación se obtiene mediante:
- –
La media global para albúmina, aspartato aminotransferasa, alanina aminotransferasa, bilirrubina, calcio, cloruro, colesterol, colesterol unido a lipoproteínas de alta densidad (cHDL), creatincinasa, creatinina, fosfatasa alcalina, fosfatos, glucosa, hierro (II + III), ión potasio, ión sodio, triglicérido, urato y urea.
- –
La media por método o instrumento para alfa-amilasa, fosfatasa ácida total, gammaglutamil transferasa, lactato deshidrogenasa y proteína.
La media global se ha elegido cuando a criterio de los organizadores de los programas la diferencia entre métodos o instrumentos es mínima, y en caso contrario, se ha elegido la media por método o instrumento.
ResultadosEl datum está compuesto por 619.430 resultados provenientes de los ciclos 2005 y 2006 para 24 muestras de control (1 por período). El número de laboratorios implicados ha sido 1.806.
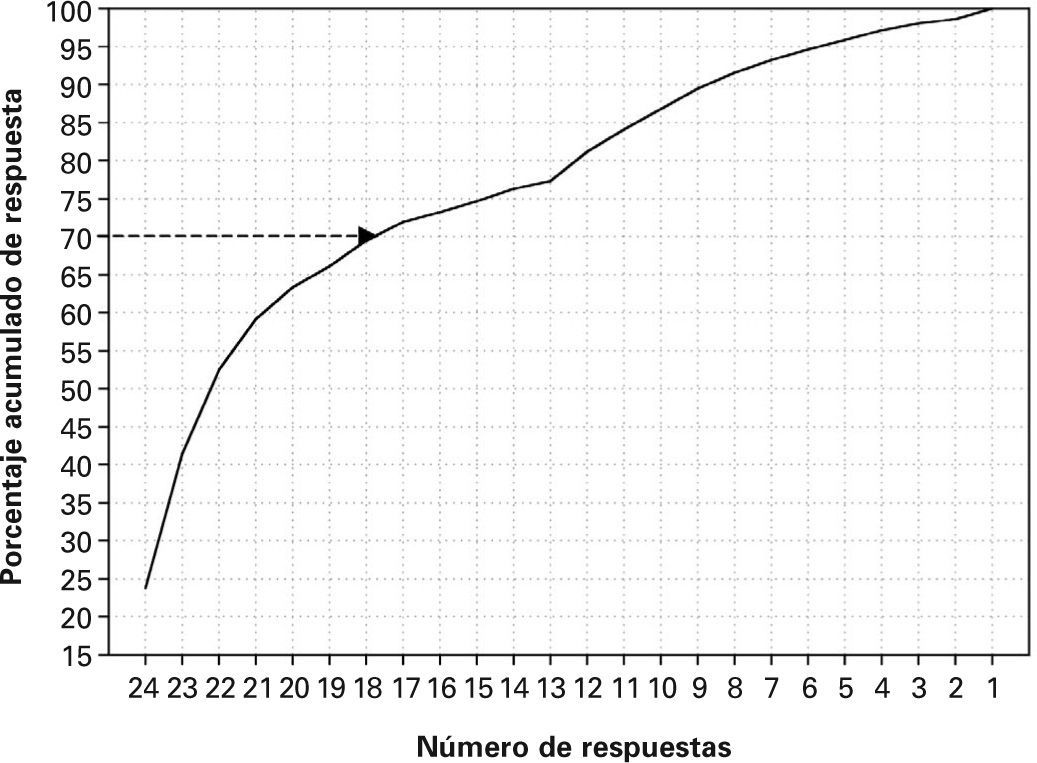
Para cada magnitud se ha realizado un recuento del número de resultados que aporta cada laboratorio. Por término medio, el 70% de los laboratorios suele contestar más del 75% de las respuestas posibles (18 de 24). Un ejemplo se muestra en la figura 1, correspondiente a la creatinina.
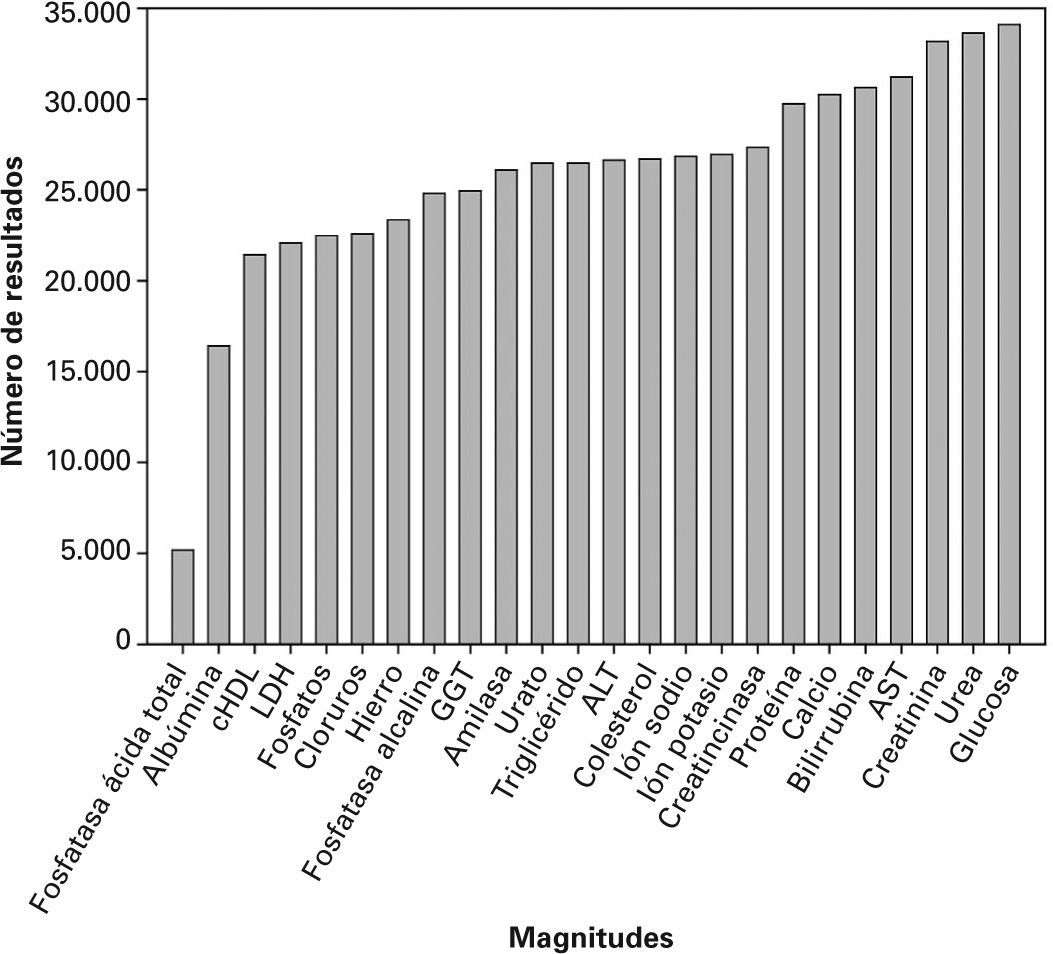
En la figura 2 se muestran los resultados tratados por cada magnitud. El número de resultados por magnitud se sitúa entre 5.158 para fosfatasa ácida total y 34.088 para la glucosa. La media de resultados obtenidos es de 25.810.
Los valores de especificación obtenidos con los datos conjuntos de los años 2005 y 2006 se presentan en la tabla 1, ordenados según el valor numérico de la especificación.
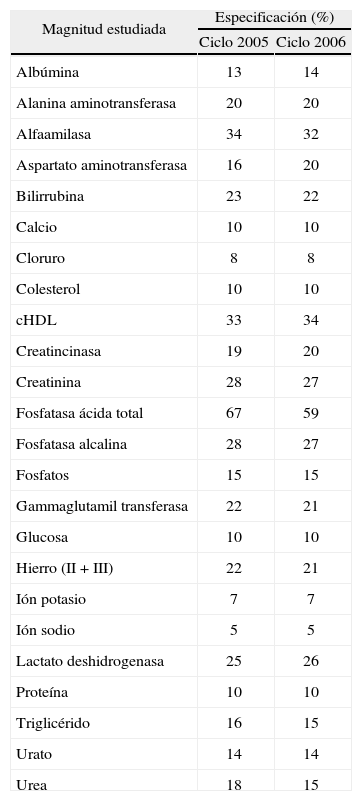
La tabla 2 presenta los resultados de especificación que se obtendrían si sólo se hubiese tenido en cuenta el ciclo 2005 y el ciclo 2006 de forma independiente. En este caso, los valores obtenidos de especificación se diferencian de media un 4,6%, con un rango de 019,3%.
Especificación que se obtendría si sólo se hubiese tenido en cuenta el ciclo 2005 y el ciclo 2006 (orden alfabético)
| Magnitud estudiada | Especificación (%) | |
| Ciclo 2005 | Ciclo 2006 | |
| Albúmina | 13 | 14 |
| Alanina aminotransferasa | 20 | 20 |
| Alfaamilasa | 34 | 32 |
| Aspartato aminotransferasa | 16 | 20 |
| Bilirrubina | 23 | 22 |
| Calcio | 10 | 10 |
| Cloruro | 8 | 8 |
| Colesterol | 10 | 10 |
| cHDL | 33 | 34 |
| Creatincinasa | 19 | 20 |
| Creatinina | 28 | 27 |
| Fosfatasa ácida total | 67 | 59 |
| Fosfatasa alcalina | 28 | 27 |
| Fosfatos | 15 | 15 |
| Gammaglutamil transferasa | 22 | 21 |
| Glucosa | 10 | 10 |
| Hierro (II + III) | 22 | 21 |
| Ión potasio | 7 | 7 |
| Ión sodio | 5 | 5 |
| Lactato deshidrogenasa | 25 | 26 |
| Proteína | 10 | 10 |
| Triglicérido | 16 | 15 |
| Urato | 14 | 14 |
| Urea | 18 | 15 |
cHDL: colesterol unido a lipoproteínas de alta densidad.
Los laboratorios participantes en los dos programas de garantía externa de la calidad implicados en este trabajo están distribuidos por su número y ubicación en todas las autonomías españolas y, por tanto, son perfectamente representativos de la prestación analítica de España.
El número de laboratorios y de resultados aportados hace del datum una referencia suficientemente sólida para reflejar el estado de la tecnología analítica del laboratorio clínico.
Es importante resaltar que la mayoría de los laboratorios participan de forma muy regular en los programas, puesto que mayoritariamente contribuyen con más del 75% de las respuestas previstas en un ciclo (fig. 1). Esto demuestra el alto grado de implicación de los laboratorios de nuestro ámbito en la garantía de la calidad.
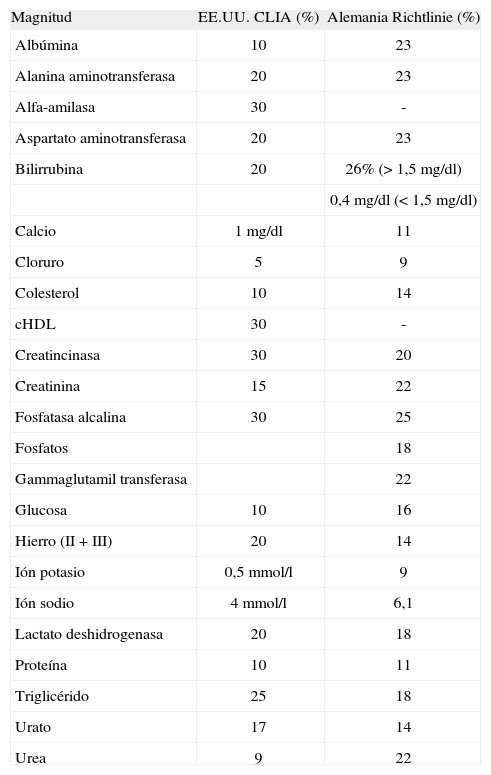
Las especificaciones de la calidad fundamentadas en el estado de la técnica (tabla 1) son comparables con las utilizadas por el CLIA en EE.UU. o la Richtlinie de Alemania (tabla 3), lo que indica que la prestación de los laboratorios de España es del mismo orden que la prestación mínima requerida en otros entornos regulados legalmente.
Especificaciones de la calidad utilizadas en otros países
| Magnitud | EE.UU. CLIA (%) | Alemania Richtlinie (%) |
| Albúmina | 10 | 23 |
| Alanina aminotransferasa | 20 | 23 |
| Alfa-amilasa | 30 | - |
| Aspartato aminotransferasa | 20 | 23 |
| Bilirrubina | 20 | 26% (> 1,5mg/dl) |
| 0,4mg/dl (< 1,5mg/dl) | ||
| Calcio | 1mg/dl | 11 |
| Cloruro | 5 | 9 |
| Colesterol | 10 | 14 |
| cHDL | 30 | - |
| Creatincinasa | 30 | 20 |
| Creatinina | 15 | 22 |
| Fosfatasa alcalina | 30 | 25 |
| Fosfatos | 18 | |
| Gammaglutamil transferasa | 22 | |
| Glucosa | 10 | 16 |
| Hierro (II + III) | 20 | 14 |
| Ión potasio | 0,5mmol/l | 9 |
| Ión sodio | 4mmol/l | 6,1 |
| Lactato deshidrogenasa | 20 | 18 |
| Proteína | 10 | 11 |
| Triglicérido | 25 | 18 |
| Urato | 17 | 14 |
| Urea | 9 | 22 |
cHDL: colesterol unido a lipoproteínas de alta densidad.
La especificación está expresada en porcentaje, salvo para las magnitudes en que se utiliza un intervalo.
La diferencia fundamental se da en creatinina, donde nuestra propuesta aceptaría una desviación superior que CLIA y Richtlinie (el 28 frente al 15 y el 22%, respectivamente). Desglosando nuestros resultados por métodos analíticos, se obtiene idéntica desviación para todos ellos. Sin embargo, cuando se estratifican por lote control, se observa que la desviación mayor ocurre para el lote de concentración más baja (cercana al límite inferior del intervalo de referencia). Debido a que esta concentración adquiere especial relevancia para el diagnóstico de patología renal, se ha considerado importante no excluirlo del trabajo. De este modo, se pone de manifiesto la necesidad de mejorar la prestación en la determinación de creatinina.
La comparación del percentil 95 obtenido en los ciclos estudiados (años 2005 y 2006) en las 24 magnitudes incluidas en el estudio evidencia que los valores son prácticamente iguales. Así pues, las especificaciones de la calidad que se propondrían para cada año de forma individual serían muy similares. Éste es el motivo por el que se decidió realizar un cómputo global teniendo en cuenta los datos obtenidos en los dos años revisados. Además, este hallazgo refuerza la robustez del modelo de cálculo utilizado en este estudio.
Es muy importante resaltar que este documento define las especificaciones para la calidad analítica basadas en las prestaciones de los métodos actuales, que es el criterio en general menos exigente según el modelo acordado internacionalmente en Estocolmo en 1999. Por este motivo, se trata de la prestación mínima aceptable, cuyo incumplimiento significa que el laboratorio no debería seguir trabajando en las condiciones actuales.
En el espíritu del comité elaborador de este documento está colaborar en el futuro con otras sociedades de otros campos del laboratorio clínico, organizadoras de programas de garantía externa de la calidad de amplia implantación nacional.
ConclusionesÉste es el primer documento de consenso de tres sociedades científicas nacionales del laboratorio clínico sobre especificaciones de la calidad de magnitudes bioquímicas, definidas sobre la base del estado de la técnica de los resultados de los programas de garantía externa de la calidad de AEFA/AEBM y de la SEQC.
Es imprescindible que el laboratorio participe en programas de garantía externa de la calidad en todas las magnitudes en que sea posible, con objeto de conocer su inexactitud y saber si cumple las especificaciones de la calidad.
El modelo de cálculo de las especificaciones propuestas es sencillo y claro, y están basadas totalmente en los resultados de programas de garantía externa de la calidad.
Asimismo, el método de cálculo es claramente robusto, ya que las diferencias entre los dos ciclos correspondientes a los años 2005 y 2006 es del 4,6% de media, y el datum del que se ha extraído la información es ampliable y se ha obtenido a partir de una muestra representativa por el gran volumen de datos que se han contemplado, por lo que es una foto real de la situación nacional.
Las especificaciones propuestas son una declaración de mínimos que todo laboratorio debería cumplir, con objeto de asegurar unas prestaciones analíticas de utilidad clínica.
Estas especificaciones son comparables a las de otros criterios internacionales vigentes.
Este documento se presentará a los gobiernos estatal y autonómico, así como a entidades evaluadoras de la calidad, como evidencia de las prestaciones de los procedimientos analíticos actuales en nuestro ámbito. También aportará criterios comunes para armonizar los laboratorios en su implicación en sistemas de gestión de la calidad.
El documento puede ser un punto de referencia que facilitará la tarea de auditores externos, al evidenciar el cumplimiento de especificaciones comunes.
Cuando un laboratorio no pueda alcanzar estas especificaciones de la calidad propuestas, es decir, si la inexactitud de sus resultados al participar en un programa de garantía externa de la calidad excede dichas especificaciones mínimas, deben analizarse inmediatamente las causas y tomar medidas, si procede.
Estas recomendaciones de consenso no implican cambios en las líneas que tradicionalmente propone cada sociedad para mejorar las prestaciones de los laboratorios clínicos.
Este modelo, contrastado con otros referentes internacionales, se aplicará a otras magnitudes de los programas ahora implicados, e incluso para programas de otras sociedades del ámbito del laboratorio clínico.