En los últimos 30 años se han desarrollado numerosas estrategias de cribado prenatal de aneuploidías mediante marcadores bioquímicos y/o ecográficos. En España no existió una política uniforme y global para el cribado prenatal hasta que, en 2005, la Sociedad Española de Ginecología y Obstetricia (SEGO) recomendó descartar la EM avanzada como única indicación para realizar prueba invasiva y propuso implantar el test combinado en todo el territorio español. Sin embargo, no hay evidencias de que exista una estrategia común.
Además, los recientes avances en tecnología genómica han abierto las puertas al desarrollo de nuevas estrategias de cribado basadas en el uso del ADN fetal en sangre materna. A la espera de evidencias objetivas sobre la eficacia de estas nuevas estrategias no invasivas en población de bajo riesgo, sería muy deseable conocer la eficacia de los cribados actuales para comparar con las estrategias futuras y, sobre todo, para tener en cuenta algunas recomendaciones recientes en nuestro país.
El presente trabajo describe la situación actual del cribado prenatal de aneuploidías en España, mediante el análisis de los datos recogidos en un sondeo en el que participaron 97 centros públicos y privados que realizan cribado de cromosomopatías en nuestras comunidades autónomas.
Con este estudio, el grupo de trabajo de Diagnóstico Prenatal de la SEQC pretende animar a la coordinación y el diálogo de todos los implicados en los procesos de cribado prenatal de aneuploidías, con vistas a consensuar los protocolos existentes en las distintas autonomías.
During the last 30 years, numerous strategies for prenatal screening of aneuploidies have been developed using sonographic and biochemical markers. In Spain, there were no uniform and global prenatal screening strategies in the different autonomous communities until 2005, when the Sociedad Española de Ginecología y Obstetricia (SEGO) recommended avoiding advanced maternal age as a unique indication for an invasive test and proposed the first trimester combined test implementation. However, there is no evidence yet that a uniform strategy exists.
Moreover, the recent advances on genomics have open up the door to the development of new screening strategies based on using fetal DNA recovered from maternal blood. Waiting for objective evidences about the efficacy of these new non-invasive strategies in low-risk population, it would be desirable to know the efficacy of present screening programs to compare them with future strategies and, to pay attention to some recent recommendations in our country.
The present work describes the present situation of prenatal screening of aneuploidies in Spain, by analysing data from a survey on 97 public and private centers envolved on chromosomopathies screening in our autonomic communities.
With this study, the Prenatal Diagnosis workgroup of the SEQC aims to impulse the coordination and the dialog of all agents implicated into aneuploidies prenatal screening programs in order to achieve a consensued protocol along the different autonomies.
El síndrome de Down (SD) o trisomía 21 (T21) es el trastorno cromosómico más frecuente, y constituye el síndrome malformativo más común y la causa más frecuente de discapacidad psíquica congénita.
La asociación entre la edad materna (EM) y el riesgo de tener un hijo con SD fue descrita por primera vez por Penrose en 19331. El cribado basado en la EM identificaba aproximadamente un 30% de los embarazos con SD, si se realizaba amniocentesis (AC) al 5% de las gestantes seleccionadas de mayor a menor edad. Desde entonces, se han sumado otras técnicas como la biopsia de vellosidades coriales (BC) o la cordocentesis que también permiten la obtención de material fetal. Todas ellas son técnicas invasivas que, como tales, no están exentas de riesgo, aunque las pérdidas fetales estimadas son inferiores a un 1%2.
En 1984, Merkatz et al.3 mostraron que los niveles de alfafetoproteína (AFP) en el suero materno eran significativamente más bajos en las embarazadas portadoras de fetos afectos de aneuploidías. Tres años más tarde, Cuckle et al.4 desarrollaron un método para estimar el riesgo de que la gestante fuera portadora de un feto afecto de SD, mediante cálculos matemático-estadísticos que combinaban los marcadores bioquímicos con el riesgo a priori estimado por la EM. Este constituyó el primer método de cribado bioquímico de aneuploidías.
A partir de este hallazgo, empezó una búsqueda intensa de marcadores bioquímicos capaces de mejorar la detección con la menor tasa de error posible, como la gonadotropina coriónica humana (hCG), el estriol no conjugado (uE3) y la inhibina A (IA). Al comienzo de la década de 1990 se dio el salto al primer trimestre, con la introducción de la proteína A asociada al embarazo (PAPP-A) y la fracción beta libre de la gonadotropina coriónica humana (fβhCG).
Paralelamente, Nicolaides et al.5 demostraron, en el primer trimestre del embarazo, una fuerte asociación entre el tamaño de un acúmulo de líquido en la parte posterior del cuello del feto, denominado translucencia nucal (TN), y el riesgo de T21 y de otras anomalías cromosómicas numéricas y estructurales. La combinación de la TN con los marcadores bioquímicos (PAPP-A y fβhCG) y con la EM permitió alcanzar tasas de detección del 80% para un 5% de falsos positivos, constituyendo la estrategia que se conoce como cribado combinado. Este puede realizarse en un solo paso, haciendo simultáneamente ecografía y determinaciones bioquímicas entre 11 y 14 semanas de gestación; o en 2 pasos, con determinaciones bioquímicas en las semanas 9-11 y ecografía en semanas 12-14, alcanzado mayor sensibilidad6,7.
Con estos y otros marcadores bioquímicos (p. ej., IA) aparecieron diferentes estrategias para el cribado del SD (combinado, integrado, triple, cuádruple, secuencial, contingente), cada una de ellas con ventajas e inconvenientes (tabla 1)8. Las estrategias secuencial y contingente emplean los mismos marcadores que la integrada, pero indicando pruebas del segundo trimestre de acuerdo con los resultados del primero. En la secuencial, el punto de corte más utilizado en el primer trimestre es 1/30 y el punto de corte integrado más utilizado es 1/184. La estrategia contingente categoriza a la embarazada según su riesgo en el primer trimestre (elevado, bajo o intermedio). Si el riesgo es elevado, se indica prueba invasiva, las gestantes de riesgo bajo siguen control habitual del embarazo sin realizar más pruebas, y a las de riesgo intermedio se les realizan test en el segundo trimestre. En este caso, los puntos de corte más utilizados en el primer trimestre son 1/30 y 1/2.000, y el punto de corte integrado es 1/217. Los estudios de coste-efectividad de las estrategias combinada, contingente, secuencial e integrada muestran resultados limitados y contradictorios. Por ello, y ante la falta de una política uniforme y global para el cribado prenatal en las diferentes comunidades autónomas, la Sociedad Española de Ginecología y Obstetricia (SEGO) recomendó en 2005 descartar la EM avanzada como única indicación para realizar prueba invasiva y propuso implantar el test combinado del primer trimestre en todo el territorio español.
Estrategias de cribado. Tasa de detección (para un 5% de FP)
| Tasa de detección, % | |
|---|---|
| Cribado en el primer trimestre: 9 a 14 semanas | |
| - Cribado ecográfico: Edad+TN | 64-70 |
| - Cribado combinado: βhCG+PAPP-A+TN | 82-87 |
| Cribado en el segundo trimestre: 15 a 18 semanas | |
| - Doble test bioquímico: AFP+hCG | 58-69 |
| - Triple test bioquímico: AFP+hCG+uE3 | 82-87 |
| - Test cuádruple bioquímico: AFP+hCG+uE3+IA | 69-82 |
| Cribado en los 2 trimestres | |
| a) Cribado integradoa | 94-96 |
| TN+PAPP-A (primer trimestre) | |
| Test cuádruple (segundo trimestre) | |
| b) Cribado serológico integradob | 85-90 |
| PAPP-A+βhCG (primer trimestre) | |
| Test cuádruple (segundo trimestre) | |
AFP: alfafetoproteína; FP: falsos positivos; hCG: gonadotropina coriónica humana; IA: inhibina A; PAPP-A:proteína A asociada al embarazo; TN: translucencia nucal; uE3: estriol no conjugado; βhCG: subunidad beta libre de la gonadotropina coriónica.
En tiempos de dificultad económica y de restricción del gasto, el estudio de coste-efectividad de las pruebas diagnósticas del SD adquiere un especial interés. Un estudio realizado por el Ministerio de Sanidad y Consumo en el año 2007, sobre la situación actual del diagnóstico prenatal del SD en el Estado español, puso de manifiesto que la estrategia de cribado más coste-efectiva es la contingente9. Sin embargo, en 2013, Manzanares et al.10 describieron que el cribado combinado era el más ampliamente extendido en los hospitales españoles.
En la última década se han propuesto diferentes marcadores ecográficos adicionales, como son la ausencia del hueso nasal, el índice de pulsatilidad del ductus venoso, la insuficiencia tricuspídea o el ángulo frontomaxilar, entre otros. Estos marcadores, en algunos casos, se introducen en los cálculos de riesgo prenatal para mejorar las tasas de detección y disminuir los falsos positivos.
Desde el descubrimiento de la presencia de ADN fetal en sangre materna11, se están investigando diferentes métodos para extraer este material genético fetal de la sangre materna con el objetivo de minimizar las pruebas invasivas. Estos métodos podrían sustituir en un futuro a los cribados de aneuploidías, aunque aún no están suficientemente validados en población de bajo riesgo. Tanto sociedades científicas como diversos autores recomiendan cautela para su implementación en la práctica clínica puesto que, por el momento, no proporcionan fiabilidad suficiente como para ser considerados test diagnósticos12–14. Podemos aventurar que las mejoras futuras vendrán de la mano de nuevas estrategias no invasivas que consigan detecciones próximas al 100% con menos del 0,1% de falsos positivos. La tendencia, por tanto, irá hacia mantener los cribados bioquímico-ecográficos más coste-efectivos e implantar estrategias contingentes15,16 con análisis de ADN fetal en las embarazadas de riesgo intermedio y pruebas invasivas en aquellas de elevado riesgo para que sean coste-efectivas17 para su aplicación poblacional en modelos sanitarios públicos.
ObjetivosDescribir la situación actual del cribado prenatal en España.
Para ello, se han sondeado los modelos organizativos de cribado de cromosomopatías de centros públicos y privados implantados en nuestras comunidades autónomas; población gestante cribada, protocolos de cribado, puntos de corte adoptados, opciones terapéuticas ofrecidas, controles de calidad implementados y control del seguimiento y de la eficacia obtenida en la población cribada.
Material y métodosDiseño del estudioEntre octubre de 2013 y noviembre de 2014 se contactó (por vía telefónica y/o correo electrónico) con 125 laboratorios que realizan cribado prenatal de aneuploidías, distribuidos en 15 de las 17 comunidades autónomas españolas, a los que se solicitó participar en una encuesta.
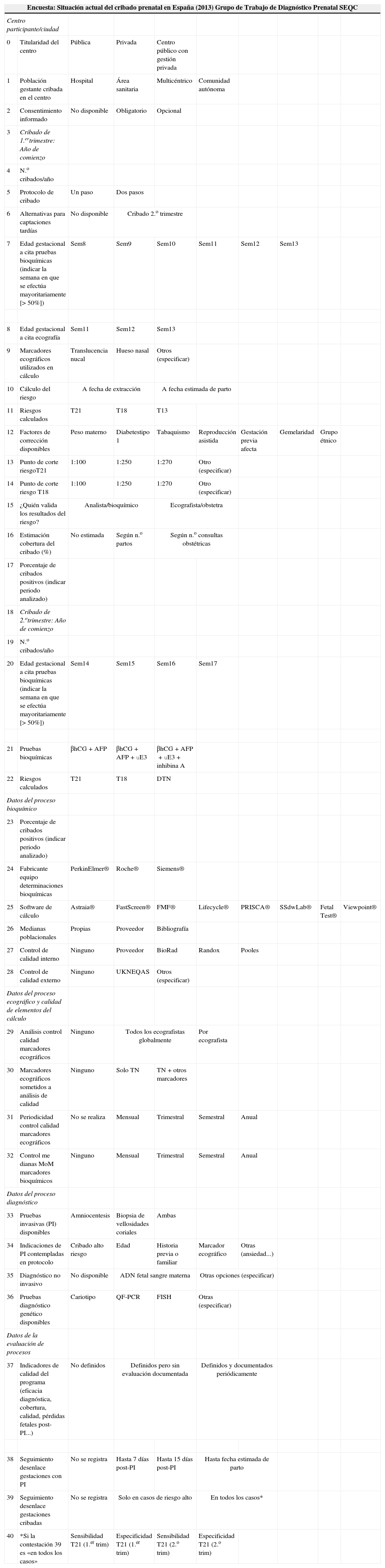
La encuesta consta de 40 preguntas clasificadas en 6 bloques (tabla 2):
- -
Identificación del centro: titularidad, población cribada y disponibilidad de consentimiento informado.
- -
Datos del cribado: protocolo utilizado, alternativa para captaciones tardías, marcadores bioquímicos y ecográficos utilizados. Relativo al cálculo del riesgo: fecha considerada para el cálculo, tipos de riesgo calculados, factores de corrección, puntos de corte y responsable de su validación. Finalmente, la cobertura del cribado y porcentaje de falsos positivos.
- -
Datos del proceso bioquímico: equipo, software, medianas poblacionales y controles de calidad utilizados.
- -
Datos del proceso ecográfico: marcadores ecográficos sometidos a control de calidad y periodicidad del mismo.
- -
Datos del proceso diagnóstico: periodicidad de control de las medianas poblacionales, indicación y tipo de pruebas invasivas disponibles, pruebas de diagnóstico genético ofrecidas.
- -
Evaluación de procesos: indicadores de calidad, seguimiento del desenlace de las gestaciones y eficacia de los programas.
Formato resumen de la encuesta realizada desglosando las posibles respuestas en las variables que se presentaron con opciones predeterminadas
| Encuesta: Situación actual del cribado prenatal en España (2013) Grupo de Trabajo de Diagnóstico Prenatal SEQC | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Centro participante/ciudad | |||||||||
| 0 | Titularidad del centro | Pública | Privada | Centro público con gestión privada | |||||
| 1 | Población gestante cribada en el centro | Hospital | Área sanitaria | Multicéntrico | Comunidad autónoma | ||||
| 2 | Consentimiento informado | No disponible | Obligatorio | Opcional | |||||
| 3 | Cribado de 1.ertrimestre: Año de comienzo | ||||||||
| 4 | N.o cribados/año | ||||||||
| 5 | Protocolo de cribado | Un paso | Dos pasos | ||||||
| 6 | Alternativas para captaciones tardías | No disponible | Cribado 2.o trimestre | ||||||
| 7 | Edad gestacional a cita pruebas bioquímicas (indicar la semana en que se efectúa mayoritariamente [>50%]) | Sem8 | Sem9 | Sem10 | Sem11 | Sem12 | Sem13 | ||
| 8 | Edad gestacional a cita ecografía | Sem11 | Sem12 | Sem13 | |||||
| 9 | Marcadores ecográficos utilizados en cálculo | Translucencia nucal | Hueso nasal | Otros (especificar) | |||||
| 10 | Cálculo del riesgo | A fecha de extracción | A fecha estimada de parto | ||||||
| 11 | Riesgos calculados | T21 | T18 | T13 | |||||
| 12 | Factores de corrección disponibles | Peso materno | Diabetestipo 1 | Tabaquismo | Reproducción asistida | Gestación previa afecta | Gemelaridad | Grupo étnico | |
| 13 | Punto de corte riesgoT21 | 1:100 | 1:250 | 1:270 | Otro (especificar) | ||||
| 14 | Punto de corte riesgo T18 | 1:100 | 1:250 | 1:270 | Otro (especificar) | ||||
| 15 | ¿Quién valida los resultados del riesgo? | Analista/bioquímico | Ecografista/obstetra | ||||||
| 16 | Estimación cobertura del cribado (%) | No estimada | Según n.o partos | Según n.o consultas obstétricas | |||||
| 17 | Porcentaje de cribados positivos (indicar periodo analizado) | ||||||||
| 18 | Cribado de 2.otrimestre: Año de comienzo | ||||||||
| 19 | N.o cribados/año | ||||||||
| 20 | Edad gestacional a cita pruebas bioquímicas (indicar la semana en que se efectúa mayoritariamente [>50%]) | Sem14 | Sem15 | Sem16 | Sem17 | ||||
| 21 | Pruebas bioquímicas | βhCG+AFP | βhCG+AFP+uE3 | βhCG+ AFP+uE3 +inhibina A | |||||
| 22 | Riesgos calculados | T21 | T18 | DTN | |||||
| Datos del proceso bioquímico | |||||||||
| 23 | Porcentaje de cribados positivos (indicar periodo analizado) | ||||||||
| 24 | Fabricante equipo determinaciones bioquímicas | PerkinElmer® | Roche® | Siemens® | |||||
| 25 | Software de cálculo | Astraia® | FastScreen® | FMF® | Lifecycle® | PRISCA® | SSdwLab® | Fetal Test® | Viewpoint® |
| 26 | Medianas poblacionales | Propias | Proveedor | Bibliografía | |||||
| 27 | Control de calidad interno | Ninguno | Proveedor | BioRad | Randox | Pooles | |||
| 28 | Control de calidad externo | Ninguno | UKNEQAS | Otros (especificar) | |||||
| Datos del proceso ecográfico y calidad de elementos del cálculo | |||||||||
| 29 | Análisis control calidad marcadores ecográficos | Ninguno | Todos los ecografistas globalmente | Por ecografista | |||||
| 30 | Marcadores ecográficos sometidos a análisis de calidad | Ninguno | Solo TN | TN+otros marcadores | |||||
| 31 | Periodicidad control calidad marcadores ecográficos | No se realiza | Mensual | Trimestral | Semestral | Anual | |||
| 32 | Control me dianas MoM marcadores bioquímicos | Ninguno | Mensual | Trimestral | Semestral | Anual | |||
| Datos del proceso diagnóstico | |||||||||
| 33 | Pruebas invasivas (PI) disponibles | Amniocentesis | Biopsia de vellosidades coriales | Ambas | |||||
| 34 | Indicaciones de PI contempladas en protocolo | Cribado alto riesgo | Edad | Historia previa o familiar | Marcador ecográfico | Otras (ansiedad...) | |||
| 35 | Diagnóstico no invasivo | No disponible | ADN fetal sangre materna | Otras opciones (especificar) | |||||
| 36 | Pruebas diagnóstico genético disponibles | Cariotipo | QF-PCR | FISH | Otras (especificar) | ||||
| Datos de la evaluación de procesos | |||||||||
| 37 | Indicadores de calidad del programa (eficacia diagnóstica, cobertura, calidad, pérdidas fetales post-PI...) | No definidos | Definidos pero sin evaluación documentada | Definidos y documentados periódicamente | |||||
| 38 | Seguimiento desenlace gestaciones con PI | No se registra | Hasta 7días post-PI | Hasta 15 días post-PI | Hasta fecha estimada de parto | ||||
| 39 | Seguimiento desenlace gestaciones cribadas | No se registra | Solo en casos de riesgo alto | En todos los casos* | |||||
| 40 | *Si la contestación 39 es «en todos los casos» | Sensibilidad T21 (1.er trim) | Especificidad T21 (1.er trim) | Sensibilidad T21 (2.o trim) | Especificidad T21 (2.o trim) | ||||
Después de un análisis preliminar, se encontraron algunas respuestas discordantes que podían deberse a una mala interpretación. Estas respuestas fueron confirmadas, en una segunda revisión, mediante contacto directo con el laboratorio participante.
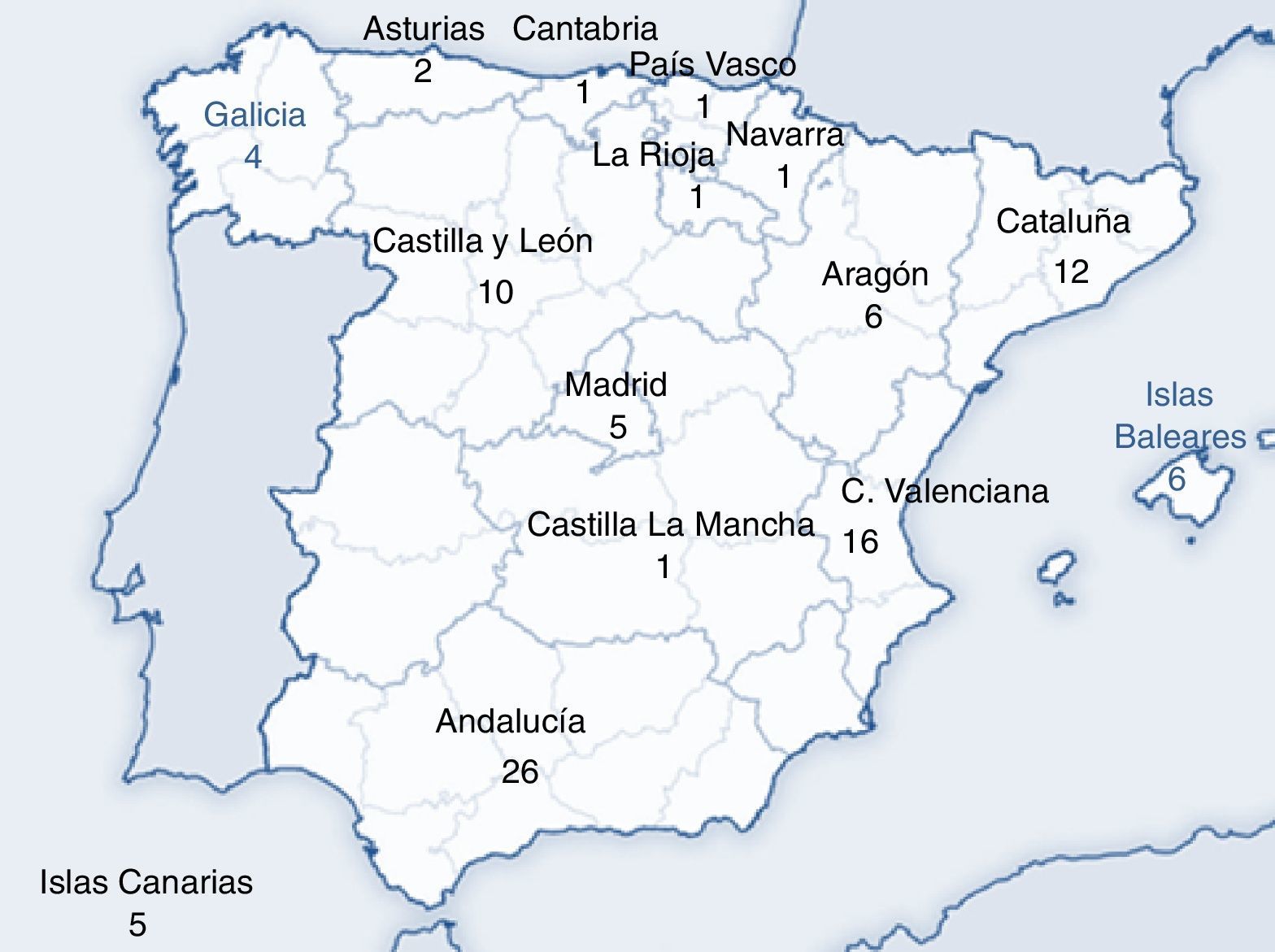
ResultadosDurante los años 2013 y 2014 se recibieron y analizaron un total de 97 encuestas: 90 provenían de centros públicos, 5 de centros públicos de gestión privada y 2 de centros privados (fig. 1). En el 77% de los centros encuestados, la población gestante cribada pertenece a una misma área sanitaria y se constató que en el 25% de los centros no dispone de consentimiento informado.
A continuación se describen los resultados de las encuestas, por procesos.
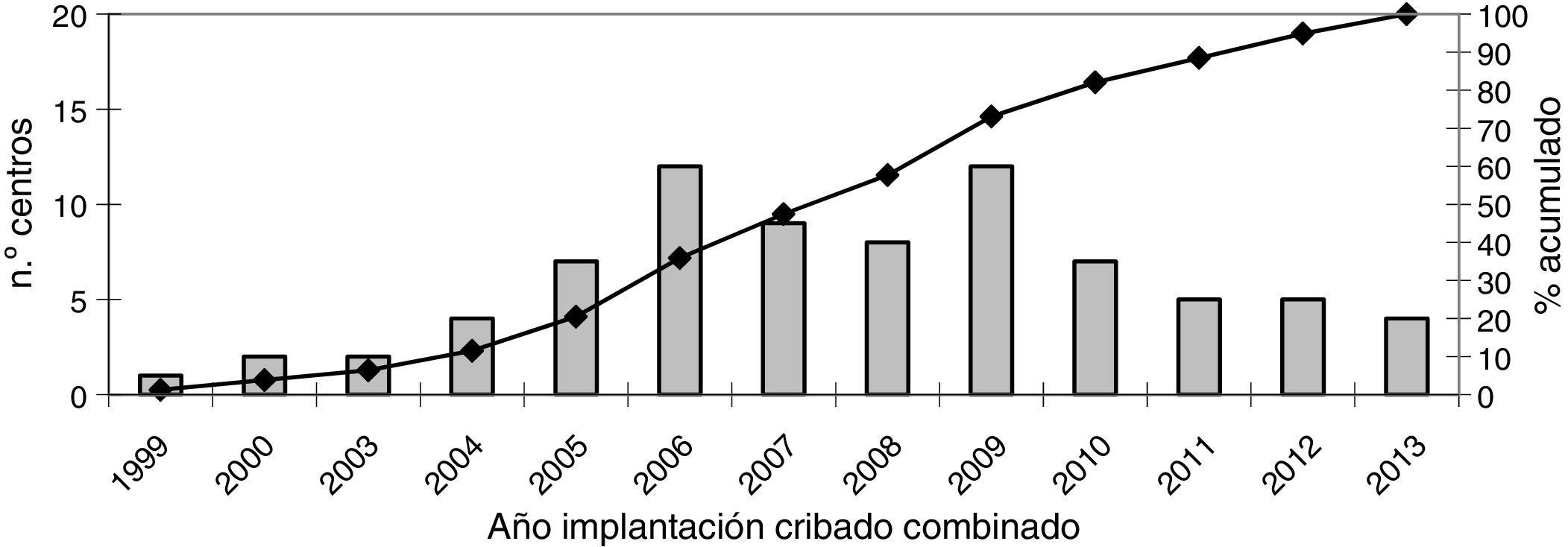
Cribado de primer trimestre: estrategiaLa estrategia de cribado prenatal de aneuploidías de primer trimestre se inició en algunos centros de España en el año 1999 pero no fue hasta el año 2008 cuando más de la mitad de los centros encuestados tuvieron implantado dicho programa (fig. 2).
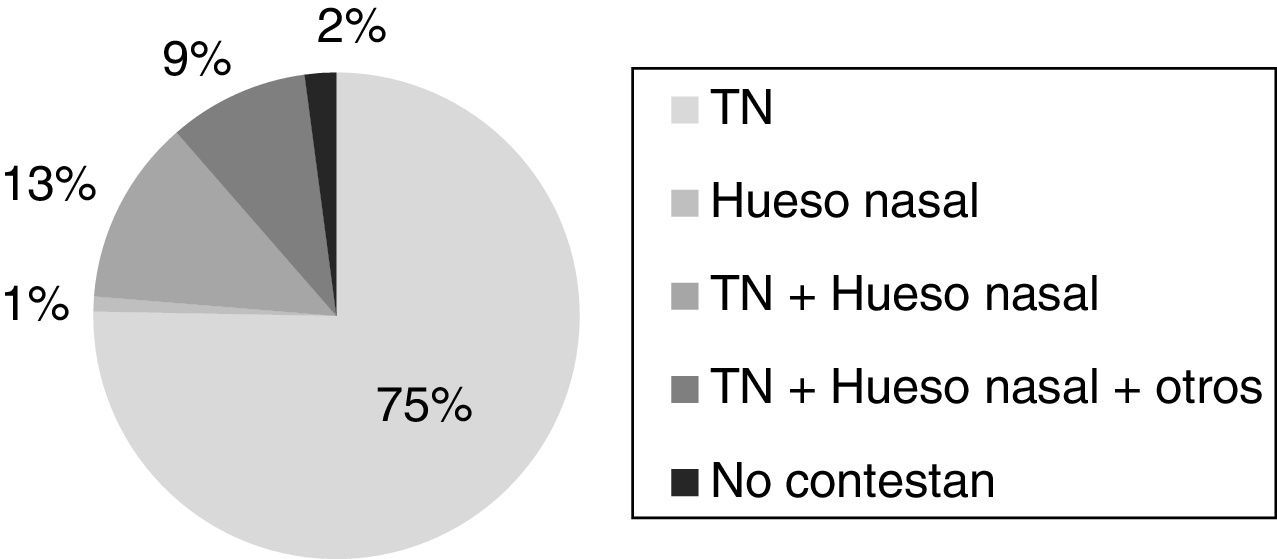
Actualmente, el 97% de los centros encuestados realizan el cribado combinado. Los marcadores bioquímicos que se valoran en él son la PAPP-A y la fβhCG y el 22% (n=21) de los centros ya incorporan otros marcadores ecográficos adicionales a la TN, como la ausencia de hueso nasal y/o índice de pulsatilidad del ductus venoso (fig. 3). El 62% de los centros realiza este proceso en 2 pasos, determinando en primer lugar los marcadores bioquímicos y posteriormente los marcadores ecográficos, mientras que el 29% determina todos los marcadores de forma simultánea. El 9% restante tiene disponibles los 2 protocolos. El responsable de la validación del riesgo es el facultativo del laboratorio en el 66% de los centros, el obstetra en el 21% y ambos en el 13%.
Las pruebas bioquímicas de primer trimestre se efectúan mayoritariamente en la semana 10 y las ecográficas en la semana 12. El 86% de los centros ofrece el cribado de segundo trimestre como alternativa para las captaciones tardías.
El cálculo del riesgo individualizado de aneuploidías fetales se estima teniendo en cuenta el riesgo a priori en la fecha probable estimada de parto en el 59% de los centros y en el 41% restante se calcula el riesgo en la fecha de la extracción de sangre.
El 56% de los centros estiman no solo el riesgo de que la gestante porte un feto afectado de T21, sino también de trisomía 18 (T18) o trisomía 13 (T13), el 43% calculan el riesgo de T21 o T18 (conjuntamente) y un 1% realiza solo el cálculo del riesgo para T21. El punto de corte por encima del cual se proponen técnicas diagnósticas para la T21 es de 1/270 en el 55% de los centros y de 1/250 en el 38%; el resto de los centros (7%) utiliza diferentes cutoffs.
Cribado de segundo trimestre: estrategiaDe los centros encuestados con cribado de segundo trimestre, el 82% utilizan 2 marcadores bioquímicos para el cálculo del riesgo (AFP+βhCG), el 10% determina 3 marcadores (AFP+βhCG+uE3) y el 8% emplean 4 marcadores (AFP+βhCG+uE3+IA). Dichas determinaciones bioquímicas se realizan mayoritariamente en la semana 15.
En este segundo trimestre, el 62% de los centros calculan el riesgo para T21, T18 y defectos de cierre del tubo neural (DTN), el 26% estiman el riesgo para T21 y DTN, el 9% calculan el riesgo para T21 y T18, y el 3% para T21.
Calidad del proceso bioquímicoLos proveedores de los equipos más utilizados para las determinaciones bioquímicas son Siemens® (43%) y Roche® (38%), seguidos de PerkinElmer® (15%).
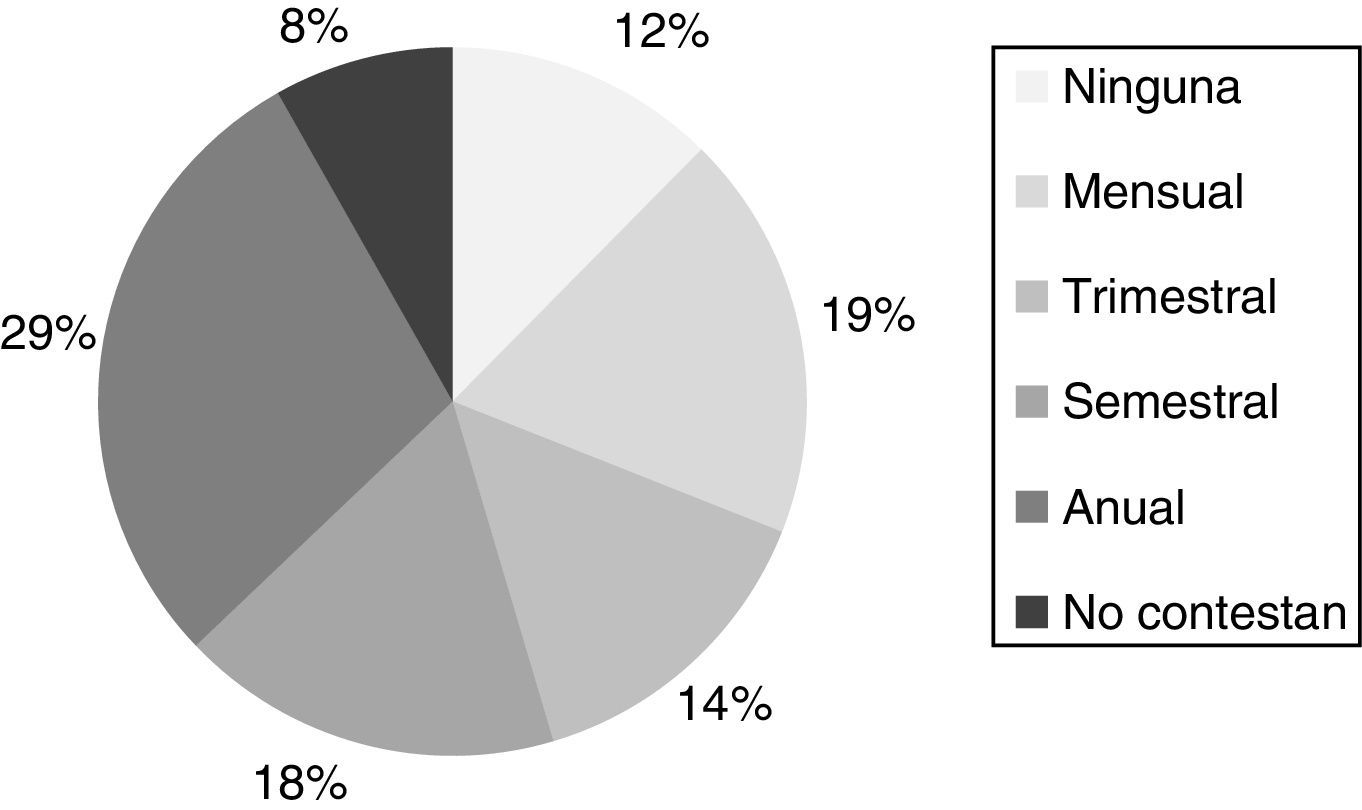
Menos de la mitad (49%) de los centros encuestados utiliza medianas poblacionales propias para el cálculo del riesgo (fig. 4). Un 12% de los centros afirman no evaluar la mediana de los múltiplos de la mediana (MoM) bioquímicos periódicamente, mientras que el resto de los centros realiza evaluaciones mensuales, trimestrales, semestrales o anuales (fig. 5).
Cabe destacar, por último, que un 24% de los centros afirma no participar en ningún programa de control de calidad externo.
Calidad del proceso ecográficoEn cuanto a los marcadores ecográficos, que se basan en una medición ecografista-dependiente, el 30% de los centros realiza una evaluación de la calidad ecográfica estratificada por ecografista, mientras que un 33% de los centros afirman que no evalúan la calidad de dichos marcadores.
Proceso diagnósticoSe observó que la AC y la BC son las técnicas invasivas más empleadas, ya que un 72% de los centros ofrece la posibilidad de realizar cualquiera de las 2, mientras que un 28% solo ofrece la AC. Una vez obtenida la muestra, la mayoría de los centros disponen del cariotipo, la reacción en cadena de la polimerasa cuantitativa fluorescente (QF-PCR) y la hibridación in situ fluorescente (FISH) para el diagnóstico genético: un 52% de los centros tienen disponibles las 3 técnicas, un 20% realiza cariotipo convencional y FISH, y otro 20% cariotipo convencional y QF-PCR. Un 6% de los centros no dispone de técnicas de diagnóstico rápido, sino que solo realiza el cariotipo convencional y un 2% únicamente realiza QF-PCR. Además, algunos centros hacen referencia a la existencia de pruebas de diagnóstico no invasivo en sangre materna. Cabe destacar que la EM continúa siendo motivo de ofrecimiento de pruebas invasivas en un 39% de los centros encuestados (n=38).
Indicadores de calidad de los procesosEl 40% de los centros no tienen definidos indicadores de evaluación del proceso de cribado prenatal, el 17% los define pero no los registra para su posterior evaluación y un 43% tiene indicadores definidos y la evaluación del proceso documentada.
El seguimiento del desenlace del cribado es muy variable entre los centros. El 34% de los encuestados no realiza seguimiento posterior de los casos cribados, y el 28% solamente recoge los seguimientos de los casos con resultado de riesgo alto. Solo el 39% registra el desenlace del cribado en todos los casos.
Tan solo el 27% de los laboratorios (n=26) han proporcionado datos de la eficacia de sus cribados de primer trimestre en términos de sensibilidad, entre el 79% y el 100%, y especificidad (>90%) y todos ellos formaban parte del grupo que afirmó realizar seguimiento en todos los casos.
DiscusiónEl estudio pone de manifiesto la falta de participación de los centros privados ya que la mayoría de las encuestas recibidas provenían de centros públicos. La estrategia más ampliamente utilizada es el cribado combinado en el primer trimestre. A pesar de que los programas de cribado bioquímico de aneuploidías comenzaron en 1984, con la determinación de AFP en suero3, en la mayoría de comunidades de España no se implementó hasta 1999 y hasta 2008 menos de la mitad de los centros encuestados tenían instaurado el cribado combinado (fig. 2). Esta estrategia es la más ampliamente utilizada en países europeos y se considera la más eficaz en el primer trimestre18. A pesar de que el informe realizado en el año 2007 por el Ministerio de Sanidad y Consumoix describe que la estrategia contingente es la más coste-efectiva, nuestros datos muestran que no se ha implantado en nuestro territorio.
La mayoría de los centros realizan el cribado combinado en 2 pasos, como recomiendan los estudios realizados por Wright et al.19 y Rodríguez et al.20 De hecho, puesto que algunos programas utilizan conexión vía web para los ecografistas involucrados, la realización previa de las determinaciones bioquímicas en sangre agiliza el proceso, ya que permite calcular el riesgo de la gestante en la cita de la medida ecográfica y entregar el informe con las interpretaciones oportunas en la misma consulta. Las recomendaciones de la SEGO del año 2013 no reflejan que exista mejor rendimiento entre realizar el cribado en uno o en 2 pasos18.
No todos los centros encuestados disponen de cribado en el segundo trimestre para captaciones tardías. El American College of Medical Genetics recomienda llevar a cabo, además del cribado combinado en el primer trimestre, la medida de AFP en suero materno entre las semanas de gestación 15-20 para el cribado de los DTN y/o la realización del estudio ecográfico. En España, las guías de práctica clínica del Sistema Nacional de Salud de 201421 recomiendan, con criterio «Fuerte», ofrecer cribado combinado entre las semanas 11 y 13+6 para determinar el riesgo de SD y ofrecer un cribado cuádruple entre las semanas 15+0 y 17+0 únicamente a aquellas gestantes que no hayan podido realizar cribado durante el primer trimestre. Sin embargo, nuestro estudio pone de manifiesto que entre el 82% de los centros que tienen implantado el segundo trimestre, únicamente el 8% realizan el cribado con 4 marcadores.
Con respecto a las plataformas analíticas, nuestro estudio muestra que la más utilizada es la plataforma de Siemens® (43%), posiblemente elegida con criterios exclusivamente económicos. Grupos de expertos como los de la Fetal Medicine Foundation (FMF)22 recomiendan que la calidad analítica, valorada con la imprecisión interdía, sea inferior al 3,5%. Esta plataforma no dispone de la certificación de la FMF.
Es conveniente el uso de medianas propias de los marcadores y la actualización periódica de las mismas18. A pesar de ello, el 51,5% de los centros encuestados utilizan las medianas bibliográficas o las que le facilita el proveedor.
Todos los centros participantes aplican factores de corrección por el peso materno, la etnia, la diabetes insulinodependiente, el hábito tabáquico y la técnica de reproducción asistida empleada antes de calcular el riesgo combinado. Al tratarse de características maternas que modifican los resultados del cribado, el no contemplar estos factores puede sobreestimar o infraestimar el riesgo20,23,24.
La Sociedad Internacional de Diagnóstico Prenatal establece que los laboratorios que realizan cribado prenatal deben participar en programas que evalúen la calidad de las determinaciones bioquímicas y ecográficas, y controlar su evolución a través de la monitorización epidemiológica de los resultados del cribado. Sin embargo, nuestro estudio muestra que un 24% de los centros encuestados no participa en ningún programa de calidad externo y un 33% no evalúa la calidad del proceso ecográfico. Desconocemos si este dato es real o únicamente refleja una falta de documentación o de información hacia los laboratorios de cribado. En cualquier caso, difícilmente se puede evaluar un programa sin verificar ciertos requisitos mínimos de calidad. Solamente un 36% tiene indicadores de calidad definidos y la evaluación del proceso documentada.
A toda gestante con cribado prenatal de aneuploidías positivo se le debe ofrecer asesoramiento genético prenatal y la posibilidad de realizar una prueba diagnóstica. El estudio genético se recomienda cuando el riesgo supera el umbral de decisión, 1/270 o 1/250 según los centros participantes. La EM mayor de 35 años fue un criterio suficiente para la realización de una técnica invasiva, pero hoy en día no se considera como criterio único18. A pesar de las recomendaciones publicadas por la SEGO y el American College of Medical Genetics, un 39% de los centros participantes en nuestro estudio la siguen considerando como indicación de prueba invasiva. Si bien este porcentaje es menor que el recogido en 2012 por Manzanares et al. (48%)10, sigue siendo muy elevado. En la guía de práctica clínica de la SEGO, solo considera la EM como criterio para indicar la realización de un estudio invasivo en aquellos casos en los que no se ha podido llevar a cabo ni el cribado combinado ni el cuádruple del segundo trimestre18.
El 72% de los centros encuestados ofrece BC, mientras que solo un 10% de los centros la tenían disponible en el 2011, según los datos publicados anteriormente9. El cambio en los últimos años del cribado prenatal de aneuploidías del segundo al primer trimestre del embarazo parece haber incrementado la realización de BC frente a la AC10.
Las técnicas de detección de anomalías cromosómicas más utilizadas son el cariotipo convencional y el estudio de los cromosomas 13, 18, 21, X e Y mediante FISH o QF-PCR. A diferencia del cariotipo convencional, la FISH o la QF-PCR no requieren un cultivo celular del material fetal, posibilitando la obtención de resultados en 48h. Por ello, la gran mayoría de los centros encuestados emplean al menos uno de estos 2 procedimientos. Sin embargo, dichas técnicas no detectan alteraciones estructurales o que afecten a otros cromosomas, y por esta razón casi todos los laboratorios realizan también el cariotipo convencional.
Para el control de la eficacia de un programa de cribado es necesario conocer la sensibilidad y la tasa de falsos positivos. Según los resultados de las encuestas, aunque hay tendencia a monitorizar los cribados positivos (28%), un 34% de los centros no realiza seguimiento del desenlace de las pruebas de cribado. Además, pocos centros participantes (27%) han proporcionado datos de la eficacia de sus cribados. Sería deseable dotar a las unidades de cribado de los recursos necesarios para obtener la información requerida y cerrar un porcentaje de casos suficiente como para evaluar con fiabilidad la eficacia del proceso. Esto reviste aún mayor interés ante el desarrollo de nuevas estrategias de cribado basadas en el ADN fetal en sangre materna con alta sensibilidad y especificidad y baja tasa de falsos positivos. A la espera de evidencias objetivas sobre la eficacia de estas estrategias no invasivas en población de bajo riesgo, sería muy deseable conocer la eficacia de los cribados actuales para poder compararlas, sobre todo teniendo en cuenta algunas recomendaciones recientes en nuestro país. En Cataluña25, se ha propuesto el cribado con ADN fetal en embarazadas con riesgo combinado intermedio (entre 1/50 y 1/3.000). En gestaciones de mayor riesgo se ofrecería BC y, en las de riesgo más bajo, no se realizarían más pruebas. Esta estrategia, que parece ser coste-efectiva, se debería explorar en nuestro país mediante un estudio piloto en aquellos centros que dispongan de un cribado combinado con eficacia demostrada.
Consideraciones finales del grupo de trabajo de Diagnóstico Prenatal de la SEQCA pesar de que el estudio llevado a cabo por el Ministerio de Sanidad en el año 2006 ya puso de manifiesto una multiplicidad de laboratorios públicos y privados, que dificultan la uniformización de los resultados del cribado, y de las recomendaciones posteriores de la SEGO, en la actualidad el Sistema Nacional de Salud dispone de una red de laboratorios públicos con una capacidad tecnológica y una dotación de recursos humanos con formación muy desigual que sigue dando lugar a una enorme dificultad para homogeneizar los resultados de un cribado poblacional de estas características.
La ausencia de control externo en muchos de los laboratorios encuestados impide valorar la calidad analítica. Una barrera funcional que no solo afecta a los laboratorios de bioquímica sino también a los equipos ecográficos y posiblemente a los laboratorios de genética. Esto imposibilita una correcta implantación del control de calidad en el proceso de cribado. La utilización de diferentes tipos de pruebas, de técnicas y de valores de referencia por parte de los laboratorios, la multiplicidad de programas informáticos que traducen los resultados de los distintos marcadores en el cálculo de riesgo, así como la ausencia de unanimidad en torno a la interpretación de las ecografías, son importantes obstáculos independientemente del tipo de cribado elegido.
La reducción del número de laboratorios, creando una red limitada de centros de referencia, es de forma consensuada por el grupo una de las medidas a tomar de cara a la consecución de un sistema de calidad en la materia. La adaptación a las nuevas tecnologías y la inversión que ello supone difícilmente puede ser asumida por el elevado número de laboratorios existentes.
El grupo coincide en la relevancia de una fuerte inversión inicial por parte de la administración para el buen funcionamiento de unos protocolos comunes de actuación con ciertas garantías de calidad y con el objetivo final de que estos protocolos sean coste-efectivos. En este sentido, sería deseable que la administración cuente con la colaboración de agencias de evaluación, de las diferentes sociedades científicas y con representantes de los profesionales implicados que unifiquen y consensúen los protocolos existentes en las distintas autonomías. Además, se debería implantar un registro nacional de anomalías congénitas para el correcto seguimiento epidemiológico del programa de cribado.
Ante la realidad de la implantación de nuevas tecnologías basadas en la medida de ADN fetal en sangre materna con protocolo contingente, basadas en el resultado del cribado combinado, se debe exigir un control de la calidad de este cribado por parte de la administración, para que puedan ser aplicadas en un futuro próximo en la sanidad pública. Actualmente hay estudios que muestran que son coste-efectivas.
Por tanto, los resultados de este estudio deben animar a la coordinación y el diálogo de todos los implicados en este proceso.
Conflicto de interesesNinguno
El grupo de trabajo de diagnóstico prenatal SEQC agradece la colaboración de todos los laboratorios encuestados, sin cuyas aportaciones no habría sido posible realizar el presente trabajo.