Desde que el NCEP ATP III (National Cholesterol Education Program. Adult Treatment Panel III) aceptó el predominio de partículas LDL (low density lipoproteins ‘lipoproteínas de baja densidad’) pequeñas y densas como factor de riesgo emergente de desarrollo de enfermedad cardiovascular, el interés por los métodos para fraccionar las LDL ha aumentado. Por eso, el presente trabajo pretende valorar la utilidad de un sistema de electroforesis en gel de poliacrilamida (Lipoprint®) para separar LDL en nuestra población.
Se recogieron 194 muestras de sangre de personas de entre 15 y 94 años (el 49%, hombres) y se calculó la imprecisión del ensayo, así como los valores de referencia por sexo. Además, se realizaron correlaciones entre los distintos parámetros lipídicos.
Se obtuvieron resultados aceptables para el estudio de imprecisión mediante el sistema Lipoprint®. Al correlacionar el diámetro medio de las partículas LDL con otros marcadores del metabolismo lipídico, destacamos una asociación inversamente proporcional con la concentración de triglicéridos y apolipoproteína (apo) B100 y directamente proporcional con la de colesterol ligado a lipoproteínas de alta densidad (cHDL). Encontramos diferencias entre sexos en los niveles de triglicéridos y colesterol ligado a LDL (mayores en hombres), y cHDL y diámetro medio de las partículas LDL (mayores en mujeres).
Al comparar el diámetro medio de las partículas LDL con los parámetros lipídicos encontramos que está asociado inversamente con la concentración de triglicéridos y apo B100, y directamente con la de cHDL, lo que se asocia a un mayor riesgo cardiovascular.
El sistema Lipoprint® es útil para la medida de la concentración y diámetro medio de las partículas LDL debido a su sencillez y rapidez de resultados. Aún así faltan estudios que relacionen los resultados obtenidos con los parámetros clínicos que se emplean en la valoración del riesgo cardiovascular.
Since NCEP ATP III accepted the small and dense LDL particle as an emergent risk factor of cardiovascular disease, the methods to calculate LDL subfractions have increased. The present report attempts to evaluate the usefulness of a polyacrylamide gel electrophoresis system (LipoprintTM) to separate LDL in our population.
194 blood samples were collected from subjects between 15–94 years old (49% men). Imprecision and lipid parameter study population ranges by sex, and the correlations between them were calculated.
Imprecision study results were acceptable. When correlating the average diameter of particle LDL with other lipid markers, we observed an inverse association with triglyceride concentration and Apo B100, and a direct association with HDL-cholesterol. We found differences between sex in triglyceride and LDL-cholesterol levels (greater in men) and HDL-cholesterol and average diameter of LDL particles (greater in women).
When comparing the average LDL particle diameter with the lipid parameters, we found that it is inversely associated with the triglyceride and Apo B100 concentration, and directly with HDL-cholesterol, which is associated with a greater cardiovascular risk.
We believe that LipoprintTM system is useful for the measurement of the concentration and average diameter of LDL particles, due to its simplicity and speed of results. Nevertheless, studies are needed that can associate the results obtained to the clinical parameters that are used in the evaluation of cardiovascular risk.
Las LDL (low density lipoproteins ‘lipoproteínas de baja densidad’) son un grupo heterogéneo de partículas con distintas propiedades físicas, que presentan una gran variedad de tamaño, densidad y composición química.
El interés por los métodos para fraccionar las LDL ha aumentado desde que el NCEP ATP III (National Cholesterol Education Program. Adult Treatment Panel III) aceptó el predominio de partículas LDL pequeñas y densas como factor de riesgo emergente de desarrollo de enfermedad cardiovascular1 y sugirió que la medida del número, tamaño y contenido de colesterol de las moléculas de LDL pequeñas y densas aporta información adicional sobre el riesgo cardiovascular2.
Sin embargo, no existe un método de referencia aceptado. La ultracentrifugación analítica se ha considerado tradicionalmente el método de elección para determinar las subfracciones lipoproteicas3. Se han utilizado otras técnicas, como la electroforesis en gradiente de gel no desnaturalizante, la ultracentrifugación en gradiente de densidad y la resonancia magnética nuclear. Todas ellas son técnicamente laboriosas, consumen mucho tiempo y recursos, y además son caras4.
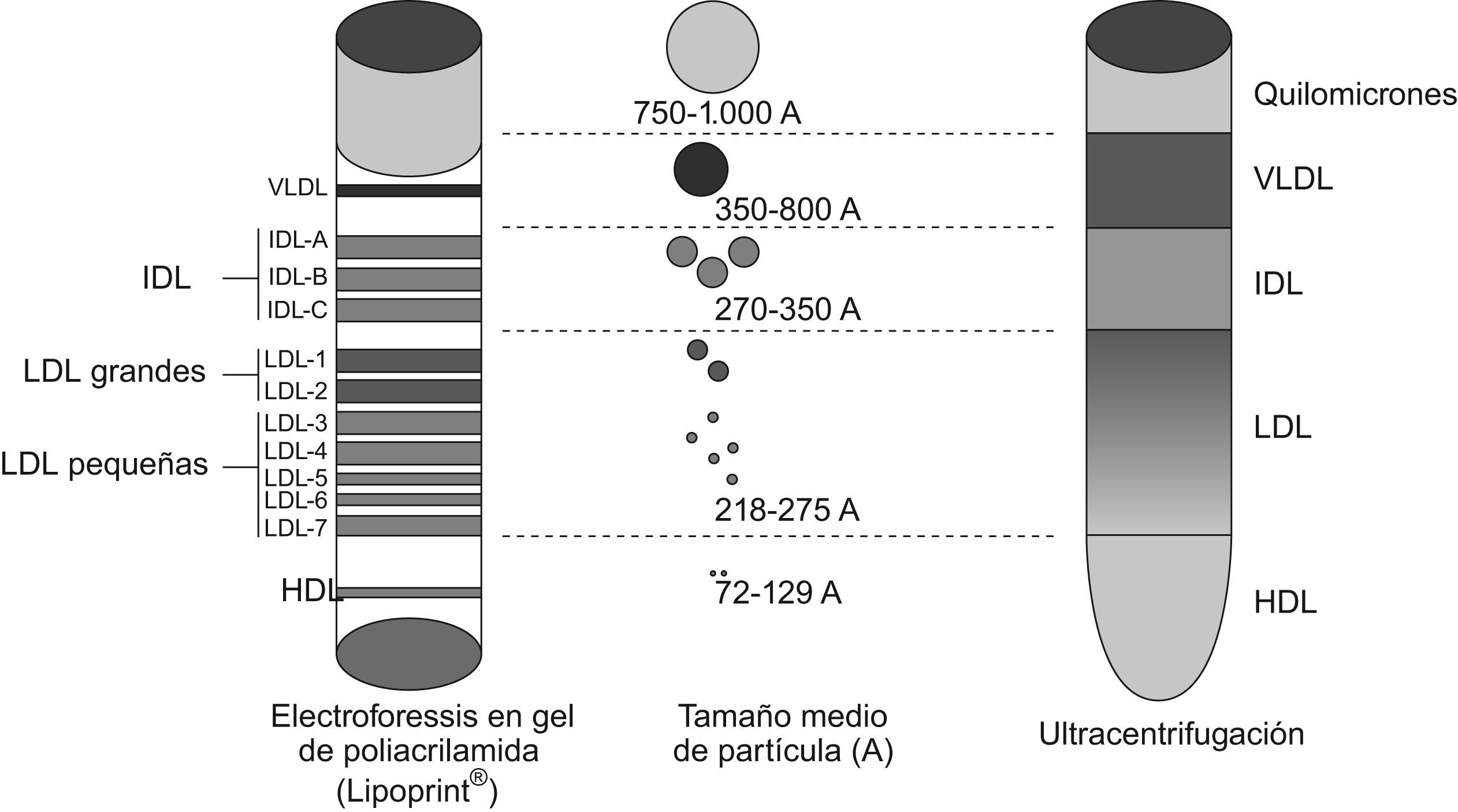
El sistema Lipoprint® es un método de electroforesis en gel de poliacrilamida que permite separar las partículas LDL en 7 subfracciones. No mide el tamaño de las partículas directamente, pero lo calcula al comparar la movilidad electroforética de la partícula con las movilidades electroforéticas de partículas de tamaños conocidos. El método es técnicamente sencillo, requiere bajo volumen de muestra y ofrece resultados rápidos.
El objetivo del presente trabajo ha sido valorar la utilidad de este método mediante la evaluación técnica del ensayo y el cálculo de valores en nuestra población.
Material y métodosMuestrasSe procesaron 194 muestras de sangre obtenidas en ayunas en un centro de salud del Área Sanitaria I de la región de Murcia. Las muestras se centrifugaron a 3.500rpm durante 15min y se mantuvieron refrigeradas a 2–8°C hasta su análisis, en un período de tiempo inferior a 24h.
La edad de los sujetos osciló entre 15 y 94 años (media de 57,5 años; desviación estándar [DE] de 17,3 años) con un 49% de hombres. Como criterio de exclusión se aplicó el presentar enfermedad terminal, hepática o renal.
Como material de control se utilizaron controles liofilizados Liposure® (Quantimetrix Corporation) y se incorporó uno en cada proceso electroforético junto a la muestras.
MétodosSistema Lipoprint LDL® QuantimetrixEl sistema Lipoprint LDL® (Quantimetrix Corporation) separa las distintas subfracciones de lipoproteínas según su diferente tamaño y carga eléctrica mediante electroforesis en gel de poliacrilamida. Permite aislar hasta 12 fracciones de lipoproteínas: 1 VLDL (very low density lipoproteins ‘lipoproteínas de muy baja densidad’), 3 IDL (intermediate density lipoproteins ‘lipoproteínas de densidad intermedia’), 7 LDL y 1 HDL (high density lipoproteins ‘lipoproteínas de alta densidad’) (fig. 1).
Requiere 25μl de suero/plasma y el tiempo total de análisis es de 2,5h. Tras ponerse en contacto el suero problema y el gel de poliacrilamida se produce la fotopolimerización del gel por exposición directa a un foco de luz fluorescente durante 30min. Posteriormente, se aplica una carga eléctrica continua durante una hora y se consiguen distintas bandas, cada una correspondiente a una fracción concreta de lipoproteína. La identificación y cuantificación de cada banda se realiza al escanear densitométricamente el gel a 610nm y procesar los datos mediante el software de Quantimetrix. De esta forma, cada banda queda identificada en función de un factor de retención y cuantificada según el área de la curva delimitada entre 2 bandas5,6.
Además, el sistema proporciona información acerca del diámetro medio de las partículas LDL, que se estima mediante el algoritmo desarrollado por Kazumi et al7.
Análisis de los parámetros lipídicosEl colesterol total, el colesterol ligado a HDL (cHDL) y los triglicéridos se cuantificaron en un analizador modular P Hitachi (Roche Diagnostics®) mediante un test colorimétrico enzimático homogéneo con los reactivos que suministró el fabricantea. El colesterol ligado a LDL (cLDL) se estimó mediante la fórmula descrita originalmente por Friedewald, Levy y Fredrickson11. Una limitación de esta estimación es que no debe emplearse cuando la concentración de triglicéridos es superior a 200mg/dl12.
Las apolipoproteínas (apo) A1 y B se midieron en un analizador BN ProSpec® (Siemens) mediante un ensayo inmunonefelométrico con los anticuerpos suministrados por el fabricanteb.
Evaluación del métodoPrecisiónLa precisión intraensayo se determinó procesando el control Liposure® 12 veces consecutivas en la misma electroforesis; la precisión interensayo analizándolo una única vez durante 12 días diferentes a lo largo del intervalo de un mes.
Valores en nuestra poblaciónSe seleccionaron 60 pacientes sin diabetes ni alteraciones del metabolismo lipídico sobre la base de los criterios ADA 199713 y las normas del National Cholesterol Education Program. Adult Treatment Panel III(NCEP)1, respectivamente. La edad osciló entre 17 y 81 años (el 55%, varones).
Correlación del diámetro medio de LDL con otros marcadores lipídicosEn el total de las 194 muestras analizamos la correlación entre el diámetro medio de la partícula LDL y los siguientes marcadores lipídicos: colesterol total, apo AI, apo B100, cLDL, triglicéridos, cHDL y cociente LDL/apo B100.
Análisis estadísticoSe obtuvieron la media, DE y coeficiente de variación (CV) para el cálculo de la precisión intraensayo e interensayo, y media e intervalos de confianza (IC) del 95% para la determinación de los valores de referencia. Los parámetros se compararon en función del sexo mediante la prueba U de Mann-Whitney.
Para analizar la correlación se empleó la ρ de Spearman y su nivel de significación (p) para un IC del 95%.
Para todos los cálculos se utilizó el software SPSS V.12.
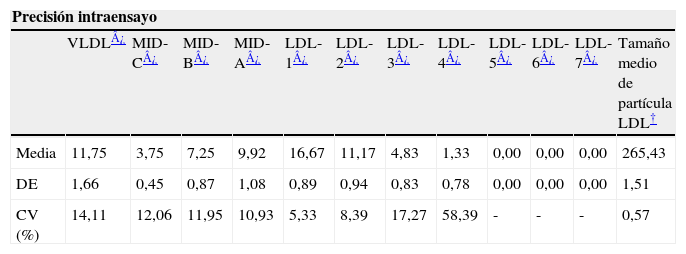
ResultadosLos CV intraensayo e interensayo se muestran en la tabla 1. Los CV de las subfracciones LDL-4 a LDL-7 superan el 50%, por lo que procedimos a agruparlas para su empleo en el resto del estudio, como aconseja el fabricante.
Coeficientes de variación intraensayo e interensayo para las subfracciones lipoproteicas medidas por el sistema Lipoprint
| Precisión intraensayo | ||||||||||||
| VLDL¿ | MID-C¿ | MID-B¿ | MID-A¿ | LDL-1¿ | LDL-2¿ | LDL-3¿ | LDL-4¿ | LDL-5¿ | LDL-6¿ | LDL-7¿ | Tamaño medio de partícula LDL† | |
| Media | 11,75 | 3,75 | 7,25 | 9,92 | 16,67 | 11,17 | 4,83 | 1,33 | 0,00 | 0,00 | 0,00 | 265,43 |
| DE | 1,66 | 0,45 | 0,87 | 1,08 | 0,89 | 0,94 | 0,83 | 0,78 | 0,00 | 0,00 | 0,00 | 1,51 |
| CV (%) | 14,11 | 12,06 | 11,95 | 10,93 | 5,33 | 8,39 | 17,27 | 58,39 | - | - | - | 0,57 |
| Precisión interensayo | ||||||||||||
| VLDL¿ | MID-C¿ | MID-B¿ | MID-A¿ | LDL-1¿ | LDL-2¿ | LDL-3¿ | LDL-4¿ | LDL-5¿ | LDL-6¿ | LDL-7¿ | Tamaño medio de partícula LDL† | |
| Media | 17,67 | 5,25 | 8,00 | 9,67 | 14,08 | 10,08 | 4,00 | 0,83 | 0,00 | 0,00 | 0,00 | 266,03 |
| DE | 6,54 | 2,73 | 3,28 | 4,68 | 1,98 | 1,73 | 2,00 | 1,19 | 0,00 | 0,00 | 0,00 | 3,43 |
| CV (%) | 37,03 | 52,08 | 40,94 | 48,39 | 14,03 | 17,16 | 50,00 | 143,21 | - | - | - | 1,29 |
CV: coeficiente de variación; DE: desviación estándar; LDL: low density lipoproteins ‘lipoproteínas de baja densidad’; MID: banda intermedia; VLDL: very low density lipoproteins ‘lipoproteínas de muy baja densidad’.
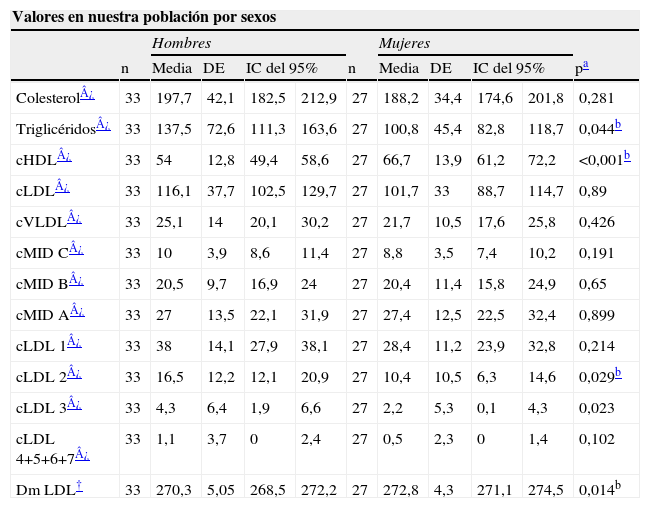
En la tabla 2 se muestran los valores en nuestra población, separados por sexo. Los triglicéridos, el cLDL y el colesterol de la subfracción 2 de LDL fueron superiores en hombres, mientras que las mujeres tuvieron concentraciones superiores de cHDL, así como el diámetro medio de las partículas LDL.
Valores en nuestra población, por sexos, de las variables lipídicas analizadas
| Valores en nuestra población por sexos | |||||||||||
| Hombres | Mujeres | ||||||||||
| n | Media | DE | IC del 95% | n | Media | DE | IC del 95% | pa | |||
| Colesterol¿ | 33 | 197,7 | 42,1 | 182,5 | 212,9 | 27 | 188,2 | 34,4 | 174,6 | 201,8 | 0,281 |
| Triglicéridos¿ | 33 | 137,5 | 72,6 | 111,3 | 163,6 | 27 | 100,8 | 45,4 | 82,8 | 118,7 | 0,044b |
| cHDL¿ | 33 | 54 | 12,8 | 49,4 | 58,6 | 27 | 66,7 | 13,9 | 61,2 | 72,2 | <0,001b |
| cLDL¿ | 33 | 116,1 | 37,7 | 102,5 | 129,7 | 27 | 101,7 | 33 | 88,7 | 114,7 | 0,89 |
| cVLDL¿ | 33 | 25,1 | 14 | 20,1 | 30,2 | 27 | 21,7 | 10,5 | 17,6 | 25,8 | 0,426 |
| cMID C¿ | 33 | 10 | 3,9 | 8,6 | 11,4 | 27 | 8,8 | 3,5 | 7,4 | 10,2 | 0,191 |
| cMID B¿ | 33 | 20,5 | 9,7 | 16,9 | 24 | 27 | 20,4 | 11,4 | 15,8 | 24,9 | 0,65 |
| cMID A¿ | 33 | 27 | 13,5 | 22,1 | 31,9 | 27 | 27,4 | 12,5 | 22,5 | 32,4 | 0,899 |
| cLDL 1¿ | 33 | 38 | 14,1 | 27,9 | 38,1 | 27 | 28,4 | 11,2 | 23,9 | 32,8 | 0,214 |
| cLDL 2¿ | 33 | 16,5 | 12,2 | 12,1 | 20,9 | 27 | 10,4 | 10,5 | 6,3 | 14,6 | 0,029b |
| cLDL 3¿ | 33 | 4,3 | 6,4 | 1,9 | 6,6 | 27 | 2,2 | 5,3 | 0,1 | 4,3 | 0,023 |
| cLDL 4+5+6+7¿ | 33 | 1,1 | 3,7 | 0 | 2,4 | 27 | 0,5 | 2,3 | 0 | 1,4 | 0,102 |
| Dm LDL† | 33 | 270,3 | 5,05 | 268,5 | 272,2 | 27 | 272,8 | 4,3 | 271,1 | 274,5 | 0,014b |
cHDL: colesterol ligado a lipoproteínas de alta densidad; cLDL: colesterol ligado a lipoproteínas de baja densidad; cMID: colesterol unido a banda intermedia; cVLDL: colesterol ligado a lipoproteínas de muy baja densidad; DE: desviación estándar; Dm: diámetro medio; IC: intervalo de confianza; LDL: low density lipoproteins ‘lipoproteínas de baja densidad’.
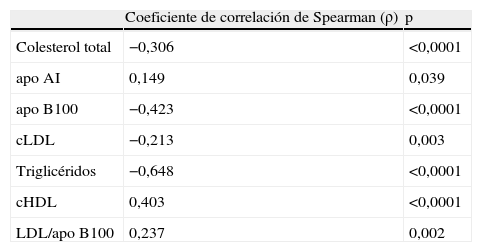
En la tabla 3 se presentan las correlaciones del diámetro medio de la partícula LDL con el resto de las variables lipídicas. Encontramos significación estadística con todas las variables estudiadas, pero la mayor asociación se presentó de forma inversamente proporcional con la concentración de triglicéridos.
Correlación del tamaño medio de partículas de lipoproteínas de baja densidad con otros marcadores lipídicos
| Coeficiente de correlación de Spearman (ρ) | p | |
| Colesterol total | −0,306 | <0,0001 |
| apo AI | 0,149 | 0,039 |
| apo B100 | −0,423 | <0,0001 |
| cLDL | −0,213 | 0,003 |
| Triglicéridos | −0,648 | <0,0001 |
| cHDL | 0,403 | <0,0001 |
| LDL/apo B100 | 0,237 | 0,002 |
apo: apolipoproteína; cHDL: colesterol ligado a lipoproteínas de alta densidad; cLDL: colesterol ligado a lipoproteínas de baja densidad; LDL: low density lipoproteins ‘lipoproteínas de baja densidad’.
Actualmente, ninguno de los métodos disponibles para determinar las subfracciones de LDL se ha establecido como método de referencia, que determine su valor potencial como factor adicional de riesgo cardiovascular4. El sistema electroforético Lipoprint presenta la ventaja de que la FDA (Food and Drug Administration) lo aprobó para su uso clínico, aporta controles internos para la evaluación de la imprecisión técnica y además estima el diámetro medio de las partículas LDL. El uso de controles en cada proceso electroforético garantiza la fiabilidad de los resultados y permite la estandarización del ensayo.
Los valores obtenidos para nuestra población de estudio muestran un perfil lipídico menos favorable en hombres que en mujeres. Al comparar el diámetro medio de partículas LDL con los parámetros lipídicos encontramos que está asociado inversamente con la concentración de triglicéridos y apo B100, y directamente con la de cHDL. Otros autores también describen una fuerte asociación entre el aumento de las LDL pequeñas y densas y la concentración plasmática de triglicéridos, así como con los niveles bajos de cHDL14,15, parámetros asociados a un mayor riesgo cardiovascular16. Sin embargo, no podemos asegurar que las subfracciones que nosotros separamos se correspondan exactamente con las obtenidas en estos estudios.
Hay pocos estudios que evidencien la utilidad de estas partículas como biomarcadores de enfermedad cardiovascular. El Quebec Cardiovascular Study describió que el aumento de las LDL pequeñas y densas es un predictor fuerte e independiente de enfermedad coronaria en los primeros 7 años y que las concentraciones elevadas de las partículas LDL grandes y ligeras se encuentran asociadas a un perfil más favorable de riesgo cardiovascular17. Recientemente, Koba et al también han demostrado que los niveles de LDL pequeñas y densas son indicadores más potentes de aterosclerosis coronaria grave que los niveles de LDL total18.
Sin embargo, dado que el número estimado de subfracciones de LDL depende del método empleado, la extrapolación de resultados a pacientes resulta difícil. Además, la ausencia de un método de referencia y la falta de estandarización limitan su empleo en la clínica. El sistema Lipoprint® es el único método aprobado por la FDA para su uso clínico con la incorporación de controles internos y resultados que correlacionan satisfactoriamente con las técnicas actualmente disponibles en la mayoría de los laboratorios clínicos. Su sencillez, rapidez de resultados y bajo volumen de muestra requerida lo hacen útil para la medida de la concentración y diámetro medio de partículas LDL.
Para concluir, faltan estudios que comparen la exactitud diagnóstica entre los diferentes métodos y que relacionen los resultados obtenidos con los parámetros clínicos que se emplean en la valoración del riesgo cardiovascular.
Colesterol total: método Roeschlau y Allain modificado8; referencia reactivo 11875523. cHDL: método Betaquant9; referencia reactivo 3038602, 3038904. Triglicéridos: método Wahlefeld10; referencia reactivo 11876040.
apo AI: reactivo N Antisera to Apolipoprotein AI, n.∘ referencia OVED 09; apo B: reactivo N Antisera to Apolipoprotein B; reactivo suplementario N Supplementary Reagent P (OUMU15) BN ProSpec.