Las enfermedades tiroideas, después de la diabetes mellitus, se encuentran entre los trastornos endocrinos más comunes durante el embarazo, con una incidencia del 5-10%. Es importante su detección y tratamiento precoz ya que puede tener consecuencias negativas tanto para la madre como para el feto.
El hipertiroidismo se encuentra en menor frecuencia que el hipotiroidismo durante el embarazo, entre 0,1-1%. Se caracteriza por presentar tirotropina baja con hormonas tiroideas elevadas, siendo la enfermedad de Graves la causa más frecuente (el 85% de los casos).
A continuación se expone el caso de un lactante con hipertiroidismo primario de etiología autoinmune, hijo de una madre sin diagnóstico previo de hipertiroidismo durante la gestación.
Thyroid diseases, after diabetes mellitus, are among the most common endocrine disorders during pregnancy, with an incidence of 5-10%. Early detection and treatment is important, as they can have negative consequences for both the mother and the foetus.
Hyperthyroidism is less frequent than hypothyroidism during pregnancy, being between 0.1% and 1%. It is characterised by a low thyrotropin with elevated thyroid hormones, with Graves’ disease being the most frequent cause (85% of cases).
The following is the case of an infant with primary hyperthyroidism of autoimmune origin, the son of a mother without previous diagnosis of hyperthyroidism during gestation.
Durante el embarazo la causa más frecuente de hipertiroidismo es la enfermedad de Graves, presentándose en el 85% de los casos1,2.
Esta enfermedad puede tener consecuencias negativas tanto para la embarazada como para el feto, por lo que una detección rápida y una terapia adecuada disminuirán la aparición de complicaciones, como son: parto prematuro, aborto, recién nacido de bajo peso, hipertensión arterial, insuficiencia cardíaca, hipertiroidismo neonatal y tormentas tiroideas1,2.
La enfermedad de Graves se caracteriza por presentar bocio difuso con o sin oftalmopatía y anticuerpos estimulantes del receptor de tirotropina (TSH) (TRAb).
Deberá prestarse especial atención al nivel de los TRAb, ya que pueden atravesar la placenta y afectar al feto3, después de la semana 10-12 del embarazo, cuando el tiroides fetal comienza a funcionar, provocando hipertiroidismo fetal o neonatal.
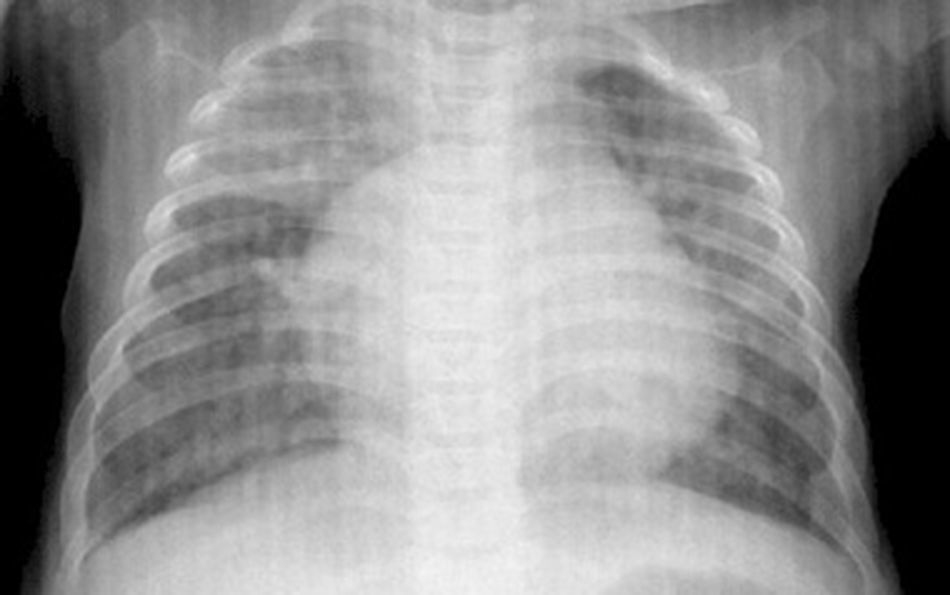
Presentación del casoLactante de 2 meses acude a urgencias del Hospital del Puerto de Santa María (Cádiz) por decaimiento, rechazo de las tomas y alteración del patrón respiratorio. Se le realiza radiografía de tórax y se visualiza cardiomegalia.
En su estancia presenta empeoramiento clínico y es trasladado al Hospital Puerta del Mar (Cádiz). A su llegada muestra mal estado general, no respuesta a estímulos, respiración acidótica, bradicardia brusca, hepatomegalia de 3-4cm, anuria, acidosis mixta e hipoglucemia severa. Al no mejorar, y dada su inestabilidad clínica por fallo multiorgánico, shock y sospecha de miocardiopatía o enfermedad metabólica se le traslada al Hospital Universitario Virgen del Rocío (Sevilla).
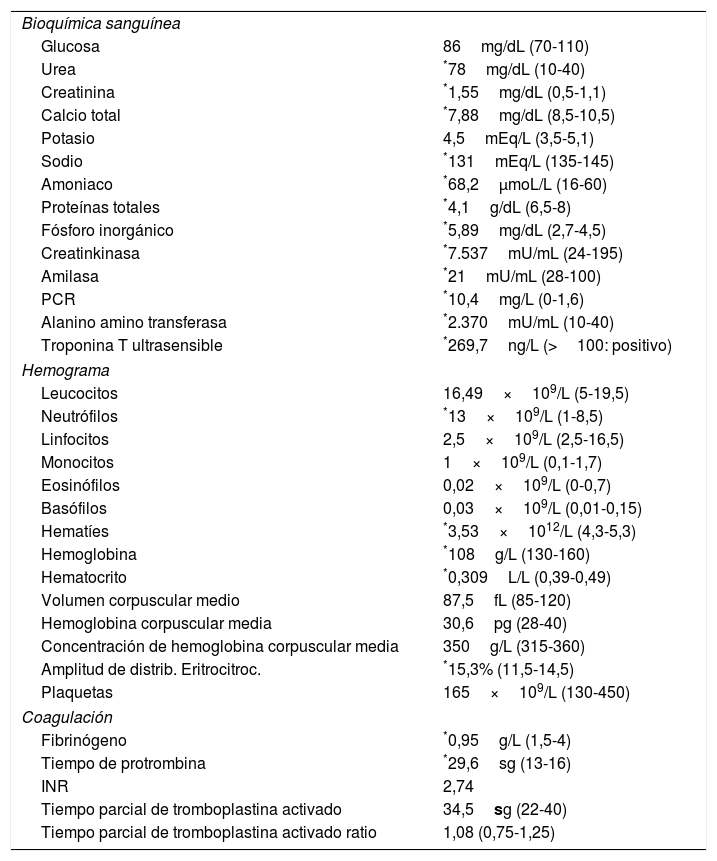
A su ingreso se realiza analítica, presentando múltiples alteraciones (tabla 1) y destacando valores muy elevados de creatinkinasa y transaminasas, probablemente causados por la cardiopatía y hepatomegalia que presenta el paciente. Además, en radiografía de tórax se observa cardiomegalia, siendo diagnosticado de una miocardiopatía dilatada y ventrículo izquierdo con mala contractilidad (fig. 1).
Analítica al ingreso del lactante en el Hospital Universitario Virgen del Rocío
| Bioquímica sanguínea | |
| Glucosa | 86mg/dL (70-110) |
| Urea | *78mg/dL (10-40) |
| Creatinina | *1,55mg/dL (0,5-1,1) |
| Calcio total | *7,88mg/dL (8,5-10,5) |
| Potasio | 4,5mEq/L (3,5-5,1) |
| Sodio | *131mEq/L (135-145) |
| Amoniaco | *68,2μmoL/L (16-60) |
| Proteínas totales | *4,1g/dL (6,5-8) |
| Fósforo inorgánico | *5,89mg/dL (2,7-4,5) |
| Creatinkinasa | *7.537mU/mL (24-195) |
| Amilasa | *21mU/mL (28-100) |
| PCR | *10,4mg/L (0-1,6) |
| Alanino amino transferasa | *2.370mU/mL (10-40) |
| Troponina T ultrasensible | *269,7ng/L (>100: positivo) |
| Hemograma | |
| Leucocitos | 16,49×109/L (5-19,5) |
| Neutrófilos | *13×109/L (1-8,5) |
| Linfocitos | 2,5×109/L (2,5-16,5) |
| Monocitos | 1×109/L (0,1-1,7) |
| Eosinófilos | 0,02×109/L (0-0,7) |
| Basófilos | 0,03×109/L (0,01-0,15) |
| Hematíes | *3,53×1012/L (4,3-5,3) |
| Hemoglobina | *108g/L (130-160) |
| Hematocrito | *0,309L/L (0,39-0,49) |
| Volumen corpuscular medio | 87,5fL (85-120) |
| Hemoglobina corpuscular media | 30,6pg (28-40) |
| Concentración de hemoglobina corpuscular media | 350g/L (315-360) |
| Amplitud de distrib. Eritrocitroc. | *15,3% (11,5-14,5) |
| Plaquetas | 165×109/L (130-450) |
| Coagulación | |
| Fibrinógeno | *0,95g/L (1,5-4) |
| Tiempo de protrombina | *29,6sg (13-16) |
| INR | 2,74 |
| Tiempo parcial de tromboplastina activado | 34,5sg (22-40) |
| Tiempo parcial de tromboplastina activado ratio | 1,08 (0,75-1,25) |
También se sospechó de enfermedad metabólica por presentar: hiperamoniemia, hiperlactacidemia, coagulopatía, hipertransaminasemia, acidosis metabólica severa e hipoglucemia.
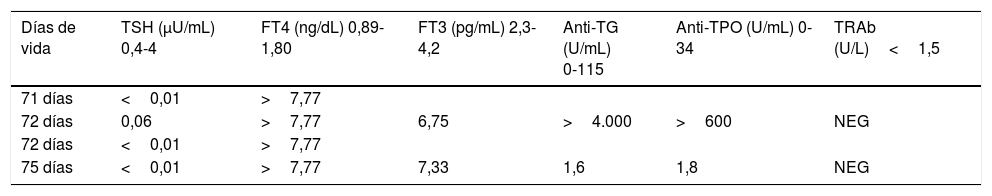
Tras solicitar estudio de hormonas tiroideas, el análisis es llevado a cabo desde el laboratorio mediante un inmunoanálisis de electroquimioluminiscencia «ECLIA», en los autoanalizadores Cobas 8000 (módulo e802) y Modular Analytics (módulo E170) de Roche Diagnostics®. El estudio muestra una TSH de 0,01μU/mL (intervalo de medición 0,005-100μU/mL) y una tiroxina libre (FT4)>7,7ng/dL (intervalo de medición 0,023-7,7ng/dL), confirmado con 2 muestras (tabla 2); ante estos resultados se avisa telefónicamente desde el laboratorio de hormonas, y el paciente es diagnosticado de hipertiroidismo primario en estudio.
Perfil tiroideo del lactante durante su ingreso en nuestro hospital
| Días de vida | TSH (μU/mL) 0,4-4 | FT4 (ng/dL) 0,89-1,80 | FT3 (pg/mL) 2,3-4,2 | Anti-TG (U/mL) 0-115 | Anti-TPO (U/mL) 0-34 | TRAb (U/L)<1,5 |
|---|---|---|---|---|---|---|
| 71 días | <0,01 | >7,77 | ||||
| 72 días | 0,06 | >7,77 | 6,75 | >4.000 | >600 | NEG |
| 72 días | <0,01 | >7,77 | ||||
| 75 días | <0,01 | >7,77 | 7,33 | 1,6 | 1,8 | NEG |
La madre informa que durante el periodo de gestación solo ha tomado el tratamiento habitual de yodo y ácido fólico, del mismo modo en la lactancia tampoco ha ingerido ningún tipo de medicamento, alimentándose el lactante exclusivamente de leche materna. En la evaluación del cribado neonatal de hipotiroidismo congénito no presentó ninguna alteración. Pasó la revisión al mes de vida sin encontrar ningún hallazgo patológico, sin embargo, refiere que desde el nacimiento ha ganado solo 600g.
Se realiza ecografía tiroidea, encontrándose dentro de la normalidad. Asimismo, se determinaron niveles de anticuerpos antitiroideos: los anticuerpos antiperoxidasa y antitirogoblulina mostraron valores elevados, y los TRAb fueron negativos. La metodología empleada en el laboratorio para la determinación de los anticuerpos antiperoxidasa y antitiroglobulina es un inmunoanálisis de electroquimioluminiscencia «ECLIA» de tipo competitivo, en los autoanalizadores Cobas 8000 (módulo e802) y Modular Analytics (módulo E170) de Roche Diagnostics®. Por otro lado, los TRAb fueron analizados mediante «ELISA» (ensayo por inmunoabsorción ligado a enzimas) de RSR Limited; se trata de inmunoglobulinas inhibidoras de la unión de TSH, basados en que la TSH y los TRAb compiten en su unión al receptor de TSH, pero no son capaces de distinguir el tipo de TRAb. Estos son usados por la mayoría de los laboratorios y hacen referencia principalmente al material Thyroid Stimulating Antibody 1st IS 90/672 (NIBSC/OMS).
Tras los resultados obtenidos en el lactante, se decide revisar la historia de la madre, donde no constan antecedentes previos de alteración tiroidea. Además se indica que durante el embarazo no presentó indicios de hipertiroidismo bioquímico ni clínico, por lo que no se justificó la determinación de los TRAb en ese momento.
Debido a la sospecha de hipertiroidismo neonatal, se le solicita a la madre estudio bioquímico tiroideo, mostrando valores eutiroideos de TSH 0,97μU/mL (0,4-4μU/mL) y FT4 1,59ng/dL (0,89-1,8ng/dL), salvo niveles TRAb positivos (3,17U/L [<1,5U/L]), considerándose el hipertiroidismo neonatal de naturaleza autoinmune, ya que los TRAb son positivos en la madre y estos no se encuentran habitualmente presente en la población sana4.
La vida media de los TRAb maternos en el neonato es de aproximadamente 12 días, lo cual justifica los valores negativos que presenta nuestro lactante en las distintas muestras (tabla 2), sin embargo el estímulo tiroideo puede mantenerse durante 3-12 semanas5,6.
Teniendo en cuenta estos resultados se decide iniciar tratamiento con: carbimazol, solución de lugol y dexametasona. Después de varios días, se repite estudio del perfil tiroideo (tabla 2), donde se observa que los valores de los anticuerpos, anteriormente elevados, se han normalizado debido al efecto inmunomodulador del tratamiento7; sin embargo, el grado de afectación del paciente es muy grave y el tiroides se mantiene alterado, presentando concentraciones de TSH, FT4 y FT3 que indican hipertiroidismo.
A los 15 días de ingreso en la unidad de cuidados intensivos, se desencadena un empeoramiento de la función cardíaca, con fracaso multiorgánico, muy mala perfusión periférica, saturación sanguínea de oxígeno y frecuencia cardíaca en descenso.
Finalmente, el lactante hace parada cardíaca de la que no se recupera y fallece.
DiscusiónEn 1998 se publicaron las guías8 para la medición de TRAb durante el embarazo y hasta ahora no han cambiado. En ellas, se sugiere medir títulos de anticuerpos al menos una vez durante el embarazo a toda mujer con enfermedad de Graves activa o anteriormente tratada con terapia ablativa, no importando el nivel hormonal que la paciente tenga en el momento del embarazo, debiendo medirse durante el tercer trimestre (alrededor de la semana 26), y si los niveles son mayores del 50% con respecto al valor normal hay una alta probabilidad de hipertiroidismo neonatal8. Además en las guías del 2017 de la American Thyroid Association para el diagnóstico y tratamiento de la enfermedad tiroidea durante el embarazo y el parto, se recomienda medir la TSH, y anticuerpos (anti-TPO) si procede, durante el primer trimestre9.
En general los anticuerpos antitiroideos pueden ser detectables hasta en el 15% de gestantes con eutiroidismo; la positividad incrementa el riesgo de disfunción tiroidea durante el embarazo y posparto9. Estas mujeres tienen mayor riesgo de abortos recurrentes, tanto en embarazos espontáneos como después de fertilización in vitro, de parto prematuro y de desprendimiento de placenta.
El hipertiroidismo fetal se presenta en aproximadamente el 1-5% de hijos de madres hipertiroideas y puede ser consecuencia tanto del hipertiroidismo materno primario como de la enfermedad de Graves gestacional activa o de la enfermedad de Graves tratada previa a la concepción5,10. En todos los casos hay paso de hormonas y/o anticuerpos por vía transplacentaria, los cuales hiperestimulan la glándula tiroidea fetal, desencadenando una sintomatología similar a la de nuestro lactante.
Una forma clínica infrecuente es la ocurrida en nuestro caso. Se trata de la enfermedad de Graves del recién nacido, donde los TRAb fueron detectados de forma casual en la madre, ya que no presentaba antecedentes previos de alteración tiroidea en su historia. En gestantes con enfermedad de Graves se recomienda determinar los TRAb durante el tercer trimestre del embarazo5. Si son negativos, no se precisa seguimiento del feto/neonato. Si los TRAb superan en 2 o 3 veces el límite alto de lo normal, se trata de un hipertiroidismo neonatal de alto riesgo, y precisa ecografías tiroideas seriadas (cada 4-6 semanas)5.
En nuestro hospital, el manejo de los recién nacidos de madres con enfermedad de Graves abarcan: determinación de los TRAb; evaluación de TSH y FT4 en el recién nacido; evaluación clínica y bioquímica semanalmente durante el tratamiento con fármacos antitiroideos en los casos de hipertiroidismo neonatal; consenso en el inicio y duración del tratamiento en estos recién nacidos.
Uno de los puntos importantes es la determinación de los TRAb alrededor de la semana 26 de gestación, para poder detectar a todas las gestantes con alteración tiroidea tanto ya conocida como desconocida. La determinación de estos anticuerpos es esencial, ya que pueden atravesar libremente la placenta, pudiéndose encontrar en el cordón umbilical asociados a un mayor riesgo de hipertiroidismo neonatal5.
Los TRAb maternos suelen desaparecer de la circulación neonatal aproximadamente a los 12 días de vida, sin embargo, el estímulo tiroideo se mantiene durante más tiempo (3-12 semanas)5,6. La remisión completa del paciente depende de los niveles iniciales de TRAb, siendo frecuente que esta se produzca a las 20 semanas, y prácticamente en la totalidad de los pacientes a las 48 semanas11. En nuestro caso, los niveles de TRAb pasaron desapercibidos al no haber sido determinados durante la gestación, con lo que no podían conocerse los niveles iniciales. Además, el lactante ingresó a las 8 semanas de vida, con lo cual ya había eliminado completamente los TRAb maternos, aunque el grado de afectación del paciente era elevado, al encontrarse muy alterada la función tiroidea.
ConclusionesLa implantación de protocolos de estudio de la función tiroidea durante el embarazo que incluyan la determinación de anticuerpos antitiroideos (anti-TPO y TRAb) en la semana 26 de gestación, independiente del valor de las hormonas tiroideas maternas, representa un reto médico, ya que contribuiría a detectar la presencia de títulos elevados de anticuerpos antirreceptor de TSH, predictores de riesgo de hipertiroidismo neonatal, tal como se expone en nuestro caso clínico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesCada uno de los autores expuestos cumplimos los requisitos de autoría, así como declaramos que no existe ningún conflicto de intereses.