El hallazgo casual de resultados discrepantes en la determinación de un parámetro bioquímico cuando se realiza en distintas diluciones de la misma muestra, puede orientar hacia una interferencia analítica. Se presenta el estudio de 3 pacientes en los que se demostró una interferencia positiva en la medida inmunoturbidimétrica de antiestreptolisina-O debido a la presencia de una inmunoglobulina monoclonal IgM-κ.
The casual finding of disparate results in the determination of an analyte when it is measured at different dilutions on the same sample can lead us to suspect the presence of analytical interference. We present the study of 3 patients in whom a positive interference was proved on the immunoturbidimetric measurement of antistreptolysin-O due to the presence of a monoclonal immunoglobulin IgM Kappa.
Las inmunoglobulinas monoclonales son una patología relativamente frecuente, y pueden encontrarse en un 1% de personas mayores de 50 años y hasta en más del 3% en mayores de 70 años1. En ensayos automáticos de diferentes metodologías, incluyendo nefelometría, turbidimetría y diversos ensayos inmunológicos, se ha demostrado la presencia de interferencia con inmunoglobulinas monoclonales debido a la formación de precipitados durante el análisis de la muestra.
Dependiendo del momento en el que ocurra la agregación, se obtendrán resultados falsamente aumentados o disminuidos. Dado que una forma de detectar dicha interferencia es observar la falta de correlación de los valores de una magnitud en diferentes diluciones, podemos aprovecharnos de la observación de las discrepancias en dichos resultados cuando el analizador realiza automáticamente una dilución.
Se presenta el estudio de 3 pacientes en los que se detecta una interferencia en la determinación de antiestreptolisina-O (ASLO). En los 3 casos la interferencia se sospechó al obtener en la primera determinación un valor de ASLO alto junto con alarma de absorbancia excesiva y posteriormente un valor indetectable en la dilución automática de 1:6 que el analizador realiza ante dicha alarma.
Se estudia además la posible interferencia en otros parámetros que según la bibliografía científica revisada2–4 pueden alterarse en casos de presencia de componentes monoclonales cuando se utilizan técnicas nefelométricas o inmunoturbidimétricas, como es nuestro caso (proteína C-reactiva [PCR], ferritina, transferrina y factor reumatoide), no observándose interferencia para ninguno de ellos.
Material y métodosLa determinación de ASLO se realizó mediante una técnica inmunoturbidimétrica, Tina-quant de Roche, en un analizador modular P de Roche Diagnostic, Tokio, Japón. Este test consta de 2 pasos:
- –
Pipeteo de muestra y adición de tampón TRIS (tris hidroximetil amino metano) 170mmol/l, pH 8,2.
- –
Adición de partículas de látex recubiertas de estreptolisina en tampón borato 10mmol/l, pH 8,2; los anticuerpos de la muestra reaccionan con la estreptolisina que recubre el látex formando un complejo antígeno-anticuerpo y esta aglutinación se mide turbidimétricamente.
El intervalo de medición de esta magnitud es de 20-600UI/ml y el rango de referencia en un autoanalizador modular de Roche es<200UI/ml en adultos y<150UI/ml en niños.
Ante la sospecha de interferencia se realizaron las siguientes acciones:
- –
Diluciones seriadas de las muestras desde 1:2 hasta 1:8 con NaCl al 0,9% y determinación de ASLO, PCR, factor reumatoide, ferritina y transferrina en todas ellas, mediante inmunoturbidimetría Tina-quant de Roche, en el mismo analizador modular P de Roche Diagnostic, Tokio, Japón.
- –
Determinación de ASLO por una técnica alternativa (ASO-látex Spinreact, Sant Esteve de Bas, España).
- –
Solicitud de proteinograma e inmunofijación en las 3 muestras.
- –
Solicitud de determinación de inmunoglobulinas en las 3 muestras.
La técnica ASO-látex de Spinreact está basada en la aglutinación en porta de la mezcla de una gota de suero del paciente con una de reactivo que contiene una suspensión de partículas de látex recubiertas con estreptolisina O. La presencia de aglutinación indica una concentración de ASLO >200UI/ml.
El proteinograma y la inmunofijación se realizaron en un equipo Hydrasys (Sebia Hispania S.A., Barcelona, España), mientras que la dosificación de inmunoglobulinas (IgG, IgA e IgM) y las cadenas ligeras totales (κ, λ) se realizó en un nefelómetro BNII (Dade-Behring, Barcelona, España), calculándose el cociente κ/λ.
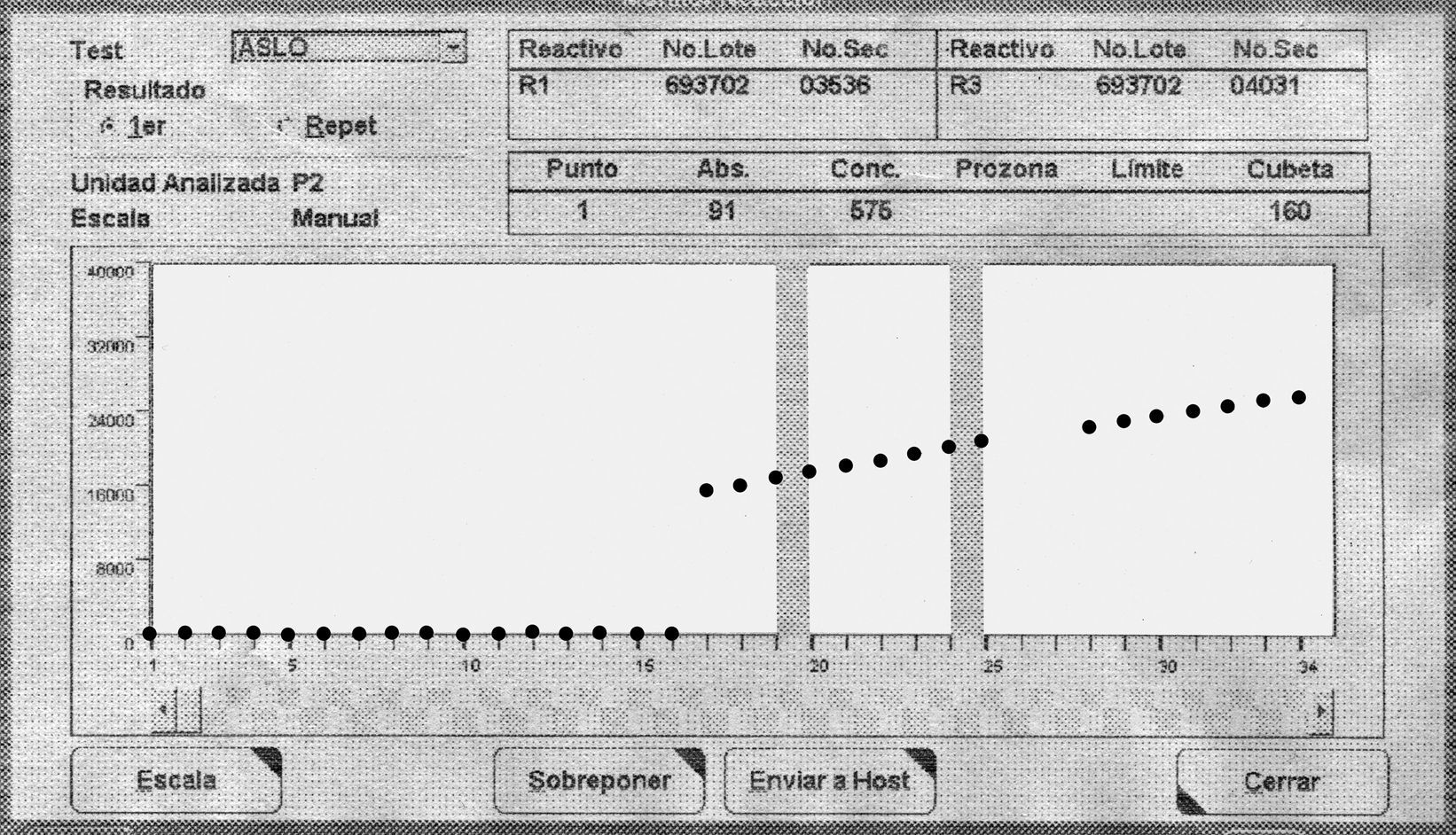
Las curvas de reacción de los pacientes problema (obtenidas en el propio analizador modular P Roche) se comparan con las de un paciente control. Se utilizó un paciente control con una concentración elevada de ASLO (575UI/ml), que no presentaba patología monoclonal (no se observó pico monoclonal en el proteinograma, y la dosificación de inmunoglobulinas estaba dentro del rango de referencia).
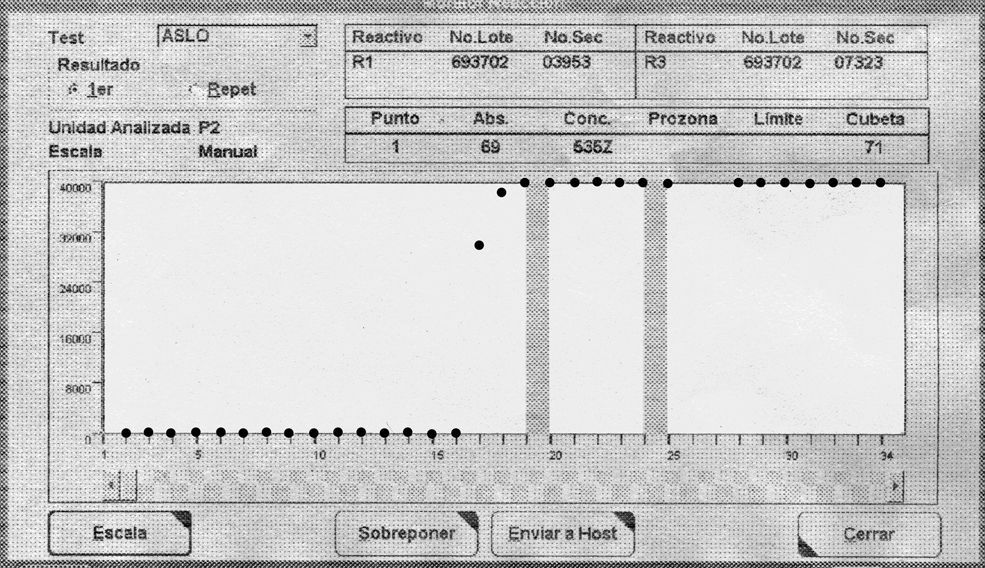
ResultadosEn la medición de ASLO en el modular P de Roche se obtuvo un valor 1.245UI/ml en el caso A, de 480UI/ml en el B y de 535UI/ml en el C, y en todos ellos apareció la alarma “Z” de absorbancia excesiva. El analizador realiza automáticamente una dilución 1:6 de la muestra obteniéndose valores con signo negativo en los 3 casos junto con la alarma “$” que corresponde a resultados por debajo del límite de detección de la técnica.
En las curva de reacción de las muestras de los 3 pacientes se puede observar un aumento drástico de la turbidez al añadir el segundo reactivo (fig. 1), lo que contrasta con una reacción más lenta en el caso del paciente control (fig. 2).
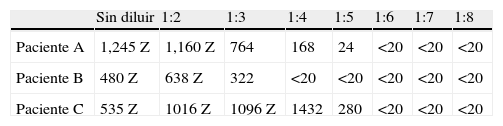
Los resultados de la medición de ASLO en las diluciones seriadas de cada uno de los pacientes se muestran en la tabla 1. Se observa como la alarma de absorbancia excesiva está presente hasta la dilución 1:2 (pacientes A y B) y 1:3 (paciente C), lo que invalida la medición. A partir de estas diluciones, los valores de ASLO van disminuyendo hasta dar un valor indetectable con la dilución 1:6 en los casos A y C, y con la dilución 1:4 en el caso B.
Resultados del antiestreptolisina-O (ASLO) (UI/ml) en los 3 pacientes a las distintas diluciones realizadas
| Sin diluir | 1:2 | 1:3 | 1:4 | 1:5 | 1:6 | 1:7 | 1:8 | |
| Paciente A | 1,245 Z | 1,160 Z | 764 | 168 | 24 | <20 | <20 | <20 |
| Paciente B | 480 Z | 638 Z | 322 | <20 | <20 | <20 | <20 | <20 |
| Paciente C | 535 Z | 1016 Z | 1096 Z | 1432 | 280 | <20 | <20 | <20 |
Z: alarma de absorbancia excesiva. Muestra muy concentrada o lipémica. Los valores de ASLO se expresan multiplicados por su dilución, excepto en caso de que el resultado estuviera marcado con alarma (medición inválida).
Los valores del resto de las magnitudes analizadas en las diluciones seriadas (transferrina, ferritina, PCR y factor reumatoide) fueron muy similares a los del suero sin diluir, y no se encontró evidencia de interferencia para estos constituyentes. El resultado de la medición de ASLO por la técnica alternativa de Spinreact fue negativo en los 3 casos.
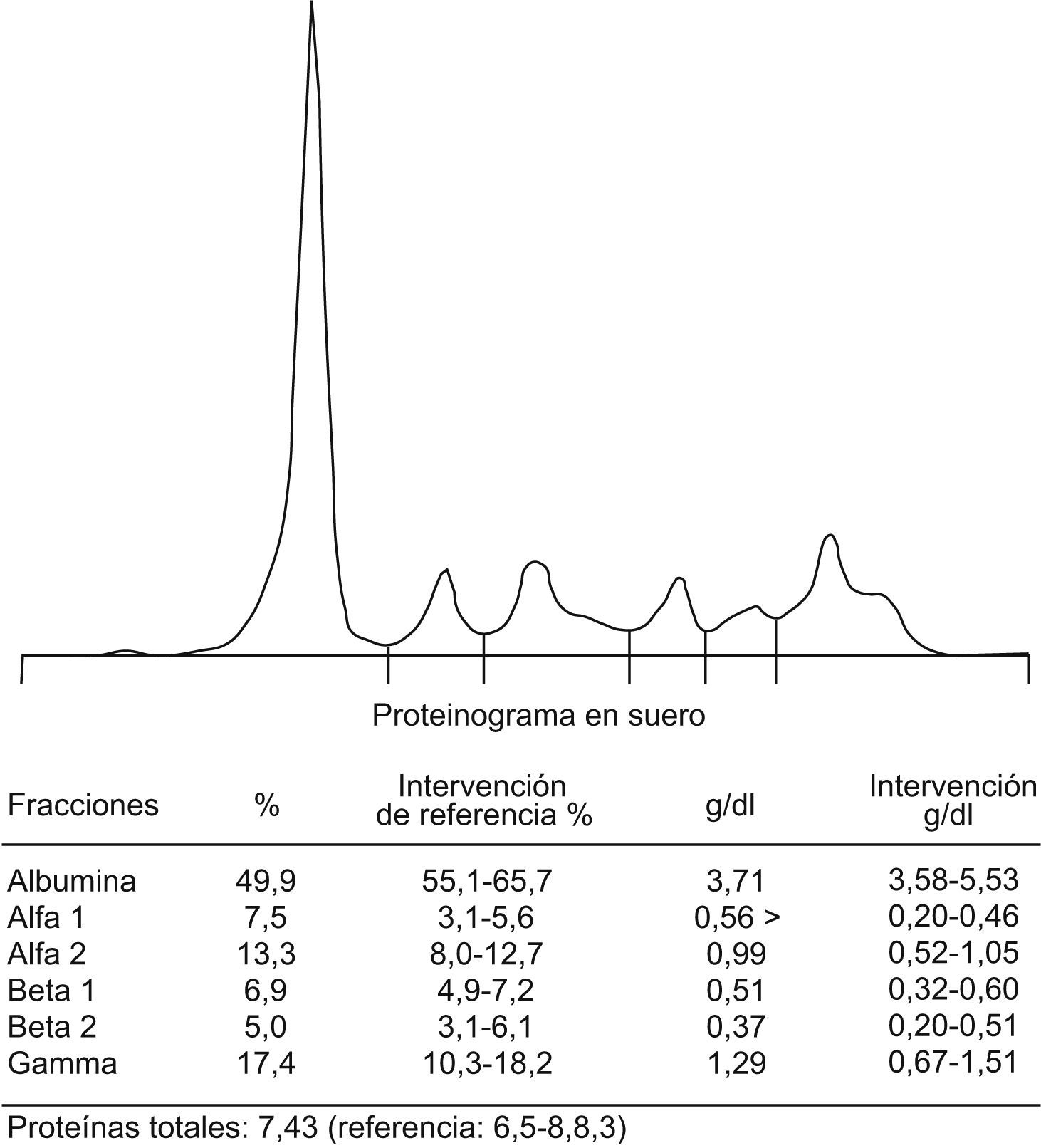
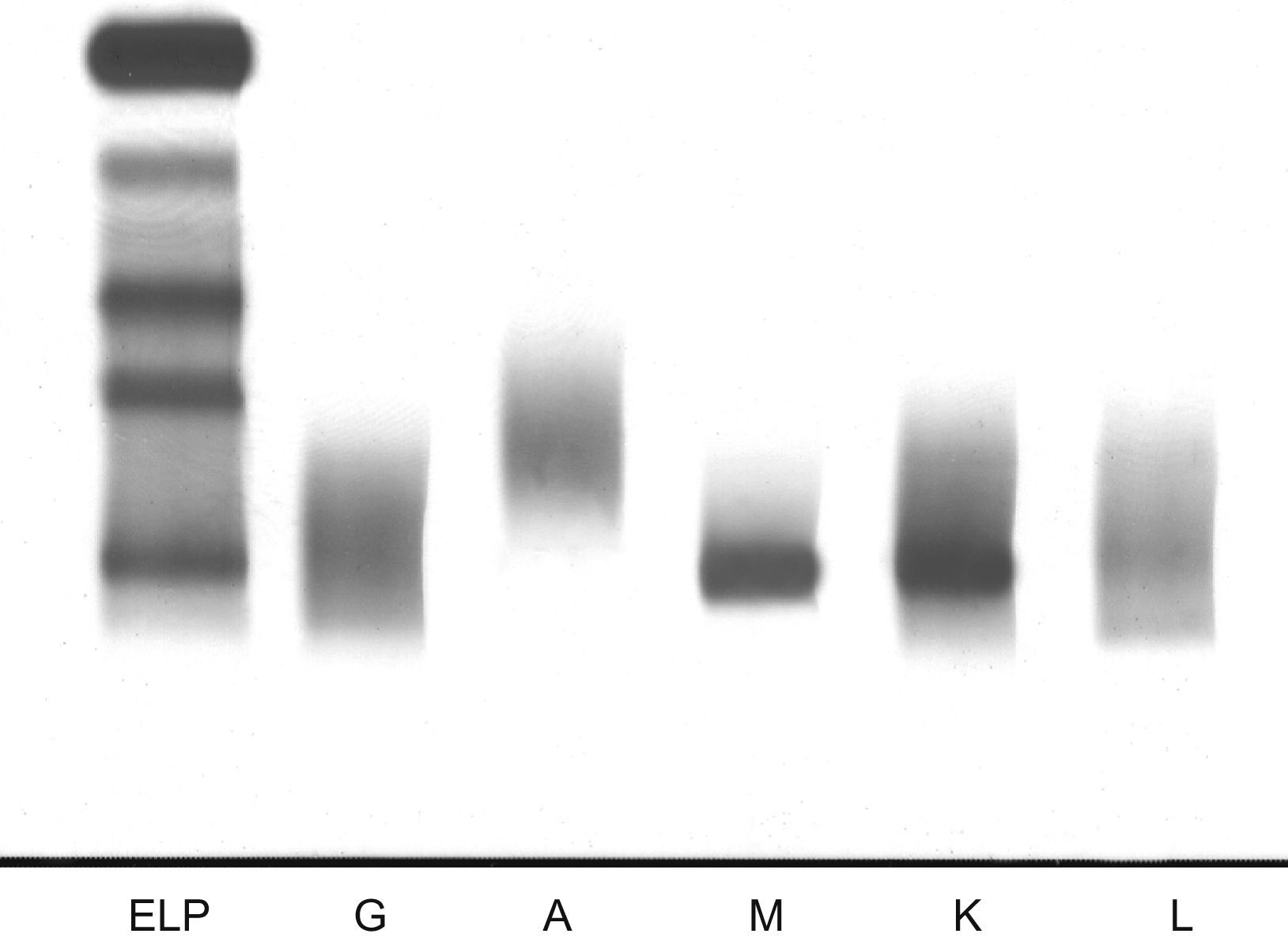
En el proteinograma realizado en las muestras de los 3 pacientes se observó la presencia de pico en la fracción gamma sin inhibición del resto de la zona gamma (fig. 3), que en la inmunofijación se reveló como una inmunoglobulina IgM-κ en todos ellos (fig. 4).
En la determinación de inmunoglobulinas se obtuvo un valor de IgM de 7,64g/l en el caso A, de 2,85g/l en el B y de 7,85g/l en el C (valores de referencia: 0,34-2,40g/l). Los valores de IgG e IgA en los 3 pacientes se encontraban dentro de los rangos de referencia.
En la determinación de cadenas ligeras totales, en los casos A y B no se encontró ninguna alteración; las cadenas ligeras κ se encontraban dentro de los rangos de normalidad (valores normales: 1,7-3,7g/l), así como las cadenas ligeras λ (valores normales: 0,92-2,1g/l) y el cociente κ/λ (valores normales: 1,35-2,65). En el paciente B también se encontraban dentro de los rangos de normalidad las cadenas ligeras κ y λ, pero el cociente κ/λ estaba aumentado (3,19).
DiscusiónEn la literatura científica se han descrito numerosas interferencias, tanto por hipergammaglobulinemia monoclonal1–6 como policlonal7 en la determinación de diversas magnitudes cuando se utilizan técnicas inmunológicas, turbidimétricas o nefelométricas debido a la formación de precipitados durante la reacción. Entre estas inmunoglobulinas interferentes la IgM parece encontrarse frecuentemente8. En nuestro estudio se dio la circunstancia de que los 3 pacientes presentaban una banda monoclonal IgM-κ, con unos valores normales de proteínas totales séricas y ninguno tenía un diagnóstico previo de gammapatía.
En algunos casos, se ha sugerido que la interferencia puede deberse a las partículas de látex utilizadas en algunos ensayos7, aunque éste no parece ser nuestro caso debido a que no se ha encontrado interferencia en el resto de las técnicas que utilizan látex (ferritina, PCR y factor reumatoide).
Yamada et al4 describieron un caso de interferencia positiva simultánea en la determinación de ASLO y PCR en un paciente que presentaba una inmunoglobulina monoclonal IgM-κ. Estos autores sugieren que dicha IgM se uniría a una parte de los complejos látex-anticuerpo anti-PCR y látex-antígeno estreptolisina-O pero no llegaron a determinar qué parte del complejo estaría implicada.
En la mayoría de los inmunoanálisis comerciales para determinar anticuerpos antiestreptolisina-O se utiliza estreptolisina-O purificada a partir de cultivos de Streptococcus pyogenes, aunque ya se ha conseguido construir y expresar estreptolisina-O recombinante9. Los inmunoanálisis que emplean este tipo de purificados de estreptolisina, presentan una variación entre lotes mayor, y pueden incluir otros antígenos extracelulares solubles que también se unirán luego a las partículas de látex.
Dado que la estreptolisina del reactivo de Roche se obtiene de cultivo, creemos que la interferencia podría deberse a la unión de IgM monoclonal a una parte del complejo látex-antígeno estreptolisina-O que se encuentra en el reactivo de Roche pero no en el de Spinreact.
Hay un método alternativo, Rantz-Randall10, que utiliza hematíes de carnero, conejo o humanos tipo 0, que evitaría este problema ya que se basa en el principio de que los anticuerpos neutralizan la actividad hemolítica de la estreptolisina-O. Sin embargo, este método presenta diferentes inconvenientes derivados del empleo de hematíes frescos, y es difícilmente automatizable, lo que hace que no esté habitualmente disponible en los laboratorios clínicos.
Como conclusión queremos destacar la utilidad de comparar el resultado de la determinación inicial y del valor de la dilución automática que hace el aparato a fin de detectar discrepancias que nos hagan sospechar una interferencia. En estos casos es recomendable revisar la curva de reacción y compararla con una curva normal a fin de detectar anomalías en el desarrollo de la reacción. Sería recomendable una dilución automática de al menos 1:6, acorde con nuestros datos, aunque no podemos descartar que haya otros pacientes en los que la interferencia sea mayor y precisen diluciones superiores.
Por otra parte, hay que recordar que una vez detectada una interferencia debida a la presencia de una inmunoglobulina monoclonal se debe pensar en la posibilidad de que haya otras magnitudes afectadas cuando se utilizan métodos con fundamentos similares.





![Curva de reacción de paciente control (antiestreptolisina-O [ASLO] 575UI/ml). Curva de reacción de paciente control (antiestreptolisina-O [ASLO] 575UI/ml).](https://static.elsevier.es/multimedia/18884008/0000000100000002/v1_201305031546/S1888400808000056/v1_201305031546/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


