La metahemoglobinemia es una entidad poco frecuente, cuyo diagnóstico se basa en la aparición de niveles elevados de metahemoglobina en sangre, tanto en adultos como en niños. Es una de las causas importantes de cianosis, y en ocasiones la severidad de su presentación puede requerir el ingreso en Unidades de Cuidado Intensivo. Las causas pueden ser adquiridas o congénitas, siendo ésta última debida a mutación en el gen de la hemoglobina reductasa dependiente de NADPH. La forma adquirida o metahemoglobinemia tóxica se produce cuando los hematíes son expuestos a sustancias químicas oxidantes que aumentan la producción de metahemoglobina, sobrepasando los mecanismos reductores de protección que actúan normalmente.
Se presenta el caso de una mujer de 18 años, con cuadro de cianosis de aparición súbita diagnosticada de metahemoglobinemia tóxica tras utilización de crema anestésica tópica EMLA® (mezcla de anestésicos locales, lidocaína y prilocaína).
Methaemoglobinaemia is a very uncommon disorder, with its diagnosis being based on the appearance of high levels of methaemoglobin in the blood, both in adults and children. It is an important cause of cyanosis, and occasionally its severity of its presentation may require admission to an Intensive Care Unit. It may be acquired or hereditary; the latter being due to a mutation of the NADPH-dependent haemoglobin reductase gene. The acquired form or toxic methaemoglobinaemia is produced when red cells are exposed to oxidising chemicals that increase methaemoglobin production, overwhelming the regulatory mechanisms that function normally.
A case is presented of an 18 year old woman with clinical picture of the sudden appearance of cyanosis, diagnosed as toxic methaemoglobinaemia after using EMLA® topical anaesthetic cream (mixture of local anaesthetics, lidocaine and prilocaine).
La metahemoglobinemia se produce cuando el grado de oxidación del hierro contenido en el grupo hemo de la molécula de hemoglobina supera los mecanismos compensadores de los hematíes, y pasa al estado férrico, siendo funcionalmente incapaz de transportar oxígeno y dióxido de carbono1. La oxidación del hierro de su estado ferroso (Fe2+) a su forma férrica (Fe3+) ocurre de manera constante en el organismo; sin embargo, esta reacción se puede revertir gracias a la acción de diversos mecanismos compensadores como el sistema enzimático directo de reducción compuesto por el citocromo b5 y la NADPH-MHb reductasa, y el sistema endógeno indirecto que también interviene en la reducción e incluye sistemas enzimáticos, ácido ascórbico y el ciclo del glutatión.
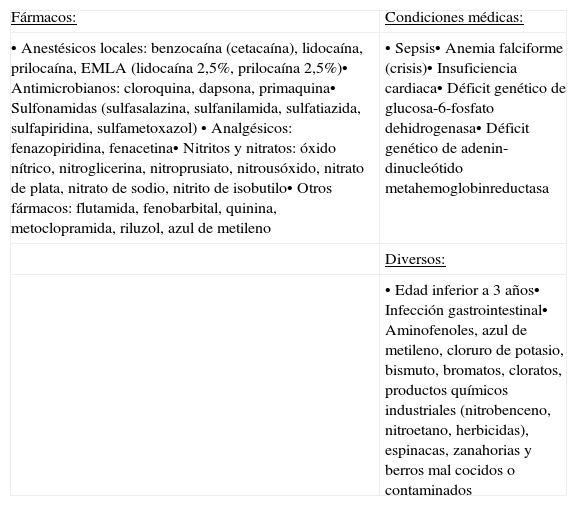
Al oxidarse el hierro de la hemoglobina, ésta se convierte en metahemoglobina (MetHb). En condiciones normales, representa menos del 1,3% de la hemoglobina total1. Cuando este valor supera el 2% es posible establecer el diagnóstico de metahemoglobinemia1–4. La oxidación inhabilita a la hemoglobina para el transporte eficaz de oxígeno, ya que disminuye su afinidad, tanto por éste como por el CO2, lo que se traduce a nivel celular en hipoxia tisular2,5. La metahemoglobinemia puede ser congénita como consecuencia de una mutación genética que produce una hemoglobina anormal (hemoglobina M) o por deficiencia de alguna de las enzimas del sistema directo de reducción (herencia autosómica recesiva), o adquirida por oxidación inducida por agentes externos6. Las principales causas de metahemoglobinemia adquirida se presentan en la tabla 1.
Factores predisponentes de metahemoglobinemia adquirida.
| Fármacos: | Condiciones médicas: |
| • Anestésicos locales: benzocaína (cetacaína), lidocaína, prilocaína, EMLA (lidocaína 2,5%, prilocaína 2,5%)• Antimicrobianos: cloroquina, dapsona, primaquina• Sulfonamidas (sulfasalazina, sulfanilamida, sulfatiazida, sulfapiridina, sulfametoxazol) • Analgésicos: fenazopiridina, fenacetina• Nitritos y nitratos: óxido nítrico, nitroglicerina, nitroprusiato, nitrousóxido, nitrato de plata, nitrato de sodio, nitrito de isobutilo• Otros fármacos: flutamida, fenobarbital, quinina, metoclopramida, riluzol, azul de metileno | • Sepsis• Anemia falciforme (crisis)• Insuficiencia cardiaca• Déficit genético de glucosa-6-fosfato dehidrogenasa• Déficit genético de adenin-dinucleótido metahemoglobinreductasa |
| Diversos: | |
| • Edad inferior a 3 años• Infección gastrointestinal• Aminofenoles, azul de metileno, cloruro de potasio, bismuto, bromatos, cloratos, productos químicos industriales (nitrobenceno, nitroetano, herbicidas), espinacas, zanahorias y berros mal cocidos o contaminados |
Las manifestaciones clínicas que ocurren al elevarse la MetHb en los eritrocitos son debidas a la hipoxia tisular1. La cianosis es el signo característico y se presenta cuando los niveles de MetHb superan el 10-15% de la hemoglobina total3. La hipoxia desencadena una reacción simpática caracterizada por ansiedad, irritabilidad y taquicardia. En una etapa avanzada se puede encontrar disnea, confusión, alteración en el estado de alerta, fallo cardiopulmonar, crisis convulsivas y coma7. La gravedad de los síntomas generalmente se correlaciona con los niveles medidos de metahemoglobina, sin embargo, esta relación se modifica en presencia de cardiopatía, neuropatía y/o anemia (tabla 2). Si el nivel de MetHb excede del 70% de la hemoglobina total, se puede presentar colapso vascular, estado de coma, e incluso muerte8,9.
Manifestaciones clínicas según concentración de metahemoglobina.
| Concentración de MetHb (g/dL) | % sobre Hb totala | Síntomasb |
| < 1,5 | < 10 | Ninguno |
| 1,5-3,0 | 10-20 | Cianosis |
| 3,0-4,5 | 20-30 | Ansiedad, cefalea, taquicardia |
| 4,5-7,5 | 30-50 | Fatiga, estado mental confuso, mareo, taquipnea e incremento de la taquicardia |
| 7,5-10,5 | 50-70 | Coma, crisis convulsivas, arritmias y acidosis |
| > 10,5 | > 70 | Muerte |
El diagnóstico de presunción de la metahemoglobinemia es clínico y se debe sospechar cuando la cianosis aparece de forma súbita y la saturación de oxígeno no mejora a pesar de administrar oxígeno al 100%. El color de la sangre de estos pacientes es «achocolatada» y se mantiene tras la exposición al oxígeno8,9. La confirmación diagnóstica se realiza mediante estudios de laboratorio, siendo el método recomendado la medición en sangre arterial de las distintas fracciones de hemoglobina mediante cooximetría2,10.
En cuanto al tratamiento, deben distinguirse dos fases, la primera de soporte y estabilización y una segunda fase de identificación de la causa y desintoxicación1,2,14. Se debe evitar el contacto con la fuente de la intoxicación lo antes posible6. Si se trata de un fármaco por vía oral, para disminuir la absorción del medicamento ingerido se puede utilizar carbón activado, en dosis de 1 g/kg/dosis vía oral o por sonda nasogástrica y repitiendo la dosis cada seis horas, según la evolución15. La mayor parte de los casos leves y moderados requieren solamente descontaminación y apoyo con oxígeno al 100%.
El azul de metileno es el antídoto específico, y se emplea a dosis de 1-2mg/kg/dosis en una dilución al 1 o 2% por vía intravenosa en infusión durante 5 minutos, y sus efectos deben observarse dentro de la primera hora de administración1,11,13. Cuando la MetHb supera el 50% de la hemoglobina total, se recomienda usar 2-4mg/kg/dosis, hasta un máximo de 7mg/kg/dosis8,9. Aunque no existen estudios clínicos controlados que sustenten la eficacia del azul de metileno, la experiencia clínica sugiere que este medicamento incrementa la tasa de reducción de hemoglobina hasta seis veces13. Su uso se recomienda cuando el paciente presenta síntomas y niveles de MetHb por encima del 20%, o cuando el paciente presenta compromiso en el transporte de oxígeno por alguna otra patología concomitante como la presencia de anemia, neumonía e insuficiencia cardiaca8,9. La mejoría clínica generalmente se presenta en los primeros 30 minutos, y una segunda dosis de azul de metileno se utiliza sólo en los casos graves, en los que todavía se encuentra evidencia de formación de MetHb. El azul de metileno es poco efectivo en pacientes con deficiencia de glucosa-6-fosfato deshidrogenasa, ya que su acción depende de la nicotinamida-adenina dinucleótido fosfato (NADP+). Su eficacia es mayor en eritrocitos intactos y disminuye en presencia de hemólisis13.
Otros antioxidantes como el ácido ascórbico (vitamina C), N-acetilcisteína y tocoferol (vitamina E) también se han utilizado, aunque son menos útiles en casos agudos ya que son de acción más lenta8,9,13.
En el manejo de pacientes con hemólisis grave o deficiencia de glucosa-6-fosfato deshidrogenasa, se recomienda realizar una transfusión por recambio, con las complicaciones que ésta conlleva; en estos casos, no debe emplearse azul de metileno ya que resulta ineficaz13. En casos extremos puede plantearse como opción terapéutica el uso de oxigenoterapia en cámara hiperbárica, con objeto de incrementar la cantidad de oxígeno disponible.
Caso clínicoMujer de 18 años, sin antecedentes personales patológicos conocidos de interés que, al ingreso en el servicio de Urgencias, presenta sensación de mareo con cefalea pulsátil, cianosis central y periférica de aparición súbita inicialmente en cara y dos horas posteriores también en palmas y plantas, después de utilizar hacía dos horas una crema anestésica (lidocaína 2,5%, prilocaína 2,5%) en el 51% de la superficie corporal (piernas, brazos, axilas) 30 minutos antes de una sesión de fotodepilación.
En el examen clínico destaca la existencia de cianosis central y periférica, taquicardia sinusal (112 lpm) y aumento de la frecuencia respiratoria (32rpm), siendo el resto de la exploración normal.
En las pruebas complementarias del estudio cardio-pulmonar (placa de tórax y electrocardiograma) no se evidenciaron hallazgos patológicos.
En los análisis de urgencias se obtienen los siguientes resultados (entre paréntesis se muestra el intervalo de referencia):
- •
Hemograma: hemoglobina 13,4g/dL (11,5-15,3); hematocrito 40,2% (33,7-45,4); leucocitos 13,6 x 103/μL (3,7-11,6); neutrófilos 83,9% (41-74); linfocitos 8,7% (18-48); monocitos 5,5% (3,5-11,6).
- •
Gasometría arterial: pH 7,45 (7,35-7,45); pO2 68,1 mmHg (80,0-95,0); StO2 94,9% (95,0-98,0); concentración total O2 14,6 Vol/dL (16,0-21,5); pCO2 33,7 mmHg (35,0-45,0); fracción de MetHb 18% (0,4-1,5); bicarbonato 22,7 mmol/L (21,0-26,0); exceso de bases −0,6 mmol/L (−2,0-3,0).
- •
Bioquímica: glucosa 79,0mg/dL (70-110); Na 137,5 mmol/L (135-145); K 4,3 mmol/L (3,5-5,1); calcio total 9,68mg/dL (8,5-10,1); creatinina 94,2μmol/L (44-106); urea 14 mmol/L (6,4-17); ALT 0,6μkat/L (0,5-1,1); AST 0,3μkat/L (0,3-0,6); LDH 182 UI/L (100-190).
Tras la administración de oxigenoterapia durante una hora empeoran los síntomas de la paciente, manteniéndose la cianosis y los síntomas adrenérgicos. En la exploración física se evidenció un aumento de la taquicardia y de la taquipnea.
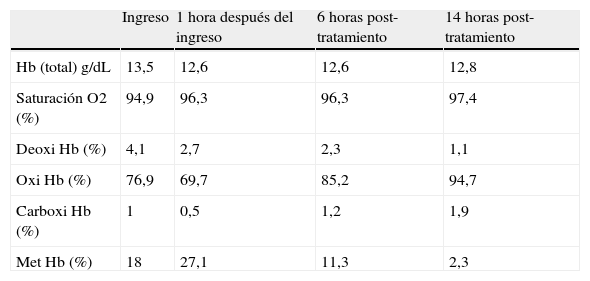
En una nueva gasometría arterial una hora después de instaurar la oxigenoterapia se observa un aumento de la presión parcial de oxígeno (76,1 mmHg), con normalización de la presión parcial de anhídrido carbónico (36,0 mmHg), manteniéndose la saturación arterial de oxígeno dentro de la normalidad (96,3%). En el resultado de la cooximetría destaca un resultado de la fracción de MetHb muy elevado de 27,1% (hemoglobina 12,6mg/dL). Siguiendo los procedimientos del laboratorio para comunicación de avisos críticos, el facultativo del laboratorio contactó con el facultativo responsable de la paciente para la comunicación del resultado de la MetHb contribuyéndose además a interpretar el mismo en el contexto clínico de la paciente. En la tabla 3 se muestran los resultados de magnitudes de cooximetría y su evolución en el tiempo.
Resultados de magnitudes de cooximetría y su evolución en el tiempo.
| Ingreso | 1 hora después del ingreso | 6 horas post-tratamiento | 14 horas post-tratamiento | |
| Hb (total) g/dL | 13,5 | 12,6 | 12,6 | 12,8 |
| Saturación O2 (%) | 94,9 | 96,3 | 96,3 | 97,4 |
| Deoxi Hb (%) | 4,1 | 2,7 | 2,3 | 1,1 |
| Oxi Hb (%) | 76,9 | 69,7 | 85,2 | 94,7 |
| Carboxi Hb (%) | 1 | 0,5 | 1,2 | 1,9 |
| Met Hb (%) | 18 | 27,1 | 11,3 | 2,3 |
Ante estos resultados, se replantea el diagnóstico diferencial de la cianosis siendo razonable descartar aquellas causas que provocan una baja presión arterial del oxígeno, así como variantes de hemoglobina con baja afinidad por oxígeno. Quedaría pues como causa de la misma la existencia de una metahemoglobinemia probablemente adquirida secundaria a tóxicos.
Tras una anamnesis más exhaustiva, la paciente menciona la utilización, una hora antes de una sesión de fotodepilación, de una crema anestésica tópica (EMLA®), a dosis de 30g, aplicada con film transparente en forma de vendaje oclusivo, para aumentar su absorción, en el 51% de la superficie corporal (piernas, brazos, axilas e ingles). Esta crema contiene dos anestésicos locales: lidocaína y prilocaína. Su uso es ampliamente reconocido como anestésico local en la piel y mucosas a una dosis máxima recomendada de 10g, estando descrita como reacción adversa rara (menos del 0,1%) de casos la metahemoglobinemia en niños pero no en adultos4,16,17.
Por lo tanto se llega al diagnóstico definitivo de metahemoglobinemia secundaria a la administración de EMLA®. La paciente respondió favorablemente al tratamiento con oxígeno (8 lpm) y un agente antioxidante - ácido ascórbico (1g/8 horas iv.), manteniéndose en observación durante 18 horas trascurridas las cuales se le da el alta hospitalaria tras evolución clínica favorable.
DiscusiónLa metahemoglobinemia es un cuadro agudo, con frecuencia con un único signo clínico (la cianosis) que desaparece espontáneamente en varios minutos, o la mayoría de las veces en pocas horas. Puede aparecer como consecuencia de un contacto con sustancias oxidantes o por situaciones diversas como causas alimentarias, genéticas o incluso idiopáticas, por lo que es necesaria una adecuada sospecha clínica para realizar un diagnóstico y tratamiento correctos. El principal signo clínico es la cianosis rápida y progresiva, a veces con distribución en placas, más visible en las mucosas, la cara y las extremidades, que en la infancia se acentúa con el llanto. En ocasiones presenta repercusión hemodinámica con taquicardia y taquipnea. Los pacientes más graves pueden presentar acidosis metabólica, arritmias cardíacas y sintomatología neurológica como disminución del nivel de conciencia, coma y convulsiones generalizadas3,4,17–20.
Un dato clave para la sospecha clínica es la discrepancia entre la saturación de oxígeno medida por pulsioximetría y la presión parcial de oxígeno medidas en la gasometría arterial3,4,17,21,22. Los pacientes generalmente aparentan estar menos graves de lo que se esperaría en función del grado de cianosis que presentan13, y la saturación de oxígeno medida por pulsioximetría no mejora con oxígeno a 100%.
La crema anestésica EMLA® al 5%, mezcla de lidocaína (25mg/ml) y prilocaína (25mg/ml), es un anestésico tópico usado para disminuir el dolor de procedimientos cutáneos6,10,12. EMLA® se emplea sobre la piel, en la mucosa genital y en las úlceras de piernas para causar la insensibilidad o pérdida de la sensibilidad temporales en el área sobre la que se aplica. Los efectos adversos son mínimos y se limitan a reacciones locales de la piel como palidez y enrojecimiento cutáneo, si bien existe un potencial riesgo de metahemoglobinemia derivado de la capacidad de los metabolitos de la prilocaína de oxidar la hemoglobina. La metahemoglobinemia secundaria a la administración de EMLA® no está descrita como reacción adversa en adultos en la ficha técnica de la Agencia Española del Medicamento, aunque sí se menciona en niños como efecto secundario raro16. La dosis recomendada en niños y adultos es de 1-2g aplicados bajo un apósito oclusivo aproximadamente una hora antes del procedimiento. El efecto analgésico del EMLA® varía con la duración de la aplicación y con el intervalo entre la aplicación de la crema y el inicio del procedimiento20. Como particularidad del caso clínico destaca la alta dosis de crema utilizada y la superficie corporal empleada (51% de la superficie corporal) con vendaje oclusivo para aumentar la eficacia del producto lo que pudo provocar una mayor absorción de anestésico.
En los analizadores de gases del laboratorio de urgencias se dispone de cooxímetro y en todas las gasometrías realizadas se realiza una cooximetría con objeto de informar la saturación de oxígeno medida y el resultado de la cooximetría si se solicita. En este caso, el estudio de cooximetría no fue solicitado por el facultativo de urgencias, pero ante la existencia de un resultado tan patológico desde el laboratorio se decide informar y avisar como resultado crítico. Ello fue decisivo para el correcto diagnóstico y tratamiento de la paciente. El posterior seguimiento de la paciente se realizó con la monitorización de los resultados de la fracción de MetHb.
En general, el pronóstico de esta patología es bueno, aunque dependerá del nivel de MetHb en el momento del diagnóstico y del estado basal de salud del paciente así como de las posibles patologías concomitantes que presente. El pronóstico también puede modificarse cuando el paciente no responde a la administración de azul de metileno.
En conclusión, ante la presencia en un paciente adulto de un cuadro de cianosis de aparición brusca que no mejora tras oxigenoterapia inicial, se debe sospechar la existencia de una metahemoglobinemia de posible origen tóxico. Para confirmarlo, debe solicitarse al laboratorio un análisis con gasometría arterial y cooximetría. Por otra parte, el laboratorio debe considerar un resultado elevado de la fracción de MetHb como un resultado crítico de forma que pueda contribuir a un rápido diagnóstico y evolución del paciente.
Este trabajo corresponde a una comunicación científica presentada y premiada en el III Congreso Nacional del Laboratorio Clínico celebrado en Valencia del 14 al 16 de octubre de 2009.