Los intervalos de referencia biológicos permiten comparar el valor observado en una medición realizada en una muestra biológica con unos valores de referencia obtenidos en una población de individuos bien definida con el fin de que sea posible la valoración clínica de los pacientes1. Los intervalos de referencia pueden estar asociados a estados de salud o bien a otros estados fisiológicos o patológicos.
La norma ISO 15189 en la edición del año 20132 indica en el apartado 5.5.2. Intervalos de referencia biológicos o valores de decisión clínica que «el laboratorio debe definir los intervalos de referencia biológicos…, debe documentar el fundamento de los intervalos de referencia…y debe comunicar esta información a los usuarios. Cuando un intervalo de referencia biológico…ya no sea pertinente para la población objeto del servicio, se deben hacer los cambios apropiados y comunicárselos a los usuarios». Además, en esta edición de la norma se indica que «cuando el laboratorio cambia un procedimiento analítico o un procedimiento preanalítico, el laboratorio debe revisar los intervalos de referencia…, según sea aplicable». Disponer de intervalos de referencia adecuados es, por tanto, un requisito indispensable para los laboratorios clínicos.
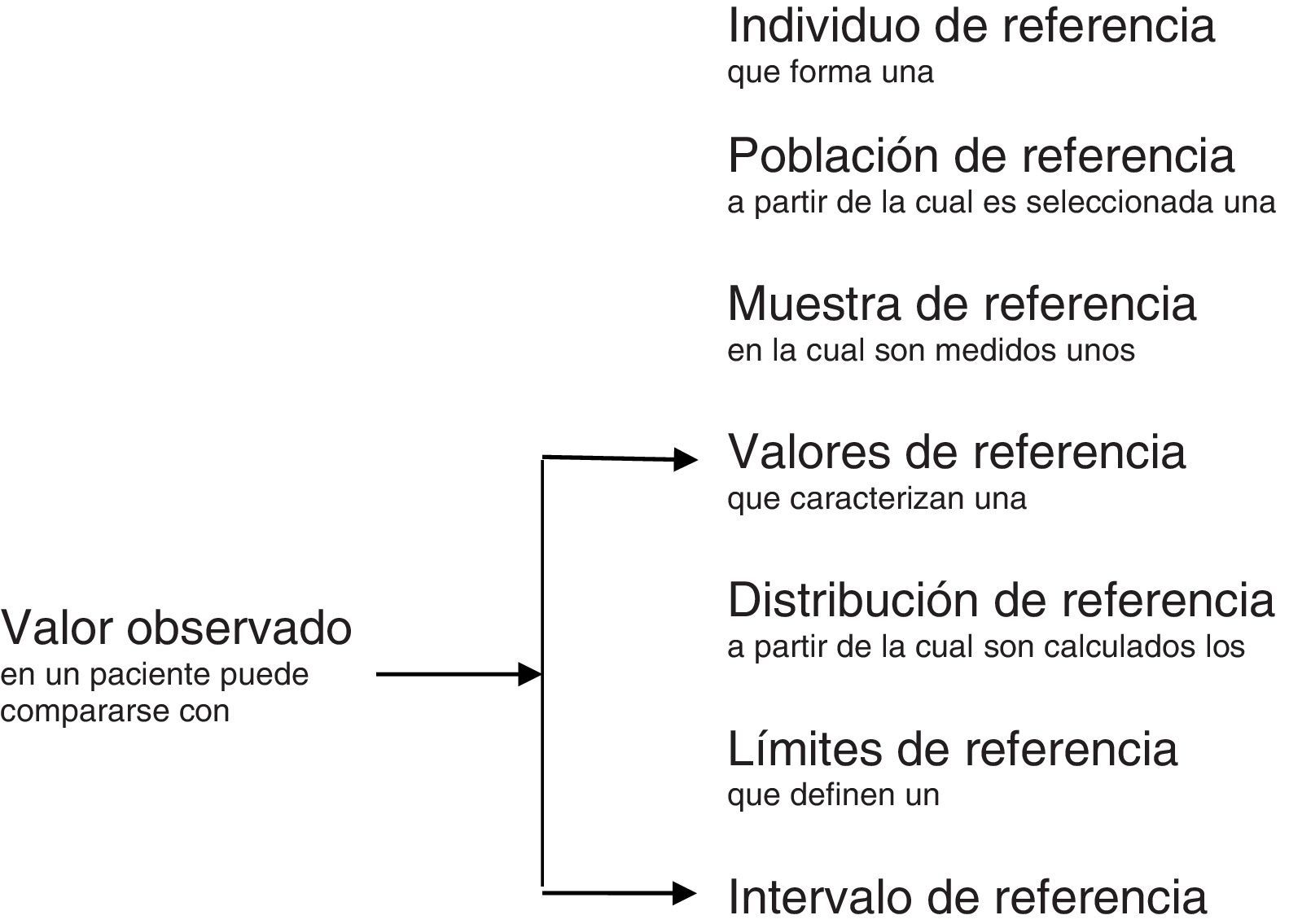
Un valor de referencia es un valor medido de una magnitud particular obtenido con fines comparativos en un individuo de referencia3. El individuo de referencia debe cumplir unos requisitos preestablecidos. Estos requisitos dependen de la finalidad de los valores de referencia e incluyen los criterios de inclusión, de exclusión y los de partición, en su caso. Cuando los valores de referencia son de individuos presuntamente sanos, los criterios de exclusión sirven para que en la muestra de individuos de referencia no haya variación de origen iatrogénico o patológico. Los criterios de partición permiten la selección de individuos de referencia con la finalidad de formar grupos homogéneos. En cualquier caso, la descripción de los individuos de referencia ha de ser lo más completa posible. En la figura 1 se muestra la relación entre algunos de los términos que se han mencionado.
El proceso para establecer un intervalo de referencia comprende, entre otros, la selección de los individuos de referencia, la definición del procedimiento de medida, la recopilación de los valores medidos de la magnitud en cuestión, el análisis estadístico de los resultados y la adecuada presentación de los valores de referencia en los informes del laboratorio clínico.
Existen diversas variables que pueden influir en un intervalo de referencia, 2 son de particular importancia: el procedimiento de medida empleado y la población de referencia a partir de la cual los individuos de la muestra de referencia son seleccionados.
Los límites de referencia biológicos son los valores extremos del intervalo de referencia, que comprende habitualmente el 95% central de los valores de referencia. Para la estimación de los intervalos de referencia biológicos se usan distintos métodos estadísticos dependiendo de si los valores obtenidos siguen la distribución de Laplace-Gauss, método paramétrico, o no la siguen, método no paramétrico. La estimación paramétrica requiere que el número mínimo de individuos seleccionados sea de 40 para cada grupo homogéneo (o para cada partición, en caso de que las haya). Si se usa el método no paramétrico, no es necesario asumir ninguna distribución subyacente de los valores obtenidos y, para tener estimaciones fiables de los límites de referencia (con intervalos de confianza del 90%) es aconsejable un tamaño de muestra mínimo de 120 individuos para cada grupo homogéneo3. Se recomienda el uso del método no paramétrico para establecer un intervalo de referencia.
Existe una guía del Clinical and Laboratory Standards Institute (CLSI)3 que contiene instrucciones detalladas para definir y establecer los intervalos de referencia biológicos. No obstante, son muy pocos los laboratorios clínicos que en la práctica diaria tienen la capacidad suficiente para establecer sus propios intervalos de referencia, debido a la dificultad de obtener individuos de referencia suficientes y al elevado coste de las mediciones. Para obviar este problema, el CLSI propone como alternativa la transferencia y revisión de intervalos de referencia previamente establecidos.
La transferencia de un intervalo de referencia es el proceso por el cual se adapta un intervalo de referencia previamente establecido a otro procedimiento de medida o a una población diferente. No es necesario recoger muestras de individuos de referencia y, simplemente, se pueden usar muestras de individuos de los que no se dispone de información sobre su estado de salud.
La revisión de un intervalo de referencia es el proceso por el cual se confirma que un intervalo de referencia puede ser transferido, con una razonable confianza, usando un número relativamente pequeño de individuos de referencia.
Se recomienda que el laboratorio disponga de un procedimiento normalizado para la transferencia y revisión de valores de referencia.
Objeto y campo de aplicaciónEl objeto de este documento es la descripción de procedimientos recomendados para transferir un intervalo de referencia y proceder a su revisión.
El campo de aplicación abarca los sistemas y procedimientos de medida utilizados en el laboratorio clínico que proporcionan valores escalares (cuantitativos). No se incluyen en el ámbito de este documento los exámenes de laboratorio mediante los cuales se asignan valores a propiedades en escalas nominales u ordinales (propiedades cualitativas o semicuantitativas), tampoco se incluyen los valores discriminantes ni los intervalos terapéuticos, ni es aplicable a los intervalos de referencia individuales.
DefinicionesEn este documento también son aplicables los términos y definiciones recogidos en el documento «Vocabulario de términos de metrología para el laboratorio clínico»4 publicado por la Comisión de Metrología y Sistemas Analíticos.
Individuo de referenciaPersona seleccionada para el análisis sobre la base de criterios bien definidos.
Nota: por lo general es importante definir el estado de salud de la persona3.
Intervalo de referenciaIntervalo entre, e incluyendo, 2límites de referencia.
Nota: se designa como el intervalo de valores entre el límite inferior de referencia y el límite superior de referencia (por ejemplo, para el calcio, el intervalo de referencia es de 2,27 a 2,57mmol/l; en algunos casos, solo es importante un límite de referencia, generalmente el límite superior, «x», y el intervalo de referencia correspondiente es de 0 a x)3.
Límites de referenciaValor derivado de la distribución de referencia y usado con fines descriptivos3.
Muestra de referenciaNúmero suficiente de personas seleccionadas para representar a la población de referencia3.
Población de referenciaGrupo que consiste en todos los individuos de referencia.
Nota: la población de referencia, por lo general, tiene un número desconocido de miembros y, por lo tanto, es una entidad hipotética; la población de referencia puede consistir en un solo miembro (por ejemplo, una persona puede servir como referencia para sí mismo o para otra persona)3.
Revisión de un intervalo de referenciaProceso que asegura, con una confianza razonable, utilizando un número relativamente pequeño de individuos de referencia (por ejemplo, n=20), que un intervalo de referencia establecido en otro lugar, o transferido de otro estudio, se puede utilizar de forma local3.
Transferencia de un intervalo de referenciaProceso por el cual se adapta un intervalo de referencia previamente establecido a un nuevo procedimiento de medida o a una nueva ubicación3.
Valor aberranteElemento de un conjunto de valores que es incoherente con otros elementos de dicho conjunto.
Valor de referenciaValor (resultado de una prueba) obtenido por la observación o medición de un tipo particular de magnitud en un individuo de referencia.
Nota: los valores de referencia se obtienen a partir de una muestra de referencia3.
ProcedimientoLos procedimientos que se describen a continuación están parcialmente basados en la guía publicada por el CLSI3. La transferencia de intervalos de referencia excede la estricta comparación de los procedimientos de medida (compatibilidad de resultados) e incluye también la comparación de las poblaciones de referencia.
Transferencia en un cambio del procedimiento de medidaEs el caso de la sustitución en el laboratorio de un procedimiento de medida o de un sistema de medida por otro cuando el laboratorio clínico desea mantener los mismos valores de referencia. Es aplicable también cuando en una misma institución se están usando procedimientos o sistemas de medida distintos (laboratorio de urgencias y laboratorio de actividad programada…) para medir la misma magnitud, y se precisa tener un único intervalo de referencia. En estos casos, se desea transferir los intervalos de referencia propios de un procedimiento de medida a otro distinto, pero que se aplica a una misma población.
Para hacer la transferencia es necesario realizar un análisis de la compatibilidad metrológica de los valores obtenidos con los 2procedimientos de medida, es decir, debe estudiarse si existen diferencias significativas entre los resultados obtenidos con los 2procedimientos de medida. Para ello, puede utilizarse el protocolo recomendado por la Comisión de Metrología y Sistemas Analíticos5.
El análisis de los resultados del estudio de compatibilidad puede mostrar una de las siguientes situaciones:
- a)
La detección de diferencias significativas de tipo constante y de tamaño no despreciable en comparación con el intervalo de referencia. En este caso, los resultados obtenidos no son compatibles y es aconsejable no transferir los valores de referencia. Con frecuencia estas situaciones son ocasionadas por diferencias en la especificidad analítica de los procedimientos y no se pueden corregir con un factor.
- b)
La detección de diferencias significativas de tipo proporcional entre los 2procedimientos. Los resultados obtenidos no son compatibles, pero se puede realizar la transferencia si se aplica un factor de corrección. Para hacer esta corrección, se debe cumplir que los 2procedimientos de medida tengan imprecisión y especificidad analítica similares.
- c)
Si no se detectan diferencias significativas entre los 2procedimientos y si ambos tienen imprecisión y especificidad analítica similares, puede realizarse la transferencia del intervalo de referencia.
Siempre que se haya realizado una transferencia de un intervalo de referencia, es recomendable hacer una revisión con una pequeña muestra de individuos de referencia usando el procedimiento descrito en el apartado «Revisión de un intervalo de referencia transferido».
Transferencia en un cambio de la población de referenciaEste procedimiento se aplica cuando un laboratorio quiere transferir los valores de referencia obtenidos en otro laboratorio o producidos por la industria de diagnóstico in vitro con un procedimiento de medida cuyos resultados son compatibles con los obtenidos mediante el procedimiento de medida que utiliza el laboratorio (ver apartado anterior), pero que han sido estimados a partir de una población distinta. En este caso, para evaluar la transferencia se estudiará si todos los elementos esenciales del estudio original son consistentes con la población actual y, entre ellos, se valorará especialmente que:
- -
Los criterios geográficos y demográficos de la población original sean similares a los de la población actual.
- -
Las variables preanalíticas estén adecuadamente descritas y sean similares a las del procedimiento actual.
- -
El método estadístico usado para determinar el intervalo de referencia sea adecuado.
Si se considera que se cumplen las condiciones anteriores y que la población es la misma, se pueden asumir directamente los valores de referencia. En caso de que se sospeche que la población es distinta o si no se conocen las condiciones preanalíticas o el método estadístico usado, es recomendable hacer una revisión del intervalo de referencia usando el protocolo descrito en el apartado «Revisión de un intervalo de referencia transferido».
Revisión de un intervalo de referencia transferidoEl estudio que se describe en este apartado se aplica cuando los laboratorios que transfieren intervalos de referencia deben revisarlos.
Para revisar si unos valores de referencia transferidos son adecuados, se seleccionan 20 individuos de referencia de la población de referencia del laboratorio y se comparan los resultados obtenidos con los valores de referencia originales. La selección de estos individuos y la obtención de los resultados de referencia se hace de acuerdo con las guías para la obtención de valores de referencia3. Estos 20 individuos de referencia deben representar a la población de referencia del laboratorio al que se transfieren los valores y han de cumplir los criterios de inclusión, exclusión y partición establecidos. En el caso de que haya criterios de partición, se seleccionan 20 individuos para cada grupo.
A continuación, se procede al análisis siguiendo las especificaciones del procedimiento de medida. Una vez obtenidos los resultados, se analiza la existencia de posibles valores aberrantes usando el método de Dixon6 o el de Tukey7. Los resultados aberrantes identificados se eliminan y se obtienen nuevos valores a partir de nuevos individuos de referencia hasta que se tengan 20 valores sin la presencia de resultados aberrantes.
Una vez obtenidos los resultados, se observa el número de valores que están fuera del intervalo de referencia y se siguen las instrucciones contenidas en la tabla 1. Si los resultados obtenidos indican que se debe rechazar la transferencia del intervalo de referencia, el laboratorio debe analizar los procedimientos de medida usados o considerar la posible existencia de diferencias en las características biológicas de las 2poblaciones. En esta situación, el laboratorio debe plantearse si estima sus propios intervalos de referencia siguiendo las recomendaciones del estudio, pero a escala completa (40 o 120 muestras de referencia dependiendo del método estadístico usado).
Interpretación de la revisión de un intervalo de referencia
| Muestra | Aceptar si: | Seleccionar nueva muestra de 20 individuos si: | Rechazar si: |
|---|---|---|---|
| 1.ª muestra de 20 individuos | 2 o menos resultados están fuera del intervalo original | 3 resultados están fuera del intervalo original | 4 o más resultados están fuera del intervalo original |
| 2.ª muestra de 20 individuos | 2 o menos resultados están fuera del intervalo original | 3 o más resultados están fuera del intervalo original |
Fuente: basada en CLSI3.