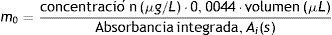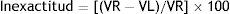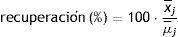El interés en la medida de cromo es debido al problema existente con las prótesis metal-metal. Estas liberan cromo a la circulación sanguínea y a los tejidos produciendo efectos perjudiciales para la salud.
El objetivo de este estudio es validar un método para la medida de cromo en suero mediante espectroscopía de absorción atómica con atomización electrotérmica y corrección de fondo por efecto Zeeman longitudinal.
Los límites de detección y cuantificación fueron de 0,074 y 0,247μg/L, respectivamente. La masa característica encontrada fue de 7,1pg/0,0044 unidades de absorbancia. La curva de calibración es lineal entre 0 y 10μg/L. La pendiente obtenida con adiciones estándar de cromo está incluida dentro del intervalo de confianza de la curva de calibración con patrones acuosos, por tanto no hay efecto matriz. Se comprobó la exactitud y precisión empleando material de referencia Seronorm Trace Elements Serum. La recuperación media obtenida fue de 99,32%.
El método propuesto resultó sensible, robusto, exacto y preciso para el análisis de cromo en suero como indicador de riesgo para la salud.
The interest of measuring chromium in serum is due to the problem with metal-on-metal bearings. They release this metal into tissues and the blood circulation producing harmful effects on health.
The aim of this study is to validate a method for chromium determination in serum samples by electrothermal atomization atomic absorption spectrometry technique with longitudinal Zeeman-effect background correction.
The features of the method were proved. The detection and quantification limits were 0.074 y 0.247μg/L, respectively. The characteristic mass was 7.1pg/0.0044 absorbance units. The calibration curve is linear between 0 and 10μg/L. The slope of the standard addition curve is included within the confidence interval of the calibration curve using aqueous standards, so that, there is not matrix effect. The precision and accuracy were tested using reference material Seronorm Trace Elements Serum. The mean recovery was 99.32%.
The proposed method proves to be sensitive, robust, accurate and precise for biomonitoring the concentration of chromium in serum samples as an indicator of health risk.
El cromo es un oligoelemento metálico que pertenece al grupo VIB de la tabla periódica, siendo su masa atómica de 51,996g/mol. El cromo químicamente existe en varios estados de oxidación desde -2 hasta +6. Los estados de oxidación más estables son el trivalente (+3) y el hexavalente (+6). El Cr3+ es la forma con mayor estabilidad química; por su parte, el Cr6+ es tóxico para el organismo.
Este metal es esencial para algunas especies, incluyendo los seres humanos. El cromo tiene un rol muy importante en el metabolismo de los hidratos de carbono y de los lípidos1. En 1993, Striffer et al. demostraron experimentalmente la acción ejercida por el cromo en la expresión o actividad del receptor de la insulina2. Sin embargo, este tema ha causado controversia debido a la existencia de otras investigaciones que demuestran lo contrario, por ejemplo, en 2011, Ali et al. evidenciaron que los suplementos de cromo no parecían mejorar la resistencia a la insulina o el metabolismo de la glucosa en pacientes con riesgo de padecer diabetes mellitus tipo 2, y por tanto, es poco probable la atenuación del riesgo de diabetes mellitus3. Además, Wang et al. sugirieron que una respuesta clínica al cromo puede ser más probable en individuos resistentes a la insulina con diabetes mellitus tipo 2 que tienen niveles de glucosa en ayunas y de hemoglobina glicosilada más elevados4.
En Abril de 2010, una alerta de seguridad de la Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido (MHRA), referente a las prótesis de cadera metal-metal, recomendó medir cromo y cobalto en el seguimiento de los pacientes con prótesis debido a que este tipo de implantes liberan metales a la circulación sanguínea, así como a los tejidos, produciendo efectos nocivos para la salud5. Además, la MHRA recomienda que todos los pacientes sintomáticos con prótesis metal-metal se deben monitorizar anualmente durante todo el periodo en el que lleven la prótesis y, en el caso de que se trate de una prótesis de tipo ASR de DePuy o de que el diámetro de la cabeza del fémur sea superior a 36 milímetros, esta monitorización debe realizarse incluso aunque los pacientes no presenten síntomas. Sin embargo, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) solo recomienda realizar seguimientos en pacientes en los que hay sospecha de reacción adversa, no siendo necesario por tanto en pacientes asintomáticos6.
El cromo que se libera de las prótesis metal-metal fundamentalmente procede del desgaste de las superficies de apoyo, aunque también puede liberarse debido a la corrosión del metal. Esta liberación depende del diseño de la prótesis, del ángulo de inclinación, del tamaño de la cabeza del fémur así como del sexo (más frecuente en mujeres), de la orientación, de la actividad del paciente y del estado de la función renal de este5. Múltiples estudios han descrito síntomas sistémicos graves en pacientes con prótesis de cadera metal-metal. Estos incluyen síntomas neurológicos como sordera, ceguera, neuropatía periférica, disestesias en las extremidades, disminución de la concentración y deterioro cognitivo6. Actualmente no existe evidencia de que la liberación de metales a la circulación sanguínea aumente el riesgo de cáncer pero existen estudios con más de 10.000 pacientes que aseguran que este tipo de implantes no deben ser considerados seguros hasta que se disponga de resultados con mayor tiempo de seguimiento7.
La liberación de cromo a la circulación también puede provocar reacciones inflamatorias locales así como la formación de masas en el tejido blando. Estas reacciones pueden causar necrosis tisular, osteólisis, dolores inexplicables, dislocación y fallo de la propia prótesis. En general, estos problemas afectan solamente a menos del 1% de los pacientes exceptuando el caso de las prótesis ASR de DePuy, que han sido retiradas debido a que presentaban un desgaste más rápido6.
En la actualidad existe un gran interés en la cuantificación de la liberación de cromo a partir de prótesis como un medio para identificar las posibles reacciones adversas al metal. La necesidad de obtener un método para la determinación de este metal se debe al reciente aumento de la demanda de solicitudes en las determinaciones de cromo en los laboratorios clínicos de rutina por parte de los cirujanos ortopédicos5. Todo ello hace que la disposición de un método simple de absorción atómica de horno de grafito para su medida sea una ventaja para este tipo de laboratorios, especialmente en el caso de no disponer de equipos de espectrometría de masas con fuente de plasma de acoplamiento inductivo (ICP-MS).
En relación al espécimen, la sangre total parece ser mejor debido a que requiere una menor manipulación, sin embargo, Walter et al. comprobaron que el suero es la muestra idónea para la detección de cromo debido a que presenta un mejor reflejo de las concentraciones reales del metal que la sangre8. Además, en general se recomienda realizar la medida del cromo en suero debido a que existen estudios que correlacionan la concentración sérica de este metal con el desgaste de la prótesis6.
En la actualidad no existe un punto de corte universal que defina las concentraciones de cromo elevadas en pacientes con prótesis metal-metal. Sin embargo, se han propuesto varias concentraciones umbral, por ejemplo, la MHRA recomienda que la concentración de cromo en sangre total sea inferior a 7μg/L debido a que concentraciones más elevadas sugieren reacciones adversas en los tejidos blandos. Otros autores establecen como punto de corte 4,97μg/L de cromo para evitar el rechazo de la prótesis. Smet et al. encontraron que las concentraciones de cromo superiores a 17μg/L eran indicativas de metalosis6.
La determinación de este metal en la mayoría de las muestras biológicas resulta difícil debido a las interferencias de matriz y a las bajas concentraciones de metal presentes en este tipo de muestras9. Por otro lado, los atomizadores electrotérmicos (horno de grafito) ofrecen la ventaja de ser extraordinariamente sensibles con pequeños volúmenes de muestra10.
El objeto del presente trabajo es describir la metodología a seguir para la validación de un método desarrollado por el propio laboratorio para la determinación de cromo sérico por espectroscopía de absorción atómica con atomización electrotérmica con corrección de fondo por efecto Zeeman aplicable a los laboratorios clínicos.
Material y métodosLa contaminación procedente del polvo y de las partículas en suspensión del aire representa una fuente de contaminación de los especímenes en el caso del análisis de cromo. Para reducir este tipo de contaminación es necesario trabajar en una zona sin corrientes de aire, aislada del paso y con unas medidas específicas de limpieza descritas en el documento «Requerimientos técnicos y ambientales de las instalaciones para el análisis de elementos traza»11. Se recomienda realizar la extracción de sangre con palomilla para que la sangre no pase directamente de la aguja al tubo especial de elementos traza.
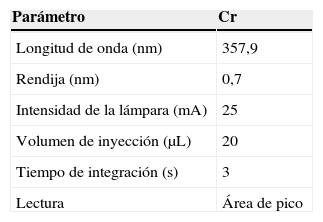
InstrumentaciónPara el análisis de cromo se utilizó un espectrómetro de absorción atómica Aanalyst 800 Perkin Elmer equipado con horno de grafito y efecto Zeeman longitudinal, así como automuestreador AS-800 y tubos de grafito con plataforma de L¿vov integrada. También se utilizó una lámpara monoelemental de cátodo hueco Perkin Elmer.
ReactivosPara la construcción de la curva de calibrado se emplearon disoluciones estándares de cromo. La calibración se realizó a partir de una disolución madre de cromo con ácido nítrico al 2% (Perkin Elmer), cuyo valor de referencia es 1g/L. Las disoluciones patrón se prepararon por diluciones sucesivas de la disolución madre con agua bidestilada libre de metales de Versylene Fresenius.
Los reactivos químicos utilizados son de alta pureza, específicos para el análisis de elementos traza y con un certificado de pureza en el que figura la concentración que contienen de otros elementos.
Los reactivos utilizados para la determinación de cromo en suero fueron los siguientes:
- •
Tritón X-100 de Sigma Aldrich.
- •
Nitrato de paladio de Perkin Elmer.
- •
Nitrato magnésico hexahidratado de Perkin Elmer.
Antes de la utilización del material de vidrio, este se limpió por inmersión en ácido nítrico al 10% (v/v) durante 24 horas. Tras dicho lavado se enjuagó el material con agua bidestilada libre de metales.
Material de referenciaLas muestras de referencia en suero (dos niveles refs. 201405 y 203105), cuyos valores de referencia son 1,5 y 4,8μg/L, respectivamente, fueron facilitadas por Seronorm (Billingstad, Noruega). Este material de referencia se encontraba liofilizado y se reconstituyó mediante la adición de 3mL de agua bidestilada.
Material biológicoPara evitar la contaminación se utilizaron tubos especiales para la medición de elementos traza (BD Vacuntainer ® Silicón, REF 368380; 6,0mL). Se dejó que coagulara la sangre al menos 30 minutos a temperatura ambiente y después se centrifugaron los tubos durante 10 minutos a 1000-1200 g12. La localización de la punción venosa se limpió con clorhexidina, un antiséptico con función bactericida y fungicida.
Modificador de matrizSe utilizó un modificador de matriz para obtener sales estables de cromo a altas temperaturas, por lo que se eliminó el efecto matriz. Asimismo, la eliminación del efecto de matriz se comprobó mediante la realización de la curva de adiciones estándar.
La preparación del modificador de matriz se realizó de la siguiente manera:
- •
500μL de paladio (10g/L de Pd (NO3)2 en HNO3 al 15%).
- •
500μL de nitrato de magnesio (10g/L de Mg(NO3)2×6H2O).
- •
100μL de tritón X-100 (Sigma Aldrich).
- •
49mL de agua bidestilada libre de metales (Versylene Fresenius).
Las disoluciones estándar de cromo se diluyeron con igual volumen de modificador de matriz. La dilución se realizó añadiendo a 200μL de modificador de matriz 200μL de disolución patrón, homogeneizando la muestra con la misma punta de pipeta y evitando la formación de burbujas. Las concentraciones de la curva de calibración fueron de 2, 4, 6,8 y 10μg/L. En el caso de muestras con concentraciones de cromo superiores a 10μg/L, estas deben ser diluidas empleando modificador de matriz. Es importante destacar que se utilizaron estándares de estas concentraciones debido a que existen estudios que sugieren que las concentraciones de cromo medias en pacientes con prótesis metal-metal que no presentan efectos perjudiciales para la salud, se encuentran entre 1 y 2μg/L5. Además, la MHRA establece como punto de corte para pacientes con prótesis de cadera metal-metal una concentración de cromo de 7μg/L, ya que por encima de este umbral de concentración se han encontrado reacciones adversas en tejidos blandos en este tipo de pacientes6.
La disolución blanco se preparó a partir de agua bidestilada y modificador de matriz en proporción 1:1 (v/v).
Análisis por espectroscopía de absorción atómica con atomización electrotérmicaLas condiciones instrumentales empleadas en el análisis de cromo se esquematizan en la tabla 1.
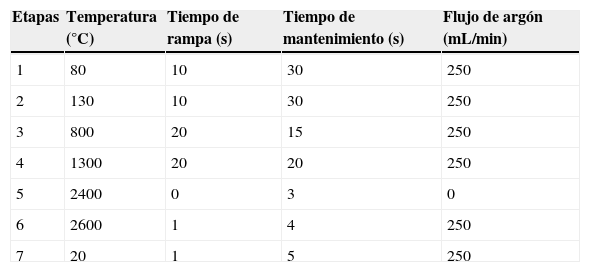
Con el fin de conseguir la mayor sensibilidad analítica posible, se utilizó un programa de temperaturas (tabla 2), que comienza por dos etapas de secado para evaporar el agua de la muestra. Posteriormente y para eliminar la materia orgánica se procedió a una etapa de pirólisis a 800°C, aumentando posteriormente a 1300°C, con el fin de eliminar totalmente el efecto matriz. Por último, la lectura se realizó en ausencia de gas a 2400°C, por ser la temperatura de atomización en la que se alcanzó la mayor sensibilidad analítica.
Validación del método analíticoLos parámetros característicos del método analítico se determinaron por medidas de blancos y disoluciones estándar a diferentes concentraciones. Para validar este método se determinaron los siguientes parámetros: límite de detección y cuantificación, rango de linealidad, masa característica, especificidad y exactitud, recuperación y estudio de precisión13.
Para la determinación del límite de detección se analizaron 30 blancos acuosos y se tomó como valor del mismo el triple de la relación entre la desviación típica de las absorbancias de los blancos y la pendiente de la calibración acuosa. El límite de cuantificación se calculó como diez veces la relación antes mencionada.
Con objeto de comprobar la linealidad del procedimiento, se realizó una curva de calibración con patrones acuosos de 5 puntos, con concentraciones desde 2 hasta 10μg/L diluidos a 1:2 con el modificador de matriz.
La masa característica se calculó utilizando la absorbancia integrada corregida por el blanco de un patrón de concentración conocida (en μg/L) sabiendo el volumen inyectado en el horno (en μL), mediante la fórmula:
Para verificar la ausencia de interferencias provocadas por la matriz se empleó el método de adiciones estándar sobre varias mezclas de muestras reales. En este caso se realizó una curva de calibración por el método de las adiciones estándar, adicionando a un pool de sueros cantidades de cromo necesarias para alcanzar una concentración final de aproximadamente 2, 4, 6 y 8μg/L.
Para determinar la exactitud del método se determinó la veracidad (expresada en términos de inexactitud), el estudio de recuperación y la precisión.
La veracidad se expresó en términos de sesgo o inexactitud (bias) y se calculó hallando la diferencia entre la media aritmética de las concentraciones halladas x¯j y el valor de referencia aceptado μ¯j14.
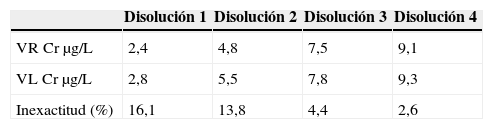
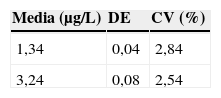
Para evaluar la inexactitud del método se analizaron 4 disoluciones de concentración 2,4; 4,8; 7,5 y 9,1μg/L de cromo durante 10 días diferentes realizando todos los días una calibración diferente. Dichas disoluciones fueron preparadas a partir de material certificado: Seronorm Trace Elements Serum y material de referencia de Perkin Elmer, ambos citados en los apartados 2.2 y 2.3. Se aplicó la fórmula:
Donde VR y VL son el valor de referencia y el valor de laboratorio, respectivamente.
Para el estudio de recuperación se añadió a una muestra de concentración conocida, diferentes cantidades de estándar y se halló la diferencia entre la muestra analizada sin la adición de estándar y las muestras a las que se añadió estándar.
Para estimar el sesgo expresado en términos de recuperación se calculó la media teórica μ¯j que tendría que dar dependiendo de la cantidad de estándar añadida y se aplicó la fórmula siguiente:
Las concentraciones empleadas para el cálculo de la recuperación fueron de 2, 4, 6 y 8μg/L.
La precisión puede considerarse a tres niveles: repetibilidad, precisión intermedia y reproducibilidad.
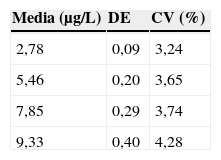
La repetibilidad se obtuvo analizando dos pools de suero 20 veces, mientras que la precisión intermedia se halló analizando durante 10 días 4 disoluciones de concentración 2,78; 5,46; 7,85 y 9,33μg/L de cromo realizando todos los días una calibración diferente. Dichas disoluciones fueron preparadas a partir de material certificado: Seronorm Trace Elements Serum y material de referencia de Perkin Elmer, ambos citados en los apartados 2.2 y 2.3.
ResultadosLos límites de detección y cuantificación fueron de 0,074μg/L y 0,247μg/L, respectivamente.
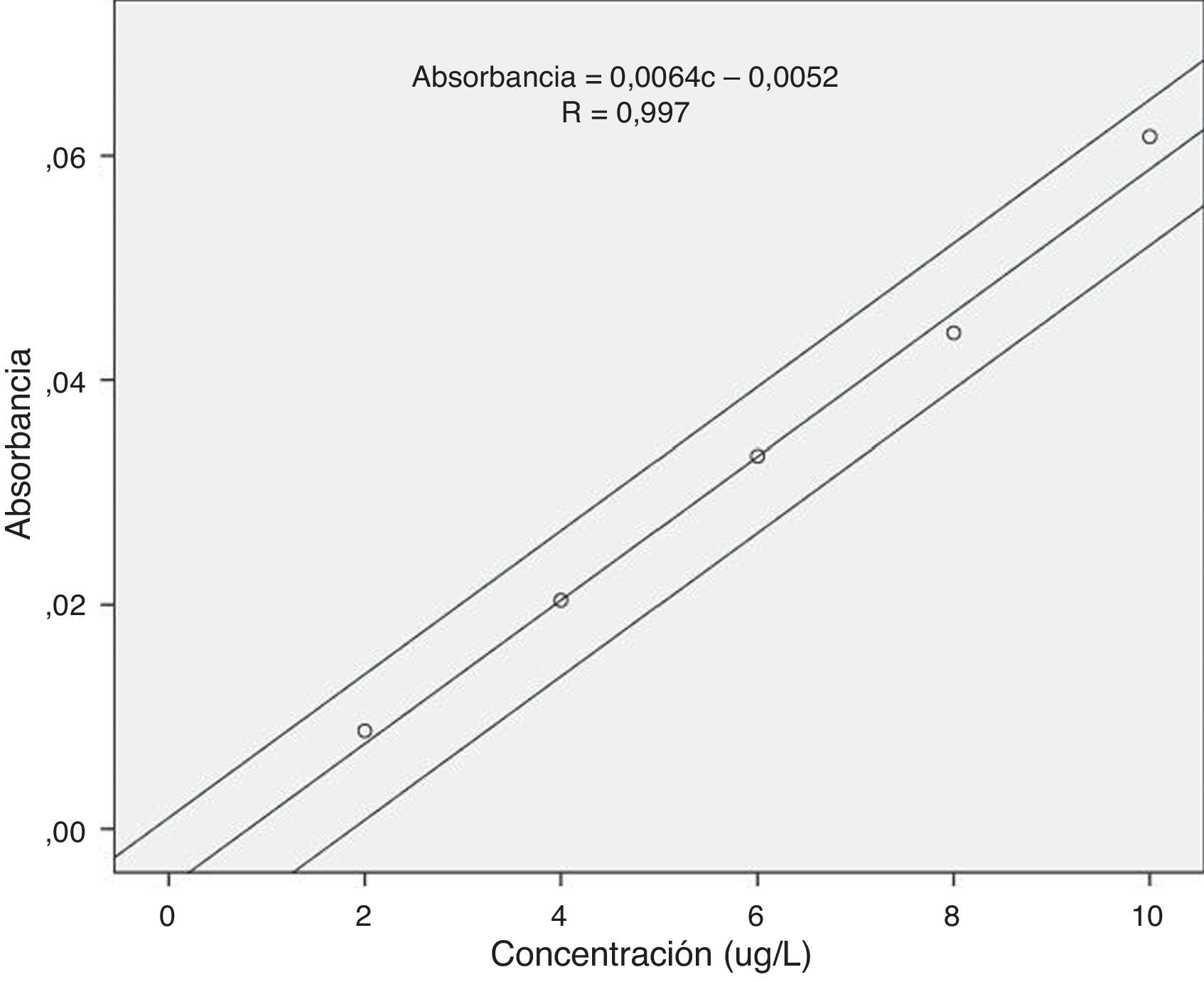
La curva de calibración con patrones acuosos de 5 puntos se observa en la figura 1. El coeficiente de variación de los factores de respuesta, relación entre la absorbancia y la concentración, fue inferior al 5% (4,72%), por lo que la calibración entre 0 y 10μg/L se puede considerar lineal. Además, se puede considerar que la recta de regresión pasa por el origen al estar incluido este valor dentro del intervalo de confianza al 95% del valor de la ordenada en el origen (b=-0,008- 0,004). El coeficiente de correlación al cuadrado de la recta de regresión fue 0,994.
La masa característica obtenida es de 7,1pg y se encontró dentro del 20% del valor establecido por el fabricante (7pg/0,0044 A-s).
La pendiente de la recta de regresión de las adiciones estándar (0,005088 abs·L/μg), cuyo coeficiente de correlación al cuadrado fue 0,99738, está incluida dentro del límite de confianza al 95% de la pendiente de la regresión de la curva de calibración realizada con los patrones acuosos (0,005070–0,006958 abs·L/μg), por lo que podemos afirmar que no existe efecto matriz y que se pueden utilizar patrones acuosos para obtener la curva de calibración.
Los resultados obtenidos para evaluar la inexactitud se recogen en la tabla 3.
Se halló una recuperación media de un 99,32%.
Los resultados referentes a la repetibilidad se observan en la tabla 4, mientras que los correspondientes a la precisión intermedia se recogen en la tabla 5.
El método evaluado es lineal en las concentraciones séricas estudiadas, que comprenden desde 2μg/L hasta 10μg/L.
Debido a que valores de cromo inferiores a 7μg/L no se consideran de relevancia clínica15, la obtención de un límite de detección de 0,074μg/L se consideró como apropiada, tratándose pues de un método sensible y adecuado para biomonitorizar la concentración de cromo en pacientes que presentan prótesis de tipo metal-metal. Es un procedimiento preciso y exacto utilizando material de referencia así como muestras biológicas de suero.
Es de destacar tanto la rapidez del análisis como la ausencia de efecto matriz, lo que hace posible el análisis directo de las muestras de suero evitando cualquier procedimiento de digestión de la muestra y, por tanto, evitando también contaminaciones.
Por todo lo anterior, se considera que el método evaluado es eficaz para el análisis de cromo en suero, lo que resulta de gran interés para los laboratorios clínicos para biomonitorizar la concentración de cromo en muestras biológicas como indicador de riesgo para la salud humana, especialmente, en pacientes que presentan prótesis metal-metal.
Conflicto de interesesLos autores declaran no tener ningún potencial conflicto de interés relacionado con el artículo.