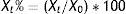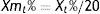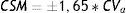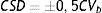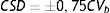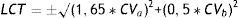Para asegurar la fiabilidad de los resultados de las magnitudes bioquímicas en muestras conservadas durante varios días, se aconseja realizar estudios de estabilidad según las condiciones de conservación empleadas.
Con el presente estudio queremos conocer los límites de estabilidad de 27 magnitudes bioquímicas bajo las condiciones de conservación utilizadas en nuestro laboratorio.
Material y métodosSe recogieron 20 muestras de suero en tubos con gel separador y se conservaron a 4°C. Las magnitudes bioquímicas se midieron 2 veces al día, con un intervalo de 6h, durante 5 días.
El cambio de concentración de las magnitudes a cada uno de los tiempos (Xt) respecto al valor inicial (X0) se expresó como cambio porcentual (Xt%)=(Xt/X0)*100 y se calculó la media de dicho cambio (Xmt%).
La estabilidad se evaluó según 3 criterios. Criterio metrológico según la variación analítica interdía (CVa), por el que la Xmt% no podría superar al cambio significativo mínimo (CSM=±1,65*CVa). Criterio biológico basado en la variación biológica intraindividual (CVb), por el que la Xmt% no podría superar al cambio significativo deseable (CSD=±0,5*CVb). Y criterio combinado de ambos, por el que la Xmt% no podría superar el límite de cambio total (LCT=±√(1,65*CVa)2+ (0,5*CVb)2).
ResultadosVeinte magnitudes se consideraron no estables según CSM y 14 según CSD. Al final del estudio, 9 magnitudes se consideraron no estables según el criterio LCT.
ConclusiónLos criterios CSM y CSD resultan demasiados restrictivos. La combinación de ambos se ajusta más a las necesidades de nuestro laboratorio. Cada laboratorio debería estudiar la estabilidad de sus muestras con sus propias condiciones de conservación.
To ensure the reliability of the results of biochemical parameters in samples stored for several days, it is advisable to carry out stability studies according to the storage conditions employed.
The limits of stability of 27 biochemical parameters under the storage conditions used in our laboratory were determined.
Material and methodTwenty samples were collected in serum tubes with gel separator and stored at 4°C. The biochemical parameters were measured twice daily at an interval of 6h for 5 days.
The change in the concentration of parameters at each of the times (Xt) compared to the initial value (X0) was expressed as a percentage change (Xt%)= (Xt/X0)*100 and the mean percentage change (Xmt%) was calculated.
The stability was evaluated according to 3 criteria. Metrology criteria according to within-day analytical variation (CVa), by which Xmt% could not exceed the minimum significant change (MSC=±1.65*CVa). Biological criteria based on intra-individual biological variation (CVb), by which Xmt% could not exceed the desirable significant change (DSC=±0.5*CVb). And the criteria based on the combination of both, by which Xmt% could not exceed the total limit of change (TLC=±√(1.65*CVa)2+ (0.5*CVb)2).
ResultsThe 20 parameters were considered stable according to MSC and 14 were according to DSC. In the end, nine parameters were considered stable according to the TLC criteria.
ConclusionMSC and DSC criteria are too restrictive. The TLC criteria is better suited to the needs of our laboratory. Each laboratory should investigate the stability of samples with their own storage conditions.
Una buena práctica en los laboratorios clínicos es evaluar las condiciones bajo las que se trabaja para poder juzgar el correcto funcionamiento del mismo, la calidad del servicio que ofrece y la relación coste/efectividad en sus procedimientos, tanto en la etapa preanalítica, analítica como postanalítica.
Es común en los laboratorios conservar las muestras durante un periodo determinado para, en el caso de ser necesario, poder comprobar un valor obtenido con anterioridad o añadir una nueva prueba.
El inconveniente de dicha práctica reside en que cualquier material biológico puede sufrir cambios por efecto de la temperatura que serán acumulativos a lo largo del tiempo1. Por este motivo es importante evaluar durante cuánto tiempo, bajo unas condiciones de almacenamiento concretas, una magnitud bioquímica es estable. Por encima de ese tiempo diremos que dicha magnitud ha perdido su estabilidad y no debería de ser analizada, pues su valor no tiene validez clínica.
En nuestro estudio, hemos querido conocer los límites de estabilidad de las 27 magnitudes bioquímicas más solicitadas por los clínicos de nuestro hospital usando los tubos primarios y las condiciones de conservación empleadas en nuestro laboratorio.
Material y métodosSelección y procesamiento de muestrasEste estudio se desarrolló en el área de rutina del Laboratorio CORE del Hospital Clínic de Barcelona durante el mes de mayo de 2013.
Se seleccionaron de nuestra carga de trabajo diaria y de forma aleatoria 20 muestras de suero que no presentaban signos aparentes de hemólisis, ictericia ni lipemia. No se aplicó ningún criterio más de exclusión a fin de reproducir las características de trabajo de nuestro laboratorio.
Las 20 muestras de suero fueron obtenidas en el servicio de extracciones de nuestro hospital. Para ello se utilizaron tubos de suero con gel separador de 5mL (BD Vacutainer® SST II Advance). Las muestras se dejaron coagular durante una hora a temperatura ambiente, y tras este paso se centrifugaron y procesaron por el analizador ADVIA 1800 (Siemens Diagnostics®).
Evaluación de la estabilidadLas muestras se procesaron 2 veces al día con un intervalo de 6h, durante 5 días consecutivos, siendo medidas las 27 magnitudes bioquímicas seleccionadas: glucosa (Glu), urea nitrogenada (BUN), creatinina (Crea), ácido úrico (AU), colesterol total (TC), colesterol-HDL (HDL), triglicéridos (TG), aspartato aminotransferasa (AST), alanina aminotransferasa (ALT), γ-glutamiltransferasa (GGT), fosfatasa alcalina (FA), bilirrubina directa (DBI), bilirrubina total (TBI), lactato deshidrogenasa (LDH), creatina cinasa (CK), proteína (PT), albúmina (AL), proteína C reactiva (PCR), amilasa (AMY), lipasa (LYP), sodio (Na), potasio (K), cloruro (Cl), calcio (Ca), magnesio (Mg), fosfato (P) y hierro (Fe).
Inmediatamente después de cada una de las series analíticas, las muestras se conservaron destapadas en armarios metálicos que se encuentran dentro de una cámara de refrigeración a 4±2°C, sin ventilación y en condiciones de oscuridad.
Controles de calidadAntes de cada serie analítica, se procesaron los materiales control de valor intermedio utilizados como control interno en nuestro laboratorio (Liquid Assayed Multiqual y Liquichek Immunology™ de Bio-Rad®). Aquellos procedimientos de medida que no cumplían los requisitos de calidad establecidos en nuestro laboratorio (media±2*desviación estándar), fueron calibrados y nuevamente controlados.
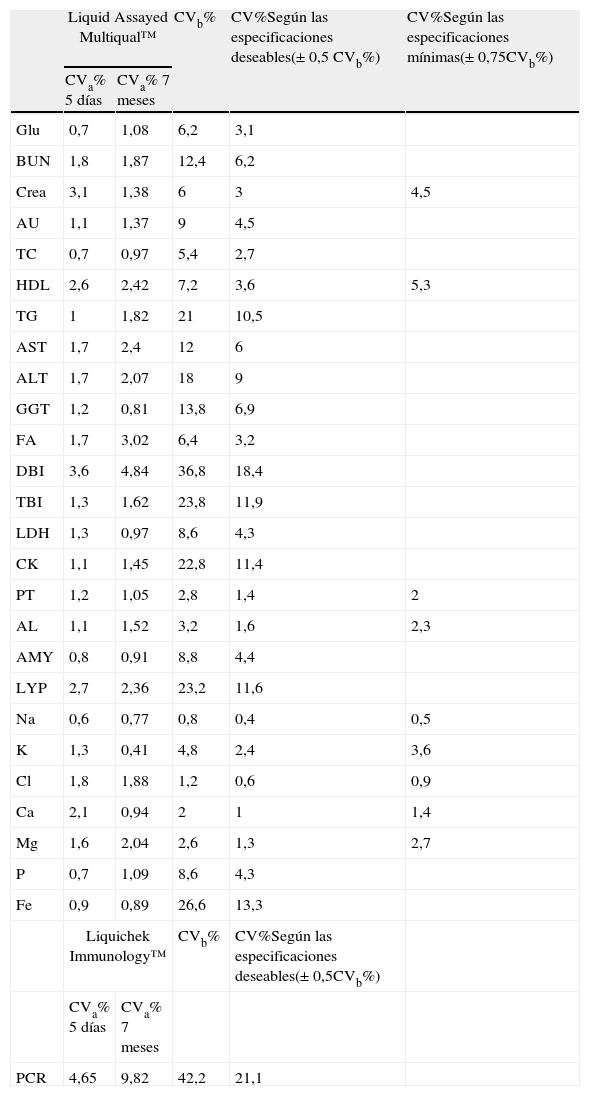
Se calculó el coeficiente de variación analítico para cada magnitud durante los 5 días del ensayo. A su vez se calculó el coeficiente de variación interdía de los controles de calidad interno de nivel intermedio, utilizando los datos obtenidos en los 7 meses anteriores a la fecha del estudio, para cada una de las magnitudes (tabla 1).
Controles de calidad
| Liquid Assayed Multiqual™ | CVb% | CV%Según las especificaciones deseables(±0,5 CVb%) | CV%Según las especificaciones mínimas(±0,75CVb%) | ||
| CVa% 5 días | CVa% 7 meses | ||||
| Glu | 0,7 | 1,08 | 6,2 | 3,1 | |
| BUN | 1,8 | 1,87 | 12,4 | 6,2 | |
| Crea | 3,1 | 1,38 | 6 | 3 | 4,5 |
| AU | 1,1 | 1,37 | 9 | 4,5 | |
| TC | 0,7 | 0,97 | 5,4 | 2,7 | |
| HDL | 2,6 | 2,42 | 7,2 | 3,6 | 5,3 |
| TG | 1 | 1,82 | 21 | 10,5 | |
| AST | 1,7 | 2,4 | 12 | 6 | |
| ALT | 1,7 | 2,07 | 18 | 9 | |
| GGT | 1,2 | 0,81 | 13,8 | 6,9 | |
| FA | 1,7 | 3,02 | 6,4 | 3,2 | |
| DBI | 3,6 | 4,84 | 36,8 | 18,4 | |
| TBI | 1,3 | 1,62 | 23,8 | 11,9 | |
| LDH | 1,3 | 0,97 | 8,6 | 4,3 | |
| CK | 1,1 | 1,45 | 22,8 | 11,4 | |
| PT | 1,2 | 1,05 | 2,8 | 1,4 | 2 |
| AL | 1,1 | 1,52 | 3,2 | 1,6 | 2,3 |
| AMY | 0,8 | 0,91 | 8,8 | 4,4 | |
| LYP | 2,7 | 2,36 | 23,2 | 11,6 | |
| Na | 0,6 | 0,77 | 0,8 | 0,4 | 0,5 |
| K | 1,3 | 0,41 | 4,8 | 2,4 | 3,6 |
| Cl | 1,8 | 1,88 | 1,2 | 0,6 | 0,9 |
| Ca | 2,1 | 0,94 | 2 | 1 | 1,4 |
| Mg | 1,6 | 2,04 | 2,6 | 1,3 | 2,7 |
| P | 0,7 | 1,09 | 8,6 | 4,3 | |
| Fe | 0,9 | 0,89 | 26,6 | 13,3 | |
| Liquichek Immunology™ | CVb% | CV%Según las especificaciones deseables(±0,5CVb%) | |||
| CVa% 5 días | CVa% 7 meses | ||||
| PCR | 4,65 | 9,82 | 42,2 | 21,1 | |
En las 2 primeras columnas de la izquierda se muestra el coeficiente de variación analítico que presentaron las 27 magnitudes bioquímicas en los materiales utilizados como control interno durante los 5 días que duró el estudio y durante los 7 meses anteriores. En la tercera columna se muestra el coeficiente de variación biológico intraindividual para cada magnitud. Las 2 últimas columnas corresponden al coeficiente de variación biológico intraindividual según las especificaciones deseables y mínimas para la calidad analítica.
Los resultados se transformaron en sus correspondientes porcentajes, considerándose la concentración obtenida a tiempo 0 horas (X0) como el 100%. El cambio de concentración producido en ellas (Xt) en cada uno de los tiempos (6, 24, 30, 48, 54, 72, 78, 96 y 102h) respecto al valor inicial (X0) se expresó como cambio porcentual (Xt%)
En cada tiempo se calculó la media del cambio porcentual (Xmt%) de las 20 muestras para cada magnitud.
Para el estudio de estabilidad hemos seguido 3 criterios diferentes:
- a)
Criterio metrológico según la variación analítica interdía.
La media del cambio porcentual en cada tiempo se comparó con el cambio significativo mínimo (CSM) o límite de cambio aceptable2,3.
Según este criterio, una desviación en Xmt% superior a ±1,65*CVa representa una diferencia significativa en la concentración del analito que no es debida a la imprecisión propia del procedimiento de medida empleado. Los coeficientes de variación analíticos (CVa) utilizados corresponden a los resultados de QC interno obtenidos durante los siete7 meses anteriores a la fecha del estudio (tabla 1).
- b)
Criterio biológico según la variación biológica intraindividual.
Según este criterio la imprecisión de un método debe ser igual o menor a un medio del coeficiente de variación biológico intraindividual (≤0,5CVb)2,4. Un cambio en la concentración del analito no será atribuible a la variación biológica intraindividual cuando Xmt% exceda el límite fijado por el cambio significativo deseable (CSD).
Los CVb de cada analito se consultaron en el listado de componentes de variación biológica publicado por Ricos et al.5 en su revisión del 2012 disponible online, correspondiendo este CSD a las especificaciones deseables para la calidad analítica (http://www.westgard.com/biodatabase1.htm).
Para aquellas magnitudes cuya Xm%, a determinados tiempos, superase el límite de CSD según estas especificaciones deseables, se calculó de nuevo el límite CSD según las especificaciones mínimas (http://www.westgard.com/minimum-biodatabase1.htm) (tabla 1).
- c)
Criterio combinado de variación analítica interdía y variación biológica intraindividual.
Se fijó el límite de cambio total (LCT), que emplea una combinación de los 2 criterios anteriormente mencionados. Así, consideramos que una magnitud dejaba de ser estable cuando la Xmt% excedía este LCT2,6,7.
Para el cálculo de LCT, el CVb siguió los mismos criterios que en el apartado anterior.
Los resultados obtenidos en los materiales control para las 27 magnitudes medidas antes de cada serie analítica estuvieron dentro del intervalo especificado por el sistema de calidad interno de nuestro laboratorio. La imprecisión analítica que mostraron estos materiales control, tanto en los 5 días de estudio, como en los 7 meses anteriores a este, fue aceptable (CV<10%) (tabla 1).
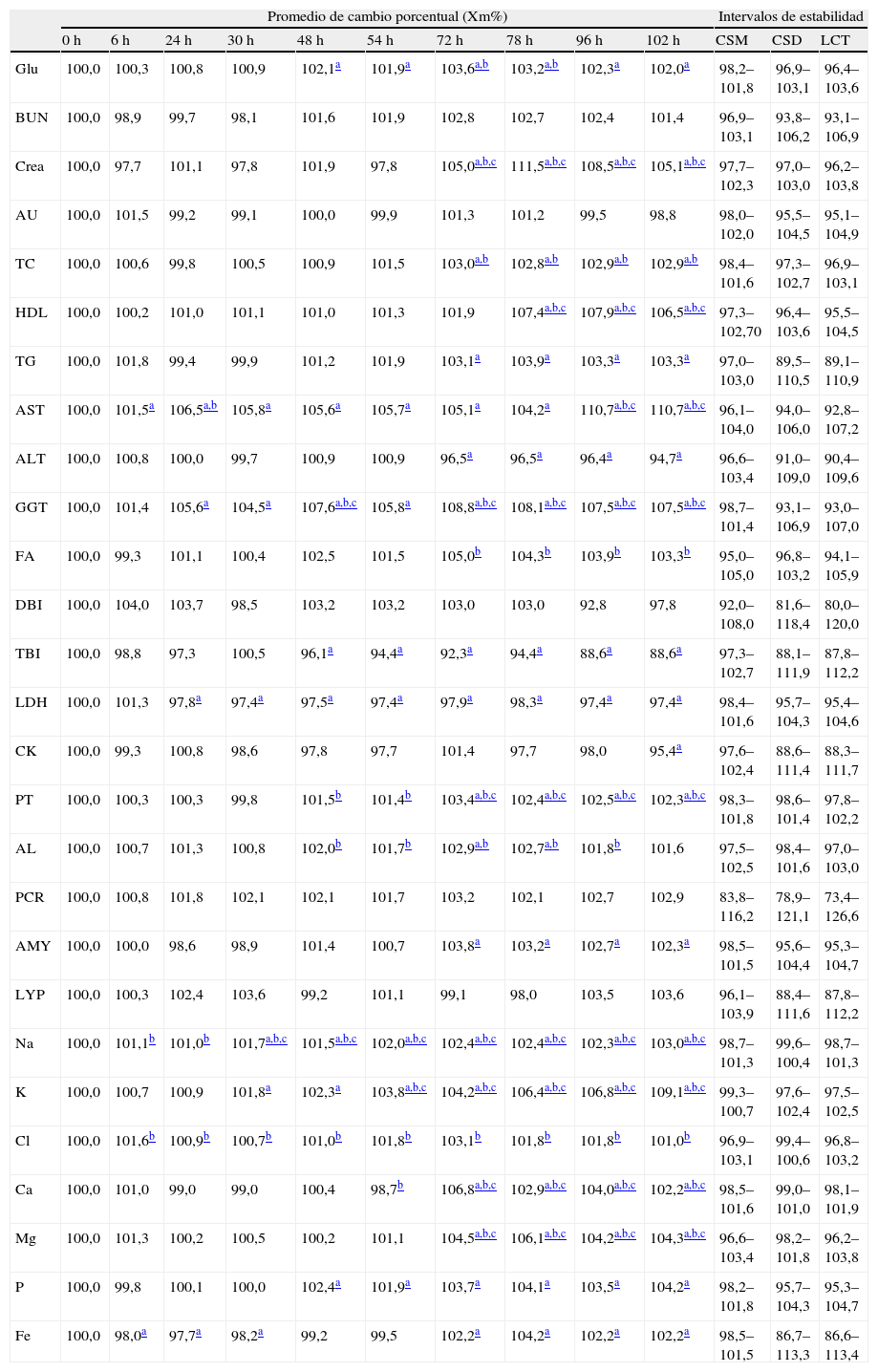
En la tabla 2 se muestra para cada magnitud el promedio de cambio porcentual (Xmt%) a los distintos tiempos. A su vez se muestran los intervalos establecidos según CSM, CSD y LCT, indicándose el momento en que las diferencias de concentración encontradas superaron dichos intervalos.
Promedio de cambio porcentual de las 27 magnitudes en cada tiempo del estudio e intervalos de estabilidad creados según los 3 modelos propuestos (CSM, CSD y LCT)
| Promedio de cambio porcentual (Xm%) | Intervalos de estabilidad | ||||||||||||
| 0h | 6h | 24h | 30h | 48h | 54h | 72h | 78h | 96h | 102h | CSM | CSD | LCT | |
| Glu | 100,0 | 100,3 | 100,8 | 100,9 | 102,1a | 101,9a | 103,6a,b | 103,2a,b | 102,3a | 102,0a | 98,2–101,8 | 96,9–103,1 | 96,4–103,6 |
| BUN | 100,0 | 98,9 | 99,7 | 98,1 | 101,6 | 101,9 | 102,8 | 102,7 | 102,4 | 101,4 | 96,9–103,1 | 93,8–106,2 | 93,1–106,9 |
| Crea | 100,0 | 97,7 | 101,1 | 97,8 | 101,9 | 97,8 | 105,0a,b,c | 111,5a,b,c | 108,5a,b,c | 105,1a,b,c | 97,7–102,3 | 97,0–103,0 | 96,2–103,8 |
| AU | 100,0 | 101,5 | 99,2 | 99,1 | 100,0 | 99,9 | 101,3 | 101,2 | 99,5 | 98,8 | 98,0–102,0 | 95,5–104,5 | 95,1–104,9 |
| TC | 100,0 | 100,6 | 99,8 | 100,5 | 100,9 | 101,5 | 103,0a,b | 102,8a,b | 102,9a,b | 102,9a,b | 98,4–101,6 | 97,3–102,7 | 96,9–103,1 |
| HDL | 100,0 | 100,2 | 101,0 | 101,1 | 101,0 | 101,3 | 101,9 | 107,4a,b,c | 107,9a,b,c | 106,5a,b,c | 97,3–102,70 | 96,4–103,6 | 95,5–104,5 |
| TG | 100,0 | 101,8 | 99,4 | 99,9 | 101,2 | 101,9 | 103,1a | 103,9a | 103,3a | 103,3a | 97,0–103,0 | 89,5–110,5 | 89,1–110,9 |
| AST | 100,0 | 101,5a | 106,5a,b | 105,8a | 105,6a | 105,7a | 105,1a | 104,2a | 110,7a,b,c | 110,7a,b,c | 96,1–104,0 | 94,0–106,0 | 92,8–107,2 |
| ALT | 100,0 | 100,8 | 100,0 | 99,7 | 100,9 | 100,9 | 96,5a | 96,5a | 96,4a | 94,7a | 96,6–103,4 | 91,0–109,0 | 90,4–109,6 |
| GGT | 100,0 | 101,4 | 105,6a | 104,5a | 107,6a,b,c | 105,8a | 108,8a,b,c | 108,1a,b,c | 107,5a,b,c | 107,5a,b,c | 98,7–101,4 | 93,1–106,9 | 93,0–107,0 |
| FA | 100,0 | 99,3 | 101,1 | 100,4 | 102,5 | 101,5 | 105,0b | 104,3b | 103,9b | 103,3b | 95,0–105,0 | 96,8–103,2 | 94,1–105,9 |
| DBI | 100,0 | 104,0 | 103,7 | 98,5 | 103,2 | 103,2 | 103,0 | 103,0 | 92,8 | 97,8 | 92,0–108,0 | 81,6–118,4 | 80,0–120,0 |
| TBI | 100,0 | 98,8 | 97,3 | 100,5 | 96,1a | 94,4a | 92,3a | 94,4a | 88,6a | 88,6a | 97,3–102,7 | 88,1–111,9 | 87,8–112,2 |
| LDH | 100,0 | 101,3 | 97,8a | 97,4a | 97,5a | 97,4a | 97,9a | 98,3a | 97,4a | 97,4a | 98,4–101,6 | 95,7–104,3 | 95,4–104,6 |
| CK | 100,0 | 99,3 | 100,8 | 98,6 | 97,8 | 97,7 | 101,4 | 97,7 | 98,0 | 95,4a | 97,6–102,4 | 88,6–111,4 | 88,3–111,7 |
| PT | 100,0 | 100,3 | 100,3 | 99,8 | 101,5b | 101,4b | 103,4a,b,c | 102,4a,b,c | 102,5a,b,c | 102,3a,b,c | 98,3–101,8 | 98,6–101,4 | 97,8–102,2 |
| AL | 100,0 | 100,7 | 101,3 | 100,8 | 102,0b | 101,7b | 102,9a,b | 102,7a,b | 101,8b | 101,6 | 97,5–102,5 | 98,4–101,6 | 97,0–103,0 |
| PCR | 100,0 | 100,8 | 101,8 | 102,1 | 102,1 | 101,7 | 103,2 | 102,1 | 102,7 | 102,9 | 83,8–116,2 | 78,9–121,1 | 73,4–126,6 |
| AMY | 100,0 | 100,0 | 98,6 | 98,9 | 101,4 | 100,7 | 103,8a | 103,2a | 102,7a | 102,3a | 98,5–101,5 | 95,6–104,4 | 95,3–104,7 |
| LYP | 100,0 | 100,3 | 102,4 | 103,6 | 99,2 | 101,1 | 99,1 | 98,0 | 103,5 | 103,6 | 96,1–103,9 | 88,4–111,6 | 87,8–112,2 |
| Na | 100,0 | 101,1b | 101,0b | 101,7a,b,c | 101,5a,b,c | 102,0a,b,c | 102,4a,b,c | 102,4a,b,c | 102,3a,b,c | 103,0a,b,c | 98,7–101,3 | 99,6–100,4 | 98,7–101,3 |
| K | 100,0 | 100,7 | 100,9 | 101,8a | 102,3a | 103,8a,b,c | 104,2a,b,c | 106,4a,b,c | 106,8a,b,c | 109,1a,b,c | 99,3–100,7 | 97,6–102,4 | 97,5–102,5 |
| Cl | 100,0 | 101,6b | 100,9b | 100,7b | 101,0b | 101,8b | 103,1b | 101,8b | 101,8b | 101,0b | 96,9–103,1 | 99,4–100,6 | 96,8–103,2 |
| Ca | 100,0 | 101,0 | 99,0 | 99,0 | 100,4 | 98,7b | 106,8a,b,c | 102,9a,b,c | 104,0a,b,c | 102,2a,b,c | 98,5–101,6 | 99,0–101,0 | 98,1–101,9 |
| Mg | 100,0 | 101,3 | 100,2 | 100,5 | 100,2 | 101,1 | 104,5a,b,c | 106,1a,b,c | 104,2a,b,c | 104,3a,b,c | 96,6–103,4 | 98,2–101,8 | 96,2–103,8 |
| P | 100,0 | 99,8 | 100,1 | 100,0 | 102,4a | 101,9a | 103,7a | 104,1a | 103,5a | 104,2a | 98,2–101,8 | 95,7–104,3 | 95,3–104,7 |
| Fe | 100,0 | 98,0a | 97,7a | 98,2a | 99,2 | 99,5 | 102,2a | 104,2a | 102,2a | 102,2a | 98,5–101,5 | 86,7–113,3 | 86,6–113,4 |
Al finalizar el estudio; BUN, AU, DBI, PCR y LYP no superaron los límites de cambio fijados por ninguno de los 3 criterios propuestos.
Veinte de las 27 magnitudes excedieron los intervalos de cambio propuestos por el criterio CSM: Glu, Crea, TC, HDL, TG, AST, ALT, GGT, TBI, LDH, CK, PT, AL, AMY, Na, K, Ca, Mg, P y Fe.
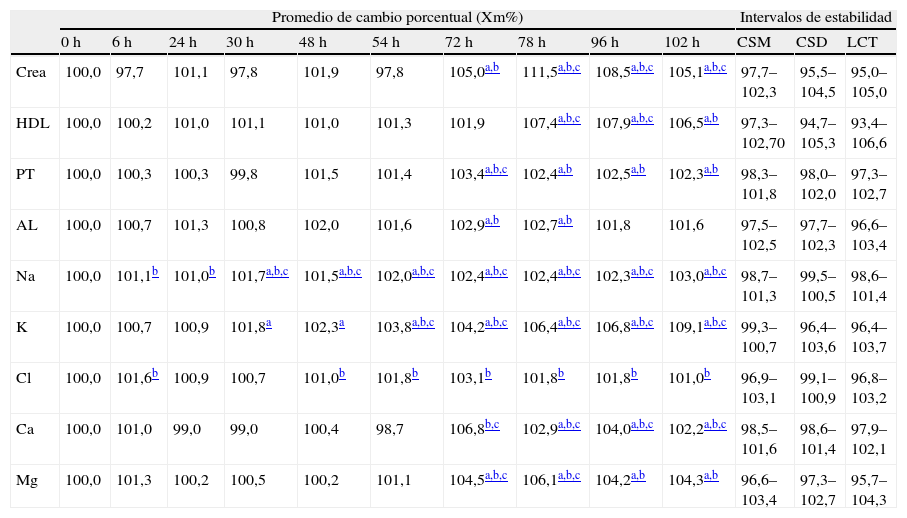
Siguiendo el criterio CSD, si aplicamos en su cálculo las especificaciones deseables para la variación biológica (tabla 1), 14 magnitudes no cumplían este criterio de estabilidad: Glu, Crea, TC, HDL, AST, GGT, FA, PT, AL, Na, K, Cl, Ca y Mg. Al aplicar las especificaciones mínimas (tabla 1) en aquellas magnitudes en las que dicho dato estaba disponible (Crea, HDL, PT, AL, Na, K, Cl, Ca y Mg), el límite de CSD y LCT (tabla 2) se amplió y el cambio de concentración observado anteriormente en PT, AL, Cl y Ca, pasó a considerarse tolerable en algunos de los tiempos del estudio, aunque en las últimas series analíticas se consideraron inestables igualmente (tabla 3). Para Crea, HDL, K, Na y Mg no supuso mejora alguna.
Promedio de cambio porcentual de las 9 magnitudes en las que se pudo recalcular los intervalos de estabilidad para CSD y LCT
| Promedio de cambio porcentual (Xm%) | Intervalos de estabilidad | ||||||||||||
| 0h | 6h | 24h | 30h | 48h | 54h | 72h | 78h | 96h | 102h | CSM | CSD | LCT | |
| Crea | 100,0 | 97,7 | 101,1 | 97,8 | 101,9 | 97,8 | 105,0a,b | 111,5a,b,c | 108,5a,b,c | 105,1a,b,c | 97,7–102,3 | 95,5–104,5 | 95,0–105,0 |
| HDL | 100,0 | 100,2 | 101,0 | 101,1 | 101,0 | 101,3 | 101,9 | 107,4a,b,c | 107,9a,b,c | 106,5a,b | 97,3–102,70 | 94,7–105,3 | 93,4–106,6 |
| PT | 100,0 | 100,3 | 100,3 | 99,8 | 101,5 | 101,4 | 103,4a,b,c | 102,4a,b | 102,5a,b | 102,3a,b | 98,3–101,8 | 98,0–102,0 | 97,3–102,7 |
| AL | 100,0 | 100,7 | 101,3 | 100,8 | 102,0 | 101,6 | 102,9a,b | 102,7a,b | 101,8 | 101,6 | 97,5–102,5 | 97,7–102,3 | 96,6–103,4 |
| Na | 100,0 | 101,1b | 101,0b | 101,7a,b,c | 101,5a,b,c | 102,0a,b,c | 102,4a,b,c | 102,4a,b,c | 102,3a,b,c | 103,0a,b,c | 98,7–101,3 | 99,5–100,5 | 98,6–101,4 |
| K | 100,0 | 100,7 | 100,9 | 101,8a | 102,3a | 103,8a,b,c | 104,2a,b,c | 106,4a,b,c | 106,8a,b,c | 109,1a,b,c | 99,3–100,7 | 96,4–103,6 | 96,4–103,7 |
| Cl | 100,0 | 101,6b | 100,9 | 100,7 | 101,0b | 101,8b | 103,1b | 101,8b | 101,8b | 101,0b | 96,9–103,1 | 99,1–100,9 | 96,8–103,2 |
| Ca | 100,0 | 101,0 | 99,0 | 99,0 | 100,4 | 98,7 | 106,8b,c | 102,9a,b,c | 104,0a,b,c | 102,2a,b,c | 98,5–101,6 | 98,6–101,4 | 97,9–102,1 |
| Mg | 100,0 | 101,3 | 100,2 | 100,5 | 100,2 | 101,1 | 104,5a,b,c | 106,1a,b,c | 104,2a,b | 104,3a,b | 96,6–103,4 | 97,3–102,7 | 95,7–104,3 |
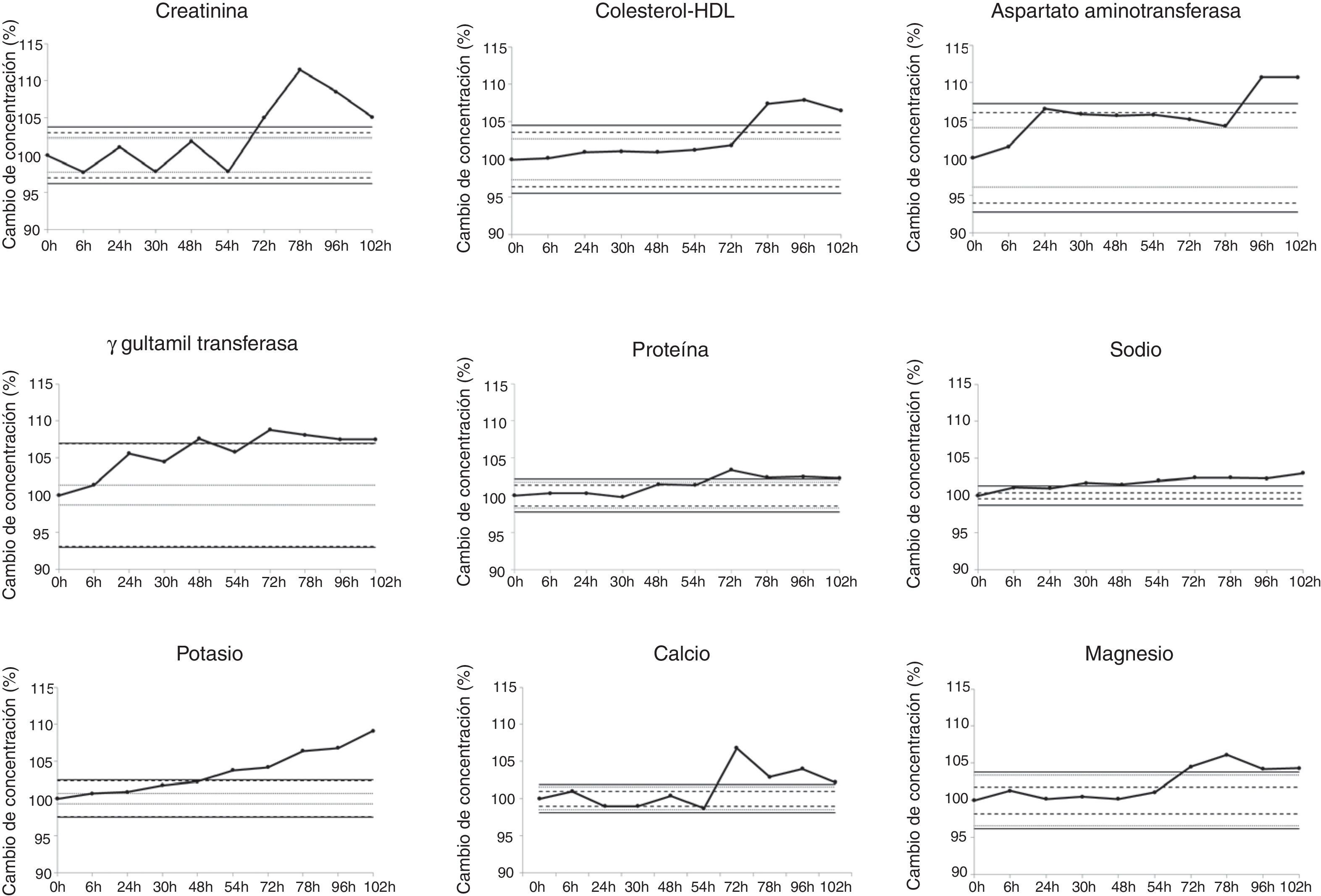
Por último, según el criterio combinado LCT, 9 magnitudes se consideraron alteradas al final del estudio: Na a las 30h; K a las 54h; Crea, GGT, PT, Ca y Mg a las 72h; HDL a las 78h y AST a las 96h.
En la figura 1 se representa la evolución del cambio en la concentración de estas 9 magnitudes, así como sus diferentes límites de estabilidad.
Cambio de concentración porcentual a los diferentes tiempos del estudio (Xt%) para las 9 magnitudes que no se pudieron considerar estables según el criterio LCT.
La línea rayada representa el límite de estabilidad según el criterio CSM.
La línea de puntos representa el límite de estabilidad según el criterio CSD.
La línea continua representa el límite de estabilidad según el criterio LCT.
En el presente estudio hemos podido comprobar la utilidad práctica de conservar las muestras de suero refrigeradas, una vez analizadas, ya que más de la mitad de las magnitudes bioquímicas estudiadas (18/27) permanecen estables a las 102h tras su primer análisis según el criterio LCT. En este periodo de tiempo, los clínicos de nuestro hospital podrían solicitar repeticiones o añadir estas pruebas, sin necesidad de volver a someter al paciente al proceso de extracción de la muestra.
Siguiendo el criterio basado en la imprecisión analítica, CSM, 20 parámetros no deberían de ser medidos a las 102h de su almacenamiento o incluso antes. Algunos de ellos, como AST y Fe, podemos considerarlos alterados tras su medición inicial (X0). También se podría llegar a rechazar el resultado de alguna magnitud precipitadamente como en el caso de la AL, cuya Xmt% supera el intervalo de aceptación CSM a las 72 y 78h pero no así a las 96 y 102h. También en los casos de PT, Na, Cl, Ca y Mg, la estabilidad se pierde muy pronto. Esto se debe al pequeño CV analítico que encontramos en estas técnicas, que genera un estrecho margen de variación a lo largo del tiempo. Por ello, los límites de aceptabilidad derivados de solo el análisis de la imprecisión analítica pueden llevar a un rechazo innecesario de los resultados obtenidos con métodos muy precisos7.
Si únicamente tuviéramos en cuenta la imprecisión derivada de la variación biológica, según el criterio CSD, 14 de los 27 parámetros no deberían ser analizados 102h después de su primera medición, e incluso antes. El rango de diferencias de concentración que permite este CSD es más amplio que el obtenido para el CSM, excepto para PT, AL, Na, Cl, Ca y Mg donde la imprecisión analítica de estas técnicas es muy cercana al resultado del cálculo que establece los límites para el CSD (0,5*CVb) o superior (Na, Cl y Mg). Utilizando las especificaciones mínimas de calidad para el cálculo del CSD (0,75*CVb), se consigue que PT, AL, Cl y Ca cumplan el criterio de estabilidad CSD durante un periodo de tiempo más largo.
En el caso de Glu (72 y 78h) y AST (24h), no cumplen el criterio CSD debido al estrecho margen de aceptación que permite este criterio basado en el CVb deseable, ya que en tiempos posteriores sí lo cumplen.
El empleo de los criterios CSM y CSD para establecer los límites de cambio aceptable generan unos límites de estabilidad demasiado restrictivos bajo nuestras condiciones de trabajo habituales. Debido a esto, seguimos el criterio de LCT, propuesto por Zhang et al.7, para evaluar la estabilidad de las 27 magnitudes bioquímicas y así establecer el límite de cambio clínicamente aceptable de una magnitud en una muestra a lo largo del tiempo.
Según el criterio LCT, 9 parámetros bioquímicos (Crea, HDL, AST, GGT, PT, Na, K, Ca y Mg) no se pueden considerar estables al finalizar el estudio. El aumento de concentración producido en todos ellos a lo largo del tiempo se debe probablemente a la evaporación que sufren las muestras, no durante su almacenaje en refrigeración, sino durante las distintas series analíticas donde se analizaban los 20 tubos simultáneamente y estos permanecían a temperatura ambiente.
En el caso del colesterol-HDL, Bausserman et al.8 describieron una disminución significativa de su concentración, en suero conservado a 4°C, a partir del tercer día de almacenamiento. Otros autores como Oddoze et al.2 no vieron cambios en este analito al final de su estudio, utilizando las mismas condiciones de conservación del suero, debido a que el tiempo de conservación de las muestras fue solo de 24h. Nosotros hemos observado un incremento en la concentración de colesterol-HDL, paralelo al aumento en TC y TG, que tendría una significación clínica a partir del cuarto día de conservación y que también podría atribuirse al aumento de concentración por evaporación.
AST y GGT también se ven afectados por esta evaporación en las muestras, no habiéndose descrito anteriormente en la literatura cambio en la actividad de estas enzimas en muestras de suero conservadas en refrigeración9.
O’Keane y Cunningham10 observaron en su estudio un aumento de la concentración de creatinina a las 48h en muestras de plasma o suero debido a la interferencia existente entre las pseudocreatininas y la reacción de Jaffe. En nuestro estudio también se da un aumento de creatinina significativo pero a partir de las 72h.
A partir de los resultados obtenidos podemos concluir que los cambios de concentración observados durante el proceso de conservación se deben probablemente a 2 procesos: degradación por inestabilidad del analito y aumento de la concentración por evaporación, aunque en la mayoría de los casos solo se observa este último.
La estabilidad de magnitudes bioquímicas séricas medidas en muestras conservadas durante un periodo de tiempo determinado ha sido descrita por numerosos autores2,3,7,10–12. Las diferentes técnicas analíticas empleadas, el tiempo de almacenamiento de las muestras, así como los distintos criterios para establecer los límites de estabilidad, dificultan la comparación de los resultados obtenidos.
Por eso se hace necesario que cada laboratorio conozca la estabilidad de las magnitudes bioquímicas en las condiciones en las que trabaja, debido a que estas serán distintas según el ambiente de conservación, el tiempo de almacenamiento y los métodos empleados en su análisis.
LimitacionesEl diseño del estudio puede haber influido en la inestabilidad de las magnitudes ya que, durante las diferentes series analíticas, los mismos 20 tubos fueron procesados a temperatura ambiente, fuera de las condiciones de refrigeración en las que permanecían almacenados, acelerando así su evaporación.
Conflicto de interesesLos autores de este artículo declaran no tener ningún tipo de conflicto de interés.