Analizar el valor predictivo de diversas aproximaciones: cuantificación de la concentración de apolipoproteína B (apoB), estimación del cLDLf y estimación del no-cHDL, como predictivos de elevaciones de la magnitud de la concentración de cLDL.
Material y métodosEstudio multicéntrico transversal en el que se han analizado las muestras rutinarias de 6.094 pacientes consecutivos. En cada paciente se ha cuantificado el cLDL mediante una técnica de ultracentrifugación de rutina (cLDLu) y la concentración de apoB por uno de los métodos inmunológicos estandarizados y se ha estimado el cLDLf y el no-cHDL. Las magnitudes obtenidas han sido utilizadas para analizar sus valores predictivos del cLDLu en función de tres grupos de concentración de Tg (<200, entre 200 y 400 y más de 400mg/dL) y los grupos de riesgo definidos por el ATPIII (cLDL>70, 100, 130 o 160mg/dL).
Resultados y conclusionesCon todas las magnitudes analizadas se obtiene un buen valor predictivo positivo, variable para las diferentes concentraciones de Tg y que es máximo para la apoB con puntos de corte de alta especificidad (AE). Las estimaciones con cLDLf infraestiman la situación de riesgo del paciente, mientras que las que utilizan el no-cHDL la sobreestiman.
ConclusiónEn pacientes con Tg<200mg/dL puede utilizarse prácticamente sin riesgo la fórmula de Friedewald; en pacientes con Tg elevados es recomendable la apoB (puntos de corte de AE) como predictor positivo y el no-cHDL como predictor negativo.
To analyse the predictive value of several approaches to cardiovascular risk prevention: measuring apolipoprotein B concentrations (apoB), estimation of fractionated LDL cholesterol (cLDLf) and non-HDL cholesterol (HDLc), to predict increases in LDL cholesterol.
Material and MethodsCross-sectional multicentre study in which routine samples from 6094 consecutive patients were analysed. In each patient, LDLc was quantified by routine ultracentrifugation technique (LDLu) and apoB concentrations by a standard immunological method. We also estimated the LDLf and non-HDLc. The values obtained were used to analyse the predictive values of unfractionated LDL cholesterol (cLDLu) into three groups according to their triglyceride concentration (<200, between 200 and 400 and 400mg/dL) and risk groups as defined by the Adult Treatment Panel (ATP) III guidelines (LDL-C> 70, 100, 130 or 160mg/dL).
Results and conclusionsWith all the variables analysed we obtained a good positive predictive value, which varied according to the triglyceride concentrations, with the highest values being obtained for apoB with high specificity cut-off points (AE). Calculations with LDLf values underestimate the patient's risk, while those using non-HDLc overestimate it.
ConclusionThe Friedewald formula can be used practically without risk in patients with triglycerides below 200mg/dL. In patients with elevated triglycerides, apoB (AE cut-off points) is recommended as a positive predictor, and non-HDLc as a negative predictor.
Numerosos estudios epidemiológicos y clínicos han demostrado consistentemente que magnitudes elevadas de la concentración de colesterol de las LDL (cLDL) medidas en suero o plasma se asocian con un incremento del riesgo de enfermedad cardiovascular (RCV)1–3. Por ello, dichas magnitudes permiten establecer unos puntos de decisión que son un objetivo común para el diagnóstico y manejo de las hiperlipidemias y para la evaluación del RCV4–7. Existen diversas formas de calcular el RCV, una de las más recomendadas es la propuesta por el Adult Treatment Panel III (ATPIII)8 que propone estimar el riesgo de accidentes cardiovasculares en 10 años, mientras muchas de las otras alternativas únicamente están orientadas a la estimación del riesgo de muerte cardiovascular. En ella, además, se definen como objetivos terapéuticos diferentes dianas de cLDL en función del riesgo global estimado para cada individuo.
En este sentido, se hace necesario disponer de métodos estandarizados para la medida de las concentraciones de cLDL que nos permitan estimar con seguridad la adecuación de las magnitudes de este constituyente encontradas en cada individuo, con las planteadas como objetivo terapéutico en función de su RCV, y que además cumplan con los objetivos analíticos recomendados por el National Colesterol Education Program (NCEP): error total ≤13%, sesgo ≤4% e imprecisión ≤4%9.
El método aceptado como de referencia para la medición del cLDL es el de beta-cuantificación9, método desarrollado por el CDC que precisa de dos pasos, uno de ultracentrifugación (UC) y otro de precipitación; es un método laborioso que requiere mucho tiempo, equipos costosos y personal entrenado, lo que restringe su uso solo para laboratorios especializados. En los laboratorios clínicos usualmente se estima la concentración de cLDL mediante la fórmula de Friedewald (cLDLf)10 a partir de las medidas de colesterol total (CT), triglicéridos (Tg) y colesterol de las HDL (cHDL); sin embargo, su inexactitud en pacientes con hipertrigliceridemia (HTG) y en otras condiciones clínicas (síndrome metabólico, diabetes mellitus, síndrome nefrótico o enfermedades hepáticas), hace que no se pueda utilizar con fiabilidad en muestras con concentraciones de Tg>200mg/dL11–13. En los últimos años se han desarrollado unos métodos completamente automatizados denominados métodos homogéneos, que mediante reactivos específicos miden con criterio selectivo directamente el cLDL; sin embargo, no se han evaluado completamente, no están estandarizados y ofrecen dudas en ciertas condiciones clínicas que pueden alterar las características de las lipoproteínas14.
Alternativamente, algunos expertos abogan por utilizar el colesterol de las lipoproteínas no HDL (c-noHDL) para mejorar la predicción del riesgo en pacientes con HTG, ya que estima el colesterol contenido en todas las lipoproteínas aterogénicas: LDL, IDL y VLDL. Así, el ATPIII recomienda que en los pacientes con concentraciones de Tg >200mg/dL se calcule el c-noHDL con unos objetivos 30mg/dL más altos que el cLDL para cada categoría de riesgo8.
Más recientemente, se ha propuesto el uso de las concentraciones de apolipoproteína B (apoB) en conjunto con un perfil lipídico estándar15. Ello es porque la apoB es un componente estructural de las partículas lipoproteicas aterogénicas y cada una de ellas (LDL, IDL y VLDL) transporta solamente una molécula de apoB. Además, su cuantificación está estandarizada por la IFCC y no requiere para su medida un espécimen en ayuno15.
En función de lo anterior, el objetivo de este trabajo fue el de analizar si la medición de apoB puede aportar mayor precisión en la estimación de la adecuación de la situación individual a la deseable, en función de su nivel de RCV en 10 años, en pacientes con HTG y compararla con los otros métodos que tienen la misma finalidad: cLDLu (como magnitud de comparación), cLDLf y c-noHDL.
Material y métodosTipo de estudioEstudio multicéntrico transversal en el que han participado los laboratorios de cinco hospitales, que cuantificaron la concentración de cLDL en suero mediante el método de beta-cuantificación (cLDLu): Hospital Universitario Marqués de Valdecilla (Santander), Hospital de Galdakao (Vizcaya), Hospital San Jorge (Huesca), Hospital Virgen Macarena (Sevilla) y Hospital Dr. Negrín (Las Palmas de Gran Canaria).
Población estudiadaLa población en estudio fue toda aquella a la que se solicitó un estudio de dislipemia en el que, según los criterios específicos de cada uno de los centros participantes (población total), se incluía la medición de cLDLu. No se utilizó ningún criterio de exclusión, a excepción de que no se dispusiera de alguna de las magnitudes del mismo: CT, Tg, colesterol HDL por precipitación (cHDLp) y apoB. EL número total de registros completos de pacientes recogidos tras su anonimización en un periodo de 7 años y agrupados en una base de datos única, fue de 6.094. Dado que uno de los principales problemas relacionados con la estimación del cLDL es la influencia de la concentración de Tg, cuya elevación puede ser el reflejo de una composición anormal de la VLDL, para los análisis del estudio se estratificó a los pacientes en tres grupos: Tg<200mg/dL, Tg entre 200-400mg/dL y Tg > 400mg/dL.
Procedimientos analíticosLos procedimientos analíticos utilizados fueron los rutinarios para cada uno de los centros participantes. Todos los procedimientos para la medición de la concentración de CT y Tg estuvieron basados en los métodos CHOD-PAP y GPO-PAP, si bien con las formulaciones características de cada plataforma analítica utilizada. Para la medición del cHDLp, se utilizó la técnica de precipitación con ácido fosfotúngstico-Mg++ seguida de la cuantificación de colesterol en el sobrenadante16. Para esta medición se realizaron adaptaciones del método de rutina (volúmenes de muestra y reactivo) que asegurasen un rango dinámico adecuado para las concentraciones esperadas (entre 2 y 30mg/dL en el sobrenadante mencionado, equivalentes a cHDL comprendidos entre 7 y 105mg/dL).
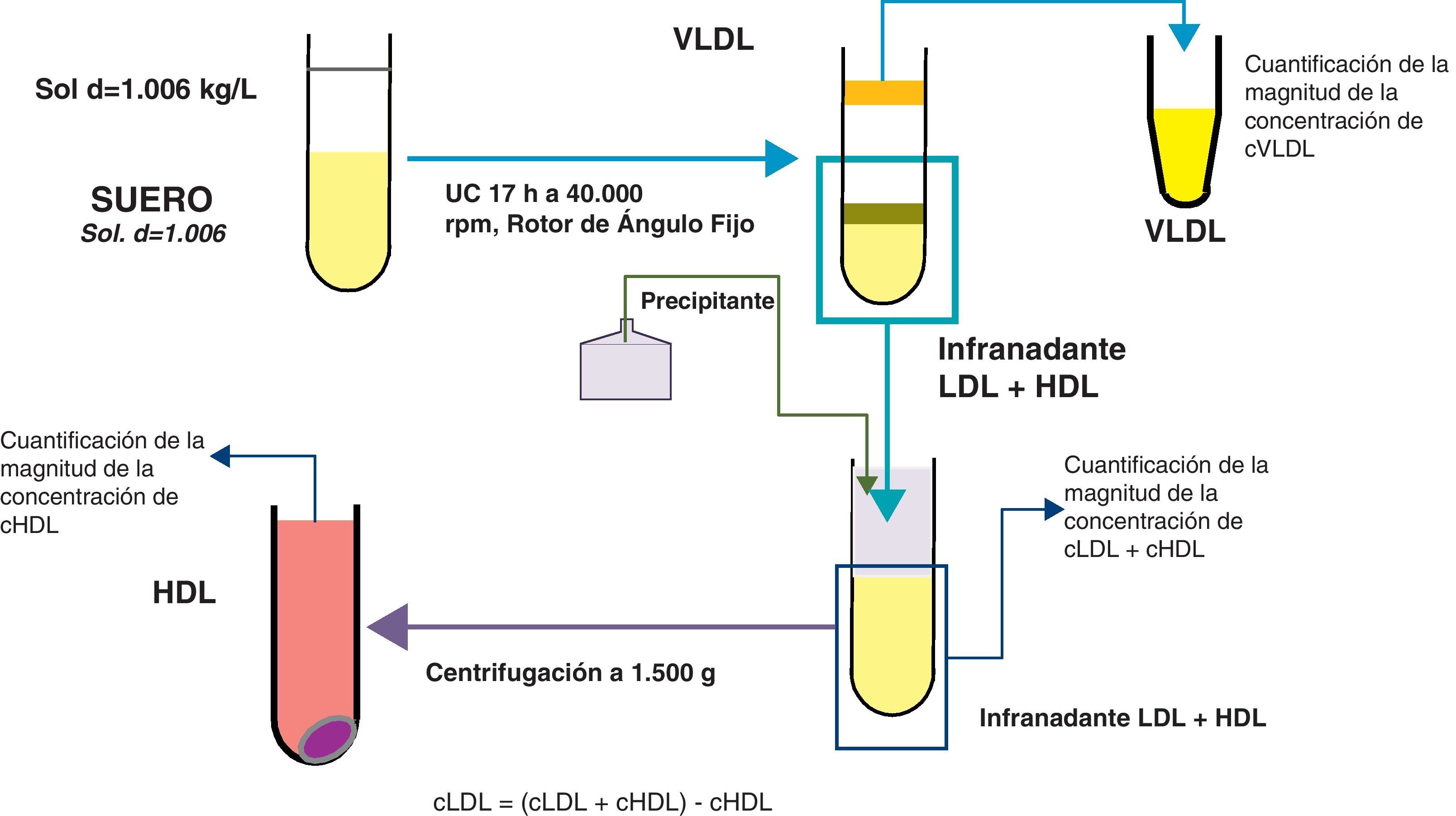
Para la cuantificación del cLDLu se utilizó el método de «rutina» recomendado por el Cholesterol Reference Method Laboratory Network (CRMLN)17 para la separación de lipoproteínas por UC (separación de VLDL por UC y de LDL por precipitación del infranadante), aunque utilizando ácido fosfotúngstico-Mg++ como reactivo precipitante en lugar de heparina-Mn++, que de forma breve se expone en la figura 1. Se utilizaron tubos de pared gruesa en los que se depositó un volumen de suero (previamente conservado con 10μl/ml de suero de una solución conservante conteniendo 5g de cloramfenicol, 41g de EDTA tetrasódico, 50g de azida sódica y 10 g de sulfato de gentamicina por litro de solución ajustada a pH 7,4) y se le superpuso un volumen de suero fisiológico (densidad 1,006 kg/L, conteniendo 50mg de cloramfenicol, 410mg de EDTA tetrasódico, 80mg de sulfato de gentamicina, y 500mg de azida sódica por litro de solución y ajustado a un pH de 7,4); a continuación los tubos fueron sometidos a una UC; la velocidad y el tiempo de UC fueron calculados para cada rotor utilizado en función del factor k del mismo. Dos laboratorios utilizaron un rotor Beckman 50.3 Ti (Beckman Instruments) donde los tubos se centrifugaron a 40.000rpm durante 17 horas a 15°C. Los tres laboratorios restantes utilizaron una TLA rotor 100.3 (Beckman Instruments) y los tubos se centrifugaron a 100.000rpm durante 2,5 horas a 16°C. Tras la UC, se homogeneizó la capa sobrenadante (VLDL) y se separó por aspiración de un volumen aproximadamente igual al de suero fisiológico utilizado previamente, utilizándose posteriormente para la medida de su concentración en colesterol (cVLDL). EL infranadante fue denominado como L+H y se utilizó para la cuantificación de su concentración de colesterol y para la precipitación de LDL (necesaria para la medida del cHDL). De esta manera, se midió directamente la concentración de colesterol de VLDL, de L+H y de HDL, ajustándose en todos los casos por los cambios de volumen desde el volumen de suero inicial al volumen de las fracciones obtenidas. El contenido en cLDLu se calculó como la diferencia entre el colesterol de L+H menos el cHDL.
Adicionalmente se estimó la concentración de cLDLf mediante la fórmula de Friedewald y el c-nHDL (CT menos cHDL). La apoB fue medida en diferentes plataformas automatizadas mediante métodos inmunoturbidimétricos o inmunonefelométricos estandarizados18. Todos los centros participantes en el estudio, siguieron un control de calidad externo para colesterol y triglicéridos que aseguraba un sesgo inferior al 3%. Por lo que respecta a la cuantificación de apoB y cHDL, se cruzaron muestras entre centros para asegurar que las diferencias medias (en todos los casos se utilizó el mismo método de precipitación mencionado previamente) entre centros no superaban el 4%. Uno de los laboratorios colaboradores participó también en un programa de control externo del CDC, asegurándose un sesgo inferior al 3%.
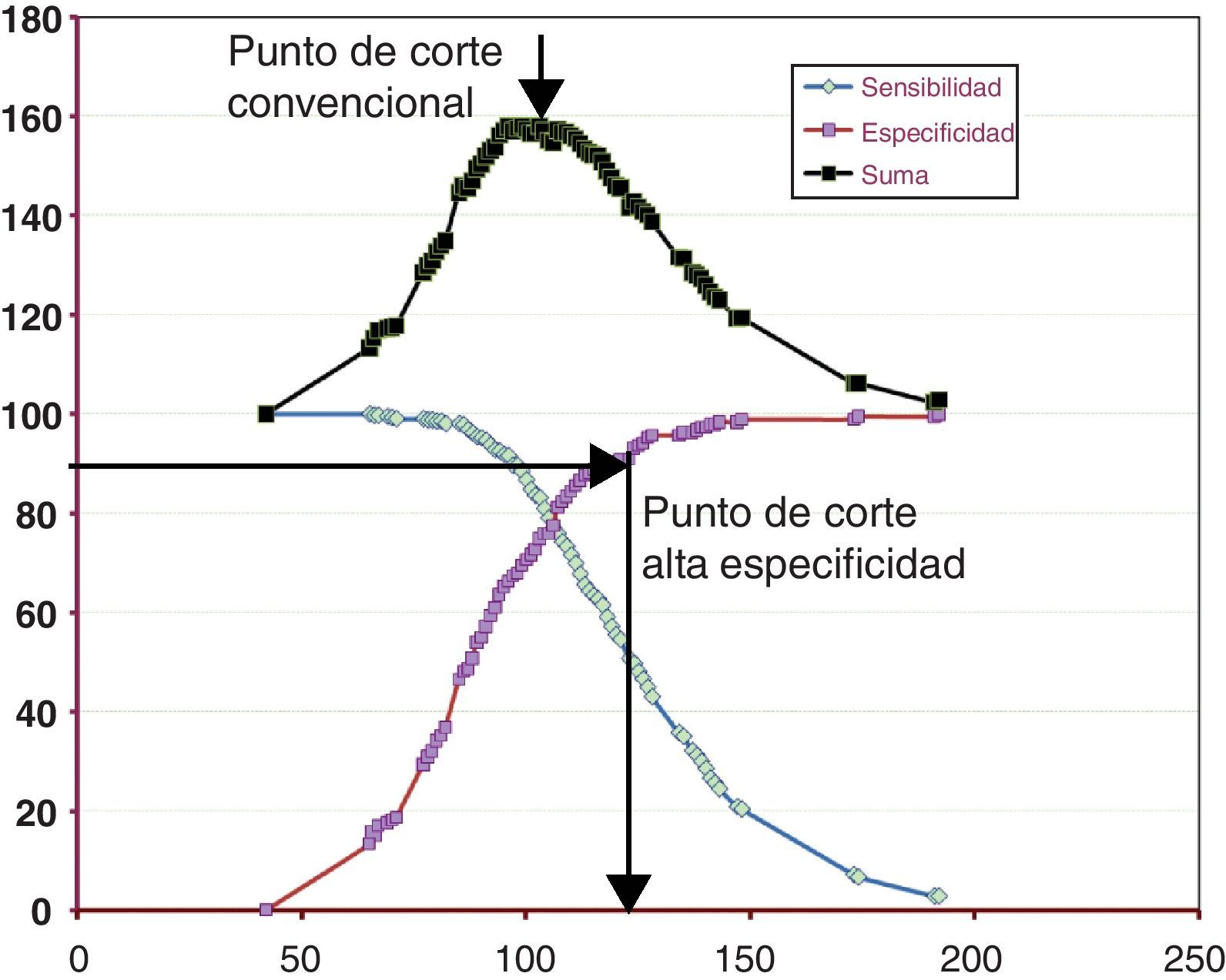
Análisis estadísticosPara análisis descriptivos, se utilizó la media y el intervalo de confianza del 95% de la misma (IC95%) o la desviación típica, según el tipo de análisis. Los pacientes fueron estratificados en función de la magnitud de su concentración de Tg (<200mg/dL, 200-400mg/dL y >400mg/dL), y se realizó un análisis ANOVA para la comparación de las magnitudes de las diferentes variables obtenidas (cLDLf y cLDLu) para cada estrato de Tg. Además, y utilizando los puntos de corte definidos en las recomendaciones actuales (70, 100, 130 y 160mg/dL para el cLDL), se calculó mediante curvas ROC los puntos de corte correspondientes para apoB. Este cálculo se realizó con dos aproximaciones: el punto de corte convencional (valor con máxima suma de sensibilidad y especificidad), y un punto de corte de alta especificidad (AE) considerando para ello la concentración de apoB que superaba una especificidad del 90%. En ambos casos, la población se dicotomizó en dos grupos: los individuos cuya cLDLu se encontraba por encima de cada uno de los valores de decisión del ATPIII y la que se encontraba por debajo de los mismos.
Por otra parte, para las comparaciones entre grupos de riesgo formados, en el caso de c-noHDL, se consideró (como indican las recomendaciones) que los punto de corte eran iguales a los de cLDL aumentados en 30mg/dL. Una vez clasificados los pacientes en función de las magnitudes de los diferentes constituyentes medidos o estimados, se estudió el valor predictivo positivo (VPP) y negativo (VPN) de los puntos de corte seleccionados para cada una de las magnitudes biológicas en estudio. Para todos estos análisis se utilizaron los programas SPSS (PASW statistics v18) y Medcalc V9.
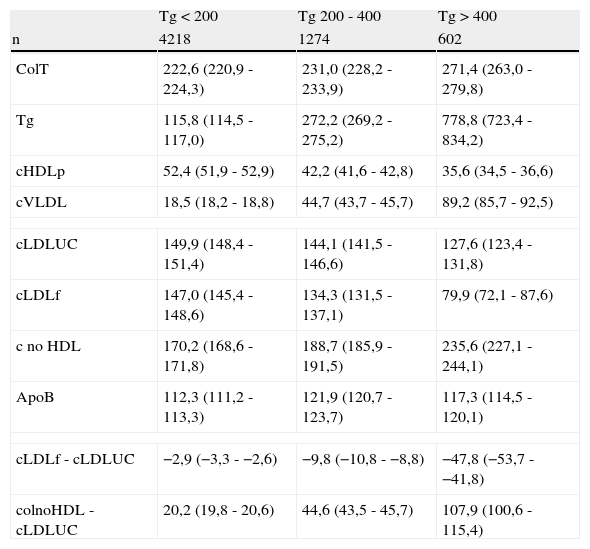
ResultadosDel total de los 6.094 pacientes integrados en el estudio; 4.218, 1.274 y 602 pertenecían a las categorías de Tg<200mg/dL, Tg 200 - 400mg/dL y Tg>400mg/dL, respectivamente. En la tabla 1, se indican las magnitudes medias y el IC95% de las mismas para todos los constituyentes de las lipoproteínas y estratificados por las diferentes categorías de Tg. Como puede observarse, todas las magnitudes fueron significativamente diferentes entre las categorías de Tg formadas, incluyendo las diferencias entre LDLu y LDLf por una parte y LDLu y c-noHDL por otra. También se encontraron diferencias estadísticamente significativas entre cLDLu y cLDLf para cada una de las categorías de Tg estudiadas. Destaca que la diferencia entre c-noHDL y cLDLu no se mantiene en los 30mg/dL recomendados, sino que aumenta progresivamente a medida que aumenta la concentración de Tg. Así mismo, la diferencia entre cLDLf y cLDLu va haciéndose más negativa a medida que la concentración de Tg aumenta.
Magnitudes medidas o estimadas de los constituyentes lipídicos de los pacientes del estudio, estratificadas en función de la concentración de trigliceridos. Los resultados se expresan en mg/dL (media [IC95%])
| Tg<200 | Tg 200 - 400 | Tg>400 | |
| n | 4218 | 1274 | 602 |
| ColT | 222,6 (220,9 - 224,3) | 231,0 (228,2 - 233,9) | 271,4 (263,0 - 279,8) |
| Tg | 115,8 (114,5 - 117,0) | 272,2 (269,2 - 275,2) | 778,8 (723,4 - 834,2) |
| cHDLp | 52,4 (51,9 - 52,9) | 42,2 (41,6 - 42,8) | 35,6 (34,5 - 36,6) |
| cVLDL | 18,5 (18,2 - 18,8) | 44,7 (43,7 - 45,7) | 89,2 (85,7 - 92,5) |
| cLDLUC | 149,9 (148,4 - 151,4) | 144,1 (141,5 - 146,6) | 127,6 (123,4 - 131,8) |
| cLDLf | 147,0 (145,4 - 148,6) | 134,3 (131,5 - 137,1) | 79,9 (72,1 - 87,6) |
| c no HDL | 170,2 (168,6 - 171,8) | 188,7 (185,9 - 191,5) | 235,6 (227,1 - 244,1) |
| ApoB | 112,3 (111,2 - 113,3) | 121,9 (120,7 - 123,7) | 117,3 (114,5 - 120,1) |
| cLDLf - cLDLUC | −2,9 (−3,3 - −2,6) | −9,8 (−10,8 - −8,8) | −47,8 (−53,7 - −41,8) |
| colnoHDL - cLDLUC | 20,2 (19,8 - 20,6) | 44,6 (43,5 - 45,7) | 107,9 (100,6 - 115,4) |
Todas las magnitudes analizadas son significativamente diferentes entre los grupos definidos por los diferentes estratos de concentración de triglicerido.
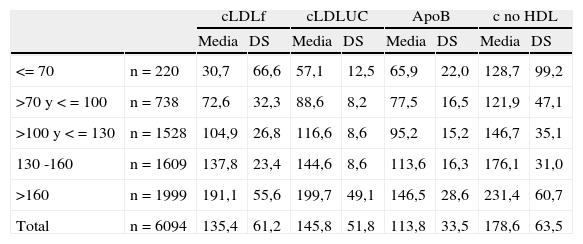
Cuando clasificamos a la población de pacientes en función de los puntos de corte definidos por el ATPIII, se observa (tabla 2) cómo las magnitudes de cada uno de los constituyentes estudiados aumenta a medida que aumenta la concentración de cLDLu. En este caso, también se observa que la concentración estimada de cLDL (cLDLf) siempre es inferior a la medida (cLDLu), mientras que a excepción del estrato de cLDLu inferior a 70mg/dL, el c-noHDL siempre se mantiene aproximadamente 30mg/dL por encima del cLDLu.
Medias y desviación típica (DS) para cada uno de las magnitudes en estudio, en función de los puntos de corte de cLDL (ATPIII)
| cLDLf | cLDLUC | ApoB | c no HDL | ||||||
| Media | DS | Media | DS | Media | DS | Media | DS | ||
| <=70 | n=220 | 30,7 | 66,6 | 57,1 | 12,5 | 65,9 | 22,0 | 128,7 | 99,2 |
| >70 y <=100 | n=738 | 72,6 | 32,3 | 88,6 | 8,2 | 77,5 | 16,5 | 121,9 | 47,1 |
| >100 y <=130 | n=1528 | 104,9 | 26,8 | 116,6 | 8,6 | 95,2 | 15,2 | 146,7 | 35,1 |
| 130 -160 | n=1609 | 137,8 | 23,4 | 144,6 | 8,6 | 113,6 | 16,3 | 176,1 | 31,0 |
| >160 | n=1999 | 191,1 | 55,6 | 199,7 | 49,1 | 146,5 | 28,6 | 231,4 | 60,7 |
| Total | n=6094 | 135,4 | 61,2 | 145,8 | 51,8 | 113,8 | 33,5 | 178,6 | 63,5 |
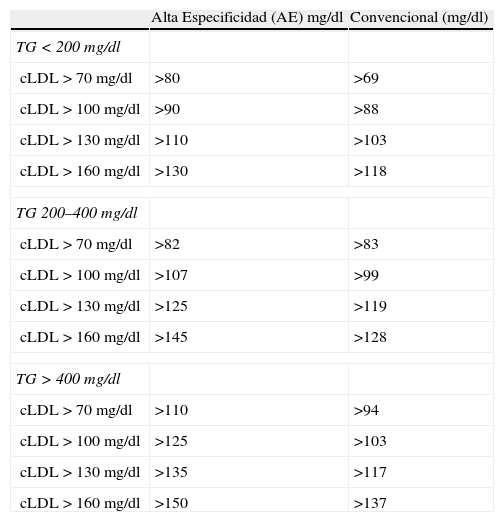
En la tabla 3 se indican los puntos de corte obtenidos, y en la figura 2 un ejemplo de la obtención de uno de los puntos de corte.
Puntos de corte para ApoB (mg/dl)
| Alta Especificidad (AE) mg/dl | Convencional (mg/dl) | |
| TG<200 mg/dl | ||
| cLDL>70 mg/dl | >80 | >69 |
| cLDL>100 mg/dl | >90 | >88 |
| cLDL>130 mg/dl | >110 | >103 |
| cLDL>160 mg/dl | >130 | >118 |
| TG 200–400 mg/dl | ||
| cLDL>70 mg/dl | >82 | >83 |
| cLDL>100 mg/dl | >107 | >99 |
| cLDL>130 mg/dl | >125 | >119 |
| cLDL>160 mg/dl | >145 | >128 |
| TG>400 mg/dl | ||
| cLDL>70 mg/dl | >110 | >94 |
| cLDL>100 mg/dl | >125 | >103 |
| cLDL>130 mg/dl | >135 | >117 |
| cLDL>160 mg/dl | >150 | >137 |
Las curvas representan sensibilidad, especificidad y la suma de ambas, para cada magnitud de apoB tomada como punto de corte en pacientes con Tg superiores a 400mg/dL y con la equivalencia de apoB de 100mg/dl. El punto de corte convencional corresponde a la máxima suma de sensibilidad y especificidad. El punto de corte de alta especificidad (AE) corresponde al primer punto con una especificidad superior al 90%.
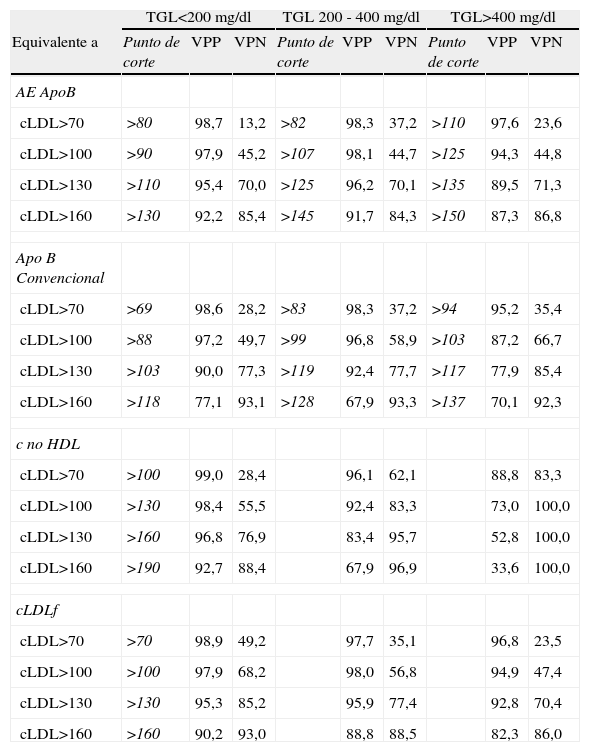
En la tabla 4 se expone los VPP y VPN que se obtuvieron de las magnitudes estudiadas, respecto a los puntos de corte de cLDL y para cada estrato de concentración de Tg.
Valor predictivo de apoB y otras estimaciones, respecto a los puntos de corte de cLDL
| TGL<200 mg/dl | TGL 200 - 400 mg/dl | TGL>400 mg/dl | |||||||
| Equivalente a | Punto de corte | VPP | VPN | Punto de corte | VPP | VPN | Punto de corte | VPP | VPN |
| AE ApoB | |||||||||
| cLDL>70 | >80 | 98,7 | 13,2 | >82 | 98,3 | 37,2 | >110 | 97,6 | 23,6 |
| cLDL>100 | >90 | 97,9 | 45,2 | >107 | 98,1 | 44,7 | >125 | 94,3 | 44,8 |
| cLDL>130 | >110 | 95,4 | 70,0 | >125 | 96,2 | 70,1 | >135 | 89,5 | 71,3 |
| cLDL>160 | >130 | 92,2 | 85,4 | >145 | 91,7 | 84,3 | >150 | 87,3 | 86,8 |
| Apo B Convencional | |||||||||
| cLDL>70 | >69 | 98,6 | 28,2 | >83 | 98,3 | 37,2 | >94 | 95,2 | 35,4 |
| cLDL>100 | >88 | 97,2 | 49,7 | >99 | 96,8 | 58,9 | >103 | 87,2 | 66,7 |
| cLDL>130 | >103 | 90,0 | 77,3 | >119 | 92,4 | 77,7 | >117 | 77,9 | 85,4 |
| cLDL>160 | >118 | 77,1 | 93,1 | >128 | 67,9 | 93,3 | >137 | 70,1 | 92,3 |
| c no HDL | |||||||||
| cLDL>70 | >100 | 99,0 | 28,4 | 96,1 | 62,1 | 88,8 | 83,3 | ||
| cLDL>100 | >130 | 98,4 | 55,5 | 92,4 | 83,3 | 73,0 | 100,0 | ||
| cLDL>130 | >160 | 96,8 | 76,9 | 83,4 | 95,7 | 52,8 | 100,0 | ||
| cLDL>160 | >190 | 92,7 | 88,4 | 67,9 | 96,9 | 33,6 | 100,0 | ||
| cLDLf | |||||||||
| cLDL>70 | >70 | 98,9 | 49,2 | 97,7 | 35,1 | 96,8 | 23,5 | ||
| cLDL>100 | >100 | 97,9 | 68,2 | 98,0 | 56,8 | 94,9 | 47,4 | ||
| cLDL>130 | >130 | 95,3 | 85,2 | 95,9 | 77,4 | 92,8 | 70,4 | ||
| cLDL>160 | >160 | 90,2 | 93,0 | 88,8 | 88,5 | 82,3 | 86,0 | ||
TGL, Trigliceridos; AE ApoB, punto de corte de alta especificidad; ApoB convencional, punto de corte resultante de la máxima suma de especificidad y sensibilidad; c no HDL, colesterol no HDL, el punto de corte recomendado es 30mg superior al de cLDL; cLDLf, colesterol de LDL estimado mediante la fórmula de Friedewald; VPP, Valor predictivo positivo; VPN, Valor predictivo negativo.
Si bien la estimación del RCV no está basada en la magnitud de la concentración de cLDL, sino en la presencia e intensidad del resto factores de riesgo mayores8, las decisiones de intervención se toman en función de unos objetivos de cLDL concretos que dependen del nivel de riesgo individual. No obstante, la cuantificación del colesterol de LDL requiere una metodología (UC) que no suele estar disponible en la mayor parte de los laboratorios clínicos, ni siquiera en la versión simplificada recomendada por el CDC10. Esta última cuestión hace que habitualmente se estime la magnitud del cLDL mediante su cálculo a través de la fórmula de Friedewald, o incluso se recomiende el uso del c-noHDL8.
Si bien algunos autores y organizaciones nacionales empiezan a considerar a la apoB como una magnitud que debería desplazar a la de cLDL15,19 para minimizar las limitaciones ya mencionadas, esta opinión no está totalmente consolidada, tanto por el hecho de formar parte de más de una lipoproteína, como por el hecho de que VLDL y LDL (lipoproteínas con apoB) no tienen el mismo significado aterogénico. Por este motivo en este trabajo nos hemos propuesto analizar la posible utilidad de la cuantificación de apoB, no como medida alternativa a la del cLDLu pero predictiva de la misma, y comparar los resultados obtenidos con los que se obtienen con las otras aproximaciones disponibles.
Como puede observarse en la tabla 1, una de las razones de que el cLDLf, aún siendo de un uso prácticamente universal, cree un elevado grado de incertidumbre es que a medida que aumenta la magnitud de la concentración de Tg, presenta resultados cada vez más disminuidos en relación con el cLDLu, de tal forma que cuando las concentraciones de Tg son >200mg/dL el cLDLf está lejos de cumplir los objetivos analíticos de sesgo <4% y error total <12% recomendado por el NCEP. Esta diferencia progresiva hace que con concentraciones de Tg elevados, el paciente aparente estar más cerca de su objetivo terapéutico de lo que realmente está (midiendo el cLDLu) y pueda dar lugar a errores que pueden justificar una pequeña parte del denominado como «riesgo residual» por algunos autores.
Por otra parte, si hacemos caso de las recomendaciones del ATPIII8 y utilizamos la magnitud del c-noHDL, nos encontramos con el efecto contrario: para bajas concentraciones de Tg, las diferencias entre cLDLu y c-noHDL pueden ser incluso inferiores a las recomendadas, pero a medida que se incrementa la magnitud de la concentración de Tg, estas diferencias aumentan claramente a favor del c-noHDL y la situación del paciente puede parecer mucho peor de lo que realmente es (si la estimamos en función de los puntos de corte de cLDL+30mg/dL).
Teniendo en cuenta los dos datos anteriores, no es extraño que algunos autores hayan reclamado el uso de la apoB como «sustituto» del cLDLu, e incluso la American Diabetes Association (ADA)20 haya propuesto unos puntos de corte de 80 y 90mg/dL como equivalentes a cLDLu de 70 y 100mg/dL respectivamente en pacientes diabéticos o con síndrome metabólico. En nuestro estudio, hemos obtenido los puntos de corte de apoB (tabla 3) que previsiblemente podrían clasificar a la población como portadores de concentraciones de cLDL superiores o inferiores a los limites recomendados (70, 100, 130 y 160mg/dL) por el ATPIII, mediante dos sistemas: obteniendo el punto de corte convencional, y un punto de corte de alta especificidad (ambos estratificados por la concentración de Tg), y los hemos comparado con el resto de estimaciones. Nuestros resultados (tabla 4) aconsejan que en pacientes con Tg >200mg/dL se utilicen los puntos de corte de alta especificidad, ya que aportan un elevado VPP, es decir, que si un paciente presenta una magnitud de la concentración de apoB superior a esos puntos de corte, tiene una muy elevada probabilidad de que su cLDL sea también superior al punto de corte equivalente. No obstante, el VPN es relativamente bajo (como es lógico al desplazar el punto de corte hacia una especificidad elevada), y en el caso de querer descartar que un paciente tenga una cLDL elevada es preferible utilizar otras aproximaciones, entre las que destaca la del c-noHDL, con VPN muy elevadas si utilizamos los puntos de corte recomendados por el ATPIII. También es de destacar que los puntos de corte obtenidos para apoB (AE) coinciden con los del ADA20 únicamente cuando los Tg son inferiores a 200mg/dL (que precisamente es el caso en el que no es necesario su uso), mientras que para pacientes con Tg entre 200 y 400mg/dL o superiores a 400mg/dL, estos puntos de corte se elevan progresivamente. Si mantuviéramos los puntos de corte anteriormente mencionados (80 y 90mg/dL) para pacientes con Tg >400mg/dL, la sensibilidad aumentaría hasta el 95%, pero la especificidad bajaría a aproximadamente un 50%.
Es evidente que siempre es necesario llegar a algún tipo de «acuerdo» entre sensibilidad y especificidad en el momento de establecer un punto de corte como predictivo de «algo». En nuestro caso, creemos que es preferible un VPP elevado que permita que no omitamos a «pacientes» que es conveniente tratar o intensificar el tratamiento, a utilizar puntos de corte de alta sensibilidad con un alto riesgo de realizar un exceso de intervención.
ConclusionesA partir de los resultados de nuestro estudio, puede concluirse que en pacientes con Tg <200mg/dL puede utilizarse prácticamente sin riesgo la fórmula de Friedewald; en pacientes con Tg elevados es recomendable la apoB (puntos de corte de AE) como predictor positivo y el c-noHDL como predictor negativo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo corresponde a una comunicación científica presentada y premiada con accésit en el IV Congreso Nacional del Laboratorio Clínico celebrado en Zaragoza del 20 al 22 de octubre de 2010.