El tracto genital femenino ejecuta un análisis de semen particular, identificando y seleccionando el mejor espermatozoide para la fecundación. Este análisis in vivo trata de asegurar que la descendencia reciba el material genético de mejor calidad. La selección artificial de espermatozoides implica eliminar las barreras naturales con las que se encuentra el gameto masculino en su largo recorrido.
Las técnicas convencionales de selección de espermatozoides que se emplean en reproducción asistida (swim-up y gradientes de densidad específicos), se fundamentan en la recuperación o selección de los espermatozoides con mejor movilidad y morfología, pero no distinguen espermatozoides funcionalmente capaces de fecundar ni genéticamente normales.
El objetivo de las técnicas avanzadas es seleccionar el espermatozoide con las mejores características funcionales para ICSI o FIV y conseguir una progenie sana. La introducción de nuevas técnicas en el Laboratorio de Andrología podría suponer un salto cualitativo en los resultados en reproducción.
The female genital tract performs a particular sperm analysis, identifying and selecting the best sperm for fertilization. This in vivo analysis seeks to ensure that the offspring receives the best genetic material. Through artificial sperm selection, natural barriers along the female tract are skipped.
Conventional selection techniques used in assisted reproduction are based on sperm motility and morphology, not distinguishing between fecundating ability or genetic normality.
The object of advanced sperm selection techniques is to retrieve the spermatozoa with better functional characteristics for intracytoplasmic sperm injection or in vitro fertilization. The introduction of these techniques in the andrology laboratory might represent a qualitative leap in assisted reproduction results.
La disfunción espermática está implicada en la esterilidad en más del 40% de las parejas que solicitan tratamiento1,2. El análisis básico de semen es la prueba complementaria que más información aporta en el diagnóstico y pronóstico andrológico pero, excepto en casos extremos, no estima el potencial fértil del individuo.
El tracto genital femenino ejecuta un análisis de semen particular, identificando y seleccionando el mejor espermatozoide para la fecundación. Este análisis in vivo trata de asegurar que la descendencia reciba el material genético de mejor calidad3.
La selección artificial de espermatozoides implica eliminar las barreras naturales con las que se encuentra el gameto masculino en su largo recorrido (tabla 1). En la inseminación intrauterina, se obvia el filtro preciso que supone el moco cervical. En la fecundación in vitro (FIV), de un pool de espermatozoides, se selecciona el primero que penetra el ovocito. La inyección citoplásmica de un espermatozoide (ICSI) supone un desafío al paradigma de la evolución, la selección la realiza el operador en base a criterios subjetivos. Se emplean gametos que tendrían una probabilidad muy baja de éxito en reproducción natural. Es posible conseguir gestación empleando espermatozoides de «peor calidad» pero es necesario definir qué características están presentes en la célula que puedan impactar negativamente el desarrollo fetal.
Funciones del espermatozoide y técnicas de reproducción
| COITO | IUI | FIV | ICSI | |
|---|---|---|---|---|
| Interacción con el moco cervical | ✓ | × | × | × |
| Transporte a través del útero | ✓ | × | × | × |
| Paso por el itsmo tubárico | ✓ | ✓ | × | × |
| Contacto con el epitelio de la trompa | ✓ | ✓ | × | × |
| Hiperactivación | ✓ | ✓ | × | × |
| Penetración de la zona pelúcida | ✓ | ✓ | ✓ | × |
| Descondensación del ADN, actividad del centrosoma, ARN y proteínas espermáticas | ✓ | ✓ | ✓ | ✓ |
FIV: fecundación in vitro; ICSI: inyección intracitoplásmica de espermatozoide; IUI: inseminación intrauterina.
La microinyección es la técnica de fecundación más agresiva con una tasa de niño en casa en torno al 30%4. Estos resultados apuntan a que la activación del ovocito y el desarrollo embrionario pueden no ocurrir e incluso, espermatozoides con daños en el núcleo, podrían fertilizar ovocitos y causar abortos.
Las técnicas convencionales de selección de espermatozoides que se emplean en reproducción asistida (swim-up y gradientes de densidad específicos), se fundamentan en la recuperación o selección de los espermatozoides con mejor movilidad y morfología, pero no distinguen espermatozoides funcionalmente capaces de fecundar ni genéticamente normales. Los test diagnósticos funcionales podrían dar respuesta a algunos diagnósticos de infertilidad idiopática. Pero, como la ICSI trata la mayoría de las deficiencias diagnosticadas con estos test, los resultados obtenidos no necesariamente influyen en las decisiones del clínico.
El objetivo de las técnicas avanzadas es seleccionar el espermatozoide con las mejores características funcionales para ICSI o FIV y conseguir una progenie sana. La introducción de nuevas técnicas en el Laboratorio de Andrología podría suponer un salto cualitativo en los resultados en reproducción.
El laboratorio clínico proporciona el soporte fundamental para la manipulación de gametos y su empleo en reproducción.
Objeto y campo de aplicaciónEl objetivo principal de este documento es revisar algunos de los métodos avanzados de selección de espermatozoides disponibles. Hemos seleccionado los métodos que tienen mayor impacto bibliográfico, puesto que la aplicación de la mayoría de ellos es muy limitada.
Desde la Comisión de Andrología y TRA, consideramos que este documento puede aportar una base de conocimiento que facilitará posteriores revisiones y actualizaciones sobre los métodos de selección de espermatozoides.
La selección de espermatozoides vivos inmóviles para microinyección se tratará en un documento específico sobre vitalidad.
El campo de aplicación de este documento son todos aquellos laboratorios en los que se realicen técnicas de reproducción asistida.
Test funcionales y métodos de selección espermáticaEl espermatozoide maduro es una célula altamente especializada. En el proceso de la espermiogénesis, las espermátidas se transforman de célula redonda con actividad nuclear, a célula con flagelo y un núcleo fuertemente compactado inactivo. Esta morfología le proporciona una hidrodinámica favorable para el movimiento y la penetración del ovocito, además de proteger el ADN durante el transporte. La cromatina se compacta en toroides con un 90% de protaminas y un 10% de histonas, confiriéndole resistencia a nucleasas pero impidiendo la autorreparación del ADN. La compactación del ADN es un proceso muy conservado en la evolución y un prerrequisito para la trasmisión del genoma masculino a las siguientes generaciones.
La apoptosis tiene un papel principal en la regulación del desarrollo de la línea germinal, es el mecanismo de eliminación de las células dañadas en los tubos seminíferos. Durante la espermatogénesis más del 75% de los espermatozoides sufren apoptosis pero algunos pueden escapar a este proceso y formar parte del eyaculado5. Los espermatozoides con cromatina anormal inician el proceso de apoptosis perdiendo su capacidad reproductiva. El porcentaje de fragmentación del ADN espermático se ha sugerido como un marcador independiente de la fertilidad masculina6. Hasta la fecha, los ensayos que evalúan la fragmentación del ADN no permiten recuperar los espermatozoides analizados, siendo solo de aplicación diagnóstica.
Los espermatozoides maduros a pesar de encontrarse en situación transcripcionalmente inerte poseen una población de ARN estable. Estos ARN se liberan durante la fecundación en el citoplasma del ovocito y se cree que contribuyen extragenómicamente al desarrollo embrionario temprano7. Existen cada vez más evidencias de que diversas modificaciones epigenéticas como metilación anormal, desequilibrio entre histonas/protaminas y retención de ARN, se asocian con infertilidad masculina, alteración en las primeras etapas del desarrollo embrionario y aborto8,9.
En la actualidad, los microarrays empleados para estudios genómicos, proteómicos y metabolómicos son de uso exclusivo para investigación. Al inconveniente de las dificultades técnicas para incorporar esta tecnología a la práctica diaria, hay que sumar la dificultad en alcanzar un patrón modelo dada la alta variabilidad biológica intra- e interindividual de las muestras de semen10. Son necesarios estudios para desarrollar técnicas de uso clínico con suficiente garantía de reproducibilidad y valor diagnóstico.
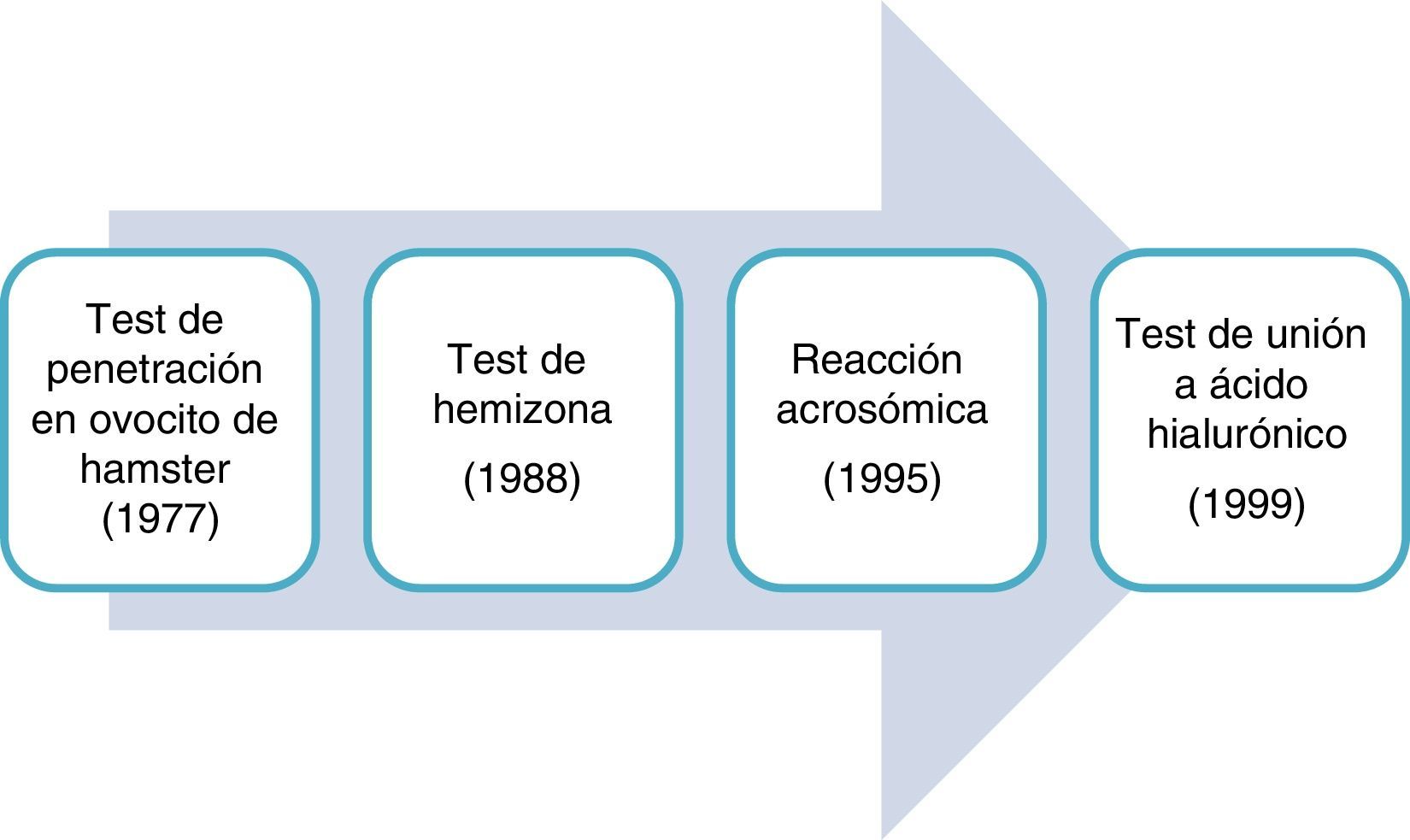
La capacidad de unión del espermatozoide al ovocito ha sido objeto de investigación desde mediados de los años 70 (fig. 1). Los primeros test de función espermática no tuvieron apenas implantación en los laboratorios clínicos debido a su alto coste, complejidad, falta de estandarización y pobre correlación con resultados en reproducción.
El test de penetración de espermatozoides fue descrito por Yanagimachi et al. en 1976 con el objeto de examinar la capacidad del espermatozoide de penetrar ovocitos de hámster sin zona11. El ensayo pretende analizar cuatro pasos del proceso de fertilización: capacitación, reacción acrosómica, fusión con el ovocito y descondensación del espermatozoide. Tras años de uso, los resultados muestran alta sensibilidad y pobre especificidad. La baja reproducibilidad y falta de estandarización metodológica no favorecen su uso para evaluar el potencial fértil12.
El test de la hemizona evalúa la unión del espermatozoide a la zona pelúcida del ovocito humano. Tiene un valor predictivo negativo alto (93%) para gestación clínica13. Quizás el test de unión a ácido hialurónico (HA) sea la evolución del test de hemizona, más simplificado, asequible y accesible14,15 (ver apartado Selección por unión a moléculas: ácido hialurónico).
La reacción acrosómica del espermatozoide supone la secreción por exocitosis de enzimas proteolíticas para penetrar la zona pelúcida y el remodelamiento de la superficie del espermatozoide para la fusión con el ovocito16. Se observa por microscopia de fluorescencia utilizando lectinas marcadas con fluorocromos que se unen a la membrana acrosómica o al contenido del acrosoma. Es necesario diferenciar entre reacción acrosómica espontánea, que tiene una prevalencia ∼4%, de la inducida por ionóforos o progesterona. Además de esta limitación, la inducción mediante ionóforos, al no ser fisiológica, no desencadena el sistema de activación señal-receptor objeto del estudio. Este problema no aparece con el empleo de progesterona que induce la reacción acrosómica y el desarrollo de patrones de movilidad de hiperactivación17. Los test de inducción de AR explican fallos de FIV pero no se correlacionan con tasas de gestación natural.
Las estrategias para seleccionar el mejor espermatozoide se basan en la madurez del espermatozoide, integridad de sus estructuras y del ADN y/o en la eliminación de los apoptóticos. El objetivo de las nuevas técnicas de selección, no es conseguir el mayor número de espermatozoides con movilidad y morfología idóneas, sino poder seleccionar al espermatozoide con la dotación genética más íntegra, con el que conseguir un recién nacido sano. Como el fin de los gametos seleccionados es la ICSI, a diferencia de las técnicas convencionales, en las avanzadas el rendimiento, expresado como el número de espermatozoides recuperados, es significativamente inferior.
Métodos basados en la ultramorfología espermáticaExamen morfológico de organelas de espermatozoides móvilesEl examen morfológico de organelas espermáticas in vivo se conoce como Motile Sperm Organelle Morphological Examination (MSOME) y surge de la necesidad de seleccionar el mejor espermatozoide para microinyectarlo.
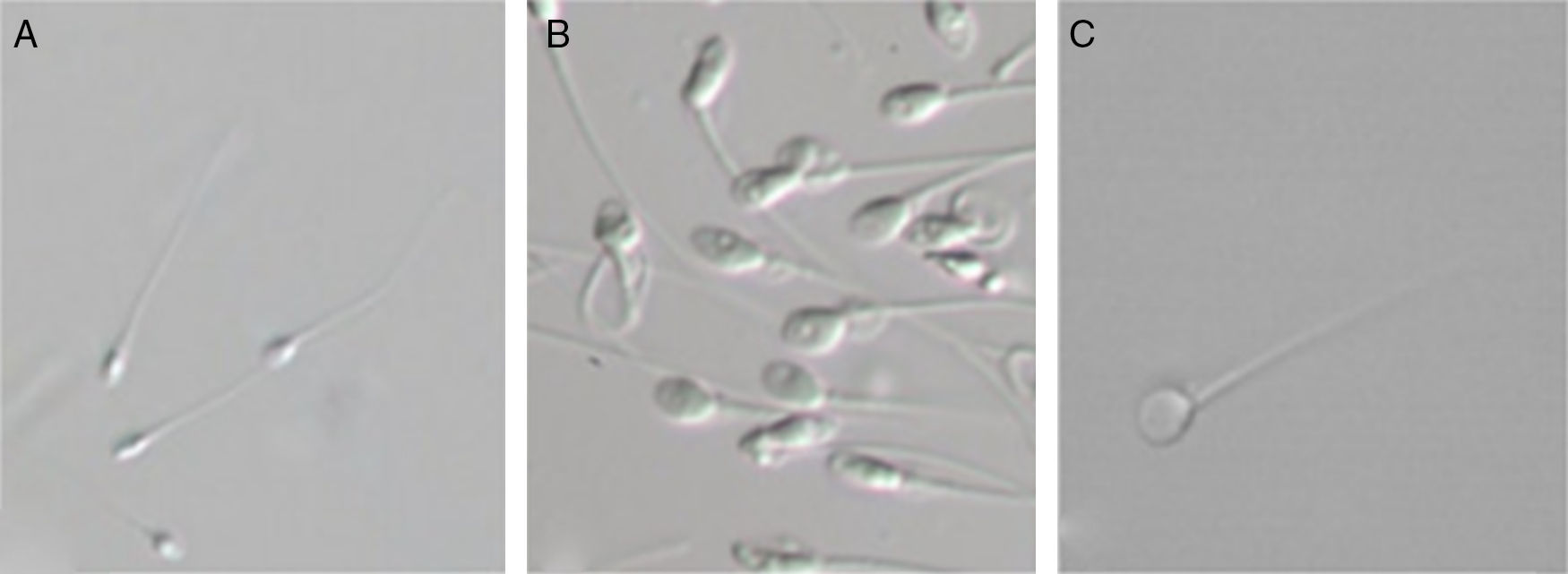
El microscopio de contraste por interferencia diferencial, también denominado microscopio Nomarski, permite obtener información sobre la densidad óptica de los espermatozoides. Emplea luz polarizada que pasa por dos prismas birrefringentes que la fraccionan en dos rayos cuyos trayectos e índices de refracción son diferentes, dando como resultado una imagen de la célula en relieve, que corresponde a variaciones de la densidad óptica. Habitualmente la selección de espermatozoides se realiza a una magnificación de 400X. El empleo de un microscopio interferencial con lentes de alto poder y el aumento digital de la imagen permite alcanzar los 6300X de forma que se puede examinar minuciosamente cada espermatozoide y valorar sus organelas. Se observa que el núcleo de algunos espermatozoides contiene vacuolas que no se distinguen a menor magnificación18 (fig. 2).
Espermatozoides vivos observados a una magnificación 400X para ICSI A) y magnificación >6000X para IMSI B) y C). Presencia de vacuolas en B). Espermatozoide sin vacuolas en C). Tomado de Marci et al.18.
Se proponen nuevos criterios morfológicos en los que se valoran: acrosoma, lámina postacrosomal, cuello, mitocondrias, cola y núcleo19. Los espermatozoides con más vacuolas se relacionan con un empaquetamiento defectuoso de la cromatina y teratozoospermia convencional20.
Los primeros trabajos se publicaron en el año 2002 por Bartoov y sus colaboradores y proponen el empleo de MSOME en teratozoospermias severas, fallos previos de ICSI, fallos de implantación y abortos de repetición19.
Los inconvenientes de esta técnica son: el equipamiento sofisticado y costoso, la necesidad de contar con personal altamente especializado y la gran inversión de tiempo necesarios para procesar las muestras.
Una publicación reciente demuestra que no supone una mejora significativa para el diagnóstico de infertilidad en el hombre21.
Más de una década de experiencia en el empleo de MSOME y la microinyección de espermatozoides seleccionados morfológicamente (IMSI) han mostrado que los resultados tanto en gestación como en recién nacidos sanos son comparables a la ICSI tradicional22.
Método basado en la birrefringenciaEl microscopio de luz polarizada es un microscopio óptico que tiene dos polarizadores dispuestos perpendicularmente entre sí que dejan pasar únicamente la luz que vibra en un solo plano. Cuando la luz penetra una estructura anisotrópica, se refracta en dos rayos polarizados que viajan a diferentes velocidades. El retardo del rayo más lento en comparación con el rápido es lo que genera el efecto de birrefringencia. Se analizan las diferentes partes del espermatozoide: núcleo, acrosoma, y flagelo, basándose en las propiedades anisotrópicas de las diferentes estructuras.
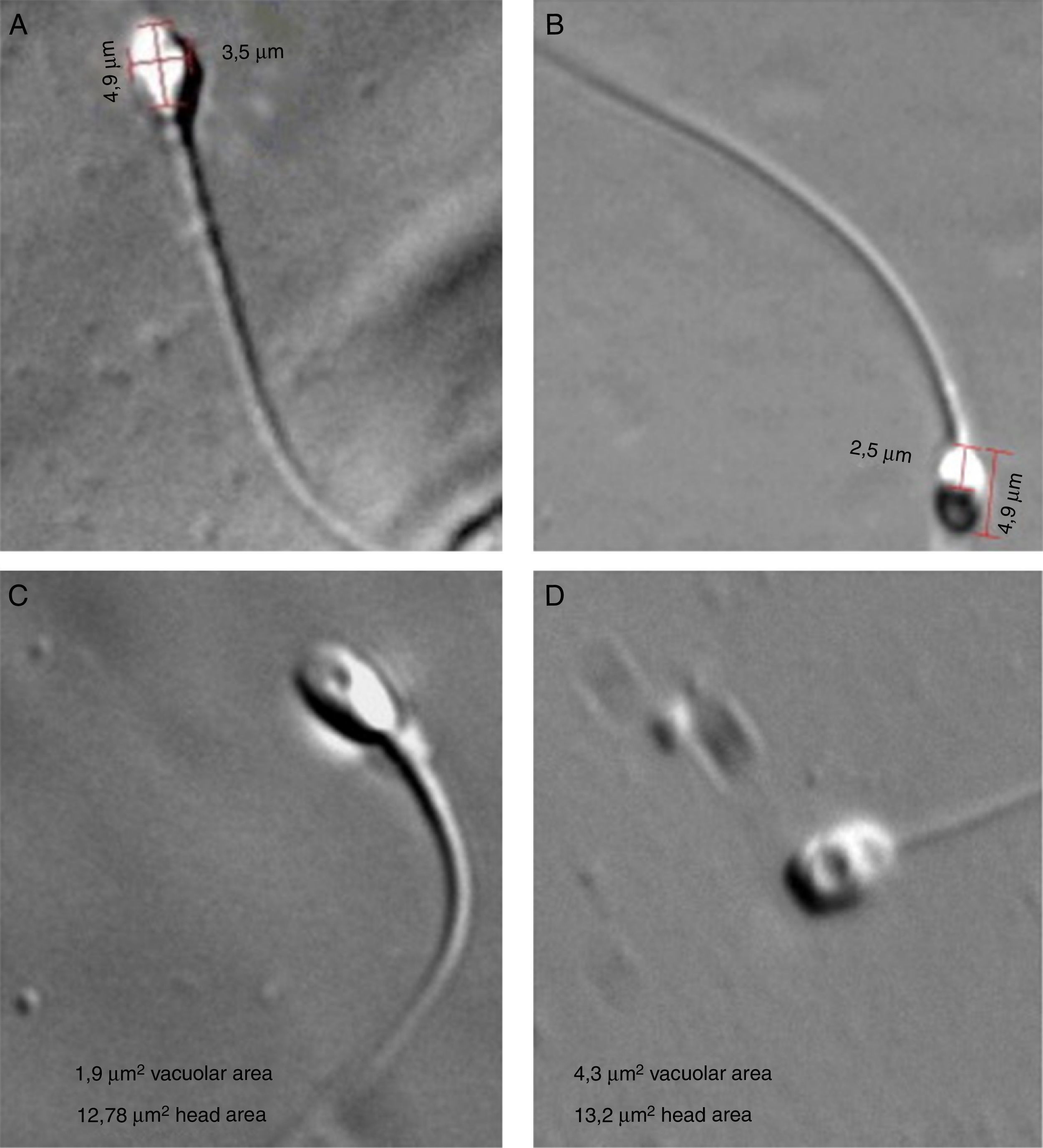
La birrefringencia natural de la cabeza del espermatozoide puede ser atribuida al estado de la reacción acrosómica, donde los espermatozoides que no han reaccionado tienen birrefringencia en la cabeza entera, mientras que los que ya han sufrido reacción acrosómica solo muestran birrefringencia en la región postacrosomal23 (fig. 3).
Observación de cabeza de espermatozoides con luz polarizada (magnificación x630). A) Espermatozoide con morfología normal muestra birrefringencia total de la cabeza. B) Espermatozoide con morfología normal con birrefringencia parcial en la region postacrosomal. C) Presencia de vacuolas en un espermatozoide parcialmente birrefringente con morfología normal; la vacuola ocupa el 15% del volumen de la cabeza. D) Estructura vacuolar grande que cubre el 33% de una cabeza de espermatozoide no birrefringente. Tomado de Magli et al23.
La ICSI provoca una disrupción mecánica de la zona pelúcida y el oolema, no siendo teóricamente necesario haber sufrido la reacción acrosómica para inducir la activación del ovocito, descondensación del ADN espermático y formación del pronúcleo. Aunque la fertilización es similar cuando se emplean espermatozoides reactivos y no reactivos, se ha demostrado que la tasa de implantación es significativamente superior con espermatozoides que ya han sufrido la reacción acrosómica24.
Además de requerir un equipamiento costoso, la desventaja de esta técnica de selección es que pocos grupos la emplean y aún necesita ser validada en la clínica.
Microespectroscopía de RamanEn microscopia óptica convencional, el reflejo de la luz cuando atraviesa un objeto se dispersa, en función de la densidad del cuerpo, dando lugar a una imagen difuminada o incluso borrosa en dos dimensiones. El microscopio confocal evita la dispersión de la luz iluminando un punto concreto de la muestra en estudio cada vez. El tratamiento de los datos genera cortes ópticos e incluso imágenes tridimensionales (fig. 4).
La unión del microscopio confocal con un espectrómetro ofrece muchas posibilidades para el estudio y selección de espermatozoides.
En la representación hiperespectral o imagen química del espermatozoide, se detecta la huella química de las diferentes partes: se distingue el núcleo de color rojo, las proteínas de color azul y la superposición de ADN y proteínas en verde. El ADN mitocondrial de la porción intermedia también se distingue en rojo.
La microespectrometría de Raman puede aportar información detallada sobre la eficiencia del empaquetamiento del ADN de una sola célula examinando el espectro láser25.
Aunque las aplicaciones de esta técnica se multiplican en biología y medicina, lo cierto es que aún no se dispone de una base de datos suficiente de espectros químicos. Para el empleo de la microespectroscopía de Raman en la práctica clínica son necesarios más trabajos que confirmen el rango de seguridad de exposición al láser y la duración de la misma. Pese a la escasa experiencia, parece ser una técnica prometedora para la evaluación de espermatozoides y tejido testicular.
Selección basada en la madurez del espermatozoideSelección basada en carga eléctricaDurante la maduración epididimaria, mediante epididimosomas y prostasomas los espermatozoides humanos adquieren una red de glicopolipéptidos, mayoritariamente CD52, altamente sialidados y cargados negativamente (entre -16 y-20mV). Este potencial facilita la interacción de los espermatozoides con el ambiente extracelular, impidiendo que se aglutinen o se unan inespecíficamente a sitios del tracto reproductor femenino26. El nivel de expresión de estas proteínas se correlaciona con el porcentaje de formas normales y capacitación27.
Basándose en su carga eléctrica negativa, es posible separar espermatozoides mediante el potencial zeta y técnicas de electroforesis.
Potencial ZEl potencial zeta o electrocinético describe la intensidad del campo eléctrico estático entre la superficie del espermatozoide y el medio en el que está suspendido. Los espermatozoides maduros tienen un potencial zeta que oscila entre -16 y -20mV por lo que son capaces de adherirse a una superficie cargada positivamente.
Por su carga negativa, los espermatozoides son capaces de unirse a tubos de plástico o cristal cuando el medio de cultivo no está suplementado con suero o albúmina. Teóricamente los espermatozoides con el ADN fragmentado tienen una carga eléctrica más positiva y no se unirían a las superficies.
La facilidad para realizar la separación de espermatozoides morfológicamente maduros con ADN íntegro y condensado, capaces de hiperactivarse, la rapidez y su bajo coste son las ventajas de este método. Entre los inconvenientes destaca su bajo rendimiento, se recuperan muy pocos espermatozoides por lo que no es de elección en muestras oligozoospérmicas. Además, dado que los espermatozoides de cromosoma X tienen más carga negativa que los de cromosoma Y, parece que hay una tendencia a seleccionar espermatozoides X28. La validación clínica y el empleo de este método son limitados.
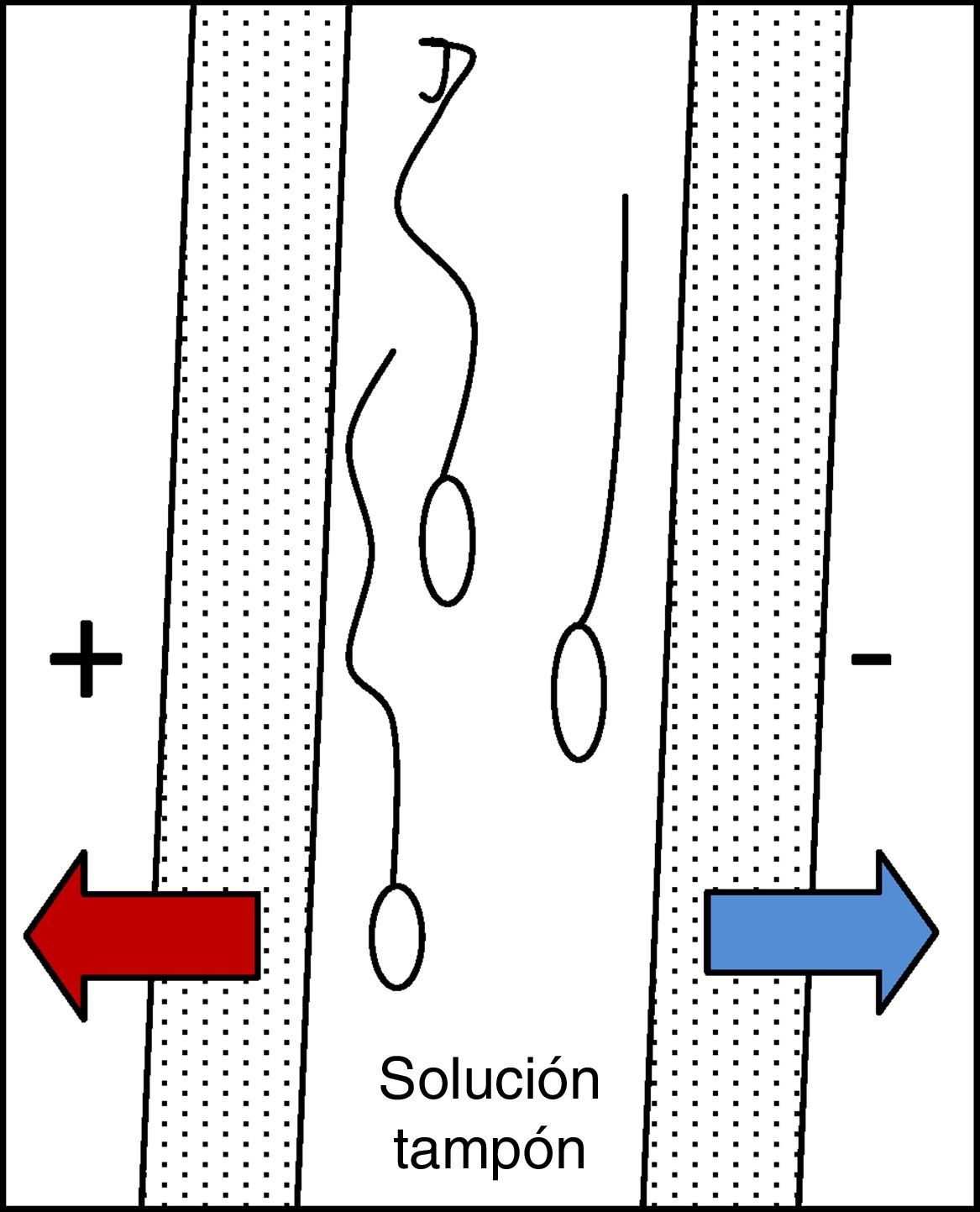
ElectroforesisEl aislamiento de espermatozoides por electroforesis se basa en el tamaño y la carga eléctrica. A mayor electronegatividad, mejor es la calidad de los espermatozoides en términos de morfología, capacitación e integridad del ADN29. El sistema consiste en una cámara dividida en dos por un filtro de policarbonato de 5μm unido a una membrana de poliacrilamida que permite el tránsito de electrólitos (fig. 5). La muestra se carga en una solución tampón y se aplica una corriente continua de 75mA con un voltaje variable entre 18 y 21V. El aislamiento de espermatozoides es rápido y eficiente incluso para muestras de biopsia testicular, consiguiendo separar selectivamente aquellos con mejor movilidad, vitalidad y morfología.
Esquema de una cámara de electroforesis para separación de espermatozoides.
Se inocula la muestra en la cámara previamente cargada con una solución tampón y se aplica una corriente continua de 75mA con un voltaje variable (18-21V). En pocos min se consigue separar la población de espermatozoides de mejor calidad del resto de espermatozoides y células.
Aunque son necesarios más estudios para determinar la validez clínica del método, ya se han publicado resultados positivos30.
MicroelectroforesisUna nueva variante es la microelectroforesis, un método que determina la carga electrostática de espermatozoides a nivel individual. El objetivo es aislar espermatozoides maduros sin daño en el ADN y a tiempo real para poder emplearlos en ICSI.
El equipo de microelectroforesis consta de tres partes: fuente de alimentación, electrodos de platino reutilizables y unidad de electroforesis desechable. Esta última tiene a su vez una unidad de electroforesis y dos cámaras para inyección de ovocitos.
En una primera fase, se deben separar los espermatozoides mediante gradientes de densidad discontinuos para eliminar células somáticas, restos celulares y lavar el exceso de proteínas glicosiladas de la superficie de los espermatozoides.
La técnica consiste en añadir al tampón de electroforesis, espermatozoides lavados y aplicar una corriente eléctrica gradual de 6 a 14mA. De este modo, se separan espermatozoides con carga negativa, neutra y positiva. Los espermatozoides de carga negativa se emplean para ICSI31.
Cámara de microfluidosLas cámaras de microfluidos tratan de mimetizar el paso de los espermatozoides a través del tracto reproductor femenino. Constan de un número variable de cámaras interconectadas por una red de microcanales. Los cambios de impedancia que se producen cuando pasa un espermatozoide aportan información sobre el tamaño celular32,33 e incluso pueden caracterizar parámetros de movilidad34.
Existen varios dispositivos patentados pero aún los resultados publicados son escasos y no están validados clínicamente.
Selección por unión a moléculas: ácido hialurónicoEl ácido hialurónico (HA) es un componente mayoritario del cúmulo oóforo, moco cervical y fluido folicular. Durante la espermatogénesis, las espermátidas elongadas expresan chaperonas, la membrana plasmática sufre una remodelación expresando sitios de unión a ácido hialurónico y a la zona pelúcida. Se presume que estos sitios son los responsables de la penetración del espermatozoide en la capa de células del cúmulo oóforo. Huszar et al. muestran la asociación entre la presencia de receptores de ácido hialurónico en la membrana y la madurez del espermatozoide35. Los espermatozoides inmaduros tienen niveles más bajos de chaperonas (HspA2), más incidencia de anormalidades cromosómicas y no son capaces de unirse a HA en fase sólida. Por tanto, la unión a HA permitiría la selección funcional de espermatozoides maduros con niveles más bajos de aneuploidías36.
El término PICSI® (Origio, Dinamarca) son las siglas de ICSI fisiológica (physiological ICSI), así llamada por el potencial para mimetizar la selección natural de espermatozoides. La PICSI® se realiza empleando una placa de Petri que contiene HA inmovilizado.
Entre las limitaciones de esta técnica de selección se encuentran:
- •
Requiere una selección previa de espermatozoides por técnicas convencionales.
- •
La firme unión de los espermatozoides a HA obliga a desprenderlos manualmente.
- •
Los ensayos clínicos concluyen que existe evidencia insuficiente en relación con mejores resultados de embarazo y nacidos vivos. Son necesarios más estudios para recomendar su uso clínico37.
- •
No hay datos sobre posibles efectos adversos.
Varios trabajos han examinado el valor predictivo de los ensayos de unión a HA y los resultados en reproducción asistida. Las conclusiones son inconsistentes: Kovacs et al., no encuentran ventajas con respecto a la ICSI convencional38, mientras que Nijs et al. observan una disminución en la tasa de abortos aunque no establecen un valor discriminante y por tanto no recomiendan su uso de forma rutinaria39.
Gradiente picomolar de progesteronaLa progesterona después de la ovulación es secretada por las células del cúmulo y difunde formando un gradiente de concentración desde las capas más superficiales hasta el interior donde se encuentra el ovocito. Un gradiente de muy baja concentración (picomolar) es suficiente para atraer el espermatozoide. Este método se basa en la capacidad del espermatozoide de dirigirse al ovocito mediante el estímulo quimiotáctico de la progesterona.
La cámara de quimiotaxis contiene dos pocillos separados, en uno se coloca una concentración de progesterona 10 pM y en el otro la suspensión de espermatozoides. Tras 15 min de incubación, se recuperan los espermatozoides que han migrado al pocillo con la solución de progesterona.
Los espermatozoides seleccionados muestran un aumento de los niveles de marcadores de capacitación: fosforilación de la tirosina, reacción acrosómica inducida por ionóforo; niveles más bajos de estrés oxidativo y menor porcentaje de ADN dañado40.
Selección basada en el estado de apoptosisSelección celular por activación magnéticaLa apoptosis es un proceso dominante durante la espermiogénesis. Solo el 25% de los espermatozoides formados alcanzan el eyaculado. La explicación más plausible es la escasa competencia espermática entre hombres dentro de un mismo ciclo ovulatorio. La presencia de el eyaculado de Fas, fosfatidilserina, Bcl-XL y p53 se ha demostrado en diferentes estudios41,42. En células viables, la fosfatidilserina está en la capa interna de la membrana celular, en células apoptóticas, en la externa. Los espermatozoides que muestran marcadores apoptóticos de membrana se asocian con daño en el material genético y morfología pobre.
La anexina-V es una proteína de aproximadamente 35kDa con alta afinidad por la fosfatidilserina cargada negativamente. En este tipo de selección celular, microesferas paramagnéticas conjugadas con anexina-V se emplean para eliminar los espermatozoides apoptóticos de una suspensión. La detección se realiza incubando los espermatozoides con esferas cubiertas de anexina-V, y la separación se lleva a cabo en unas columnas por donde se hace pasar esta solución, sometiendo la mezcla a un campo magnético. Los espermatozoides dañados quedan retenidos en la columna por efecto del campo magnético y los no apoptóticos se filtran por la columna.
Esta técnica es sencilla, económica y no requiere personal especializado. Se comercializa en un kit que incluye las columnas, los reactivos (anexinaV y el buffer) y el soporte para el campo magnético. Está indicada en alto porcentaje de espermatozoides con ADN fragmentado, factor masculino severo, pacientes tratados con quimio y/o radioterapia, fallos previos de ICSI, mala calidad embrionaria y abortos de repetición43.
El mayor inconveniente de la selección espermática por selección celular por activación magnética (magnetic activated cell sorting) es el bajo rendimiento en número de espermatozoides, por lo que no está indicada en muestras con oligozoospermia.
Con respecto a la eficiencia de la técnica en tasas de embarazo, se ha demostrado tanto mejora44, como resultados indiferentes45 en comparación con métodos convencionales de selección.
Otras variantes son la filtración por lana de vidrio con anexina-V y la selección celular por citometría de flujo empleando anexina-V fluoromarcada.
Selección por citometría de flujoLa citometría de flujo es una técnica que data en torno a 1960 y se basa en la detección de una señal fluorescente generada por una tinción incorporada a una célula. Su versatilidad permite su empleo para diferenciar espermatozoides viables de los no viables. Diferentes fluorocromos indican características distintas. Por ejemplo, el naranja de acridina se emplea para el ADN, Yo Pro 1 para apoptosis, Hoechst 33342 para vitalidad, etc.
Yo-Pro 1, identifica los espermatozoides con alteraciones en la permeabilidad de la membrana, permitiendo separar los espermatozoides vivos de los muertos y los apoptóticos46. La característica que diferencia este fluorocromo de otros colorantes nucleares, es que solo marca la población celular en apoptosis y no interfiere en la funcionalidad de las células viables.
El principal inconveniente de la citometría de flujo es la disponibilidad del equipo debido a su alto coste y el bajo rendimiento en la recuperación de espermatozoides.
Selección de espermatozoides según su gonosomaUno de los usos de la citometría de flujo en andrología es la selección del sexo de los espermatozoides en animales y humanos. Los espermatozoides se tiñen con un fluorocromo específico y las células se separan en función del contenido de ADN de los cromosomas. Los espermatozoides teñidos pasan a través de una cámara de microfluidos, se separan en microgotas que contienen un solo espermatozoide y se recogen en un tubo.
Este método de selección es una opción para familias portadoras de enfermedades ligadas al sexo. La técnica permite preseleccionar un número mayor de embriones que después pueden someterse a diagnóstico genético preimplantacional47.
El inconveniente de la citometría de flujo es el proceso en sí, los espermatozoides se someten a aceleración para pasar a través de microcanales, a cargas electrostáticas y se exponen a rayo láser. En una revisión de 4.993 parejas que optaron a selección de sexo, se concluye que es una técnica segura y eficaz para clasificar espermatozoides. Supone una opción para familias que desean reducir el riesgo de enfermedad genética o equilibrar la distribución del sexo entre sus hijos en países donde la legislación lo permita48.
ConclusionesLa introducción de la ICSI ha motivado el desarrollo de test diagnósticos más precisos y métodos de recuperación de espermatozoides más centrados en la fisiología.
Se ha demostrado que la selección ultramorfológica de espermatozoides, la IMSI, no mejora ni la tasa de embarazos ni la de recién nacidos sanos. La selección de espermatozoides que ya han sufrido la reacción acrosómica parece más fisiológica que la microinyección de un espermatozoide íntegro no reactivo, como refleja el incremento en la tasa de implantación tras el empleo del microscopio de luz polarizada. En fase experimental aún, la microespectroscopía de Raman parece una técnica prometedora para la evaluación de espermatozoides y tejido testicular.
El empleo de ácido hialurónico, a pesar de ser un buen test funcional, no se traduce en un incremento en la tasa de nacidos49,50. El uso de selección celular por activación magnética para seleccionar células no apoptóticas, tampoco parece incrementar la tasa de gestación, cuando se emplean ovocitos de donante, en comparación con los métodos de selección convencionales45.
El empleo del citómetro de flujo en andrología ofrece posibilidades diagnósticas e incluso terapéuticas. A destacar el alto coste económico y el tiempo necesario para procesar los especímenes.
Cada tecnología tiene asociados sus propios problemas de calidad. La evaluación concienzuda de cualquier tecnología que se vaya a introducir en el laboratorio de andrología es obligatoria (tabla 2). Además de la evidencia disponible respecto a beneficios y coste-efectividad, se deben tener en cuenta: la complejidad y curva de aprendizaje, la seguridad, los posibles sesgos51.
Evaluación de un test diagnóstico para fertilidad masculina (Sigman, 2014)
| ¿Qué mide el ensayo? |
| ¿Cuáles son sus indicaciones? |
| ¿Cómo se interpretan los resultados? ¿Cuáles son las implicaciones terapéuticas? |
| ¿El resultado del ensayo cambia el manejo de la pareja? |
| ¿Existe alguna terapia que pueda cambiar el resultado? |
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.