Existe un alto número de casos no diagnosticados de enfermedad celiaca, especialmente en individuos de edad avanzada. El objetivo del presente trabajo es determinar el valor predictivo del genotipado de HLA-DQ en el diagnóstico de la enfermedad celiaca en mayores de 50 años y analizar una posible relación entre la gradación de riesgo atribuida a los alelos y el diagnóstico en edad avanzada.
Materiales y métodosSeiscientos treinta y cinco pacientes fueron estudiados durante 2013 con clínica sugestiva de enfermedad celiaca. El diagnóstico fue confirmado mediante estudios serológicos y biopsia intestinal. El genotipado del HLA-DQ se realizó mediante una técnica PCR-SSOP.
ResultadosUn 10,7% de los pacientes estudiados eran mayores de 50 años con un ratio hombre mujer 1:3. La frecuencia de los alelos considerados de riesgo para la enfermedad celiaca (HLA-DQ2.5 y/o HLA-DQ8) fue del 87,5% (56 pacientes), siendo celiacos 13 de ellos. Veintiún pacientes portaban solo un alelo del DQ2.5 (DQA1*05 o DQB1*02) sin confirmarse el diagnóstico de celiaquía. Un paciente celiaco confirmado no expresaba ni DQ2 ni DQ8. El valor predictivo positivo del genotipado de HLA-DQ para el diagnóstico de EC en la población mayor de 50 años fue del 29,27% y el valor predictivo negativo del 93%.
ConclusionesDebido al alto valor predictivo negativo, la determinación del HLA-DQ es un marcador útil en el diagnóstico de la EC en individuos de edad avanzada con clínica asociada. No se encontró relación entre los alelos considerados de menor riesgo y la aparición tardía de la enfermedad.
Celiac disease is significantly undiagnosed, especially in older individuals. The aim of this study is to determine the predictive value of HLA-DQ typing in the diagnosis of celiac disease in patients over 50 and analyze the possible relationship between the gradation of risk attributed to the alleles and diagnosis in elderly.
Materials and methods635 patients were studied during 2013 with suggestive symptoms of celiac disease. The diagnosis was confirmed by serologic studies and small bowel biopsy. The HLA-DQ genotyping was performed using a PCR-SSOP technique.
Results68 of out 635 patients studied (10.7%) were older than 50 years with a male to female ratio of 1:3. The frequency of the alleles that has been associated with risk of CD (HLA DQ2.5 and/or HLA DQ8) was 87.5% (56 patients), being celiac 13 of them. 21 patients carry the half allele of HLA-DQ2.5 (DQA1*05 or DQB1*02) associated with low risk of celiac disease being none of them celiac. One patient with celiac disease did not carry DQ2.5 or DQ8 heterodimers but was positive for serological and histological analysis. The positive predictive value of the use of HLA testing in the population older than 50 years is 29.27% and the negative predictive value is 93%.
ConclusionsDue to the high negative predictive value, the determination of HLA-DQ is a useful marker in the diagnosis of CD, in individuals over 50 with associated clinical. There was no relationship between low risk alleles and late onset of disease.
La enfermedad celiaca (EC) es una enfermedad sistémica crónica, de base inmunológica que cursa con una intolerancia permanente al gluten en individuos genéticamente predispuestos. Se considera que en la patogenia de la EC intervienen factores genéticos, ambientales e inmunológicos1.
La presentación clínica es muy diversa y puede incluir el típico síndrome malabsortivo, pero también y más frecuentemente, síntomas gastrointestinales inespecíficos y una gran variedad de manifestaciones extraintestinales2.
La intolerancia al gluten es más frecuente en determinados grupos de riesgo, como los familiares de primer grado de pacientes celiacos, individuos con diversos síndromes o determinadas enfermedades autoinmunes3,4.
Con una prevalencia en torno al 1% en población caucásica, la EC ha sido históricamente considerada una enfermedad de la infancia, observándose en los últimos años un incremento en el número de nuevos casos en adultos, frente a una estabilización en población pediátrica5,6. Se estima que por cada paciente con EC conocida existen 5-7 casos sin diagnosticar7.
En individuos de edad avanzada, las manifestaciones clínicas son similares a las presentadas en los adultos jóvenes8,9. Sin embargo, el retraso diagnóstico es más acusado10 debido a la presencia de patologías concomitantes con sintomatología común que enmascaran la enfermedad.
Es crucial conocer el impacto de la EC no detectada y promover estudios que traten de evitar un diagnóstico tardío ya que los pacientes con EC no diagnosticada y/o sin un seguimiento estricto de la dieta, presentan mayor morbilidad. Además, los casos diagnosticados en pacientes por encima de los 65 años se asocian con una mayor progresión a enfermedad celiaca refractaria11 y en un reciente estudio con individuos diagnosticados en torno a los 50 años, se revela un ligero aumento en el riesgo de linfoma y carcinoma esofágico12 en estos pacientes.
El diagnóstico de la EC puede establecerse en base a criterios clínicos, serológicos y a una adecuada respuesta a la dieta libre de gluten, pero la biopsia duodenal continúa siendo el método de confirmación por excelencia13.
Los estudios familiares indican una fuerte contribución genética en el desarrollo de la EC. Existe una asociación clara con determinados alelos del sistema HLA aunque se han descrito asociaciones menores con otros genes14. La mayoría de los pacientes celiacos (más del 90% expresan el heterodímero HLA-DQ2 codificado por los alelos DQA1*05 y DQB1*02 (HLA-DQ2.5) tanto en posición cis (mismo cromosoma) como en trans (distinto cromosoma). Muchos de los individuos celiacos que no presentan dicho heterodímero, son portadores del heterodímero DQ8 (codificado por los alelos DQA1*03 y DQB1*03:02). Se encuentra descrito en la bibliografía que los pacientes DQ2 y DQ8 negativos pueden presentar alguno de los alelos que codifica el DQ2 por separado DQA1*05 o DQB1*0215.
La ausencia de los alelos mencionados anteriormente es una herramienta útil para excluir la enfermedad celiaca en pacientes pertenecientes a grupos de riesgo, y su presencia permite evitar la biopsia en determinados casos en los que la serología y la clínica es muy clara. Por otra parte, la expresión del DQ2 o DQ8 añade peso al diagnóstico en pacientes en los que el resto de marcadores no permiten filiar la enfermedad de forma concluyente, bien por resultados negativos en la serología o por presentar una biopsia con lesiones leves en la mucosa, inespecíficas de la EC16.
Existe una gradación del riesgo en función del genotipo del HLA de clase II de cada individuo17,18. En esta escala, se asigna un grado de riesgo muy alto a aquellos pacientes que presentan en su haplotipo el heterodímero HLA-DQ2.5 junto a una segunda copia del alelo DQB1*02 o el DQ8. Se establece un riesgo alto, pero ligeramente menor al grupo anterior, para aquellos individuos con presencia únicamente de un heterodímero DQ2.5 (ya sea en cis o trans). La presencia del HLA-DQ8 se considera responsable de un riesgo intermedio-bajo y la posesión aislada de uno de los alelos DQA1*05 o DQB1*02 de forma aislada se asocia con un riesgo muy bajo de padecer EC.
Actualmente, la utilidad de estos marcadores genéticos es indiscutible en el algoritmo diagnóstico de la enfermedad, considerándolos siempre en el contexto clínico del paciente.
Lo que no se conoce con exactitud son las implicaciones clínicas que puede tener dicha escala de riesgo y si podría estratificar diferentes grupos de pacientes en función de la edad e intensidad de comienzo de los síntomas, de la respuesta a la dieta, el daño en la mucosa intestinal o el pronóstico de los enfermos. Existen grupos que centran sus investigaciones en estos aspectos19,20 pero aún está por determinar el papel que juegan los diferentes alelos en el curso de la patología.
En el presente artículo se determina el valor predictivo del test molecular de HLA en pacientes mayores de 50 años con clínica sugestiva de enfermedad celiaca. También se trata de evaluar si en nuestra cohorte existe una mayor proporción de alelos que confieren un riesgo moderado o débil frente a aquellos asociados a un riesgo mayor y plantear si esto justifica el comienzo de los síntomas tardíos y el retraso diagnóstico en población de edad avanzada.
Materiales y métodosPacientesEn 635 pacientes derivados de los hospitales del grupo IDC Salud de la Comunidad de Madrid; se realizó la determinación de los marcadores genéticos DQ2 y DQ8 formando parte de un screening dirigido a pacientes con clínica sugestiva de enfermedad celiaca durante el año 2013.
Este estudio retrospectivo versa sobre la importancia del diagnóstico de EC en edad avanzada por lo que fueron incluidos todos aquellos individuos mayores de 50 años estudiados durante el año 2013 que presentaban manifestaciones clínicas relacionadas con dicha patología, considerándose el grupo de interés para el análisis de los resultados. Se excluyeron aquellos pacientes con enfermedad celiaca diagnosticada anteriormente.
Fueron recogidas las características clínicas en el momento del diagnóstico. Se incluyeron manifestaciones generales (cansancio, pérdida de peso, problemas de crecimiento en la infancia), manifestaciones gastrointestinales (dispepsia, náuseas, vómitos, dolor abdominal, diarrea, estreñimiento), manifestaciones extraintestinales (anemia, osteoporosis, infertilidad, alteraciones hepáticas, manifestaciones cutáneas) y la presencia de patologías autoinmunes relacionadas directamente con un aumento del riesgo a padecer EC como la diabetes tipo I y la enfermedad tiroidea autoinmune, entre otras.
El diagnóstico de enfermedad celiaca se realizó en consonancia con los estudios serológicos, biopsia del intestino delgado y análisis histológico de acuerdo a las guías de la Sociedad británica de Gastroenterología para el manejo de los adultos con enfermedad celiaca21.
MétodosEstudios serológicosPara la determinación de anticuerpos antitransglutaminasa tisular humana (h-tTG) de isotipo IgA e IgG y los anticuerpos antipéptidos deaminados de gliadina de isotipo IgA e IgG (DGPIgA y DGP IgG) se utilizó QUANTA LiteTM (Inova). Se consideran positivos aquellos sueros con resultado >20UI/mL. Se trata de un ensayo basado en la técnica enzyme-linked immunosorbent assay para la detección semi-cuantitativa de anticuerpos en suero.
El estudio de los anticuerpos antiendomisio se realizó por inmunofluorescencia indirecta. Se utilizó como soporte cortes de la porción distal de esófago de mono (Inova®) y se valoró la presencia del patrón reticular de fluorescencia característico en la capa muscularis mucosae del esófago.
Estudios histológicosLas muestras de biopsia duodenal fueron analizadas histopatológicamente y se evaluó el daño en la mucosa en relación a la clasificación de Marsh. (Tipo 0: mucosa normal; tipo 1: lesión infiltrativa; tipo 2: lesión hiperplásica; tipo 3: lesión destructiva siendo 3a leve, 3b marcada y 3c atrofia total).
Estudios genéticosSe realizó la extracción de ADN de las muestras de los pacientes de sangre periférica anticoagulada con EDTA utilizando el extractor QIAsymphony SP (Qiagen, Germany) y el genotipado de HLA se realizó por un método SSPO con hibridación reversa (INNO-LIPA HLA-DQ, Fujirebio, España).
Nomenclatura HLASe adoptó la nomenclatura HLA de acuerdo a la descrita por el Comité de Nomenclatura de Factores del Sistema HLA de la OMS22. La isoforma codificada por una específica combinación de alelos HLA-DQA1 y HLA-DQB1 puede ser expresado como HLAx.y donde «x» se refiere a DQB1 e «y» a DQA1. La susceptibilidad genética a la enfermedad celiaca está fuertemente asociada a la presencia del del heterodímero HLA-DQ2.5 (alelos DQA1*05 y DQB1*02) tanto en cis como en trans. Un riesgo intermedio-bajo se asocia con la posesión de HLA-DQ8. En menor grado, se asocia un riesgo potencial en individuos que portan únicamente uno de los dos alelos del heterodímero HLA-DQ2.5. La posesión aislada del alelo DQA1*05 es propuesto en esta nomenclatura como HLA-DQx.5 y el alelo DQB1*02 nombrado como HLA-DQ2.x. La ausencia de los alelos descritos en el haplotipo de los pacientes del estudio (HLA-DQx.y) fue considerado como un resultado negativo en la determinación del riesgo a padecer celiaquía atribuible a las moléculas HLA.
ResultadosResultados generales de la población de estudio mayor de 50 añosSesenta y ocho de los 635 pacientes (10,7%) eran mayores de 50 años (51 mujeres y 17 hombres, con una media de edad de 62,3 años y un rango entre los 50-79 años). Las características demográficas de la población de estudio (sexo y edad), fueron en general similares entre el grupo de los pacientes en los que se confirmó el diagnóstico de celiaquía y aquellos que resultaron no celiacos con un predominio de mujeres en ambos grupos (el ratio hombre: mujer fue de 1:3).
Todos los pacientes mayores de 50 años presentaban síntomas relacionados con la enfermedad celiaca: 68% tenían manifestaciones gastrointestinales (los síntomas más frecuentes fueron diarrea, estreñimiento, dispepsia, flatulencia y pirosis) y un 38% presentaba síntomas no gastrointestinales (destacando una alta prevalencia de anemia ferropénica y elevación de enzimas hepáticas). En este grupo de pacientes mayores de 50 años, 14 (20,6%) fueron diagnosticados de EC por los resultados obtenidos en la serología y en la biopsia duodenal (tabla 4).
En nuestra cohorte, 7 pacientes de los mayores de 50 años presentaban enfermedad autoinmune (3 presentaban tiroiditis autoinmune, un paciente padecía diabetes tipo I, 2 individuos sufrían gastritis atrófica autoinmune y un paciente presentaba cirrosis biliar primaria. Uno de los pacientes con enfermedad tiroidea autoinmune y el paciente con cirrosis biliar primaria resultaron celiacos.
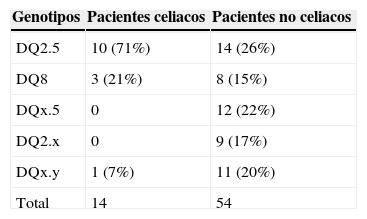
En esta población, la frecuencia de alelos relacionados con un aumento del riesgo a padecer celiaquía (HLA-DQ2.5 y/o HLA-DQ8) fue del 87,5% (56 pacientes); siendo celiacos 13 de ellos.
Dentro de la población que presentaba alguno de estos alelos, 24 de ellos portaban el alelo de alto riesgo DQ2 (HLA-DQ2.5 cis o trans) y 11 fueron positivos para HLA-DQ8. El diagnóstico de enfermedad celiaca fue confirmado en 10 y en 3 de ellos respectivamente. Un 17,6% (12 pacientes portaban únicamente un alelo del HLA-DQ2: 13,2% DQA1*05 y un 13,2% (9 pacientes) únicamente el alelo DQB1*02, no resultando celiaco ninguno de ellos (tabla 1).
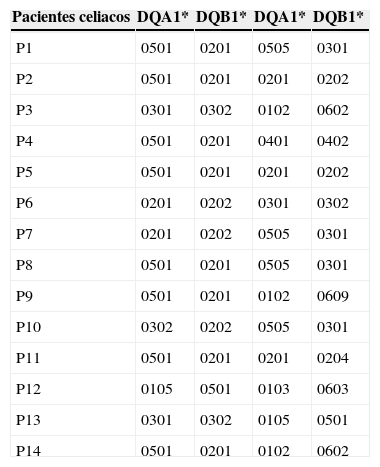
Pacientes celiacos mayores de 50 añosDentro de los 14 pacientes celiacos (tabla 2); 10 de ellos (71,4%) tenían al menos una copia del alelo DQA1*05 y del DQB1*02 teniendo 3 de ellos una segunda copia del alelo DQB1*02 y 2 de ellos una segunda copia de DQA1*05, encontrándose la dosis génica aumentada en estos pacientes.
Genotipo de HLA-DQ en los 14 pacientes celiacos
| Pacientes celiacos | DQA1* | DQB1* | DQA1* | DQB1* |
|---|---|---|---|---|
| P1 | 0501 | 0201 | 0505 | 0301 |
| P2 | 0501 | 0201 | 0201 | 0202 |
| P3 | 0301 | 0302 | 0102 | 0602 |
| P4 | 0501 | 0201 | 0401 | 0402 |
| P5 | 0501 | 0201 | 0201 | 0202 |
| P6 | 0201 | 0202 | 0301 | 0302 |
| P7 | 0201 | 0202 | 0505 | 0301 |
| P8 | 0501 | 0201 | 0505 | 0301 |
| P9 | 0501 | 0201 | 0102 | 0609 |
| P10 | 0302 | 0202 | 0505 | 0301 |
| P11 | 0501 | 0201 | 0201 | 0204 |
| P12 | 0105 | 0501 | 0103 | 0603 |
| P13 | 0301 | 0302 | 0105 | 0501 |
| P14 | 0501 | 0201 | 0102 | 0602 |
El heterodímero de alto riesgo HLA- DQ2.5 aparece marcado con gris oscuro, el resto de los alelos asociados a un menor riesgo, con gris claro.
De los 14 pacientes celiacos, 3 de ellos portaban el heterodímero DQ8, uno de ellos acompañado de la expresión de un alelo DQB1*02.
Ninguno de los pacientes con diagnóstico confirmado de EC cuenta únicamente con un alelo del DQ2.5 (DQA1*05 o DQB1*02).
Solo uno de los pacientes celiacos no poseía ni el heterodímero DQ2.5 ni el DQ8, tratándose de un paciente DQ5 y DQ6 (tabla 2).
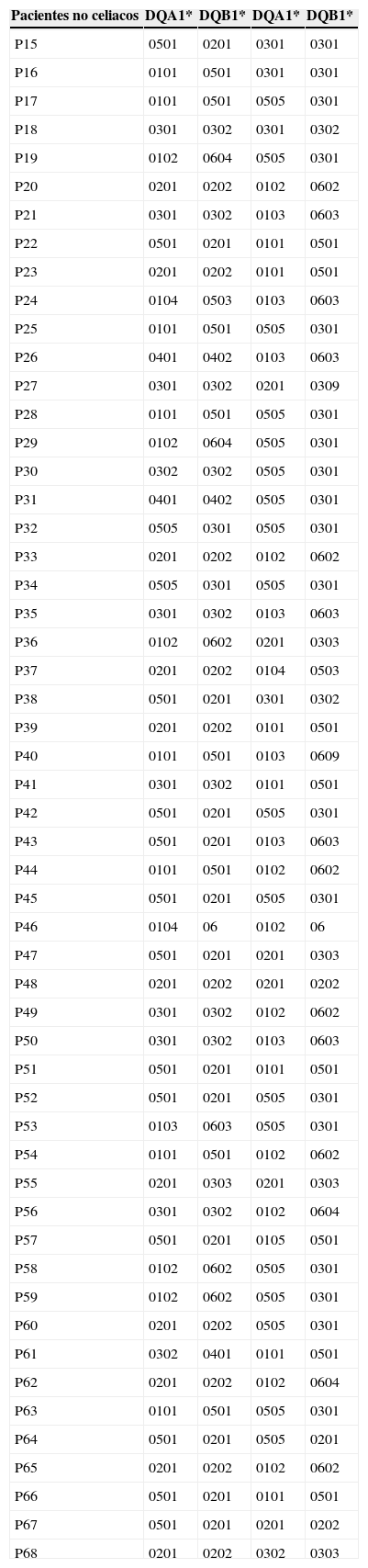
Pacientes no celiacos mayores de 50 añosEn los 54 pacientes no celiacos, 11 de ellos (20,4%) fueron negativos para la determinación de genotipo de HLA asociado a enfermedad celiaca, 14 individuos (25,9%) contaban con el heterodímero de alto riesgo HLA-DQ2.5. Dentro de este grupo, 4 de ellos expresaban también un alelo DQA1*05 y un paciente un alelo DQB1*02.
Fueron 8 los pacientes DQ8 positivos dentro del grupo de los no celiacos, 12 que solo expresaban el alelo DQA1*05 y 9 con el alelo DQB1*02 (tabla 3).
Genotipo de HLA-DQ en los 54 pacientes no celiacos
| Pacientes no celiacos | DQA1* | DQB1* | DQA1* | DQB1* |
|---|---|---|---|---|
| P15 | 0501 | 0201 | 0301 | 0301 |
| P16 | 0101 | 0501 | 0301 | 0301 |
| P17 | 0101 | 0501 | 0505 | 0301 |
| P18 | 0301 | 0302 | 0301 | 0302 |
| P19 | 0102 | 0604 | 0505 | 0301 |
| P20 | 0201 | 0202 | 0102 | 0602 |
| P21 | 0301 | 0302 | 0103 | 0603 |
| P22 | 0501 | 0201 | 0101 | 0501 |
| P23 | 0201 | 0202 | 0101 | 0501 |
| P24 | 0104 | 0503 | 0103 | 0603 |
| P25 | 0101 | 0501 | 0505 | 0301 |
| P26 | 0401 | 0402 | 0103 | 0603 |
| P27 | 0301 | 0302 | 0201 | 0309 |
| P28 | 0101 | 0501 | 0505 | 0301 |
| P29 | 0102 | 0604 | 0505 | 0301 |
| P30 | 0302 | 0302 | 0505 | 0301 |
| P31 | 0401 | 0402 | 0505 | 0301 |
| P32 | 0505 | 0301 | 0505 | 0301 |
| P33 | 0201 | 0202 | 0102 | 0602 |
| P34 | 0505 | 0301 | 0505 | 0301 |
| P35 | 0301 | 0302 | 0103 | 0603 |
| P36 | 0102 | 0602 | 0201 | 0303 |
| P37 | 0201 | 0202 | 0104 | 0503 |
| P38 | 0501 | 0201 | 0301 | 0302 |
| P39 | 0201 | 0202 | 0101 | 0501 |
| P40 | 0101 | 0501 | 0103 | 0609 |
| P41 | 0301 | 0302 | 0101 | 0501 |
| P42 | 0501 | 0201 | 0505 | 0301 |
| P43 | 0501 | 0201 | 0103 | 0603 |
| P44 | 0101 | 0501 | 0102 | 0602 |
| P45 | 0501 | 0201 | 0505 | 0301 |
| P46 | 0104 | 06 | 0102 | 06 |
| P47 | 0501 | 0201 | 0201 | 0303 |
| P48 | 0201 | 0202 | 0201 | 0202 |
| P49 | 0301 | 0302 | 0102 | 0602 |
| P50 | 0301 | 0302 | 0103 | 0603 |
| P51 | 0501 | 0201 | 0101 | 0501 |
| P52 | 0501 | 0201 | 0505 | 0301 |
| P53 | 0103 | 0603 | 0505 | 0301 |
| P54 | 0101 | 0501 | 0102 | 0602 |
| P55 | 0201 | 0303 | 0201 | 0303 |
| P56 | 0301 | 0302 | 0102 | 0604 |
| P57 | 0501 | 0201 | 0105 | 0501 |
| P58 | 0102 | 0602 | 0505 | 0301 |
| P59 | 0102 | 0602 | 0505 | 0301 |
| P60 | 0201 | 0202 | 0505 | 0301 |
| P61 | 0302 | 0401 | 0101 | 0501 |
| P62 | 0201 | 0202 | 0102 | 0604 |
| P63 | 0101 | 0501 | 0505 | 0301 |
| P64 | 0501 | 0201 | 0505 | 0201 |
| P65 | 0201 | 0202 | 0102 | 0602 |
| P66 | 0501 | 0201 | 0101 | 0501 |
| P67 | 0501 | 0201 | 0201 | 0202 |
| P68 | 0201 | 0202 | 0302 | 0303 |
El heterodímero de alto riesgo HLA- DQ2.5 aparece marcado con gris oscuro, el resto de los alelos asociados a un menor riesgo, con gris claro.
El resto de los pacientes no celiacos presentaban un haplotipo distinto sin ningún alelo considerado de riesgo para la patología de estudio (tabla 3).
De acuerdo a los resultados, el valor predictivo positivo para el uso del test de HLA en la población mayor de 50 años es de 23,2% y el valor predictivo negativo es del 93%.
DiscusiónEl diagnóstico tardío de la EC es un problema a nivel mundial ya que es una causa importante de morbilidad en la población general23. La evidencia de la enfermedad es a menudo enmascarada en individuos de edad avanzada condicionando un peor pronóstico para el paciente. Por ello, es indispensable potenciar el diseño de estudios que permitan evitar un retraso diagnóstico.
En nuestra cohorte de estudio, de los 68 individuos mayores de 50 años con sintomatología asociada, los pacientes diagnosticados finalmente de EC constituyen el 20,6%, siendo un porcentaje mayor que en otros estudios que estiman valores en torno al 4-5%9,24.
Algunos autores han reportado que la EC parece ser más frecuente en mujeres que en hombres, describiendo ratios mujer/hombre 4:125. De forma análoga en nuestra cohorte, obtenemos un ratio de prevalencia 3:1. El mismo valor es el obtenido en el grueso de nuestra población de edad mayor de 50 años con sintomatología asociada, probablemente porque algunos síntomas y condiciones patológicas asociadas (enfermedades autoinmunes, anemia ferropénica y osteoporosis) presentan una incidencia mayor en mujeres de edad avanzada que en varones de edad similar5.
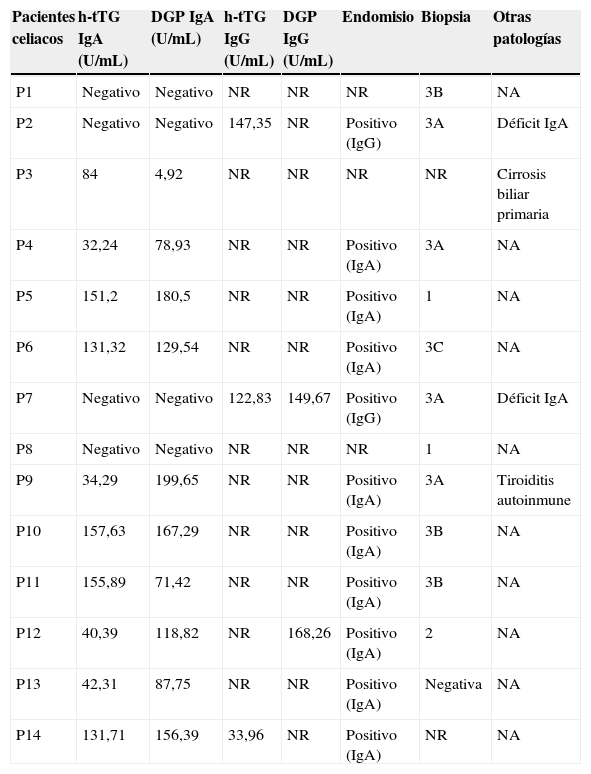
De los datos obtenidos en nuestro estudio, no podemos concluir nada acerca de la relación de otras patologías autoinmunes con la EC, ya que el número de pacientes estudiados es muy limitado (tabla 4).
Resultados serológicos, biopsia y presencia de patologías de interés en los 14 pacientes diagnosticados de celiaquía mayores de 50 años
| Pacientes celiacos | h-tTG IgA (U/mL) | DGP IgA (U/mL) | h-tTG IgG (U/mL) | DGP IgG (U/mL) | Endomisio | Biopsia | Otras patologías |
|---|---|---|---|---|---|---|---|
| P1 | Negativo | Negativo | NR | NR | NR | 3B | NA |
| P2 | Negativo | Negativo | 147,35 | NR | Positivo (IgG) | 3A | Déficit IgA |
| P3 | 84 | 4,92 | NR | NR | NR | NR | Cirrosis biliar primaria |
| P4 | 32,24 | 78,93 | NR | NR | Positivo (IgA) | 3A | NA |
| P5 | 151,2 | 180,5 | NR | NR | Positivo (IgA) | 1 | NA |
| P6 | 131,32 | 129,54 | NR | NR | Positivo (IgA) | 3C | NA |
| P7 | Negativo | Negativo | 122,83 | 149,67 | Positivo (IgG) | 3A | Déficit IgA |
| P8 | Negativo | Negativo | NR | NR | NR | 1 | NA |
| P9 | 34,29 | 199,65 | NR | NR | Positivo (IgA) | 3A | Tiroiditis autoinmune |
| P10 | 157,63 | 167,29 | NR | NR | Positivo (IgA) | 3B | NA |
| P11 | 155,89 | 71,42 | NR | NR | Positivo (IgA) | 3B | NA |
| P12 | 40,39 | 118,82 | NR | 168,26 | Positivo (IgA) | 2 | NA |
| P13 | 42,31 | 87,75 | NR | NR | Positivo (IgA) | Negativa | NA |
| P14 | 131,71 | 156,39 | 33,96 | NR | Positivo (IgA) | NR | NA |
DGP: péptidos deaminados de gliadina (isotipos IgA e IgG); resultado de anticuerpos positivo >20U/mL; h-tTG: transglutaminasa tisular (isotipos IgA e IgG); NR: no realizado; NA: no aplica.
Resultados de la biopsia en base a la clasificación de Marsh.
La asociación de la enfermedad celiaca con los genes de la región del HLA de clase II, y más concretamente con los genes HLA-DQ2.5 y HLA-DQ8 es responsable del 40% de la contribución genética descrita para dicha patología. Sin embargo es importante destacar que el 30% de los individuos con descendencia europea expresan alguno de los heterodímeros considerados de riesgo HLA-DQ2 y/o DQ8 y solo un pequeño porcentaje (1-4%) desarrollara enfermedad celiaca a lo largo de su vida1,26.
El propósito de este estudio consiste en evaluar la utilidad del genotipado molecular del HLA-DQ en el diagnóstico de la EC en pacientes de edad avanzada.
En nuestra cohorte, el número de pacientes portadores de los alelos de riesgo fueron 56 pacientes, resultando celiacos 13 de ellos (23,2%) y no celiacos 43 (76,8%). Esto corrobora que la presencia de estos haplotipos es un factor necesario pero no suficiente para el desarrollo de la enfermedad celiaca.
Se considera que aquellos pacientes HLA-DQ2.5 positivo que son homocigotos para el alelo HLA-DQB1*02 tienen un riesgo aumentado de padecer la patología y formas más agresivas de la enfermedad celiaca8,27,28. En la población de estudio, de los 14 pacientes que fueron diagnosticados de celiaquía, 10 de ellos (71,4%) poseían el heterodímero DQ2.5 en cis o en trans, 3 de ellos poseían una segunda copia del alelo HLA-DQB1*02 y 2 pacientes una segunda copia del alelo HLA-DQA1*05. Sin embargo, únicamente uno de los 43 pacientes DQ2.5 positivos no celiacos contaba con una segunda copia del alelo HLA-DQB1*02.
De los 4 pacientes celiacos restantes, 3 presentaban el heterodímero DQ8, confirmando los hallazgos de otros autores en los que se describe que la mayoría de los pacientes celiacos negativos para el heterodímero DQ2.5, presentan en su haplotipo el DQ88.
La relevancia asignada a la posesión de un único alelo del heterodímero DQ2.5 (únicamente HLA-DQA1*05 o HLA-DQB1*02) no está clara en la bibliografía. El grupo de Megiorni et al. describe que la posesión de DQ2.x confiere un bajo riesgo, mientras que consideran que DQx.5 aislado no representa un aumento de riesgo de padecer EC18. Estos resultados se encuentran en concordancia con lo obtenido en nuestra cohorte de pacientes, en la que ninguno de los pacientes que resultaron celiacos poseía DQ2.x o DQx.5 aislado frente al grupo de los no celiacos donde 9 individuos expresaban el alelo DQB1*02 aislado y 12 el alelo DQA1*05.
Inesperadamente, uno de nuestros pacientes diagnósticado de EC (P12), no poseía ni el heterodímero DQ2 ni el heterodímero DQ8, siendo su haplotipo HLA-DQ5 y HLA-DQ6. Se trata de un hecho inusual en dicha patología, pero apoya lo descrito por otros autores que señalan que el diagnóstico no puede ser excluido por la ausencia de marcadores genéticos ante una alta sospecha clínica29.
En nuestro grupo de pacientes celiacos diagnósticados en edad avanzada, no hemos encontrado una mayor representación de los alelos reconocidos como de bajo riesgo (presencia de DQ8 o un alelo del DQ2) que nos permitiera revelar si existe una relación entre la gradación del riesgo descrita para los alelos y un curso tardío o menos agresivo de la enfermedad.
Sin embargo, se trata de una cohorte muy limitada, por lo que será necesario realizar estudios retrospectivos en cohortes más amplias bien caracterizadas, en las que poder valorar el efecto de los diferentes alelos de forma apropiada.
La ausencia de los alelos considerados de riesgo para el desarrollo de la EC, tiene un valor predictivo negativo descrito por otro autores cercano al 100%30. El VPN obtenido en nuestra cohorte mayor de 50 años es del 93%. Este VPN tan alto demuestra la importancia de determinar este parámetro.
La enfermedad celiaca cumple con las características necesarias para convertirse en una enfermedad que requiere un screening poblacional31 y la determinación de la posesión de alelos de riesgo es una pieza clave en el algoritmo diagnóstico para descartar pacientes sin susceptibilidad genética. Los individuos de edad avanzada muestran una mayor morbilidad y complicaciones relacionadas con la EC debido a un retraso en el diagnóstico durante años que puede ser agravado por las patologías concomitantes propias de la edad. Es una prioridad reducir el número de casos no detectados en este grupo poblacional para permitir que se beneficien de una dieta libre de gluten.
En conclusión, debido al alto VPN, el genotipado HLA-DQ debe ser considerado como una herramienta útil en pacientes con alta sospecha asumiendo que el diagnóstico de EC es altamente improbable en individuos HLA-DQ2.5 y HLA-DQ8 negativos.
Futuros estudios permitirán demostrar si existe una relación entre los alelos del HLA-DQ y las múltiples formas de presentación clínica de la enfermedad celiaca.
FinanciaciónEl presente trabajo no ha recibido financiación alguna para su realización
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.