Evaluar los resultados clínicos en pacientes con lesiones condrales en rodilla y tobillo, a los que se les ha realizado implante de condrocitos autólogos en membrana (MACI). Se han incluido 150 pacientes tratados con MACI (siempre por el mismo equipo quirúrgico) durante los años 2002-2007.
MétodosEn todos los casos se tomó una biopsia de cartílago para utilizarla como fuente para el cultivo celular mientras se evaluaba la lesión condral por artroscopia. El implante celular se realizó por artroscopia en 53 casos, mientras que en el resto fue por cirugía abierta. Los pacientes se evaluaron siguiendo un protocolo clínico interno. En 50 pacientes se realizó seguimiento de los resultados durante un periodo medio de 2 años. En 5 pacientes se realizó una biopsia de second look a los 2 años de seguimiento.
ResultadosEn el 89% de los pacientes sin cirugías previas y en un 66% de los restantes, los resultados fueron buenos/excelentes en referencia al dolor y la movilidad; la mayoría de ellos pudieron retomar su actividad física previa, incluyendo deporte profesional. El análisis histológico de las 5 biopsias mostró que el tejido neoformado era cartílago tipo hialino, pero con menos celularidad y subjetivamente más blando que el cartílago hialino normal.
ConclusiónLa técnica artroscópica del MACI es un procedimiento prometedor para el tratamiento de las lesiones condrales y osteocondrales de rodilla y tobillo, aunque el resultado histológico evidencia que el aumento de células proporcionaría todavía resultados mejores.
Nivel de evidenciaNivel III.
Relevancia clínicaLa importancia de este estudio radica en que se presenta un gran número de casos de pacientes con lesiones condrales tratados con MACI, muchos de ellos con implante mediante artroscopia. En este estudio se comprueba que el tratamiento con MACI proporciona buenos resultados.
The aim of this work was to evaluate the clinical results of the matrix-induced autologous chondrocyte implantation (MACI) technique on chondral defects of the knee and ankle. A study was conducted on 150 patients treated with MACI (performed by the same team of surgeons in all cases) during 2002-2007.
MethodsThe lesion was evaluated by arthroscopy, and a cartilage biopsy was taken. The cellular implant was performed by arthroscopy in 53 patients, and by open surgery in the remaining cases. The results were measured following an in-house clinical protocol. Data corresponding to a mean follow-up period of 24 months were available in 50 out of the 150 implanted patients. Histological studies were performed in a second biopsy taken by arthroscopy in 5 patients 2 years after cell implantation.
ResultsIn 89% of patients without previous surgeries, and in 66% of patients with previous surgeries, the results were good or excellent for pain and motion, and most of them were able to return to their previous physical activities, including professional sport. Histological studies performed on a second biopsy showed that the new tissue is hyaline-like cartilage with lower cell numbers and subjectively softer than normal cartilage.
ConclusionArthroscopic MACI is a promising procedure to treat chondral lesions in the knee and ankle, although the histological analysis suggests that increasing cellular dosage would improve the results of the technique.
Level of evidenceLevel III.
Clinical relevanceThe importance of this study is that it presents an increased number of patients with chondral lesion treated with MACI. A high number of these patients were treated with arthroscopic MACI. In the present study it is shown that the treatment gives good results.
Las lesiones en el cartílago articular tienen una limitada capacidad de reparación, y si los defectos no se tratan, estos pueden progresar a artrosis1,2. Las técnicas tradicionales para el tratamiento de lesiones de cartílago articular, tales como mosaicoplastia, microfracturas o implante de polímeros artificiales o prótesis de metal, presentan muchas limitaciones3,4. En las últimas décadas la investigación se ha centrado en el desarrollo de técnicas para estimular la reparación y regeneración del cartílago, en particular las basadas en terapia celular, como es el caso del implante de condrocitos autólogos (ACI)5–8.
La técnica ACI se describió por primera vez en 19945 y ha sido ampliamente aplicada en pacientes en Estados Unidos y Europa6–9. El procedimiento incluye la toma de una biopsia de cartílago de una zona de no carga para el aislamiento y el cultivo de condrocitos, y el posterior implante de las células en la zona de la lesión con un recubrimiento de periostio5. Los autores, tras analizar biopsias de la zona regenerada pasado un año del implante celular, mostraron la formación de cartílago tipo hialino con la presencia de colágeno tipo ii. Publicaciones posteriores mostraron que la regeneración del cartílago se mantenía hasta 11 años después, con una mejora continuada de la sintomatología de los pacientes y sin apenas complicaciones6–9. El implante de condrocitos autólogos en medio líquido es una técnica que proporciona muy buenos resultados, aunque presenta algunos problemas asociados a la complejidad del procedimiento quirúrgico y al empleo de periostio5,10,11. En los últimos, el desarrollo de técnicas de terapia celular combinadas con el empleo de biomateriales biocompatibles y degradables ha supuesto un paso más en el tratamiento de las lesiones de cartílago articular. Recientemente se ha desarrollado una modificación de la técnica ACI en la que las células no se aplican en suspensión líquida y además no requiere la toma y posterior sutura del periostio. En este método, los condrocitos cultivados se siembran en una membrana de colágeno porcino tipo i/iii (Chondro-Gide®, Geistlich Biomaterials, Wolhusen, Suiza), que se implanta en la lesión de cartílago12–14 con las células orientadas hacia el defecto, fijando la membrana con fibrina o suturándola al hueso subcondral. La membrana de colágeno se reabsorbe a los pocos meses, quedando las células formando una matriz extracelular y regenerando el tejido15. Otra de las ventajas de esta modificación del método es que se puede realizar por técnicas mínimamente invasivas, como es la artroscopia16,17. Además, como la membrana de colágeno no es un tejido vivo, no puede tener lugar el crecimiento hipertrófico observado en algunos casos cuando se empleaba periostio. Este procedimiento se denomina matrix-induced autologous chondrocyte implantation (MACI, «implante de condrocitos autólogos en membrana»), y los resultados obtenidos tanto en cirugía abierta como en artroscopia han mostrado un alto porcentaje de regeneración de la superficie articular en los pacientes tratados (cartílago hialino rico en colágeno tipo ii)16–20.
En este estudio describimos los resultados en 50 pacientes con defectos condrales tratados en nuestra unidad empleando técnicas artroscópicas y cirugía semiinvasiva o cirugía abierta, con un seguimiento de 2 años.
Pacientes y métodosEn este estudio se muestran los resultados de 150 pacientes con lesiones condrales que fueron tratados en nuestra unidad con la técnica MACI durante los años 2002 a 2007. Todos los pacientes firmaron un consentimiento informado y el estudio se ha realizado siguiendo las directivas de la Declaración de Helsinki para estudios humanos. Los pacientes fueron evaluados siguiendo un protocolo interno, considerando los siguientes parámetros: edad, género, localización del defecto condral, miembro afectado, número y tipo de cirugías previas, rango de movilidad comparándolo con el miembro opuesto después del implante celular, y tiempo de baja laboral. El dolor se evaluó antes y después de la cirugía usando una escala analógica entre 0 (sin dolor) y 10 (dolor máximo). Los pacientes se clasificaron en 3 categorías respecto al dolor: pacientes con dolor entre 0-3 (dolor leve o malestar); pacientes con dolor entre 4-6 (dolor moderado que no interfiere con la vida normal), y pacientes con dolor entre 6-10 (dolor severo que interfiere con la vida normal). La edad media de los pacientes es de 35,7±9,9 años, siendo 120 de ellos (80,2%) hombres, y 30, mujeres (19,8%).
A cada paciente se le tomó por vía artroscópica una biopsia de cartílago de una zona de no carga y se envió al laboratorio Genzyme (Herzogenrath, Alemania) siguiendo las instrucciones de la compañía. Después de 6-8 semanas, el cultivo celular sobre membrana (un millón de células por cm2 de lesión) se implantó por artroscopia en 53 pacientes (35,3%), mientras que en los 97 pacientes restantes (64,6%) se realizó por cirugía abierta.
La mayoría de los pacientes (126 casos) presentaban lesiones en la rodilla, aunque también se incluyeron 24 pacientes con lesiones en el tobillo. En 15 (63%) de los pacientes con lesión en el tobillo esta se localizaba en la extremidad derecha, mientras que los 9 restantes presentaban lesión en la izquierda. Con respecto a la lateralidad, de los 126 pacientes con lesiones de rodilla, 72 (57%) presentaban lesiones en la pierna derecha y 54 (42%) en la izquierda. La tabla 1 muestra la localización en la rodilla de los defectos de cartílago en estos pacientes.
Localización de los defectos articulares tratados con implante de condrocitos autólogos en membrana en la rodilla (N=126 pacientes)
| Cóndilo interno | 66 (52,0) |
| Cóndilo externo | 18 (14,0) |
| Rótula | 12 (10,0) |
| Tróclea | 4 (3,1) |
| Región intercondílea | 3 (2,3) |
| Otrosa | 23 (18,6) |
Datos expresados como n (%).
En el segundo año de seguimiento se realizó una artroscopia a 5 de los pacientes tratados con MACI (3 con implante celular en tobillo, 2 con implante en rodilla), tomando una biopsia del tejido regenerado para análisis histológico, manteniéndola en formalina al 10% hasta su procesamiento. En el caso de los pacientes con implante celular en tobillo, la artroscopia se realizó para la retirada del material de osteosíntesis. En el caso de los pacientes de rodilla, acudieron a consulta por problemas en los ligamentos de la rodilla que requerían la realización de una artroscopia.
Las biopsias se incluyeron en parafina y se realizaron cortes histológicos de 4μm de espesor. Las secciones se tiñeron con hematoxilina-eosina para estudiar la arquitectura del tejido. Las preparaciones histológicas fueron analizadas por anatomopatólogos especializados.
Análisis estadísticoEl análisis estadístico se realizó utilizando el programa SPSS® 9.0 para Windows. Las variables continuas se expresaron como media±desviación estándar (y rango) y se compararon empleando el test de Kruskal-Wallis. Las variables discretas se expresaron como porcentajes y se compararon con la prueba de Chi-cuadrado de Pearson. Los valores de p<0,05 (bilateral) se consideraron estadísticamente significativos.
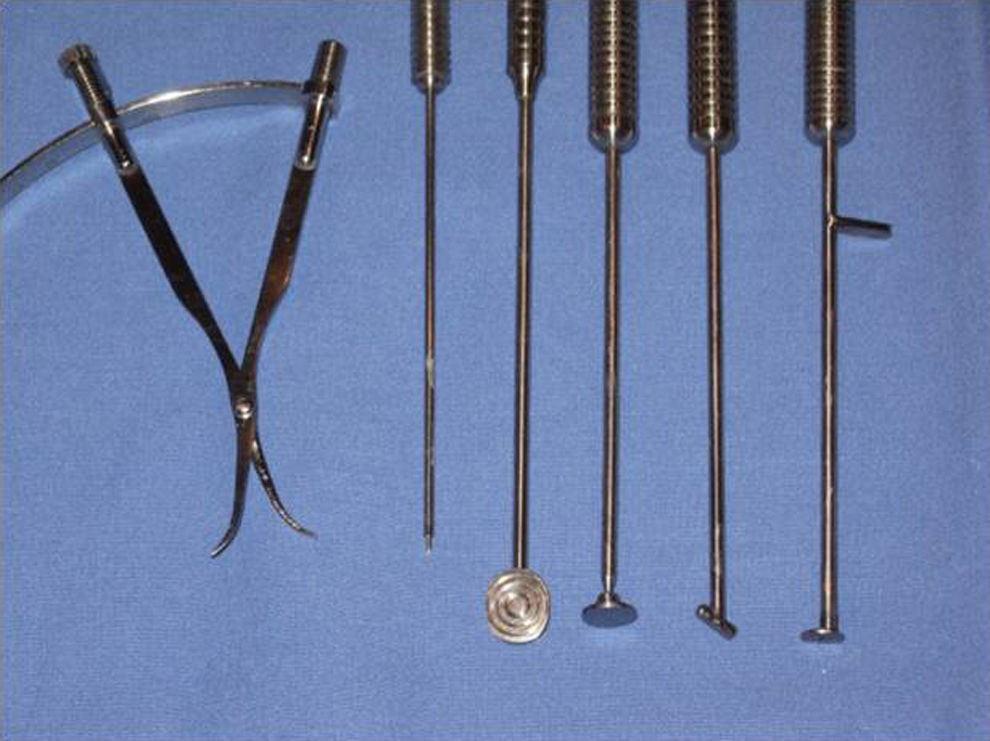
ResultadosUna de las ventajas de la técnica MACI es que puede realizarse empleando técnicas no invasivas, como es la artroscopia, empleando un instrumental diseñado y creado en nuestra unidad (fig. 1). El criterio para la realización del implante de condrocitos mediante cirugía abierta o artroscopia fue la accesibilidad a la lesión, de modo que se implantaron mediante cirugía abierta solo aquellas lesiones en las que era imposible acceder mediante artroscopia. En la serie de pacientes que describimos en este estudio se realizó la técnica por artroscopia en 53 de ellos (35,3%), mientras que en los 97 restantes (64,6%) se hizo por cirugía abierta mínimamente invasiva. En todos ellos, la membrana con las células se fijó, bien con fibrina, bien suturándola directamente al cartílago adyacente.
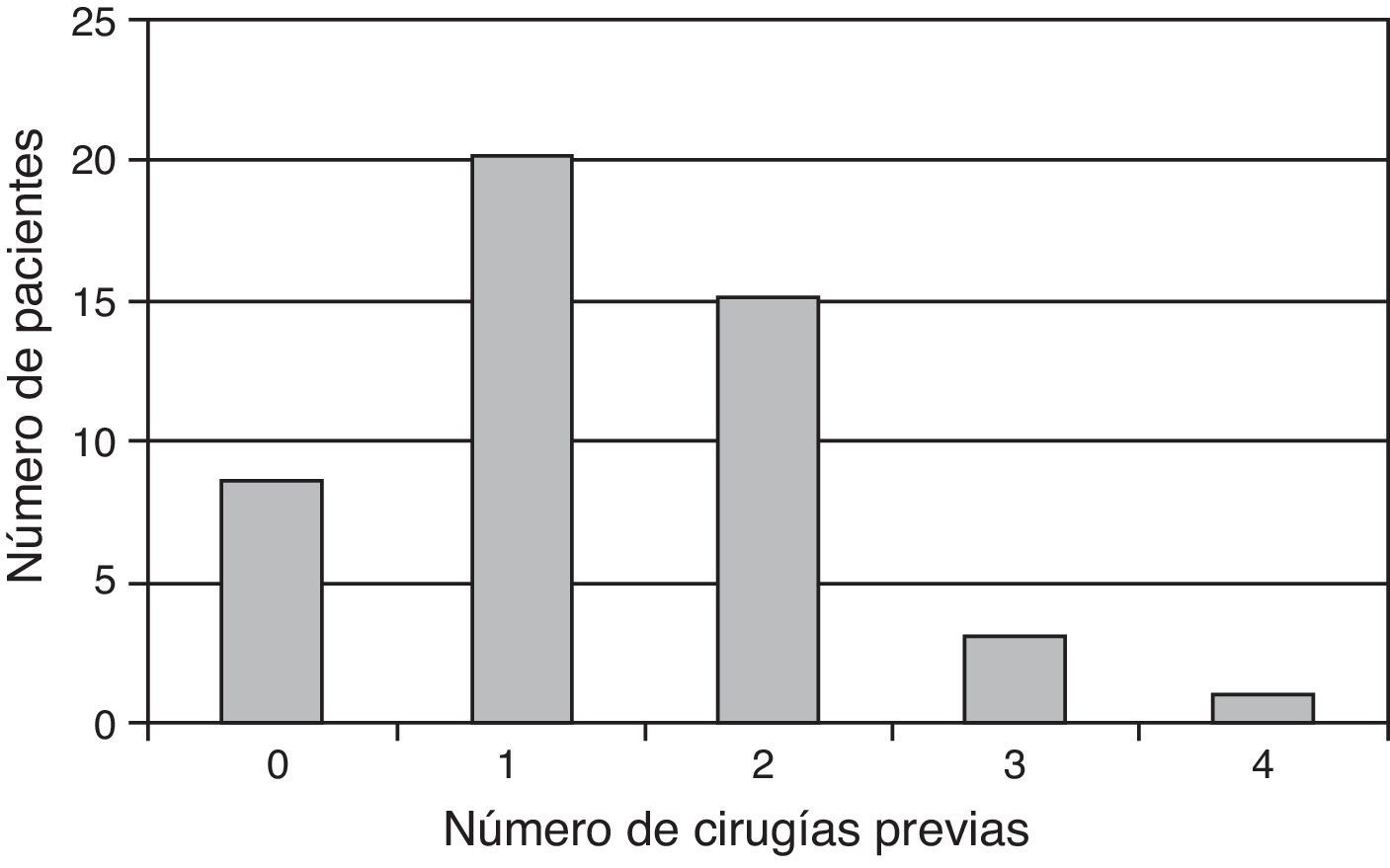
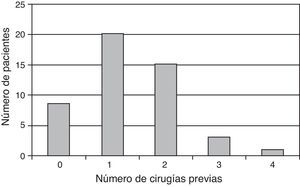
Los datos derivados de un periodo de seguimiento de 24 meses corresponden a 50 de los 150 pacientes incluidos en el estudio. Los pacientes tenían una edad media de 28,0±8,9 años, 39 de ellos (78%) eran hombres y los 11 restantes (22%) eran mujeres. En 18 de ellos el implante de condrocitos se realizó por artroscopia. Con respecto a la localización de la lesión condral, en 42 casos (84%) se localizaba en la rodilla, mientras que en 8 (16%) lo hacía en el tobillo. Nueve de los pacientes no tenían antecedentes de cirugías anteriores, mientras que 41 de ellos habían sufrido una o más cirugías previas (fig. 2), incluyendo artroscopia (13 casos); cirugías indicadas para osteocondritis disecante, tales como microperforaciones, mosaicoplastia o abrasión (21 casos); cirugía para ligamento cruzado anterior (5 casos), y osteotomía (2 casos). El diámetro de la lesión condral era mayor de 3cm2 en el 40% de los casos. La mayoría de los pacientes (70%) tenían lesión única.
De los 50 pacientes seguidos durante 2 años, en la tabla 2 se muestra el número de ellos que se incluyen en cada categoría del dolor antes y después del implante de condrocitos. Cuando comparamos las distribución del número de pacientes en las 3 categorías del dolor antes y después de la cirugía encontramos que esta comparación es estadísticamente significativa (p=0,0000000003; Chi-cuadrado de Pearson). Así, la intensidad del dolor es estadísticamente mayor antes del implante que después de este. Tras la cirugía, el porcentaje de pacientes sin dolor o con dolor leve era del 74% en aquellos que solo tenían un defecto condral y del 66,7% en aquellos con más de una lesión condral (p=0,7363; Chi-cuadrado de Pearson). Con respecto a las cirugías previas, un 89% de los pacientes que no habían experimentado cirugías previas no tenían dolor después del implante MACI, mientras que este porcentaje se reducía al 66% en aquellos en los que sí se habían practicado intervenciones quirúrgicas previas (p=0,1721; Chi-cuadrado de Pearson).
Número de pacientes incluidos en cada una de las categorías de dolor antes y después del implante de condrocitos autólogos en membrana
| Categoría del dolor | Antes de la cirugía | Después de la cirugía |
|---|---|---|
| 0-3 (ligero) | 8 (16) | 35 (70) |
| 3-6 (moderado) | 10 (20) | 13 (26) |
| 6-10 (severo) | 32 (64) | 2 (4) |
Datos expresados como n (%).
p=0,0000000003 (Chi-cuadrado de Pearson).
Antes de la cirugía, todos los pacientes presentaban una movilidad muy limitada por dolor. Sin embargo, después del implante de condrocitos, la movilidad fue totalmente recuperada en 46 pacientes (92%), mientras que 4 (8%) presentaban una movilidad ligeramente limitada (habían perdido los últimos grados de flexión). El periodo de baja laboral fue menor de 6 meses en el 64% de los casos.
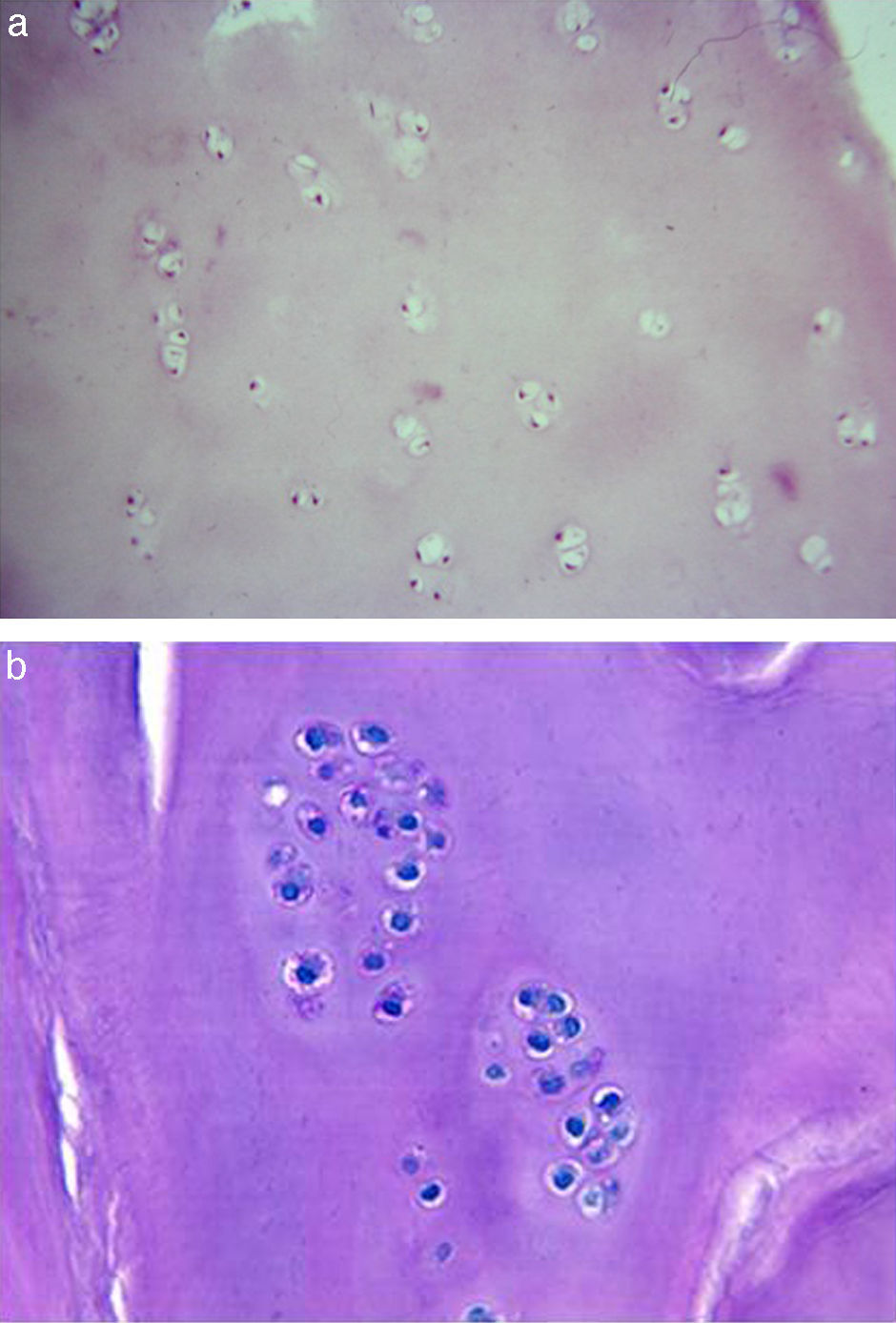
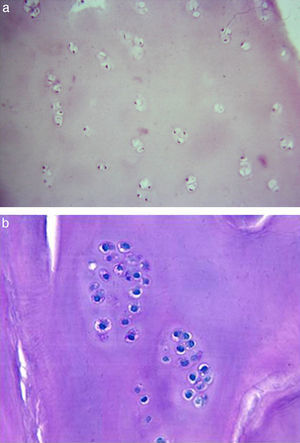
Análisis histológicoEn el segundo año de seguimiento se realizó una artroscopia a 5 de los 50 pacientes tratados con MACI en los que se llevó a cabo el seguimiento (3 con implante celular en tobillo, 2 con implante en rodilla), tomando una biopsia del tejido regenerado para la realización de un análisis histológico. Este mostró la presencia de una matriz constituida por cartílago hialino. La distribución celular muestra a los condrocitos rodeados de matriz cartilaginosa, presentando una distribución en forma de columna-cluster, solo cluster, y en algunas áreas, tipo columnar, similar a la que aparece en el cartílago normal. La formación de clusters de condrocitos es consecuencia de la mitosis reciente de las células que aún no han producido suficiente matriz como para separarse. La viabilidad celular es, en general, elevada, aunque lo que sí se observa es una menor celularidad, es decir, el número de células que conforman el nuevo tejido regenerado es menor que el observado en muestras control (fig. 3).
DiscusiónEn 1994, Brittberg et al. publicaron un trabajo en el que se describía el uso de cultivos de condrocitos autólogos (ACI) para tratar lesiones condrales5. La fuente de condrocitos era una pequeña biopsia de cartílago sano tomada en una zona de no carga, y después de la purificación y el cultivo de las células, estas se implantaban en el defecto bajo una membrana de periostio. Existen numerosas publicaciones en las que se describen resultados excelentes en pacientes con defectos condrales tratados con ACI6,21–25. Sin embargo, esta técnica presenta también numerosos problemas, la mayoría de ellos relacionados con el uso de periostio para contener las células en el defecto. En primer lugar, la recogida de periostio puede ser problemática en pacientes mayores de 35 años26. Otro problema descrito es que la sutura del periostio puede dañar el cartílago sano circundante a la lesión27. Wood et al.28 han descrito, en una serie de 294 pacientes tratados con ACI y sutura del periostio, un gran número de eventos adversos, incluyendo fallo del injerto en un 25% de la serie y la aparición de tejido hipertrófico en un 22% de los pacientes.
Se puede evitar el uso de periostio sembrando las células sobre un transportador biocompatible. Uno de los más utilizados es la membrana de colágeno tipo i/iii de origen porcino desarrollada por la compañía Geistlich. De este modo, en la técnica del implante de condrocitos autólogos inducidos por matriz, los condrocitos se siembran en la membrana a una densidad de un millón de células por cm2, y luego se corta una porción de membrana de la misma forma y tamaño que la lesión, que se implanta en el defecto condral. La utilización de un material rígido como esta membrana de colágeno para transportar las células a la lesión nos permite implantarlas mediante artroscopia29. Las ventajas de este método son las siguientes: es un método semiinvasivo, el tiempo de cirugía es más corto, y el tiempo de recuperación, más rápido.
En nuestra serie de 150 pacientes que se trataron con MACI, a un 35% se les practicó el implante mediante artroscopia. Presentamos los resultados del seguimiento a 2 años de 50 pacientes, en 18 de los cuales (36%) el implante se realizó mediante artroscopia. En una gran mayoría de ellos el dolor decreció y casi todos ellos recuperaron la movilidad tras el implante. Hemos comprobado que el resultado clínico final depende más del número de cirugías previas que del número de defectos condrales. Así, un 89% de los pacientes sin cirugías previas no presentaba dolor, mientras que el porcentaje de pacientes sin dolor era de tan solo un 66% en los pacientes con cirugías previas, aunque la comparación no fue estadísticamente significativa probablemente debido al limitado número de pacientes incluidos en el estudio. De todos modos, el porcentaje de pacientes sin dolor fue similar independientemente de presentar uno o varios defectos condrales (71,4 frente al 66,7%), y esta tendencia probablemente no se espera que varíe aunque se analicen un gran número de pacientes. Resultados similares han sido publicados por otros autores (72% de resultados buenos o excelentes) en el seguimiento a un año de pacientes tratados con MACI14. Estos mismos autores encuentran que en un 51% de ellos se puede observar cartílago similar al hialino tras un año de seguimiento. Por tanto, estos autores encuentran que los resultados del MACI son muy similares a los que se han publicado para el ACI. Sin embargo, otros autores han publicado que el porcentaje de cartílago similar al hialino producido después de un MACI es menor que el que se encuentra tras un implante ACI30. Estos resultados están en consonancia con los obtenidos tras el análisis histológico de las 5 biopsias obtenidas a los 2 años de seguimiento de MACI. En ellas se observan trazas de cartílago hialino con los condrocitos distribuidos en clusters, pero con una celularidad menor que en el cartílago normal. Una de las razones que podrían explicar esta discrepancia sería el número de células implantado en cada uno de los 2 procedimientos. Con el ACI, el número de células que se implantan es de al menos 20 millones, mientras que con el MACI solo implantamos 20 millones de células cuando la lesión tiene 20cm2, pues la densidad celular implantada mediante este procedimiento es de un millón de células por cm2 de lesión. Las lesiones condrales de los pacientes que se tratan en nuestro centro tienen como media un tamaño de 2×3cm, es decir, 6cm2, así que con la técnica MACI estamos implantando 6 millones de células, 14 millones de células menos que si utilizáramos ACI. Para evitar este problema hemos desarrollado un nuevo método para incrementar el número de células que se implantan en las lesiones condrales, que hemos denominado Instant Cemtrocell.
Se realizaron experimentos en el modelo de la oveja, donde se comprobó que el aumento de dosis proporcionaba cartílago hialino similar al normal15. Hasta el momento se han tratado más de 100 pacientes con Instant Cemtrocell con muy buenos resultados (basados en criterios clínicos y mejoría de las escalas de valoración), aunque no se publicarán hasta que no se disponga de datos de una media de 2 años de seguimiento en un número adecuado.
En conclusión, la utilización en nuestros pacientes de MACI artroscópico nos proporcionó muy buenos resultados con respecto al alivio del dolor. Sin embargo, dados nuestros resultados histológicos, pensamos que el número de células es importante para obtener mejores resultados; por ello, hemos desarrollado una modificación del MACI llamada Instant Cemtrocell en la que se incrementa el número de células para utilizar una densidad celular similar a la del ACI.
FinanciaciónEste trabajo ha sido financiado con una ayuda de la Fundación Pedro Guillén.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.