El sarcoma histiocítico (SH), término acuñado por Mathé et al.1, también se conoce como linfoma histiocítico verdadero. Es una neoplasia maligna muy rara y de causa desconocida. Está clasificado dentro de histiocitosis no-Langerhans, presentándose de forma esporádica o junto con otros desórdenes hematológicos. Se expone un caso clínico y una revisión de la literatura actual, haciendo incapié en casos con localización en cabeza y cuello, en el diagnóstico inmunohistoquímico y el manejo general.
Caso clínicoVarón de 55 años, fumador y bebedor moderado, con antecedentes de hamartoma pulmonar intervenido. Es diagnosticado de carcinoma epidermoide infiltrante no queratinizante en paladar blando-amígdala derecha (pT3N1M0). Se realiza exéresis, disección cervical funcional derecha, reconstrucción con colgajo libre radial que fracasa, y un pectoral de rescate. Recibe 66Gy de radioterapia adyuvante por un margen afectado y 1/20 ganglios positivo.
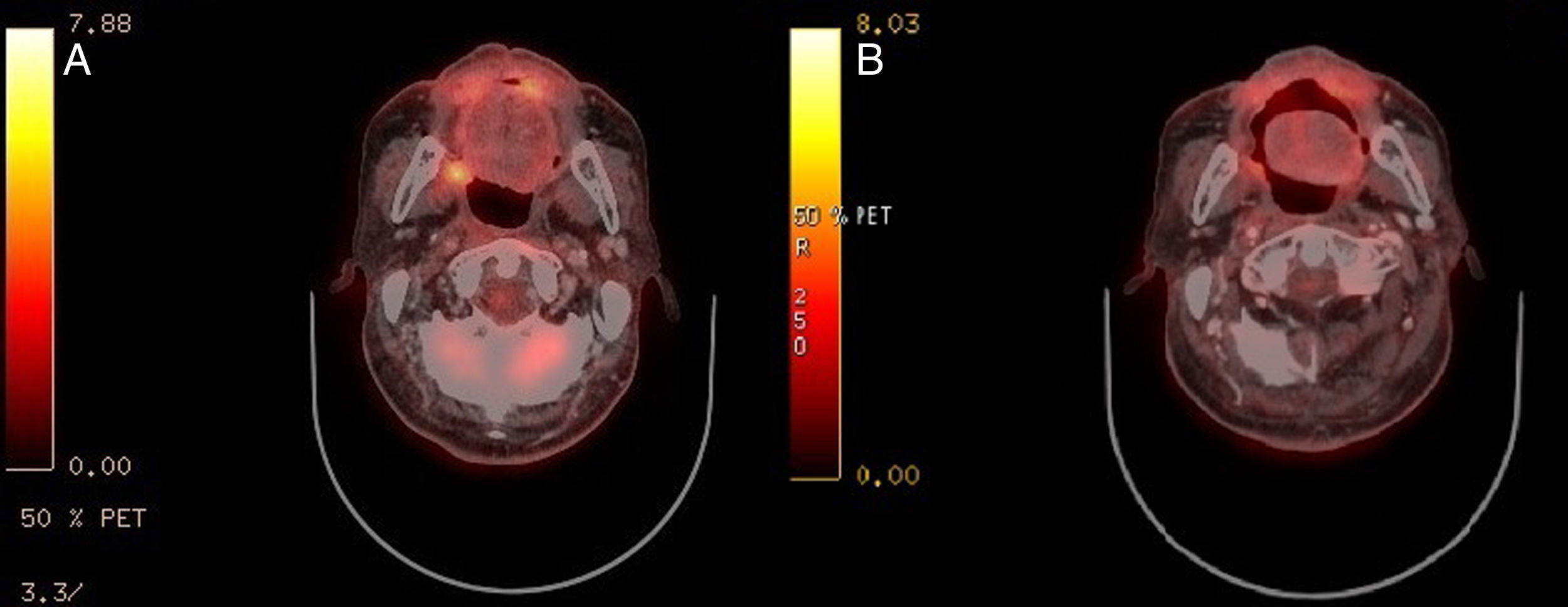
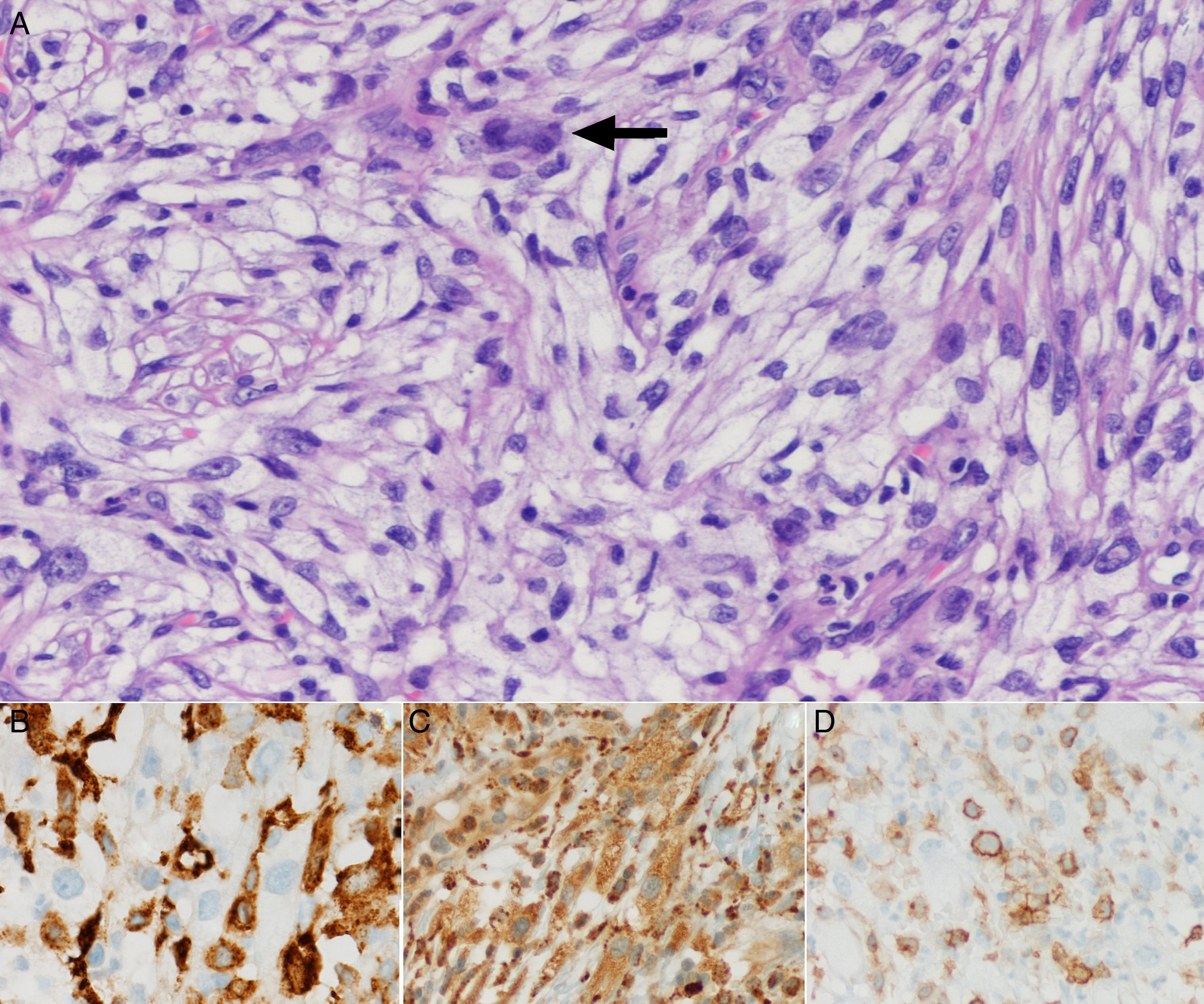
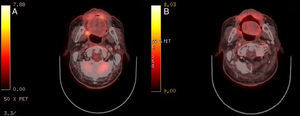
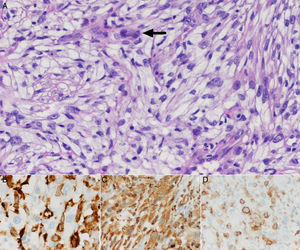
Tras 7 años y 3 meses de controles no hay sospecha de recidiva; únicamente se halla un nódulo pulmonar (NP) sin traducción metabólica, hasta que aparece una lesión exofítica polipoide de 16×12mm en zona intervenida, sin otros síntomas. La biopsia incisional informa de mucosa ulcerada con abundante componente inflamatorio y cicatricial, hiperplasia epitelial y queratosis. El Positron Emission Tomography-Computed Tomography (PET-CT) (fig. 1A) evidencia una captación SUVmáx 5,0 en la lesión, varios ganglios cérvico-torácicos reactivos y NP estable. Los análisis bioquímico, hematológico y coagulación son normales. Se realiza exéresis de la lesión y cierre directo. Los resultados anatomopatológicos iniciales no son concluyentes, y se amplía el estudio con marcadores inmunohistoquímicos, compatibles con SH (fig. 2):
- −
Positivos: CD45, CD45RO, CD163, CD68, CD4, lisozima y vimentina.
- −
Negativos: CAM 5.2, CD21, CD1a, CD30, EMA, ALK, CD20, CD3, actina, desmina, calponina, mieloperoxidasa, CD99, CD34, CD31, Bcl2, enolasa, c-Kit, AE1/AE3, HMB45, Melan-A y S-100.
- −
Índice proliferativo Ki67: 15%.
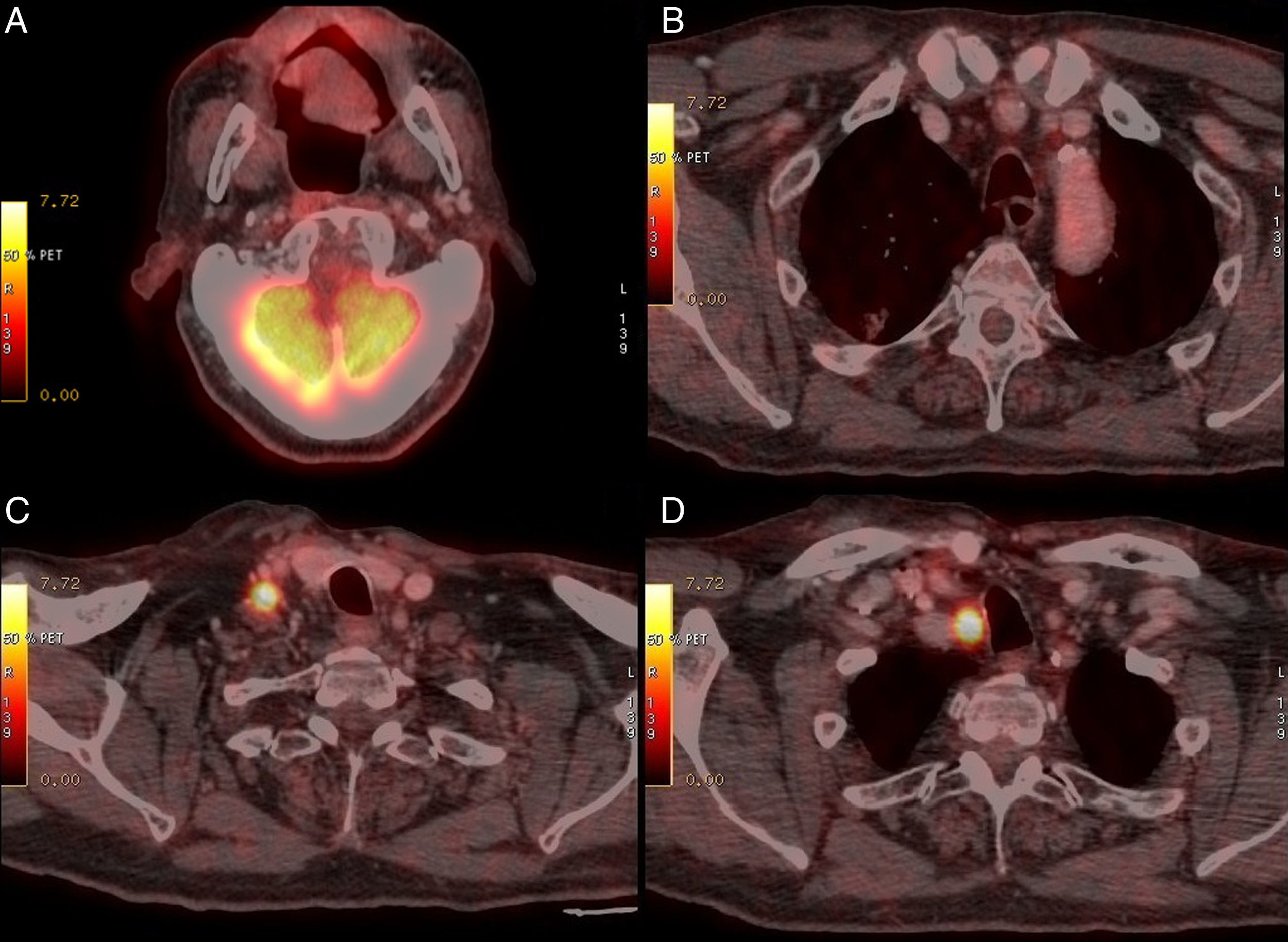
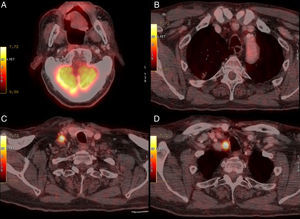
En el PET-CT (fig. 1B) 2 meses posquirúrgico, persiste la captación SUVmáx 3,7 en el lecho, disminución de adenomegalias y NP sin cambios. Se decide actitud expectante con controles periódicos. Tras 12 meses, otro PET-CT (fig. 3) no muestra cambios intraorales, pero el NP progresa definiéndose como adenocarcinoma lepídico, y aparecen ganglios cérvico-torácicos SUVmáx 9,3 y 11,0 que se biopsian, con resultado de carcinoma epidermoide poco diferenciado. Actualmente, el paciente está en tratamiento radioterápico de la enfermedad ganglionar.
DiscusiónLos sarcomas, en general, son una estirpe tumoral derivada de células mesenquimales que pueden afectar a casi cualquier tejido. Su prevalencia e incidencia son bajas, por debajo del 1% de los tumores en región de cabeza y cuello2. Aquellos con diferenciación a líneas celulares hematológicas, se clasifican más rigurosamente dentro de procesos linfoproliferativos3.
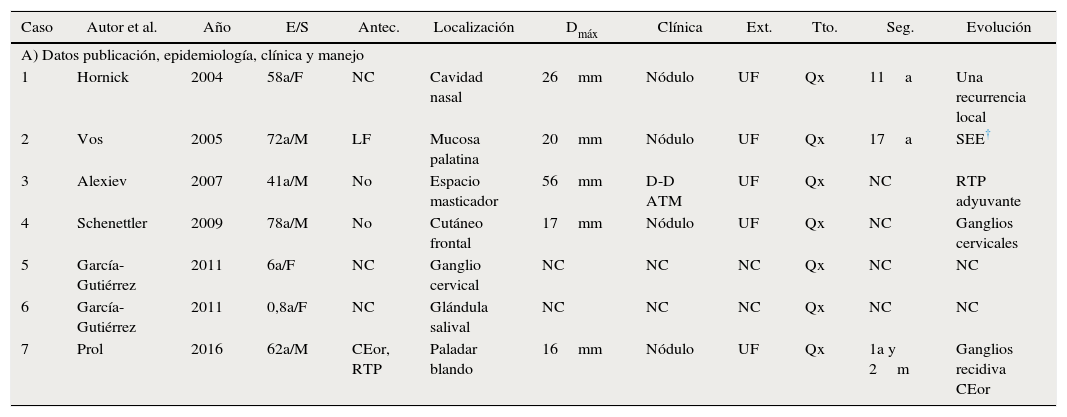
El SH es una enfermedad mal conocida, a pesar de los avances en inmunología y biología molecular, por los pocos casos reportados. La mayoría de los publicados antes de los años 90, correspondían realmente a linfomas no-Hodgkin mal tipificados4. Los estudios actuales con inmunohistoquímica validada son series cortas de pacientes: 14 de Hornick et al.5, 6 de García-Gutiérrez et al.6 y 5 de Vos et al.7; además de casos clínicos aislados8,9. Se analizan los casos publicados con localización en cabeza y cuello (tabla 1A), coincidiendo la mayoría en ser unifocales, los marcadores inmunohistoquímicos, y cirugía como tratamiento de primera línea.
Revisión de casos de SH en cabeza y cuello
| Caso | Autor et al. | Año | E/S | Antec. | Localización | Dmáx | Clínica | Ext. | Tto. | Seg. | Evolución |
|---|---|---|---|---|---|---|---|---|---|---|---|
| A) Datos publicación, epidemiología, clínica y manejo | |||||||||||
| 1 | Hornick | 2004 | 58a/F | NC | Cavidad nasal | 26mm | Nódulo | UF | Qx | 11a | Una recurrencia local |
| 2 | Vos | 2005 | 72a/M | LF | Mucosa palatina | 20mm | Nódulo | UF | Qx | 17a | SEE† |
| 3 | Alexiev | 2007 | 41a/M | No | Espacio masticador | 56mm | D-D ATM | UF | Qx | NC | RTP adyuvante |
| 4 | Schenettler | 2009 | 78a/M | No | Cutáneo frontal | 17mm | Nódulo | UF | Qx | NC | Ganglios cervicales |
| 5 | García-Gutiérrez | 2011 | 6a/F | NC | Ganglio cervical | NC | NC | NC | Qx | NC | NC |
| 6 | García-Gutiérrez | 2011 | 0,8a/F | NC | Glándula salival | NC | NC | NC | Qx | NC | NC |
| 7 | Prol | 2016 | 62a/M | CEor, RTP | Paladar blando | 16mm | Nódulo | UF | Qx | 1a y 2m | Ganglios recidiva CEor |
| Caso | CD45 | CD163 | CD68 | Lisozima | CD4 | S-100 | CD21 | CD1a | CD30 | EMA | CD20 | CD3 | Cit | Mel | Ki67 | PET-CT |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| B) Inmunohistoquímica y PET-CT | ||||||||||||||||
| 1 | + | NC | + | + | + | − | NC | NC | NC | NC | NC | NC | NC | NC | NC | NC |
| 2 | + | + | + | + | NC | − | − | − | − | − | − | − | − | − | 5% | NC |
| 3 | + | + | + | + | + | − | − | − | NC | − | − | − | NC | NC | 70% | SUVmáx 9,2 |
| 4 | + | + | + | + | + | + | NC | NC | + | NC | − | − | − | − | NC | No |
| 5 | + | + | + | + | NC | − | − | − | NC | − | − | NC | − | NC | 15% | NC |
| 6 | + | + | + | + | NC | − | − | − | NC | − | − | NC | − | NC | 10% | NC |
| 7 | + | + | + | + | + | − | − | − | − | − | − | − | − | − | 15% | SUVmáx 5,0 |
a: años; Antec.: antecedentes de interés; CEor: carcinoma epidermoide oral; Cit: marcadores de citoqueratinas; Dmáx: diámetro máximo; D-D ATM: dolor-disfunción articulación temporo-mandibular; E/S: edad/sexo; Ext.: extensión; F: femenino; LF: linfoma folicular; M: masculino; m: meses; Mel: marcadores de melanoma; NC: no consta; Qx: cirugía; RTP: radioterapia; Seg.: seguimiento; Tto.: tratamiento incial; UF: unifocal.
No hay preferencias por edad o sexo para el SH, y tampoco existe evidencia de factores de riesgo genéticos o ambientales. Puede ser una enfermedad unifocal o sistémica, con manifestaciones clínicas inespecíficas, siendo en ocasiones la sospecha inicial una formación o captación anómala en pruebas de imagen de rastreo, o seguimiento de otra enfermedad. Los tejidos afectos pueden ser ganglios linfáticos o extranodales, a destacar piel, intestino y otros tejidos blandos3.
Para un diagnóstico de confirmación, se deben descartar enfermedades como histiocitosis de Langerhans, linfohistiocitosis hemofagocítica, sarcomas de células dendríticas, linfomas no-Hodgkin (anaplásico y B difuso de células grandes), carcinomas poco diferenciados y melanoma. Se necesita un estudio analítico bioquímico-hematológico, morfológico e inmunohistoquímico de una muestra de tejido afecto (preferible biopsia escisional), y radiológico de extensión3.
La morfología anatomopatológica5–7 con tinciones hematoxilina y eosina, se caracteriza en la mayoría de casos por un patrón difuso de crecimiento, células epitelioides con citoplasma eosinófilo grande, núcleos irregulares, cromatina granular, nucléolos prominentes, atipia marcada e infiltrado inflamatorio con neutrófilos y linfocitos.
La inmunohistoquímica5–7 (tabla 1B) se basa en positividad de CD45, y de otros 2 o más antígenos de diferenciación histiocítica (CD163, CD68, lisozima,…); ausencia de marcadores para células dendríticas (CD35, CD23, CD21, CD1a,...), propios de linfoma anaplásico (CD30, EMA,...), de linaje B (CD20,...), de linaje T (CD3,....), de citoqueratinas (AE1, AE3,...) y melanoma (HMB45, Melan-A,...). Por sobreposición inmunofenotípica CD4, S-100 u otros marcadores como los dendríticos, pueden estar presentes en algunos casos. El índice proliferativo Ki67 es muy variable.
El PET-CT10 con marcador 18-fluorodeoxiglucosa se emplea como prueba complementaria en histiocitosis no-Langerhans, sin embargo su papel en SH no está bien definido. Su utilidad podría ser para rastreo de extensión, evaluación de tratamiento recibido y control de recurrencias con mayor precisión que un CT convencional, sobre todo en los casos de diseminación por ganglios linfáticos, más ávidos por glucosa que otros tejidos.
Aunque no existe un protocolo de manejo específico del SH, la tendencia es a realizar cirugía en enfermedad unifocal, opcional radioterapia adyuvante, quimioterapia o actitud expectante con controles clínico-radiológicos periódicos. En casos sistémicos se opta por quimioterapia semejante a la empleada en linfomas agresivos, por ejemplo asociación de cyclophosphamide-doxorubicin-vincristine-prednisone (CHOP). Otras opciones son nuevos fármacos biológicos, inscripción en ensayos clínicos o uso compasivo de fármacos. El pronóstico parece ser peor para formas sistémicas o unifocales de gran tamaño o recidivantes3.
ConclusionesEl SH es una enfermedad infrecuente y poco estudiada, con diagnóstico y manejo complejos. La localización intraoral, como nuestro caso, es anecdótica. Para el diagnóstico se requiere un análisis inmunohistoquímico exhaustivo, con positividad para CD45 y 2 marcadores de histiocitos, previo descarte de otros procesos linfoproliferativos y neoplasias poco diferenciadas. El papel del PET-CT respecto al CT convencional para estudio de extensión y seguimiento es controvertido. No existe consenso para el tratamiento, optando en general por cirugía en casos unifocales, y quimioterapia en sistémicos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de intereses.
Al jefe y todos los adjuntos del Servicio de Cirugía Oral y Maxilofacial, y al Dr. Ayman Gaafar Eleraky de Anatomía Patológica del Hospital Universitario Gurutzeta/Cruces.