El síndrome de plaquetas pegajosas (SPP) es un trastorno que se traduce en una serie de fenómenos protrombóticos a expensas de hiperagregabilidad plaquetaria. Es un trastorno raro y, a pesar de que puede ser identificado eficazmente mediante agregometría plaquetaria, se desconoce la etiología. Algunas publicaciones indican que el 20% de los eventos vaso-oclusivos arteriales corresponden a casos asociados al SPP. El SPP constituye un trastorno inusual; los pocos reportes oscurecen la prevalencia de esta entidad. Tiene implicación en el fracaso de colgajos libres e injertos por la formación de microtrombos. El propósito de este artículo es presentar 2 casos remitidos al Servicio de Cirugía Oral y Maxilofacial Pediátrica. Adicionalmente, se presenta una revisión actualizada sobre la etiología y diagnóstico de esta condición.
Sticky platelet syndrome (SPS) is a disorder that is associated with a series of arterial and venous prothrombotic events due to of platelet hyperaggregability. It's a rare condition, and even though there are efficient platelet aggregometry methods to diagnose the disorder, the underlying pathophysiology remains unclear. Some publications suggest that approximately 20% of vaso-occlusive events are of SPS origin. SPS is an unusual condition; the limited number of reports contributes to the lack of documentation regarding this syndrome. SPS is associated with maxillofacial free flap and graft failures due to thrombi formation. The purpose of this article is to present 2 cases of SPS seen in the Pediatric Oral and Maxillofacial Surgery Department together with a review on the etiology and diagnostic features of SPS.
El síndrome de plaquetas pegajosas (SPP) es una enfermedad autosómica dominante que se manifiesta a través de eventos tromboembólicos venosos o arteriales, asociada a hiperagregación plaquetaria1. Esta hiperagregación se presenta como una reacción anormal de las plaquetas frente a bajas concentraciones de adenosín difosfato (ADP) y epinefrina, mientras que la reacción a otros inductores de la agregación se mantiene normal. Es una condición que se mantiene subclínica y llega a manifestarse únicamente frente a la presencia de esas moléculas, traduciéndose en eventos vaso-oclusivos trombóticos. Esto se puede presentar de manera recurrente aun cuando el paciente se encuentre bajo tratamiento médico con antiagregantes orales.
En los pacientes no diagnosticados, el estímulo quirúrgico que normalmente provoca un incremento en la liberación de catecolaminas puede producir eventos isquémicos transitorios, infarto de miocardio, trombosis venosas o incluso la muerte. De igual manera, el éxito de procedimientos reconstructivos en la región maxilofacial como los colgajos microvasculares también se ve comprometido cuando coexiste esta trombofilia.
Es la segunda trombofilia más frecuente después del síndrome antifosfolípido2, sin embargo, la prevalencia del SPP no es clara en Latinoamérica, debido a la poca documentación de casos que existe en la literatura y la pobre correlación de eventos trombóticos arteriales y venosos. A continuación, presentamos un reporte de 2 casos diagnosticados con SPP remitidos al Servicio de Cirugía Oral y Maxilofacial Pediátrica de la Fundación Hospital de la Misericordia. Adicionalmente, se presenta una revisión de la literatura con un enfoque al diagnóstico y manejo.
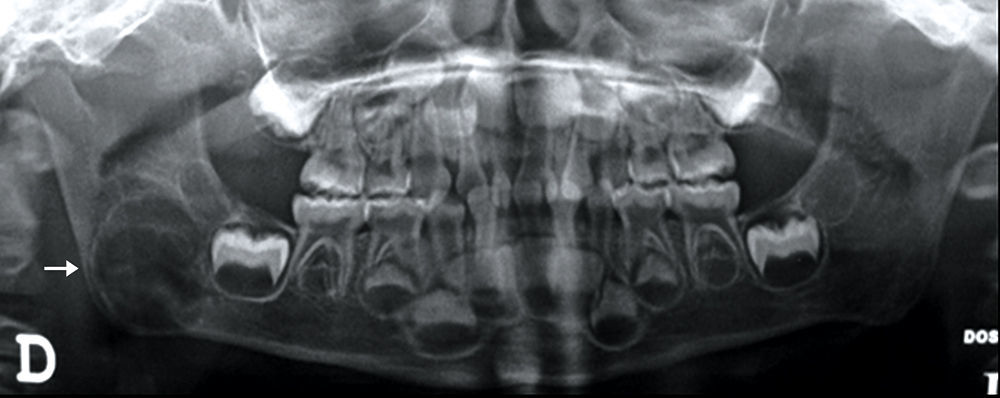
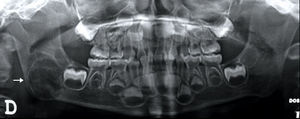
Caso 1Un paciente masculino de 3 años de edad es remitido al Servicio de Cirugía Oral y Maxilofacial Pediátrica de la Fundación Hospital de la Misericordia para valoración de masa en hemimandíbula derecha el 6 de marzo de 2012. La madre del paciente negó otros antecedentes de relevancia. El examen físico reveló aumento del volumen en hemimandíbula derecha en zona de ángulo mandibular, indurado no doloroso a la palpación. La radiografía panorámica mostró un proceso osteolítico multilocular que compromete ángulo y rama mandibular derechos (fig. 1). Fue programado para biopsia incisional de la lesión bajo anestesia general el 9 de abril de 2012. Los exámenes paraclínicos prequirúrgicos se presentan en la tabla 1. Se realiza infiltración anestésica con lidocaína al 2% con epinefrina 1: 80.000 en surco vestibular inferior derecho. No se presentaron inconvenientes durante el procedimiento quirúrgico, sin embargo, en el postoperatorio inmediato, el paciente fue ingresado en la Unidad de Cuidados Intensivos Pediátricos (UCIP), con diagnóstico de choque hipovolémico y trombocitopenia, requiriendo soporte inotrópico entre otras medidas. El paciente es trasladado a hospitalización después de 7 días de manejo en la UCIP. El mismo día del traslado sufre un episodio de convulsiones tónicoclónicas, por lo cual es trasladado nuevamente a UCIP para el estudio de la etiología de dicho episodio.
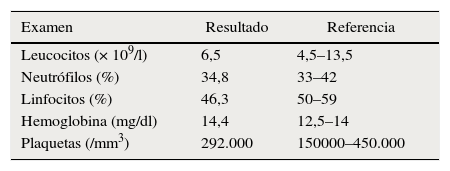
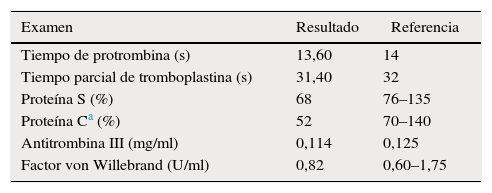
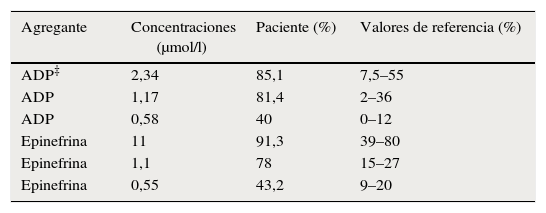
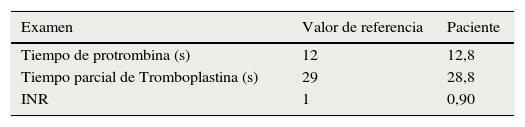
Debido a múltiples episodios convulsivos, lesiones subcorticales asociadas a embolismo, trombosis venosa superficial de miembros inferiores y trombocitopenia se inician estudios para confirmar la etiología de los eventos, con paraclínicos de coagulación y hemostasia normales (tabla 2). Posteriormente a la realización de exámenes de agregometría plaquetaria, se confirma el diagnóstico de SPP (tabla 3) confirmándose SPP tipo I. Se remite a Hematología para valoración y manejo, quienes inician terapia antitrombótica con heparina de bajo peso molecular tipo daltaheparina 2.500 UI cada día. Se da egreso del paciente, quien se encuentra actualmente estable. El resultado del análisis histopatológico de la lesión mandibular reportó mixofibroma odontogénico.
Paraclínicos de hemostasia y coagulación. Caso 1
| Examen | Resultado | Referencia |
|---|---|---|
| Tiempo de protrombina (s) | 13,60 | 14 |
| Tiempo parcial de tromboplastina (s) | 31,40 | 32 |
| Proteína S (%) | 68 | 76–135 |
| Proteína Ca (%) | 52 | 70–140 |
| Antitrombina III (mg/ml) | 0,114 | 0,125 |
| Factor von Willebrand (U/ml) | 0,82 | 0,60–1,75 |
mg/ml: miligramos/mililitros; s: segundos; U/ml: unidades de actividad enzimática por mililitro.
La proteína C (PC) es una glucoproteína vitamina K dependiente, de síntesis hepática. En pacientes con deficiencia de PC que presentan trombosis, se presenta trombosis venosa profunda en el 63% de los casos, tromboflebitis superficial en el 48% de los casos, embolismo pulmonar en el 40% de los casos.
Curva de agregación plaquetaria. Caso 1
| Agregante | Concentraciones (μmol/l) | Paciente (%) | Valores de referencia (%) |
|---|---|---|---|
| ADP‡ | 2,34 | 85,1 | 7,5–55 |
| ADP | 1,17 | 81,4 | 2–36 |
| ADP | 0,58 | 40 | 0–12 |
| Epinefrina | 11 | 91,3 | 39–80 |
| Epinefrina | 1,1 | 78 | 15–27 |
| Epinefrina | 0,55 | 43,2 | 9–20 |
ADP: adenosín difosfato; μmol/l: micromol por litro.
Una paciente femenina de 17 años de edad, diagnosticada con SPP tipo i 3 años antes de la consulta inicial, es remitida el 8 de octubre de 2012 al Servicio de Cirugía Oral y Maxilofacial Pediátrica de la Fundación Hospital de la Misericordia para exodoncia de terceros molares. Entre sus antecedentes importantes reveló un evento cerebrovascular isquémico a los 8 años, menarquia a los 12 años, herniorrafia inguinal bilateral y umbilical a los 11 años y antiagregación con 80mg de ácido acetilsalicílico cada día.
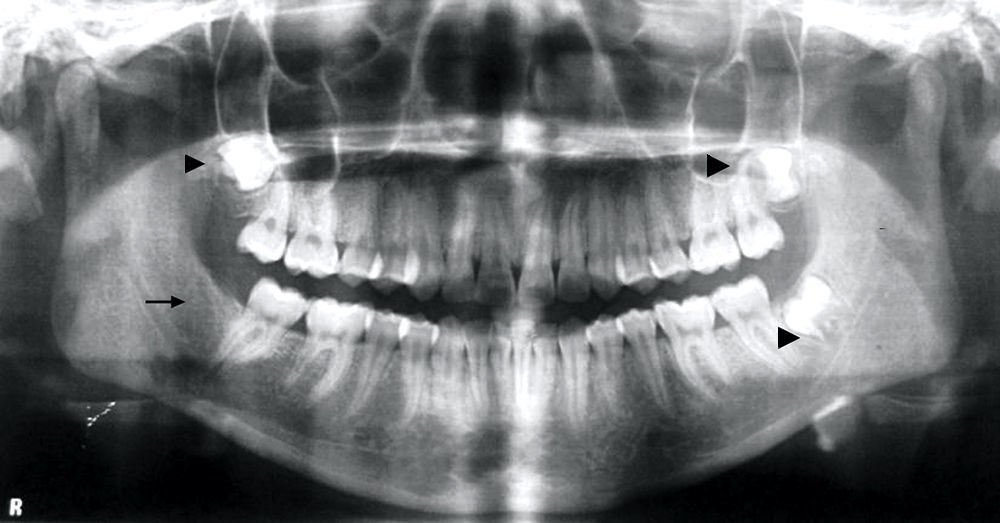
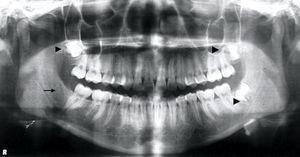
En el examen intraoral, se observaron mucosas sin enfermedad aparente, con ausencia clínica de terceros molares. La radiografía panorámica reveló terceros molares en evolución intraósea y agenesia de tercer molar inferior derecho. Diente 18 clase II C distoangular; 28 clase II C horizontal y 38 clase II B según la clasificación de Winter, Pell y Gregory3 (fig. 2).
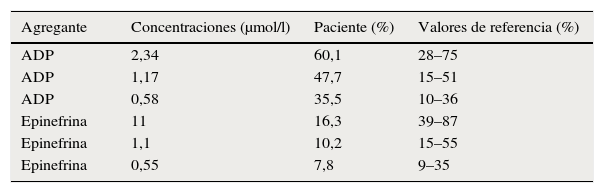
Es remitida al Servicio de Hematología en noviembre de 2012 para valoración por su antecedente sistémico. Ordenan laboratorios de hemostasia y coagulación (tabla 4) y curva de agregación plaquetaria (tabla 5). Frente a resultados de tiempos de coagulación, tromboelastograma y función plaquetaria normales, se autoriza el procedimiento con la orden de mantener la terapia antiagregante, utilizar antifibrinolíticos locales y evitar infiltración con anestésicos que contengan epinefrina.
Curva de agregación plaquetaria. Caso 2
| Agregante | Concentraciones (μmol/l) | Paciente (%) | Valores de referencia (%) |
|---|---|---|---|
| ADP | 2,34 | 60,1 | 28–75 |
| ADP | 1,17 | 47,7 | 15–51 |
| ADP | 0,58 | 35,5 | 10–36 |
| Epinefrina | 11 | 16,3 | 39–87 |
| Epinefrina | 1,1 | 10,2 | 15–55 |
| Epinefrina | 0,55 | 7,8 | 9–35 |
ADP: adenosín difosfato; μmol/l: micromol por litro.
El procedimiento se llevó a cabo en salas de cirugía bajo anestesia general el 30 de noviembre de 2012; se realizó infiltración anestésica local con bupivacaína al 0,5% sin epinefrina, con acceso a los sitios operatorios mediante colgajos mucoperiósticos y ostectomías, cursando con un período intraoperatorio normal, sin eventos hemorrágicos asociados. Se ordenó cefazolina 1g iv cada 6 h durante hospitalización. Se dio egreso a las 24 h de hospitalización sin complicaciones sistémicas.
DiscusiónEn 1986, Rubenfire et al.2 publican un estudio realizado en 41 pacientes adultos, quienes presentaban sintomatología dolorosa precordial; sin embargo, imagenológicamente, las angiografías no mostraban cambios patológicos. Los resultados de los análisis incluyeron hiperagregabilidad plaquetaria estadísticamente significativa comparados con 73 controles. En 1995, Mammen publica resultados con relación a un estudio que involucró a 200 pacientes de entre 5 y 45 años4.
Mammen se dedicó a realizar el estudio de la asociación intrafamiliar, encontrando trombosis de predominio arterial en varios casos, y una asociación autosómica dominante. En la mayoría de los pacientes no había factores de riesgo asociados. Para el diagnóstico de SPP, demostró la hiperagregabilidad plaquetaria, utilizando el ADP y epinefrina, modificando el método de turbidimetría (medición de la agregabilidad plaquetaria mediante la transmisión lumínica) descrito por Born en 1967.
Mammen4,5 clasifica el SPP en:
Tipo I: Hiperagregación con ADP y epinefrina
Tipo II: Hiperagregación con epinefrina
Tipo III: Hiperagregación con ADP.
El método más utilizado actualmente es el descrito por Mammen5. Se obtiene sangre del paciente en ayuno entre 8 y 10 de la mañana. Se desechan los primeros 5ml de sangre. Luego se aspiran 18ml en una jeringa de 20ml que contenga 2ml de una solución de citrato de sodio a 3,8%. Se centrifuga inmediatamente durante 10 min a 100 Gy a temperatura ambiental para obtener plasma rico en plaquetas (PRP). La mitad de este plasma se vuelve a centrifugar a 2.000 Gy durante 20 min a temperatura ambiente para obtener plasma pobre en plaquetas (PPP). Para las pruebas de agregación, el PRP se diluye con PPP para obtener una cuenta plaquetaria de 200 × 109/l.
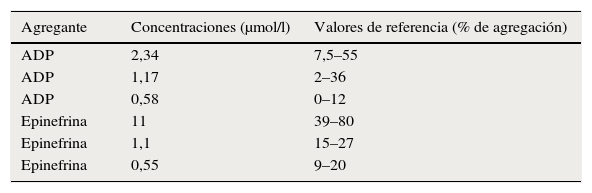
La agregación plaquetaria se mide en un agregómetro y se registran los cambios en la densidad óptica, manteniendo una temperatura de 37 °C y el agitador a velocidad constante. La agregación se induce con 3 concentraciones de 2 reactivos (tabla 6). La agregación máxima se expresa como el porcentaje de la transmisión de la luz calibrado para cada muestra. Se estudian controles normales para cada caso. Los valores anormales para la agregación plaquetaria con las 3 concentraciones de ADP (2,34; 1,17 y 0,58μmol) son variables, pero casi siempre están por encima de 55, 36 y 12%, respectivamente. Mientras que para las 3 concentraciones de epinefrina (11, 1,1y 0,55μmol) estos mismos valores están por encima de 80, 27 y 20%1,2,4–9.
Concentraciones de los reactivos y valores de referencia para diagnosticar el síndrome de plaquetas pegajosas3
| Agregante | Concentraciones (μmol/l) | Valores de referencia (% de agregación) |
|---|---|---|
| ADP | 2,34 | 7,5–55 |
| ADP | 1,17 | 2–36 |
| ADP | 0,58 | 0–12 |
| Epinefrina | 11 | 39–80 |
| Epinefrina | 1,1 | 15–27 |
| Epinefrina | 0,55 | 9–20 |
ADP: adenosín difosfato; μmol/l: micromol por litro.
La impresión diagnóstica de SPP se da cuando el paciente presenta hiperagregabilidad con un solo reactivo y a una sola concentración con historia de trombosis. El diagnóstico confirmatorio se realiza a través de una historia previa de trombosis e hiperagregabilidad plaquetaria con un solo reactivo a 2 concentraciones, o con una concentración en 2 reactivos, o con una concentración en un reactivo en 2 ocasiones de prueba1,2,4–9.
Las plaquetas contribuyen al mantenimiento de la integridad vascular y el control de la hemorragia. Después de una lesión, pueden ser activadas por una serie de agentes fisiológicos y farmacológicos, entre ellos: trombina, tromboxano A2, colágeno, factor de von Willebrand, calcio, ionóforos, análogos cíclicos de la endoperoxidasa. Los efectos de estos agentes se ejercen a través de su interacción con receptores específicos de membrana plaquetaria. Las plaquetas están involucradas en la patogénesis de los desórdenes tromboembólicos, especialmente las formas arteriales de trombosis9.
Los fármacos antiagregantes plaquetarios son los de elección para la prevención de eventos tromboembólicos en este grupo de pacientes. El ácido acetilsalicílico es el medicamento de elección con resultados favorables según algunas publicaciones10.
El ASA inhibe la agregación plaquetaria por la inhibición selectiva de la ciclooxigenasa plaquetaria, lo que disminuye la producción del tromboxano A2, lo que se traduce en disminución del riesgo de trombosis y normalización del patrón de agregación plaquetaria en la mayoría de los casos. En casos refractarios al manejo inicial, existe la opción del incremento de la dosis de ASA hasta de 325mg/ día para alcanzar la reducción del riesgo tromboembólico. La segunda opción de manejo incluye clorhidrato de ticlopidina en dosis de 250-500mg/ día11,12.
Cuando se suspende el tratamiento, aparecen nuevamente las alteraciones en las pruebas de laboratorio y aumenta el riesgo de evento vaso oclusivo. El SPP está asociado a una frecuencia aproximada de 30,6% de eventos venosos, y 60% de eventos arteriales13.
En Colombia se desconocen datos estadísticos que indiquen la frecuencia del SPP, sin embargo, han sido reportados casos de trombosis venosa profunda en pacientes gestantes que fueron posteriormente diagnosticadas con SPP10. En México, el SPP es la trombofilia más común, siendo la de tipo I la más frecuente, sin embargo en la literatura se afirma que existe una frecuencia similar para todos los subtipos de SPP13,14. En el caso 1 presentado en esta serie, se desconocía el diagnóstico de SPP. Los eventos trombóticos venosos de etiología desconocida que presentó en el postoperatorio llevaron a realizar estudios paraclínicos que finalmente condujeron al diagnóstico.
Los eventos tromboembólicos venosos se encuentran agrupados en 2 categorías: trombosis venosa profunda y tromboembolia pulmonar, con una morbimortalidad elevada a nivel mundial14. Los eventos tromboembólicos arteriales son los más graves.
Loeffelbein et al.15, en un reporte de caso de SPP en el Servicio de Cirugía Maxilofacial de la Technische Universitat Munchen en Alemania, evidenciaron trombosis arterial posterior a un procedimiento de reconstrucción microvascular mandibular. Se trataba de un paciente con antecedente de carcinoma escamocelular estadio T4 en zona retromolar izquierda, quien había sido asintomático en procedimientos previos a la reconstrucción. El fenómeno trombótico fue atribuido al SPP debido a la hiperreactividad plaquetaria evidenciada mediante las pruebas hematológicas de hiperagregación.
Mammen4–6 afirma que los pacientes con diagnóstico de SPP expresan signos identificables que los hacen susceptibles de padecer eventos trombóticos vasculares. La edad suele ser un factor de riesgo cuando el paciente es menor de 45 años, presenta eventos trombóticos en sitios poco comunes de etiología desconocida y estos son eventos repetitivos. Sin embargo, existen casos reportados en la literatura en los que los pacientes que padecen de SPP son asintomáticos en las primeras intervenciones y expresan clínicamente el síndrome con intervenciones quirúrgicas subsecuentes15. La paciente del caso 2 presentado en esta serie tenía ya el diagnóstico establecido, por lo que el manejo resultó sin complicaciones al seguir las recomendaciones del Servicio de Hematología.
En el campo de la cirugía maxilofacial y reconstructiva, algunos autores recomiendan una dosis mínima de ácido acetilsalicílico y heparina de bajo peso molecular profiláctica en aquellos pacientes con evidencia clínica de microtrombo en el postoperatorio inmediato de reconstrucción microvascular15. En los casos de reconstrucciones mediante injertos libres, el SPP podría jugar un papel importante en el fracaso de la integración de los injertos óseos. Con base en la fisiopatología de la enfermedad, la formación de trombos excluiría la posibilidad de una adecuada perfusión del sitio receptor al injerto y viceversa, comprometiendo el resultado y propiciando la pérdida del injerto. Sin embargo, es un tema que requiere más investigación.
Es importante tomar en consideración la recomendación de mantener la terapia antiagregante en este grupo de pacientes, y evitar la administración de vasoconstrictores como la epinefrina, pues este es uno de los agentes detonantes de la hiperagregación plaquetaria en el SPP.
ConclusionesDe manera paralela a las consecuencias sistémicas del SPP, las implicaciones en cirugía reconstructiva son claras. La formación de microtrombos debido a la hiperagregabilidad plaquetaria interfiere con la perfusión en colgajos libres y la integración de injertos óseos destinados a la reconstrucción de zonas del macizo facial.
Debido a las graves consecuencias para la salud, el SPP debe ser tomado en cuenta como parte de los diagnósticos diferenciales de las trombofilias. Es necesario contemplar la necesidad de investigaciones futuras que permitan conocer la prevalencia de esta condición en Latinoamérica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores niegan cualquier relación financiera o personal que pueda suponer conflicto de intereses.