Las infecciones necrosantes de partes blandas (NSTI), suponen un riesgo significativo de morbimortalidad. Debido a sus síntomas inespecíficos, es crucial mantener un alto índice de sospecha. El tratamiento implica un enfoque multidisciplinar con antibióticos de amplio espectro, desbridamiento quirúrgico precoz y radical, y soporte vital. En este estudio, analizamos las características clínicas y demográficas, las complicaciones y el tratamiento de las NSTI en un hospital de Madrid, España.
Material y métodosSe realizó un estudio observacional retrospectivo incluyendo a todos los pacientes con NSTI intervenidos en nuestro centro desde enero de 2016 hasta diciembre de 2022, donde se analizaron los datos epidemiológicos y clínicos. La escala laboratory risk indicator for necrotizing fasciitis (LRINEC) se calculó de manera prospectiva para todos los pacientes.
ResultadosSe incluyeron 22 pacientes (16 varones y 6 mujeres; edad media: 54,8). El tiempo medio desde el inicio de los síntomas hasta la consulta en urgencias fue de 3,5 días. Todos los pacientes presentaban dolor resistente al tratamiento y 16 presentaban fiebre mayor de 37,8°C (72,7%). Presentaban lesiones cutáneas 12 pacientes (54,5%) y 13 hipotensión y taquicardia (59,1%). El tratamiento consistió en soporte vital, antibioterapia y desbridamiento radical. El tiempo medio hasta la cirugía fue de 8,25h. Los cultivos intraoperatorios fueron positivos en 20 pacientes: 12 Streptococcus pyogenes, 4 Staphylococcus aureus y uno Escherichia coli. En 4 casos la infección fue polimicrobiana. La mortalidad intrahospitalaria fue del 22,73%.
ConclusionesEl enfoque multidisciplinar, incluyendo desbridamiento radical y terapia antibioterapia, sigue siendo la piedra angular del tratamiento de las NSTI. En este estudio no encontramos correlación significativa entre nuestros resultados, tasas de amputación y mortalidad con la puntuación de la escala LRINEC ni el tiempo hasta la cirugía. Nuestros resultados, estancia hospitalaria y tasa de mortalidad coinciden con lo reportado por la literatura, confirmando la alta morbimortalidad de estas infecciones a pesar del tratamiento precoz.
Necrotizing soft tissue infections (NSTI) are increasing, posing a significant risk of morbidity and mortality. Due to nonspecific symptoms, a high index of suspicion is crucial. Treatment involves a multidisciplinary approach, with broad-spectrum antibiotics, early surgical debridement, and life support. This study analyzes the characteristics, demographics, complications, and treatment of NSTI in a hospital in Madrid, Spain.
MethodsA retrospective observational study was conducted, including all surgically treated NSTI patients at our center from January 2016 to December 2022, examining epidemiological and clinical data. The Laboratory Risk Indicator for Necrotizing Fasciitis (LRINEC) was prospectively calculated for all patients.
ResultsTwenty-two patients (16 men, 6 women, mean age 54.8) were included. Median time from symptom onset to emergency room visit was 3.5 days. All reported severe treatment-resistant pain; sixteen had fever exceeding 37.8°C (72.7%). Skin lesions occurred in twelve (54.5%), and thirteen had hypotension and tachycardia (59.1%). Treatment involved resuscitative support, antibiotherapy, and radical debridement. Median time to surgery was 8.25h. Intraoperative cultures were positive in twenty patients: twelve Streptococcus pyogenes, four Staphylococcus aureus, one Escherichia coli, and four polymicrobial infection. In-hospital mortality rate was 22.73%.
ConclusionsWe examined the correlation between our results, amputation rates and mortality with LRINEC score and time to surgery. However, we found no significant relationship unlike some other studies. Nevertheless, a multidisciplinary approach with radical debridement and antibiotic therapy remains the treatment cornerstone. Our hospital stays, outcomes and mortality rates align with our literature review, confirming high morbimortality despite early and appropriate intervention.
Las infecciones necrosantes de partes blandas (NSTI) son infecciones rápidamente progresivas y destructivas que afectan a la piel, al tejido subcutáneo, a la fascia y al músculo, causando finalmente necrosis con elevada mortalidad y morbilidad a largo plazo. Actualmente, se estima una incidencia de 0,045 casos anuales por cada 1.000 individuos1,2. La tasa de mortalidad fluctúa del 7,6 al 16,6%3,4.
Para el diagnóstico, es esencial un alto índice de sospecha, ya que los síntomas son inespecíficos, siendo la fiebre y el dolor refractario al tratamiento las manifestaciones más comunes. Además, aproximadamente la mitad de los pacientes presentan lesiones cutáneas asociadas. Los principales factores de riesgo, incluyen diabetes mellitus, obesidad, inmunosupresión o abuso de alcohol. Sin embargo, también se han documentado casos de pacientes adultos jóvenes sin ningún factor de riesgo conocido5.
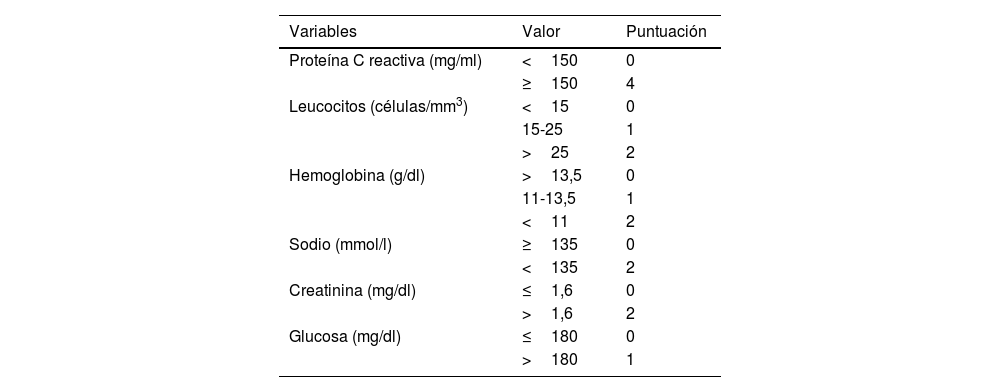
La escala Laboratory Risk Indicator for Necrotizing Fasciitis (LRINEC) es un sistema de puntuación basado en valores de laboratorio frecuentes, incluyendo recuento leucocitario, y concentraciones de hemoglobina, sodio, creatinina y glucosa, que se considera que tiene un alto valor predictivo positivo2,3. Además, la presencia de aire o burbujas, junto con el engrosamiento de la fascia, son hallazgos que respaldan adicionalmente el diagnóstico4.
El tratamiento debe llevarse a cabo por un equipo multidisciplinar, y se basa en la administración de antibióticos de amplio espectro, desbridamiento quirúrgico temprano y terapia de soporte vital.
El objetivo de este estudio es identificar los factores clínicos, analíticos y de imagen que contribuyen al diagnóstico y al tratamiento tempranos de los pacientes con NSTI. Realizamos un análisis retrospectivo de las características del paciente, presentaciones clínicas, tratamientos, complicaciones, mortalidad y su correlación con la puntuación LRINEC en nuestro hospital.
Pacientes y métodosRealizamos un estudio retrospectivo, que incluyó a todos los pacientes ingresados en nuestro hospital de Madrid (España) entre enero de 2016 y diciembre de 2022, sometidos a desbridamiento quirúrgico debido a infección necrosante. Recopilamos y analizamos información, incluyendo los datos demográficos, las comorbilidades preexistentes, los síntomas, los signos vitales, el tiempo transcurrido hasta la cirugía, microbiología y el resultado clínico. Se registraron los resultados clínicos, tales como las puntuaciones de dolor en la escala analógica visual, la capacidad de regresar al trabajo y la puntuación Functional Independence Measure (FIM), transcurrido un año de la infección.
El estudio fue realizado siguiendo los estándares éticos destacados en la Declaración de Helsinki y la resolución 008430 de 1993, con la aprobación del Comité de ética de nuestra institución (código de aprobación interna 24/005-E). Además, se informó del estudio a todos los pacientes incluidos en él, obteniéndose su consentimiento para participar en el mismo.
Se calculó la escala LRINEC para cada paciente en el momento del ingreso (tabla 1)6. A todos los pacientes se les realizó un desbridamiento quirúrgico precoz y se les administró tratamiento antibiótico de amplio espectro de forma inmediata, que se ajustó posteriormente en función del resultado de los cultivos.
Laboratory Risk Indicator for Necrotizing Fasciitis (LRINEC)
| Variables | Valor | Puntuación |
|---|---|---|
| Proteína C reactiva (mg/ml) | <150 | 0 |
| ≥150 | 4 | |
| Leucocitos (células/mm3) | <15 | 0 |
| 15-25 | 1 | |
| >25 | 2 | |
| Hemoglobina (g/dl) | >13,5 | 0 |
| 11-13,5 | 1 | |
| <11 | 2 | |
| Sodio (mmol/l) | ≥135 | 0 |
| <135 | 2 | |
| Creatinina (mg/dl) | ≤1,6 | 0 |
| >1,6 | 2 | |
| Glucosa (mg/dl) | ≤180 | 0 |
| >180 | 1 |
LRINEC: riesgo bajo<6; riesgo moderado 6-7; riesgo alto>7. Valores de referencia: PCR<10mg/ml; recuento leucocitario 4-10,5mm3; hemoglobina 12-16g/dl; sodio 135-145mmol/l; creatinina 0,51-0,95mg/dl; glucosa 60-100mg/dl.
Las variables continuas se resumen con la media y desviación estándar o mediana y rango intercuartílico (RIC), mientras que los datos categóricos se expresaron como frecuencias y porcentajes. El análisis estadístico se realizó utilizando las pruebas ANOVA y de probabilidad exacta de Fisher, mediante el software SPSS®.
Los autores, o sus familiares inmediatos, así como cualquier fundación investigadora a la que estuvieran afiliados, no recibieron ningún pago financiero ni demás beneficios de ninguna entidad comercial relacionada con el objeto de este artículo.
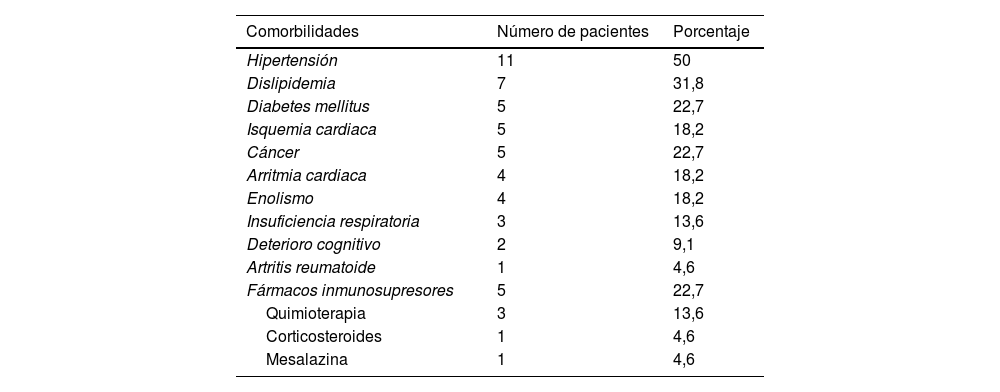
ResultadosVeintidós pacientes fueron incluidos en el estudio, siendo 16 varones y 6 mujeres. La edad media fue de 54,8 años (DE: 14,2). Entre los participantes, 5 tenían diabetes (22,7%), 4 eran alcohólicos activos (18,2%) y 5 seguían terapia inmunosupresora (22,7%): 3 pacientes recibían quimioterapia, uno recibía mesalazina y uno tomaba prednisona para su artritis reumatoide (tabla 2).
Comorbilidad
| Comorbilidades | Número de pacientes | Porcentaje |
|---|---|---|
| Hipertensión | 11 | 50 |
| Dislipidemia | 7 | 31,8 |
| Diabetes mellitus | 5 | 22,7 |
| Isquemia cardiaca | 5 | 18,2 |
| Cáncer | 5 | 22,7 |
| Arritmia cardiaca | 4 | 18,2 |
| Enolismo | 4 | 18,2 |
| Insuficiencia respiratoria | 3 | 13,6 |
| Deterioro cognitivo | 2 | 9,1 |
| Artritis reumatoide | 1 | 4,6 |
| Fármacos inmunosupresores | 5 | 22,7 |
| Quimioterapia | 3 | 13,6 |
| Corticosteroides | 1 | 4,6 |
| Mesalazina | 1 | 4,6 |
Los miembros inferiores se vieron afectados en 15 pacientes (68,2%), y los miembros superiores en 7 de ellos (31,8%). En cuanto al lado afectado, existió una incidencia más alta en el lado izquierdo, en comparación con el lado derecho, con 16 y 9 casos, respectivamente.
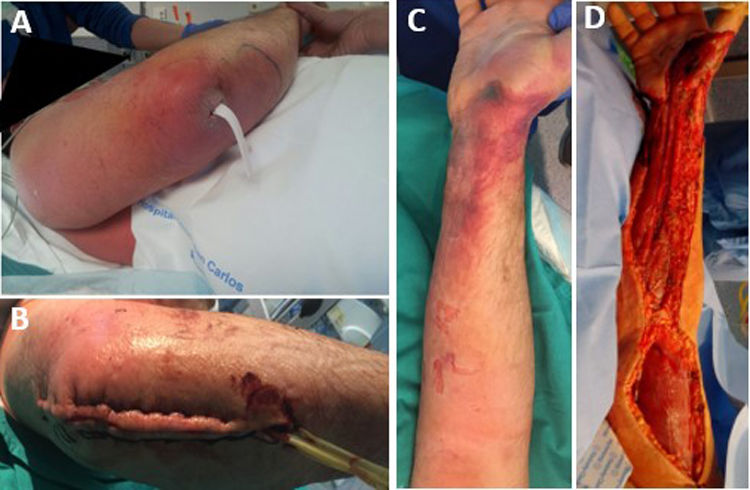
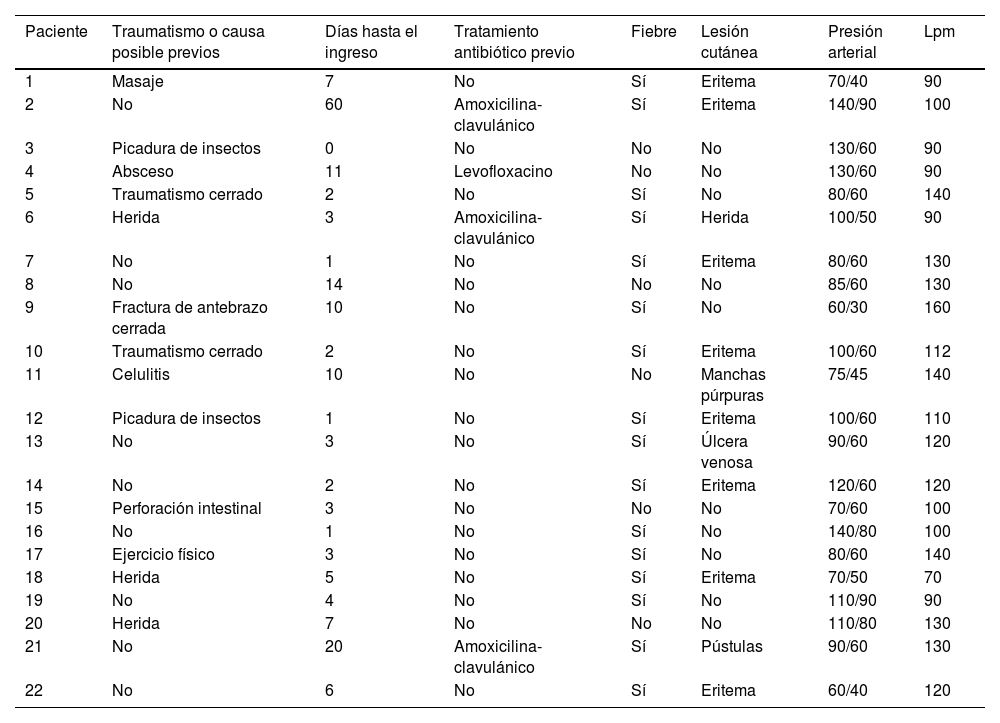
El tiempo medio entre el inicio de los síntomas y el ingreso en la unidad de urgencias fue de 3,5 días (rango: 1-10). Sin embargo, 8 pacientes (36,4%) habían consultado previamente en urgencias o su centro de salud por un episodio, como un traumatismo cerrado o una picadura de insecto, que pudo ser el desencadenante del proceso completo (fig. 1). Todos los pacientes reportaron dolor severo refractario al tratamiento, y 16 de ellos (72,7%) presentaron también fiebre por encima de 37,8°C. Nueve pacientes (40,9%) habían sufrido un traumatismo leve en la zona afectada en los días precedentes, y a 2 pacientes (9,1%) les había picado una avispa. Los hallazgos clínicos se resumen en la tabla 3.
Hallazgos clínicos
| Paciente | Traumatismo o causa posible previos | Días hasta el ingreso | Tratamiento antibiótico previo | Fiebre | Lesión cutánea | Presión arterial | Lpm |
|---|---|---|---|---|---|---|---|
| 1 | Masaje | 7 | No | Sí | Eritema | 70/40 | 90 |
| 2 | No | 60 | Amoxicilina-clavulánico | Sí | Eritema | 140/90 | 100 |
| 3 | Picadura de insectos | 0 | No | No | No | 130/60 | 90 |
| 4 | Absceso | 11 | Levofloxacino | No | No | 130/60 | 90 |
| 5 | Traumatismo cerrado | 2 | No | Sí | No | 80/60 | 140 |
| 6 | Herida | 3 | Amoxicilina-clavulánico | Sí | Herida | 100/50 | 90 |
| 7 | No | 1 | No | Sí | Eritema | 80/60 | 130 |
| 8 | No | 14 | No | No | No | 85/60 | 130 |
| 9 | Fractura de antebrazo cerrada | 10 | No | Sí | No | 60/30 | 160 |
| 10 | Traumatismo cerrado | 2 | No | Sí | Eritema | 100/60 | 112 |
| 11 | Celulitis | 10 | No | No | Manchas púrpuras | 75/45 | 140 |
| 12 | Picadura de insectos | 1 | No | Sí | Eritema | 100/60 | 110 |
| 13 | No | 3 | No | Sí | Úlcera venosa | 90/60 | 120 |
| 14 | No | 2 | No | Sí | Eritema | 120/60 | 120 |
| 15 | Perforación intestinal | 3 | No | No | No | 70/60 | 100 |
| 16 | No | 1 | No | Sí | No | 140/80 | 100 |
| 17 | Ejercicio físico | 3 | No | Sí | No | 80/60 | 140 |
| 18 | Herida | 5 | No | Sí | Eritema | 70/50 | 70 |
| 19 | No | 4 | No | Sí | No | 110/90 | 90 |
| 20 | Herida | 7 | No | No | No | 110/80 | 130 |
| 21 | No | 20 | Amoxicilina-clavulánico | Sí | Pústulas | 90/60 | 130 |
| 22 | No | 6 | No | Sí | Eritema | 60/40 | 120 |
Lpm: latidos por minuto.
Durante el ingreso en urgencias, 13 pacientes (59,1%) presentaron hipotensión y taquicardia. Doce pacientes (54,5%) tuvieron inestabilidad hemodinámica, requiriendo fármacos inotrópicos de soporte a su llegada, requiriendo su ingreso inmediato en la unidad de cuidados intensivos (UCI).
En cuanto a los valores analíticos, 17 pacientes (66,7%) presentaban un recuento leucocitario superior a 10.500/μl, y todos los pacientes mostraron neutrofilia junto con niveles elevados de proteína C reactiva (PRC) y procalcitonina. Los niveles de creatina cinasa (CK) fueron altos en 13 pacientes (59,1%), y se observó hiponatremia en 14 pacientes (63,6%).
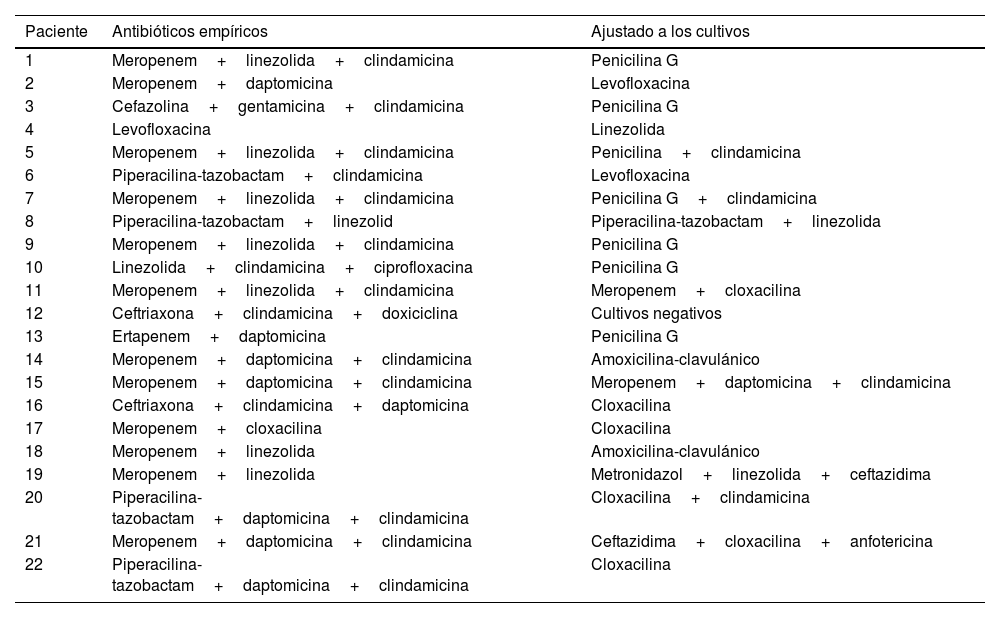
Se inició de inmediato tratamiento antibiótico de amplio espectro, aunque 4 pacientes (18,2%) habían recibido antibióticos previamente. La tabla 4 resume los tratamientos antibióticos administrados a cada paciente.
Tratamiento antibiótico
| Paciente | Antibióticos empíricos | Ajustado a los cultivos |
|---|---|---|
| 1 | Meropenem+linezolida+clindamicina | Penicilina G |
| 2 | Meropenem+daptomicina | Levofloxacina |
| 3 | Cefazolina+gentamicina+clindamicina | Penicilina G |
| 4 | Levofloxacina | Linezolida |
| 5 | Meropenem+linezolida+clindamicina | Penicilina+clindamicina |
| 6 | Piperacilina-tazobactam+clindamicina | Levofloxacina |
| 7 | Meropenem+linezolida+clindamicina | Penicilina G+clindamicina |
| 8 | Piperacilina-tazobactam+linezolid | Piperacilina-tazobactam+linezolida |
| 9 | Meropenem+linezolida+clindamicina | Penicilina G |
| 10 | Linezolida+clindamicina+ciprofloxacina | Penicilina G |
| 11 | Meropenem+linezolida+clindamicina | Meropenem+cloxacilina |
| 12 | Ceftriaxona+clindamicina+doxiciclina | Cultivos negativos |
| 13 | Ertapenem+daptomicina | Penicilina G |
| 14 | Meropenem+daptomicina+clindamicina | Amoxicilina-clavulánico |
| 15 | Meropenem+daptomicina+clindamicina | Meropenem+daptomicina+clindamicina |
| 16 | Ceftriaxona+clindamicina+daptomicina | Cloxacilina |
| 17 | Meropenem+cloxacilina | Cloxacilina |
| 18 | Meropenem+linezolida | Amoxicilina-clavulánico |
| 19 | Meropenem+linezolida | Metronidazol+linezolida+ceftazidima |
| 20 | Piperacilina-tazobactam+daptomicina+clindamicina | Cloxacilina+clindamicina |
| 21 | Meropenem+daptomicina+clindamicina | Ceftazidima+cloxacilina+anfotericina |
| 22 | Piperacilina-tazobactam+daptomicina+clindamicina | Cloxacilina |
Se realizaron estudios de imagen a todos los pacientes: ecografía en 3 casos, RMN en 2 y TAC en 16. Los hallazgos fueron inespecíficos en todos los casos, mostrando edema e infiltración de tejido subcutáneo y fascia, compatibles con infección o inflamación. Se identificaron burbujas de aire en un paciente y colecciones en 2 casos.
La confirmación del diagnóstico se basó en los resultados de los cultivos microbiológicos de las muestras tisulares obtenidas durante el desbridamiento quijúrgico inicial. En 17 pacientes (77,3%), la infección fue monomicrobiana. El microorganismo que se aisló con mayor frecuencia fue Streptococcus pyogenes, aislándose en 12 pacientes. Otros microorganismos identificados incluyeron Staphylococcus aureus (4 pacientes) o Escherichia coli (un paciente). Se detecto infección polimicrobiana en solo 4 casos. Únicamente en un paciente, que había recibido antibioterapia previamente, los cultivos intraoperatorios fueron negativos. No se detectaron casos de infección fúngica. No encontramos diferencias significativas en la evolución clínica en función del microorganismo causante.
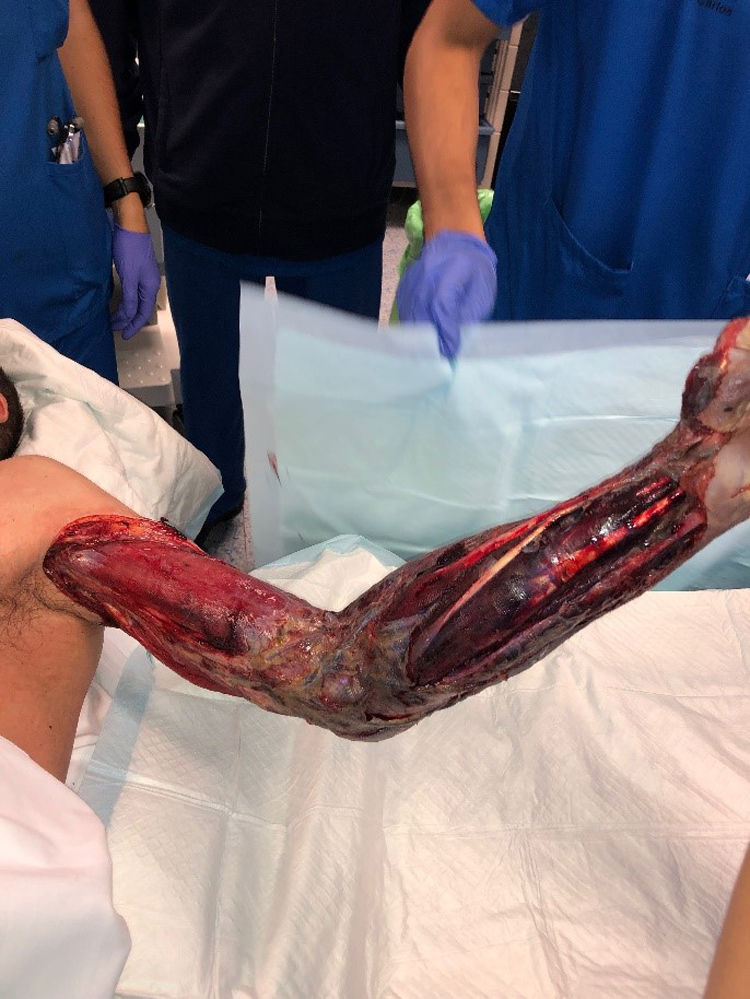
Se realizó desbridamiento radical en todos los pacientes, (figs. 1 y 2). En un paciente (4,5%) fue necesario realizar una amputación supracondílea inmediata, y en 2 casos adicionales (9,1%) se realizó una amputación tras el desbridamiento inicial, debido a la mala evolución clínica y progresión de la infección: un paciente requirió desarticulación de hombro, y otro requirió desarticulación de la cadera derecha y amputación supracondílea izquierda.
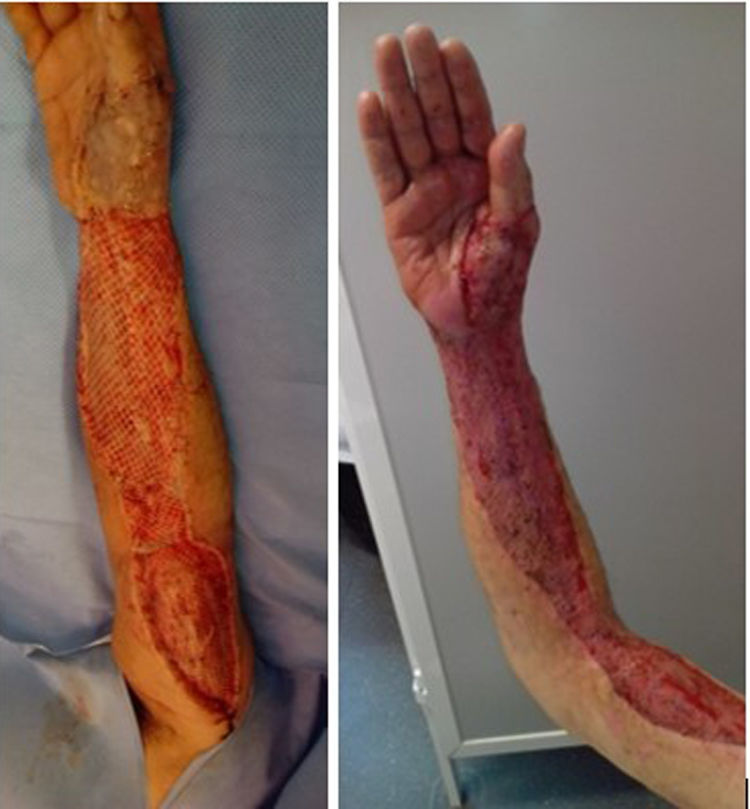
El tiempo medio transcurrido entre la llegada a urgencias y el desbridamiento quirúrgico fue de 8,25h (RIC: 3,7-50,8). No encontramos ninguna relación significativa entre el curso clínico (necesidad de amputación, reintervenciones, complicaciones o mortalidad) y el tiempo de la cirugía. Fueron necesarias segundas cirugías en 18 pacientes (81,8%). El número medio de reintervenciones fue de 3 (RIC: 0,75-4). En 10 casos (45,5%), se requirió la colaboración de un cirujano plástico para la cobertura y reconstrucción del tejido blanco (fig. 3).
Las complicaciones principales tras la cirugía incluyeron insuficiencia cardiaca (3 pacientes, 13,6%), insuficiencia renal (10 pacientes, 45,5%) e insuficiencia respiratoria (6 pacientes, 27,3%). La duración de la estancia hospitalaria varió entre uno a 71 días (mediana de 22,5 días, RIC: 15,1-34,1). Para aquellos pacientes que requirieron ingreso en UCI, la duración media de la estancia fue de 13 días (RIC: 8,5-21,5). Se produjeron 5 muertes hospitalarias en esta serie, lo cual supone una tasa de mortalidad del 22,7%.
Se calculó prospectivamente la puntuación LRINEC para todos los pacientes. Se clasificaron 6 pacientes como riesgo bajo (27,3%), 9 como riesgo moderado (40,9%) y 7 como riesgo alto (31,8%). El curso clínico de cada grupo se resume en la tabla 5.
Evolución clínica de acuerdo con la escala LRINEC
| Puntuación | Número de pacientes | Número medio de cirugías | Amputación | Estancia media (días) | Éxitus |
|---|---|---|---|---|---|
| Riesgo bajo | 6 | 3,50 | 1 | 27 | 1 |
| Riesgo moderado (6-7) | 9 | 3 | 2 | 24,54 | 1 |
| Riesgo alto (>7) | 7 | 2 | 0 | 20,46 | 3 |
| Valor de p | – | 0,83 | 0,42 | 0,59 | 0,29 |
LRINEC: Laboratory Risk Indicator for Necrotizing Fasciitis.
El periodo de seguimiento mínimo fue de un año. Un paciente murió durante el seguimiento debido a neoplasia, que ya estaba en estadio avanzado al producirse la infección necrosante. La puntuación media en la escala analógica visual de dolor fue de 5,3 (DE: 1,2) transcurrido un año de la infección. La puntuación FIM media, transcurrido un año de la infección, fue de 109 (95,5-119,5) sobre 126, con una puntuación de 112 (100-126) en los pacientes menores de 50 años, y de 102 (95-115) en los mayores de 50 años. Solo 7 pacientes pudieron regresar a sus trabajos previos, aunque, sin embargo, 5 de ellos necesitaron adaptación a los mismos, o cambio.
DiscusiónEpidemiologíaActualmente, la incidencia de NSTI se calcula en 0,045 casos anuales por cada 1.000, casi el doble de la incidencia reportada en 1999, que fue de 0,024 casos por cada 1.0001,2. Dicho aumento está probablemente asociado al incremento de la esperanza de vida y a la prevalencia de comorbilidades preexistentes. Además, factores tales como el incremento de la resistencia bacteriana y el uso de fármacos inmunosupresores pueden contribuir a esta tendencia al alza1. En este trabajo, presentamos una serie de 15 casos de NSTI tratados en nuestro hospital a lo largo de un periodo de 6 años, con una media de 2,5 casos anuales.
La diabetes mellitus es el factor de riesgo más prevalente, que se presenta en hasta el 71% de las infecciones (35,7% en nuestra serie)7. La insuficiencia renal o el abuso de fármacos son factores predisponentes comunes, aunque no se presentaron en nuestra serie4. Por otro lado, 2 pacientes de nuestra serie tenían historia de abuso de alcohol, que también se considera un factor de riesgo7. Hasta el 40% de los pacientes no tienen factor de riesgo conocido y, en consecuencia, el alto índice de sospecha es esencial.
Existe una mayor incidencia en varones mayores de 50 años. Además, algunos estudios reflejan un compromiso de los miembros inferiores más frecuente, acorde con lo observado en nuestra serie, seguido del tronco y la cabeza6,8–12.
Hallazgos clínicosSegún lo indicado previamente, los hallazgos clínicos son inespecíficos, lo cual dificulta su diferenciación de otros procesos. La NSTI deberá considerarse en los pacientes que experimentan un empeoramiento súbito2 o en los cuales las lesiones cutáneas progresan, a pesar del tratamiento antibiótico4.
El dolor se presenta en el 60-100% de los casos13–15, y generalmente está asociado a fiebre, describiéndose como desproporcionado en la exploración física2,4. Los hallazgos físicos pueden ser sutiles, y los signos externos visibles son frecuentemente mínimos. En orden de frecuencia, Las manifestaciones típicas son edema (75%), eritema (72%) y ampollas o necrosis (38%). Los signos de alarma incluyen dolor desproporcionado, bullas hemorrágicas, anestesia cutánea, progresión rápida del eritema, crepitaciones durante la exploración física, o presencia de gas en los tejidos blandos. La incidencia de estos signos de alarma es del 7 al 44%, siendo indicativa de enfermedad avanzada que requiere cirugía inmediata7,16.
El episodio desencadenante puede ser un traumatismo, incluyendo traumatismos no penetrantes, lesiones menores, y heridas quirúrgicas o traumáticas. En tales casos, el inicio de los síntomas se produce normalmente transcurrida una semana del episodio11. Sin embargo, en hasta el 50% de los casos no existe episodio desencadenante17, similar a lo observado en el 31,8% se nuestros pacientes.
DiagnósticoNo existen valores de laboratorio o radiográficos específicos en las NSTI. Sin embargo, algunos hallazgos podrían ayudar a los cirujanos a realizar un diagnóstico temprano. La presencia de leucocitosis, trombocitopenia, hiponatremia hipocalcemia e incremento de las enzimas musculares son comunes en estos pacientes17. Además, la deshidratación, la acidosis metabólica y la disfunción orgánica reflejan la gravedad de la enfermedad, debiendo levantar sospecha de la presencia de una NSTI4.
Se han desarrollado diversas puntuaciones para ayudar a los cirujanos a establecer el diagnóstico. La puntuación LRINEC es la más ampliamente utilizada, creada por Wong et al. en 20046,18. Dicha escala incorpora recuento leucocitario y valores de hemoglobina, sodio, glucosa, creatinina sérica y proteína C reactiva sérica para evaluar la probabilidad de fascitis necrosante. En la publicación original, una puntuación igual o mayor a 6 tenía un valor predictivo positivo (VPP) del 92% y un valor predictivo negativo (VPN) del 96%. Sin embargo, en un estudio más reciente que incluyó 215 pacientes en Singapur, el VPP se redujo al 40%, mientras que el VPN se mantuvo en el 95%16. En nuestra serie, el 27,3% de los pacientes fueron clasificados de riesgo bajo, de acuerdo con la puntuación LRINEC. Por tanto, aunque la puntuación LRINEC puede respaldar el diagnóstico, deberá utilizarse junto con la sospecha clínica, no debiendo considerarse un motivo de demora del tratamiento bajo ninguna circunstancia.
Ballesteros et al.6 describieron una serie de 24 pacientes tratados entre 2001 y 2008, y sugirieron que la existencia de una puntuación LRINEC más alta debería asociarse al curso clínico, describiendo una peor evolución, aumento del riesgo de amputación y estancia hospitalaria en puntuaciones altas. Heng Pek et al.8 describieron, en una serie de 27 pacientes, tratados entre 2006 y 2012, un mayor riesgo de amputación y fallecimiento en pacientes con puntuaciones en la escala LRINEC más alta, sin encontrar diferencias significativas. En nuestra serie, solo 3 pacientes (uno del grupo de riesgo bajo y 2 del grupo de riesgo medio) requirieron la amputación como tratamiento. Además, el número de pacientes fallecidos fue mayor en el grupo de riesgo alto (3 pacientes) en comparación con los grupos de riesgo medio y bajo (con un paciente cada uno). A pesar de que dichos hallazgos no fueron estadísticamente significativos, sugieren una relación potencial entre un peor pronóstico y una puntuación LRINEC más alta.
Además, Wall et al.16,19 demostraron un VPN del 99% en pacientes con sodio sérico superior a 135mEq/l y recuento leucocitario inferior a 15.400/μl. Sin embargo, únicamente el 22,72% de nuestros pacientes presentaron dichos hallazgo de laboratorio en conjunto, lo cual indica que estos parámetros en solitario no son suficientes para descartar el diagnóstico.
Por otro lado, el rol de la radiología es limitado. La ausencia de realce de la fascia es el hallazgo más específico en la IRM2,15. Otros hallazgos típicos incluyen enfisema subcutáneo en radiografías simples, lo cual se observa únicamente en el 17-30% de los casos, y la infiltración de tejido profundo, líquido y engrosamiento de la fascia en la IRM o la TAC4.
El Gold standard para el diagnóstico son los hallazgos intraoperatorios, que incluyen músculo o fascia necróticos líquido purulento grisáceo (agua de lavar carne), falta de resistencia a la presión digital contra los planos fasciales («prueba del dedo») y falta de sangrado o contracción muscular2,3,7. También es esencial identificar el microorganismo causante mediante cultivos intraoperatorios. Las NSTI polimicrobianas representan aproximadamente el 75% de los casos en algunos estudios, y están asociadas normalmente a múltiples factores de riesgo7. Sin embargo, en nuestro estudio solo el 18,18% de las infecciones fueron polimicrobianas. Este tipo de infecciones están causadas principalmente por S. pyogenes y S. aureus7, y representan el 72,73% de nuestros casos.
TratamientoEl tratamiento fundamental es la descompresión y desbridamiento del tejido necrótico lo antes posible, dado que las NSTI tienen una progresión rápida y pueden ser potencialmente mortales. Se piensa que dicha rapidez está relacionada con las toxinas bacterianas, que producen una respuesta inflamatoria que lleva a microtrombosis, isquemia, disfunción tisular y, en consecuencia, a una mayor diseminación de la infección2,7.
El término desbridamiento radical no está claramente definido. Se recomienda la eliminación de todos los tejidos necróticos y desvitalizados en todas las capas afectadas hasta lograrse márgenes tisulares sanos y sangrantes (fig. 1)5. Deberá considerarse la funcionalidad y la reconstrucción de los miembros durante la cirugía; sin embargo, estos no deben determinar el alcance del desbridamiento. Para las NSTI de las extremidades, deberán tenerse en cuenta factores tales como la magnitud de la enfermedad sistémica, el alcance del desbridamiento requerido, y la probabilidad de una extremidad funcional para determinar la necesidad de una amputación4. Además, se debe tener en cuenta que las amputaciones planificadas tienen mejor resultado y mejor recuperación, así como un retorno más rápido a la función, en comparación con los intentos fútiles de salvación del miembro mediante múltiples cirugías de desbridamiento, que pueden exponer estructuras neurovasculares y óseas5.
El restraso en el diagnóstico y tratamiento quirúrgico conduce al incremento de la mortalidad y el número de cirugías necesarias para controlar el origen2. En 1998, Bilton et al.6,20 presentaron una serie de 68 pacientes, de los que 21 fueron tratados transcurridas 24h, presentando una mortalidad del 38% y una estancia hospitalaria media de 46 días (RIC: 11-104). Los 47 pacientes restantes fueron operados antes de las 24h, presentando una mortalidad del 4,2% y una estancia hospitalaria media de 28 días (RIC: 4-45) días. Wong et al.6,18 describieron una serie de 89 pacientes tratados entre 1997 y 2002, determinando que el único factor independiente asociado a una mayor mortalidad fue la demora del tratamiento quirúrgico por encima de las 24h. Sin embargo, en nuestra serie no encontramos una relación entre el tiempo hasta cirugía y las complicaciones, necesidad de amputación o mortalidad.
Se recomienda realizar una segunda cirugía transcurridas 24-48h, ya que se piensa que esto reduce la mortalidad. Esto permite reevaluar el alcance de la infección, realizar un nuevo desbridamiento, y evitar la progresión. El número medio de procedimientos quirúrgicos es de 3 a 4, antes de realizar la cobertura de la herida2,5. Con frecuencia se requieren procedimientos específicos para la cobertura de los defectos de partes blandas. Las opciones reconstructivas incluyen sutura primaria, injertos cutáneos de grosor parcial, injertos cutáneos de espesor total, expansión tisular y colgajos pediculados o libres5.
Además de la cirugía, es esencial la antibioterapia temprana y agresiva. A pesar de no existir ensayos existe el consenso de que la antibioterapia debe incluir un agente activo contra Staphylococcus aureusresistente a la meticilina (vancomicina, daptomicina o linezolida) así como un antibiótico con actividad contra patógenos gramnegativos (piperacilina-tazobactam, ampicilina-sulbactam, cefalosporinas o carbapenémicos). De ser necesario, deberá añadirse un agente contra patógenos anaerobios, tal como metronidazol o clindamicina. La Surgical Infection Society and Infectious Disease Society of America recomienda el uso de clindamicina, ya que reduce la producción de toxinas2. Las guías sugieren mantener el tratamiento antibiótico hasta que transcurran de 48 a 72h desde la desaparición de los síntomas y fiebre4.
Se han estudiado terapias complementarias, tales como la administración de oxígeno hiperbárico (que elimina los patógenos anaerobios y la producción de toxinas) o inmunoglobulina intravenosa. Dichas opciones no se recomiendan rutinariamente, al no existir evidencia de su utilidad. Sin embargo, podrían considerarse en situaciones extremas4,7.
ResultadosHistóricamente, se han descrito tasas de mortalidad del 50 al 60% en series más antiguas, y del 20 al 30% en revisiones más recientes. Actualmente, la serie más reciente objetiva unas tasas de mortalidad del 7,6 al 16,6%4. La morbilidad asociada es también bastante alta, y está directamente relacionada con el desbridamiento quirúrgico realizado, la amputación y la gravedad de la enfermedad sistémica. La administración temprana e intravenosa de antibióticos, junto con el desbridamiento pronto, mejoran el pronóstico5.
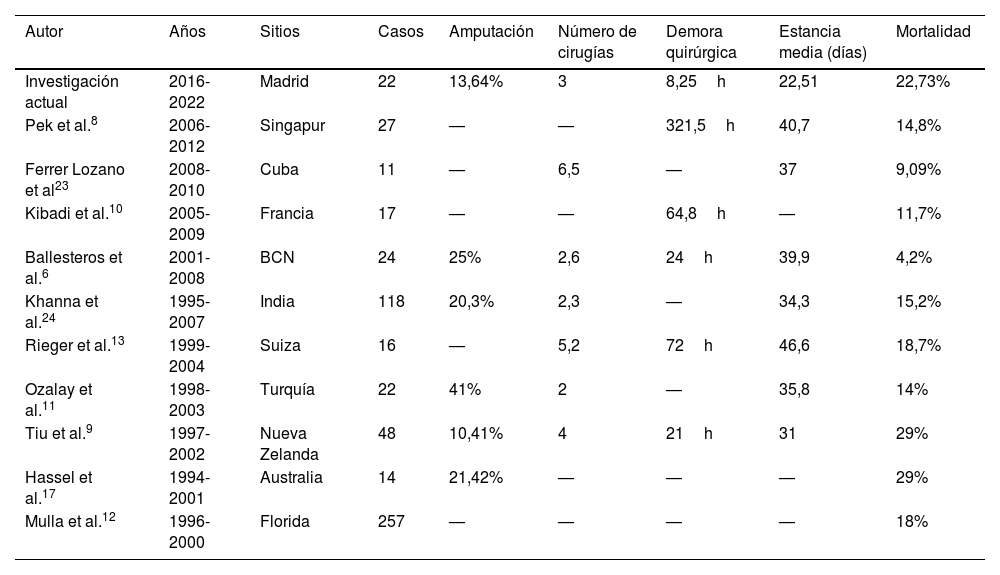
Cinco pacientes murieron en nuestra serie (22,73%), acorde con nuestra búsqueda en la literatura. Todos ellos fueron intervenidos antes de las 24h, perteneciendo solo 3 de ellos al grupo de riesgo alto, de acuerdo con la puntuación LRINEC. La tabla 6 resume los resultados de las series de casos publicados.
Series de casos previamente reportados
| Autor | Años | Sitios | Casos | Amputación | Número de cirugías | Demora quirúrgica | Estancia media (días) | Mortalidad |
|---|---|---|---|---|---|---|---|---|
| Investigación actual | 2016-2022 | Madrid | 22 | 13,64% | 3 | 8,25h | 22,51 | 22,73% |
| Pek et al.8 | 2006-2012 | Singapur | 27 | — | — | 321,5h | 40,7 | 14,8% |
| Ferrer Lozano et al23 | 2008-2010 | Cuba | 11 | — | 6,5 | — | 37 | 9,09% |
| Kibadi et al.10 | 2005-2009 | Francia | 17 | — | — | 64,8h | — | 11,7% |
| Ballesteros et al.6 | 2001-2008 | BCN | 24 | 25% | 2,6 | 24h | 39,9 | 4,2% |
| Khanna et al.24 | 1995-2007 | India | 118 | 20,3% | 2,3 | — | 34,3 | 15,2% |
| Rieger et al.13 | 1999-2004 | Suiza | 16 | — | 5,2 | 72h | 46,6 | 18,7% |
| Ozalay et al.11 | 1998-2003 | Turquía | 22 | 41% | 2 | — | 35,8 | 14% |
| Tiu et al.9 | 1997-2002 | Nueva Zelanda | 48 | 10,41% | 4 | 21h | 31 | 29% |
| Hassel et al.17 | 1994-2001 | Australia | 14 | 21,42% | — | — | — | 29% |
| Mulla et al.12 | 1996-2000 | Florida | 257 | — | — | — | — | 18% |
Se han realizado pocos estudios sobre resultados a largo plazo. Light et al.5,21 encontraron que los supervivientes de las NSTI tienen una mortalidad más alta, debido a procesos infecciosos. En nuestra serie solo se produjo una muerte durante el seguimiento, que no guardó relación con la infección.
No existen actualmente herramientas validadas para evaluar la función en estos pacientes. En el estudio realizado por Pham et al.22, el 30% de los pacientes tuvo al menos limitación funcional de leve a grave. Hakkarainen et al.5 reportaron puntuaciones menores sobre salud física y mental en estos pacientes. Además, encontraron que el 48% de los pacientes fue incapaz de retomar a su actividad previa. En nuestro estudio, el 38,89% de los pacientes regresó al trabajo, aunque el 71,42% de ellos necesitó readaptación del puesto, respaldando el hecho de que, además de las altas tasas de mortalidad, las NSTI tienen una morbilidad significativa.
ConclusionesLa progresión rápida y agresiva de las NSTI puede comprometer la viabilidad de las extremidades e incluso la vida. Por ello, la sospecha y el tratamiento multidisciplinar precoz que implican desbridamiento radical, soporte vital y antibioterapia son esenciales.
Se han propuesto diversas herramientas, tales como la puntuación LRINEC, para ayudar a realizar el diagnóstico de las NSTI. Sin embargo, en nuestro estudio, la escala LRINEC identifica únicamente el 72,72% (riesgo alto o medio) de los pacientes, por lo que las puntuaciones bajas no descartan el diagnóstico. A pesar de que algunos estudios han reportado una asociación entre la puntuación LRINEC y el pronóstico, nosotros no encontramos ninguna relación significativa. Igualmente, no encontramos una relación entre ningún factor de riesgo y la mortalidad, posiblemente en relación con el pequeño tamaño muestral. Nuestras tasas de estancia hospitalaria, resultados y mortalidad concuerdan con nuestra búsqueda en la literatura, lo cual confirma la alta morbilidad y mortalidad, a pesar de la adecuación y prontitud del tratamiento.
Nivel de evidenciaNivel de evidencia IV.
Consideraciones éticasEste estudio cuenta con la aprobación del Comité de ética e investigación del Hospital Clínico San Carlos (23/813-E). Se obtuvo consentimiento informado de todos los participantes individuales incluidos en el estudio, o de sus familiares.
FinanciaciónLos autores declaran la ausencia de subvenciones, becas o demás ayudas durante la preparación del presente artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.