Determinar los valores de densidad mineral ósea (DMO) en niños y adolescentes con afectación moderada y severa, por parálisis cerebral infantil (PCI) de nuestra área de referencia, y comparar estos valores con pacientes sanos.
Material y métodoEstudio de pronóstico de casos y controles para la valoración de la DMO en pacientes con PCI de 2 a 18 años pertenecientes a los grupos IV y V de la clasificación Gross Motor Function Classification System (GMFCS). Las mediciones de DMO se realizaron a nivel del fémur distal, se dividió esta región en 3 zonas siguiendo el protocolo de antebrazo.
ResultadosEn la muestra final de 69 pacientes se objetivan valores de DMO para cada una de las regiones estudiadas muy por debajo de los niveles de referencia. Existe una diferencia estadísticamente significativa (p<0,05) entre los valores de DMO en los 2 subgrupos estudiados.
DiscusiónLa mayor afectación desde el punto de vista neurológico en los pacientes del grupo V condiciona una situación de muy baja DMO respecto a pacientes de igual edad y sexo. En pacientes con PCI la adquisición de capital óseo no se realiza siguiendo el patrón de normalidad de la población sana.
To determine the bone mineral density (BMD) values in children and adolescents with moderate and severe infantile cerebral palsy (ICP) in our catchment area, and compare these values with a healthy population.
Material and methodA prognostic study of cases and controls for the assessment of BMD in patients from 2 to 18 years old with infantile cerebral palsy belonging to the Gross Motor Function Classification System (GMFCS) Groups IV and V. The BMD measurements were performed at distal femur level, dividing this region into 3 areas following the forearm protocol.
ResultsThe BMD for each of the three areas studied results in the final sample of 69 patients were much lower than the reference levels. There was a statistically significant difference (P<.05) between the BMD values in the two sub-groups studied.
DiscussionThe greater the involvement, from a neurological point of view, in patients classified as Group V shows a very low BMD compared to patients of similar sex and age. The acquisition of bone capital in patients with ICP does not follow the normal pattern of the healthy population.
La parálisis cerebral infantil (PCI) describe un grupo de trastornos permanentes del movimiento, y la postura que provocan una limitación de la actividad, y que son secundarios a un daño puntual y no progresivo en el cerebro en desarrollo. Los trastornos motores de la PCI se acompañan con frecuencia de alteraciones sensitivas, perceptivas, cognitivas, de la comunicación y el comportamiento, epilepsia y problemas secundarios a nivel del sistema musculoesquelético.
La osteoporosis es una condición que de manera creciente aparece como resultado de diversas afecciones infantiles. Pese a ello, aún es con frecuencia, descuidada y no tratada en esta población.
La densitometría por absorciometría dual de rayos X (DXA) es la técnica más empleada en la medición de la densidad mineral ósea (DMO) por su precisión, reproducibilidad, velocidad y mínima exposición a radiación. No existe definición densitométrica de osteoporosis en niños, de la misma manera que se aplica a los adultos, y el diagnóstico no se puede establecer únicamente en base a criterios densitométricos. Aunque pudiera ser previsible que una baja DMO se asociara a fracturas en niños, esta relación no está bien establecida. Un Z-score (que compara los valores de DMO del paciente con individuos emparejados por la edad y el sexo) entre +2,0 y −2,0 desviaciones estándar (DE) se considera dentro de los límites de la normalidad, mientras que por debajo de −2,0 DE se considera «baja DMO para su edad»1,2.
La selección de una región de interés (RI) es una cuestión con frecuencia sometida a debate. La exploración del fémur proximal se institucionalizó en la población adulta, puesto que las fracturas por osteoporosis tenían lugar en esta localización. El fémur distal es la localización más frecuente de fracturas patológicas en la población con PCI3, por lo que la elección de esta RI parece más que justificada.
El protocolo de análisis de la región distal del fémur se basa en el de antebrazo, según el cual se determina una región global de estudio del radio distal, que comprende desde la unión del tercio medio y distal del hueso4,5. La región global metafiso-diafisaria de fémur distal propuesta por Harcke6 es comparable a esta, y la subdivisión en 4 zonas se hace en base a una serie de premisas. La región de la fisis y la zona adyacente quedan eliminadas del estudio por el gran potencial de variabilidad de la DMO en función de la edad. El análisis del resto de las regiones aporta una imagen que remeda el espectro del metabolismo óseo. La región R1 representa en su mayoría hueso esponjoso, R3 y R4 representan hueso cortical y la región R2 es una zona intermedia. Cada una de estas regiones tiene una sensibilidad a los cambios en la mineralización diferente, por lo que determinan la historia secuencial del metabolismo óseo en dicha región. Henderson et al.7 proponen una nueva división en 3 regiones: R1 corresponde a hueso esponjoso de la región metafisaria, R2 es una zona metafisodiafisaria y R3 corresponde a hueso cortical. Con esta subdivisión se minimizan los efectos deletéreos que sobre las mediciones de DMO en las regiones R3 y R4 tiene la rotación del fémur durante la exploración.
Objetivos- -
Determinar los valores de DMO en niños y adolescentes con PCI grupos IV y V de la Gross Motor Function Classification System (GMFCS) de nuestra área de referencia.
- -
Comparar estos valores con las referencias de DMO existentes en la literatura para pacientes sanos.
- -
Analizar la relación que la variable clínica: afectación neurológica expresada en función de los niveles de la GMFCS, tiene sobre la DMO.
Estudio de pronóstico de casos y controles.
Población a estudioCriterios de inclusión- -
Pacientes afectos de PCI de tipo espástica y que pertenezcan a los niveles IV y V de la escala GMFCS3 con edades comprendidas entre los 2 y los 18 años.
- -
Pacientes cuyos padres/tutores o cuidadores acepten la realización de las diferentes pruebas tanto de imagen como de laboratorio.
- -
Pacientes cuyos padres/tutores o cuidadores firmen el Consentimiento Informado.
Con el fin de evitar el sesgo de selección que supone incluir en el estudio exclusivamente pacientes que se siguen de forma habitual tanto en las Consultas Externas de Neuropediatría, Rehabilitación Infantil, como de Cirugía Ortopédica y Traumatología del Hospital Infantil de los Hospitales Universitarios Virgen del Rocío de Sevilla, se contactó de forma telefónica con las Asociaciones de Parálisis Cerebral de Andalucía y Extremadura, Centros de Fisioterapia e Instituciones de internamiento de pacientes con mayor grado de afectación, para solicitar la colaboración de sus pacientes en el estudio.
Criterios de exclusión- -
Pacientes con encefalopatías de origen genético, metabólico o neurodegenerativo, o afecciones que limiten el crecimiento (p. ej., cardiopatía congénita) o que interfieran sobre el metabolismo óseo.
- -
Pacientes con otros trastornos del movimiento (atetosis o ataxia) o que presenten movimientos involuntarios de tal amplitud o frecuencia que limiten el posicionamiento adecuado o el mantenimiento de la postura que precisa el estudio de densitometría.
- -
Pacientes con trastornos de conducta y falta de colaboración para la realización de las pruebas.
Las mediciones de DMO se realizaron de forma exclusiva a nivel de fémur distal5 y de forma bilateral mediante un densitómetro DEXA Hologic QDR® Discovery Apex™ con software Apex version 2.3.2 para la subregión antebrazo compatible con sistema Microsoft® Windows® XP versión 12.05.
Se definieron 3 regiones de anchura y altura variables para adaptarlas al tamaño del hueso de cada paciente y se analizaron de forma independiente en cada uno de los miembros inferiores del paciente. La región 1 corresponde a un rectángulo que abarca el hueso metafisario y está compuesta casi de forma exclusiva de hueso esponjoso. La región 2 se extiende proximalmente desde el borde superior de la región 1 abarcando una zona transicional de hueso esponjoso y cortical. La región 3 comprende predominantemente hueso cortical. Para evitar errores interobservador en las mediciones, solo un técnico y un facultativo del Servicio de Medicina Nuclear fueron responsables de la realización y posterior análisis de las mediciones.
La exploración se llevó a cabo en decúbito lateral, posición de relativa comodidad para estos pacientes puesto que es compatible con la presencia de contracturas articulares a nivel de cadera o rodillas o la coexistencia de una escoliosis severa.
Los pacientes que solo pudieron hacerse el estudio de forma unilateral fueron igualmente incluidos en la muestra final. Los coeficientes de correlación de Pearson muestran que los valores de DMO del lado derecho explican en gran medida a los del izquierdo y viceversa. Este dato estadístico y el hecho clínico de que la afectación de ambas extremidades podría considerarse equivalente, nos permite, en adelante, emplear las medias de los valores obtenidos en el lado derecho e izquierdo para realizar el análisis de datos.
Dada la especificidad de elección de la RI para este tipo de población, no contamos con bases de datos de referencia en sujetos sanos de ámbito nacional, por lo que se emplearon como valores de referencia los determinados por el estudio de Henderson et al.7. Este estudio aporta las ecuaciones de regresión aplicables para establecer la relación entre las medidas de DMO (expresada en g/cm2) y la edad (expresada en años) para pacientes varones y mujeres (referencias específicas para el sexo) en una población de sujetos no-afroamericanos sanos para cada una de las regiones en que queda subdividido el fémur distal.
MetodologíaVariables a estudio- -
DMO: variable cuantitativa continúa expresada en g/cm2.
- -
Edad: variable cuantitativa discreta categorizada en 3 intervalos expresados en años: 2 a 6, 7 a 12 y 13 a 18 años.
- -
Afectación neurológica: variable cualitativa nominal. En la escala empleada, la GMFCS se definen 5 categorías en función de la capacidad o no de deambulación de los pacientes, bien de forma autónoma o con dispositivos de ayuda (tabla 1). En nuestro estudio solo participaron los 2 grupos de mayor nivel de afectación: IV y V.
Tabla 1.Clasificación GMFCS
Nivel I Deambula sin limitaciones Nivel II Deambula con limitaciones Nivel III Deambula con dispositivo de ayuda de tipo bastón, muletas o andador (anterior o posterior, pero sin sujeción del tronco) Nivel IV Movilidad autónoma con grandes limitaciones, puede utilizar silla de ruedas eléctrica Nivel V Transportado en silla de ruedas
Se realizó estadística descriptiva de las variables del estudio. Para ello se usaron frecuencias absolutas y relativas en el caso de las variables cualitativas. Las variables cuantitativas, según si seguían o no una distribución normal (tras la aplicación del test de Kolmogorov-Smirnov o Shapiro-Wilk [n<50]) se resumieron mediante M±DE (media, desviación estándar) o P50 (P2-P75) (mediana, rango intercuartílico) respectivamente.
Se analizó la relación entre los valores de DMO de las 3 regiones de fémur distal mediante un análisis de correlación, coeficiente de Pearson o de rho de Spearman (según proceda). El análisis de la relación de la variable DMO con respecto a las variables clínicas explicativas, se efectuó mediante una ANOVA o la t de Student para muestras independientes o H de Kruskall-Wallis y/o U de Mann-Whitney (según sigan o no distribución normal).
El nivel de significación estadística, se estableció en p<0,05.
La imputación de los datos se realizó en el programa Excel.
El análisis estadístico se realizó mediante el paquete Statistical Package for Social Sciences (SPSS® Inc., Chicago, IL, EE.UU.) versión 17.0., de la Unidad de Apoyo a la Investigación del Hospital Universitario Virgen del Rocío.
ResultadosLa muestra a estudio fue de 69 pacientes con una media de edad de 10,17 años. Del total de pacientes, 16 pertenecían al grupo IV (23,18%) y 53 al grupo V (76,81%).
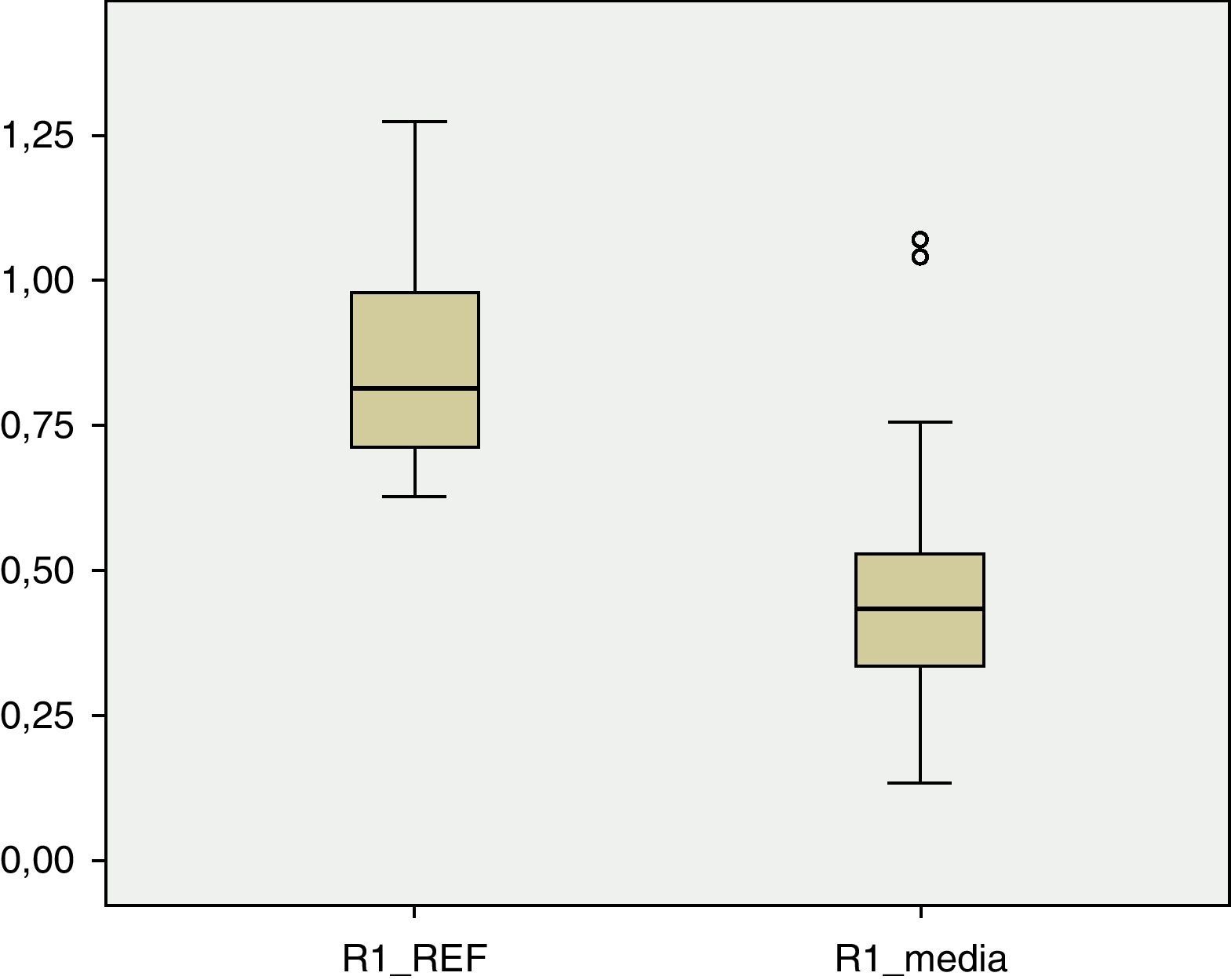
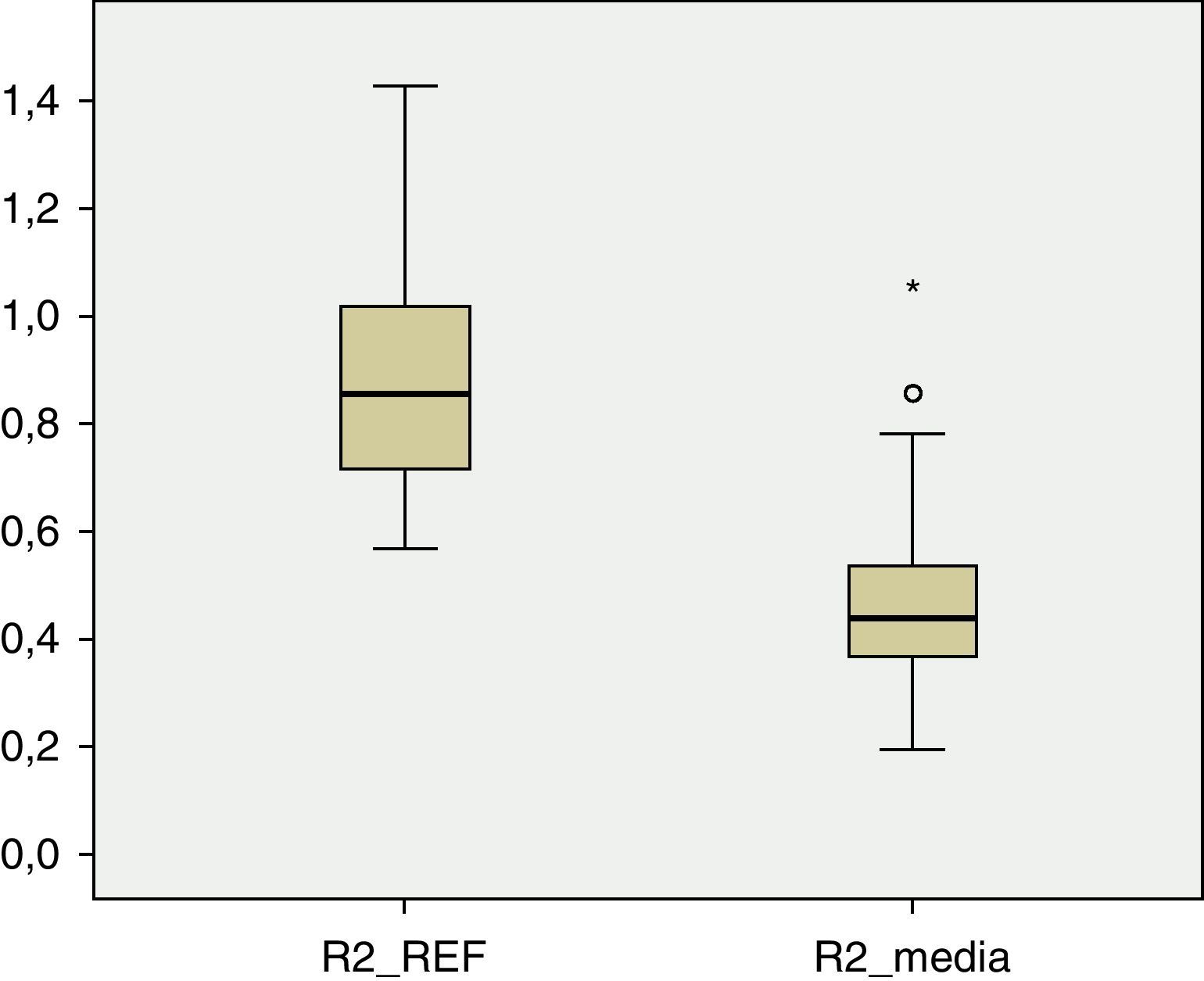
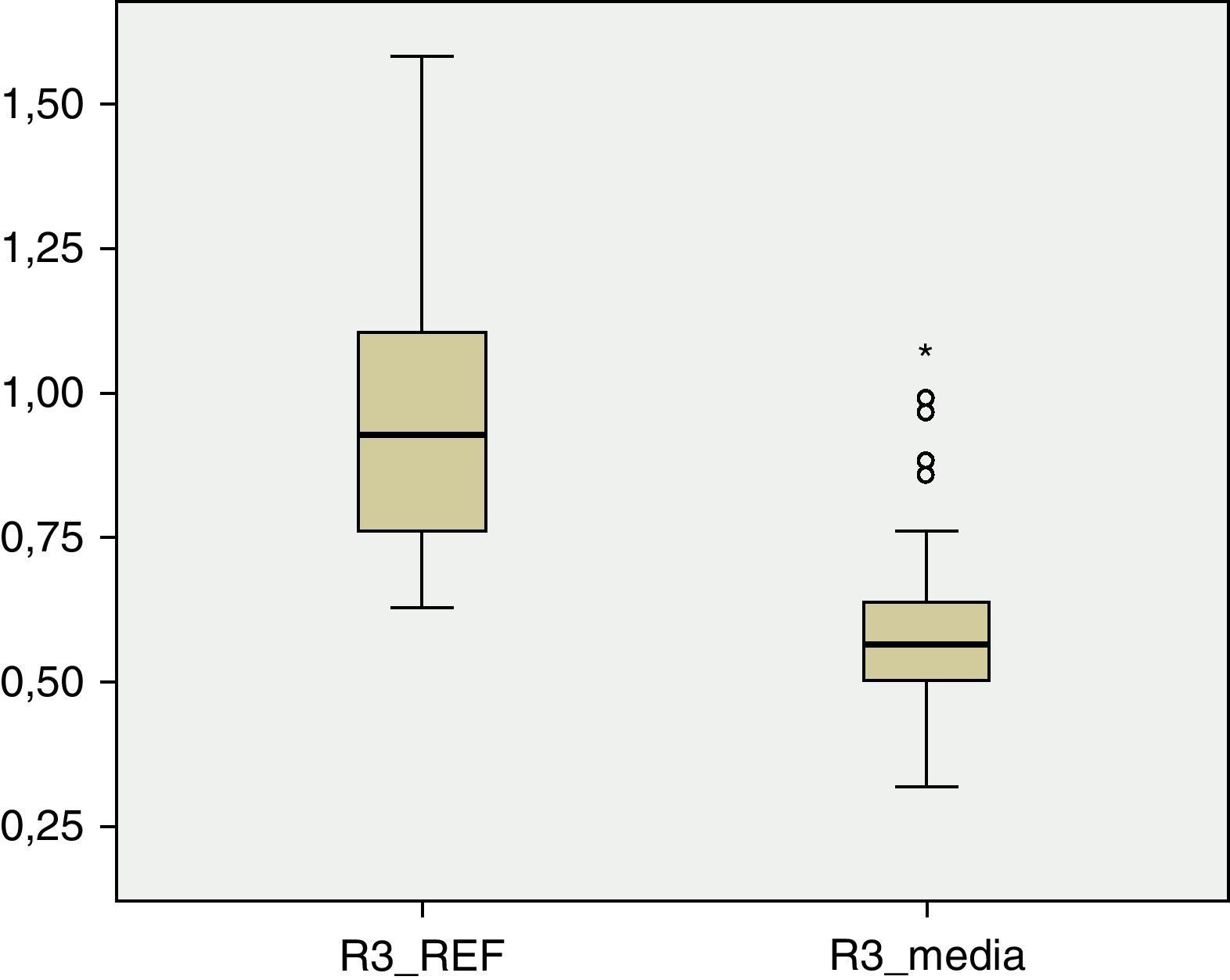
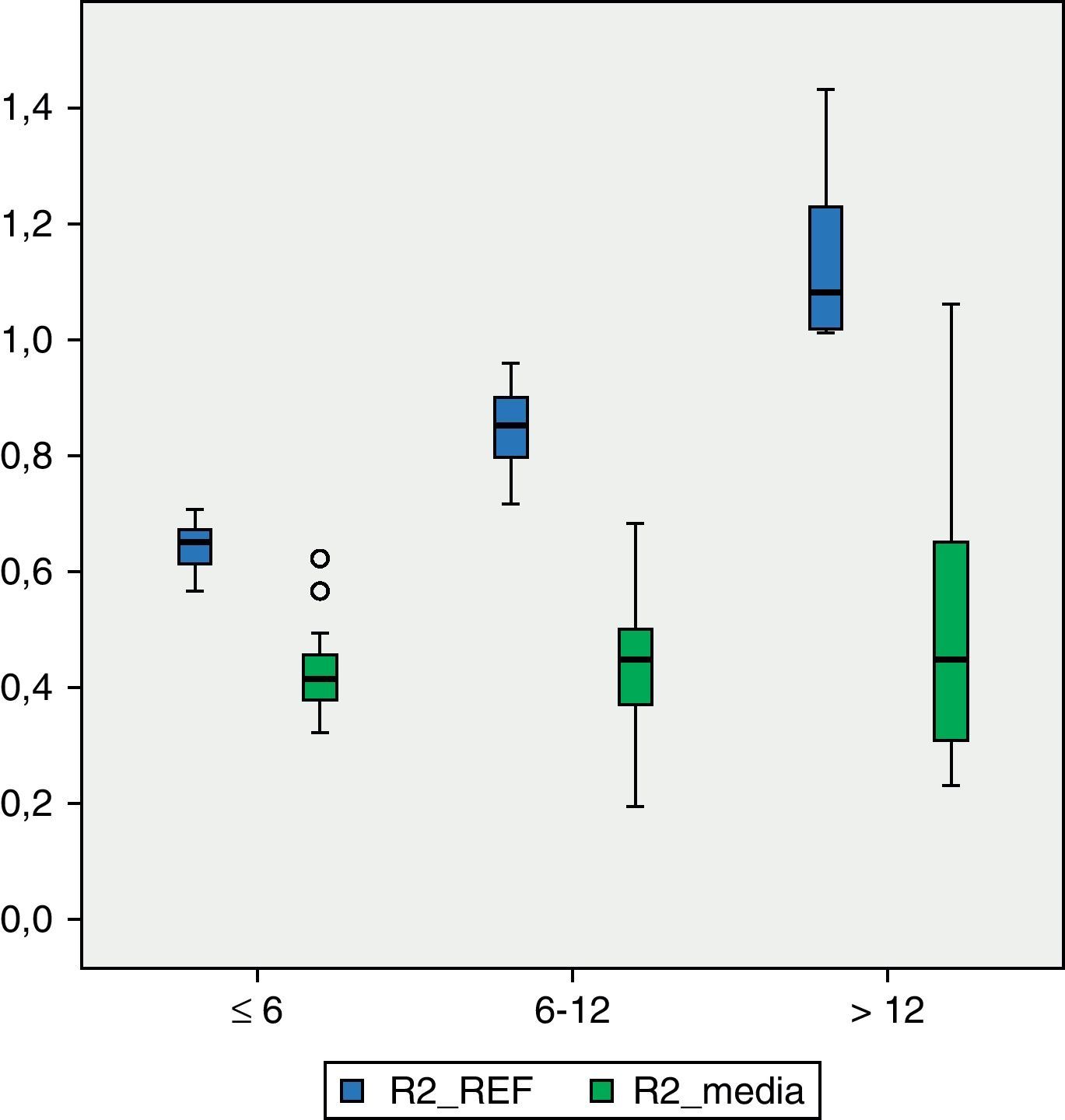
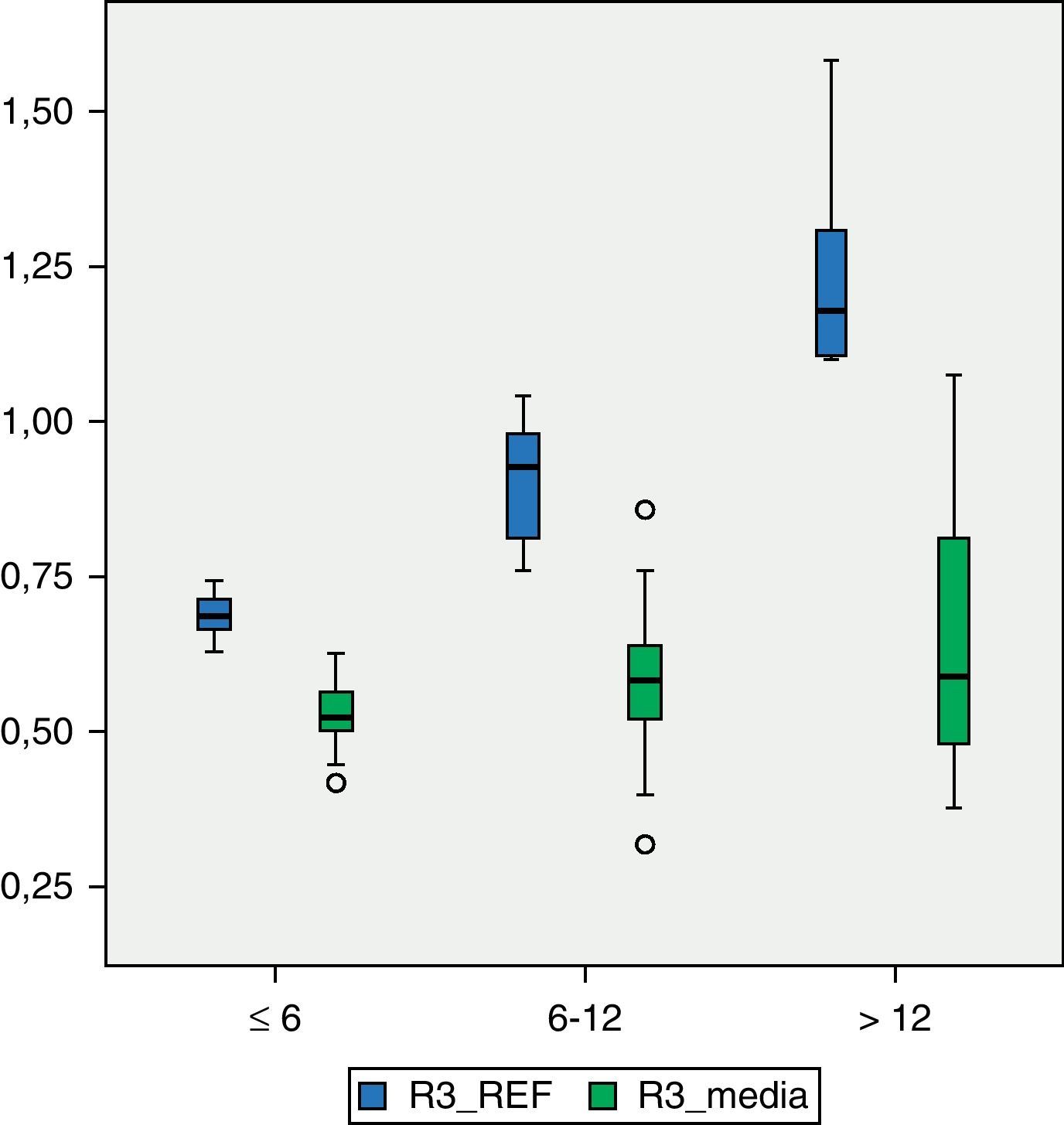
Los valores de DMO en cada una de las regiones del fémur son inferiores a los valores de referencia. En R1 (fig. 1), el valor medio de DMO en el total de la muestra poblacional es de 0,4566g/cm2 y se encuentra fuera del intervalo de ±2 DE (1,18705125-0,51444133) para dicha región. El valor de DMO medio en R2 (fig. 2) es de 0,4614g/cm2, de igual forma fuera del intervalo ±2 DE para dicha región (1,30512374-0,48147221). El valor de DMO medio en R3 (fig. 3) es de 0,5918g/cm2, que a diferencia que en los casos anteriores sí está dentro del intervalo ±2 DE (1,41434557-0,50318994), pero aún así se mantiene por debajo de 1DE de los valores de referencia.
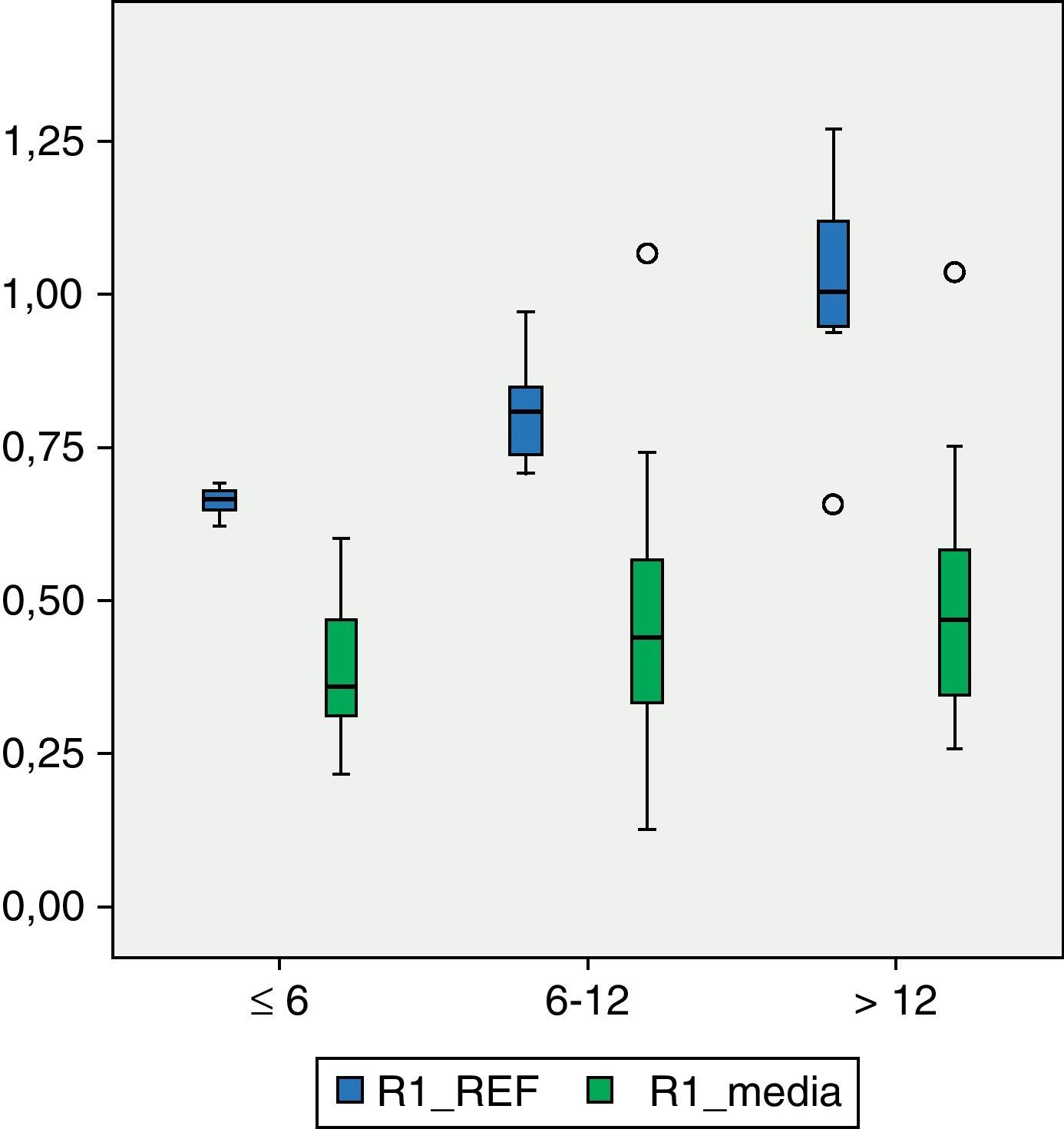
En los pacientes del grupo IV de la GMFCS (fig. 4), el valor medio de DMO en R1 es de 0,5766g/cm2 que se sitúa en el intervalo ±2 DE (1,30536987-0,49695388), pero aun así, por debajo de 1 DE del valor de referencia. De igual forma, los valores de DMO medios de R2 y R3 0,6066 y 0,7300g/cm2 respectivamente, se sitúan dentro de los intervalos ± 2DE (1,48469367-0,50860383) para R2 y (1,57747609-0,54523516) para R3, pero por debajo de 1DE de los valores de referencia para cada una de las regiones.
En los pacientes con mayor grado de afectación motora, es decir, aquellos que pertenecían al grupo V de la clasificación GMFCS (fig. 4), el valor medio de DMO para la región R1 es de 0,4203g/cm2 y está fuera del intervalo ±2 DE (1,14649054-0,52456244). El valor medio de R2 en este grupo es de 0,4176g/cm2 que, al igual que el anterior está fuera del intervalo ±2 DE (1,23082822-0,49336726). El valor medio de R3, de 0,5501g/cm2 sí está dentro de este intervalo ±2 DE (1,34935362-0,50624204), pero por debajo de 1 DE del valor de referencia para dicha región.
A pesar de que existe una diferencia numérica importante entre los 2 subgrupos, IV y V de la clasificación GMFCS, realizamos el test de Levene y posteriormente la prueba t de Student para la comparación de medias entre ambos grupos. La diferencia entre ellos resulta ser estadísticamente significativa (p<0,05) en las tres regiones: R1, p=0,01; R2, p=0,02; R3, p=0,02.
Para el estudio de la DMO en relación con la edad, las 3 categorías tienen un tamaño de 16 pacientes (2 a 6 años), 30 (7 a 12 años) y 23 pacientes (13 a 18 años) respectivamente. En la figura 5 se objetiva la relación entre los valores medios de DMO en la región 1 y los de referencia para los diferentes grupos de edad. Las figuras 6 y 7 muestran esta misma relación para las regiones 2 y 3 respectivamente. Observamos cómo no siguen en ninguna de las 3 regiones estudiadas la progresión ascendente que ocurre en pacientes sanos y es fruto de la adquisición de capital de masa ósea con el paso de los años.
DiscusiónLa «baja DMO en relación a la edad», es un problema prevalente en la población infantil y de adultos jóvenes con PCI, con afectación neurológica moderada o grave. La osteopenia asociada a otros factores como las contracturas articulares, un escaso control motor que predispone a caídas frecuentes, huesos de menor diámetro con corticales adelgazadas y la concomitancia de crisis epilépticas que precisan medicación y resultan en algunos casos muy violentas, están relacionados con la frecuente tasa de fracturas que presenta esta población3,8 que puede ascender al 20%9 y afectan con mayor frecuencia al fémur distal. La mayoría de estas fracturas se pueden tratar de forma ortopédica, sin embargo, en muchos casos requieren hospitalización, y la tasa de consolidación viciosa no es desdeñable. Las fracturas patológicas provocan un impacto negativo en la calidad de vida de estos pacientes e incrementan la necesidad de cuidados. Está probado que el problema médico más costoso en las instituciones para niños con afectación neurológica severa es el tratamiento de las fracturas por osteopenia10.
Sin embargo, los conceptos conocidos para el manejo de la osteopenia de los adultos no son extrapolables a la población infantil puesto que existe una diferencia notable entre ambas. En los adultos la osteopenia es el resultado de una pérdida de DMO que ocurre con el tiempo, sin embargo, en los niños sanos, salvo en períodos puntuales del desarrollo, la DMO incrementa de forma progresiva. En pacientes con parálisis cerebral severa o moderada, pese a que existe un incremento medio anual de la densidad ósea del 2-5%, los valores z de densidad ósea disminuyen con la edad, puesto que estos incrementos son menores a los que se dan en la población sana11, es por ello que en estos pacientes debe contemplarse la osteopenia como una manifestación de un fallo en el crecimiento y considerarla como objetivo de intervención.
La DMO en la población de pacientes afectos de parálisis cerebral ha sido estudiada por diversos autores11–13, con la serie más amplia incluyendo 139 niños y adolescentes14. Estos estudios observacionales, al igual que este, identifican aquellos factores relacionados con la «baja DMO» para una determinada edad, pero no necesariamente detectan las causas de esa disminución en la DMO. Nuestra serie de 69 pacientes presenta valores medios de DMO por debajo de 2 desviaciones estándar de los valores de referencia en las regiones 1 y 2 del fémur distal, que corresponden a las zonas metabólicamente más activas. Únicamente en la región 3, constituida principalmente de hueso cortical, los valores medios obtenidos en nuestra población se sitúan por debajo de 1DE respecto de los de referencia. Si tenemos en cuenta que el fémur es la región en la que con mayor frecuencia se producen fracturas patológicas en la población con parálisis cerebral, nuestra población estaría en situación clara de riesgo.
La interpretación de las mediciones de DMO en niños es más compleja que en los adultos, puesto que el tamaño, la forma y el contenido mineral de los huesos están en constante cambio15,16. El incremento de tamaño de los huesos precede a la adquisición de masa ósea, y la relación entre el incremento en tamaño y en masa ósea varía con la edad y en las distintas regiones corporales. Complica aún más la interpretación el hecho de que, incluso para una misma edad, los niños se encuentran en diferentes etapas de desarrollo y crecen a ritmos diferentes.
A la hora de interpretar medidas de densitometría ósea en la población infantil, se han de tener en cuenta los siguientes factores16,17:
- -
Edad cronológica18, afecta los resultados de la DMO, debido al aumento que con la edad se produce sobre el tamaño corporal.
- -
Edad ósea.
- -
Estadio desarrollo puberal (Tanner), la DMO incrementa rápidamente al inicio de la pubertad, pero la edad a la que esto ocurre es muy variable, por lo que se prefiere tomar en cuenta la madurez fisiológica19.
- -
Altura.
- -
Peso20.
- -
Raza.
En la literatura existente se pone de manifiesto que la DMO, así como los parámetros de crecimiento (altura, peso, circunferencia de brazo) se van quedando progresivamente por debajo de los valores estándar a medida que el paciente con parálisis cerebral va cumpliendo años21,22. Tras al análisis de nuestros datos en función de la edad se corrobora lo que otros autores ya han manifestado, y es que los valores de DMO en los pacientes de menor edad ya están por debajo de la normalidad, y no experimentan el incremento esperado relacionado con la adquisición de masa ósea con los años, de manera que la diferencia objetivada entre los valores medios y los de referencia es mayor en el grupo de pacientes de mayor edad.
El menor crecimiento en pacientes con PCI es un problema complejo y en el que intervienen tanto factores nutricionales como neurológicos21,23. Los mecanismos postulados a través de los cuales actúan los factores nutricionales son24: aumento de las necesidades calóricas por el mayor tono muscular y asociación de otros desórdenes del movimiento y la postura, el aumento del esfuerzo yel consumo de energía para realizar una actividad determinada, el aporte calórico insuficiente por disfunción oro-motora que dificulta la alimentación, los problemas en la dentición,las alteraciones en el comportamiento y la escasa ingesta de nutrientes necesarios, entre otros. Stallings et al.23, en un estudio sobre 142 pacientes afectos de parálisis cerebral, realizan un análisis de regresión para diferenciar el impacto de los factores nutricionales frente al de los no nutricionales, que son aquellos relacionados con la severidad de la enfermedad y con las características propias de cada individuo (edad, sexo), sobre el crecimiento. El estado nutricional es responsable del 10-15% de la variación en el crecimiento lineal de estos pacientes. El efecto de una pobre situación nutricional se va acumulando de forma que los pacientes mayores tienen mayor retraso en crecimiento que los de menor edad.
El grado de afectación neurológica medido en términos de discapacidad motora y definido por la escala GMFCS es un factor importante relacionado con la baja DMO de los pacientes con parálisis cerebral. Aunque clásicamente el concepto de ausencia de carga sobre las extremidades se postulaba como la causa directa más importante de baja densidad ósea, la evidencia acumulada sugiere que son muchos más los factores implicados24,25. En el estudio de Henderson et al.8, los valores z de DMO a nivel del fémur distal son menores en los pacientes clasificados como nivel V en la escala GMFCS, que en los pertenecientes al nivel IV a pesar de que ambos grupos son no deambulantes. Asimismo encuentra que un 96% de los pacientes de nivel V presentan valores de z<−2,0 en comparación con un 43% de los pacientes de nivel III. La capacidad de deambulación es el factor de mayor impacto sobre la DMO en el trabajo de Henderson et al.14. Nuestro estudio refleja, de igual manera, que los pacientes pertenecientes al grupo IV de la GMFCS presentan valores medios de DMO superiores, para cada una de las regiones, que los del grupo V y ello aún a pesar de que los pacientes del grupo IV hacen exclusivamente marcha de interiores o terapéutica.
ConclusionesLos valores de DMO en niños y adolescentes con parálisis cerebral grupos IV y V de la GMFCS de nuestra área de referencia se encuentran muy por debajo de los valores de referencia existentes en la literatura para pacientes sanos.
El grado de afectación según la escala GMFCS influye de forma negativa sobre la DMO en los pacientes estudiados.
La expectativa de vida en esta población varía enormemente en función de las variables clínicas como el déficit motor, retraso cognitivo, discapacidad visual o destreza manual. Si hiciéramos una estimación para un paciente severamente discapacitado en las 4 categorías, la expectativa de vida sería de aproximadamente un 50% hasta los 13 años y un 50% hasta los 3026. El mantenimiento de la situación en la que actualmente se encuentran nuestros pacientes en cuanto a DMO augura muchos problemas en relación con la osteoporosis en años venideros.
La PCI que a pesar de los mejores índices sanitarios sigue presentando tasas estables de prevalencia, requiere esfuerzos diversificados en cuanto a la investigación y el tratamiento con un nuevo enfoque multidisciplinar en el manejo clínico en respuesta a sus especiales connotaciones desde el punto de vista médico.
Nivel de evidenciaNivel de evidencia III.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.