Existe evidencia científica grado iv de la importancia que el antibiótico administrado preoperatoriamente tiene en la prevención de la infección protésica.
Hay controversia en si la isquemia aplicada en la cirugía de estos pacientes puede afectar a la concentración mínima inhibitoria del antibiótico en los tejidos periprotésicos.
Para estudiar este fenómeno hemos diseñado un estudio basado en la determinación de la concentración de antibiótico en el tejido sinovial.
Material y métodoEstudio clínico prospectivo observacional de 32 pacientes intervenidos de prótesis total de rodilla. Se administró 2g de cefonicid como profilaxis y se utilizó el manguito de isquemia en todos los pacientes, cuantificándose la concentración antibiótica mediante la cromatografía líquida de alta resolución en muestras de tejido sinovial del inicio y del final de la intervención.
ResultadosLa concentración media de antibiótico fue de 23,16μg/g (IC del 95%, 19,19-27,13) en las muestras del inicio de la intervención y de 15,45μg/g (IC del 95%, 13,20-17,69) en las muestras del final, mostrándose superiores a la concentración mínima inhibitoria del cefonicid, establecida en 8μg/g, siendo estos resultados estadísticamente significativos para ambas concentraciones (p<0,00001).
DiscusiónLa concentración de antibiótico a lo largo de una intervención estándar de prótesis total de rodilla realizada con isquemia preventiva varía a lo largo de la intervención sufriendo un descenso paulatino.
Aun así, la concentración determinada al final de la intervención no fue inferior a la concentración mínima inhibitoria del antibiótico estudiado.
Como conclusión, la utilización del manguito de isquemia no aumenta el riesgo de infección.
There is level iv evidence that the preoperative administration of antibiotics helps in the prevention of prosthetic infection.
There is controversy on whether the ischemia applied during surgery may affect the minimum inhibitory concentration of the antibiotic in the peri-prosthetic tissues.
The aim of this study is to review this phenomenon through the determination of antibiotic concentration in the synovial tissue.
Material and methodA prospective observational clinical study was conducted on 32 patients undergoing total knee replacement. Cefonicid 2g was administered as prophylaxis, with a tourniquet used for all patients. The antibiotic concentration was quantified by high performance liquid chromatography in samples of synovial tissue collected at the beginning and at the end of the intervention.
ResultsThe mean concentration of antibiotic was 23.16μg/g (95% CI 19.19 to 27.13) in the samples at the beginning of the intervention and 15.45μg/g (95% CI 13.20 to 17.69) in the final samples, being higher than the minimum inhibitory concentration of cefonicid, set at 8 μg/g. These results were statistically significant for both concentrations (P<.00001).
DiscussionThe antibiotic concentration throughout the standard total knee prosthesis surgery performed with tourniquet gradually decreases throughout the intervention.
The concentration determined at the end of the intervention was higher than the minimum inhibitory concentration required for the antibiotic studied.
In conclusion, the use of a tourniquet does not increase the risk of infection.
La técnica quirúrgica en la colocación de una prótesis total de rodilla (PTR) ha experimentado un gran avance y alto perfeccionamiento, pero no está exenta de complicaciones. La infección, junto al aflojamiento aséptico, es la complicación principal, ya que sus consecuencias conllevan una repercusión importante tanto a nivel del enfermo, a nivel hospitalario, social y económico1-3. La causa más frecuente de contaminación se produce durante el acto quirúrgico. La existencia de infección depende de las condiciones del paciente y del medio, y de la presencia del implante, que permite la infección por inóculos bacterianos menores y por microorganismos poco virulentos. La profilaxis antibiótica pretende mantener altas concentraciones de antibiótico durante toda la intervención para evitar la multiplicación de los gérmenes que contaminan el campo quirúrgico4,5. Particularmente, en cirugía ortopédica y traumatología, está establecido que la administración de una dosis de antibiótico activo frente a la mayor parte de la flora contaminante unos 30 min antes de la intervención, disminuye de forma significativa el riesgo de infección de la herida quirúrgica6-9.
En la práctica clínica, muchas de las intervenciones que incumben extremidades, utilizan el manguito de isquemia o torniquete neumático para evitar el sangrado durante el tiempo operatorio. Con este sistema se consigue un campo quirúrgico exangüe, con lo que se evita la pérdida sanguínea y se facilita la labor del cirujano, aunque también ha generado dudas sobre su efecto negativo respecto a la llegada del antibiótico profiláctico.
El objetivo de este estudio es evaluar si la concentración de antibiótico profiláctico se mantiene por encima de la concentración mínima inhibitoria (CMI) durante toda la intervención de PTR cuando se utiliza el manguito de isquemia.
Material y métodoDiseño del estudioEstudio clínico observacional de 32 pacientes intervenidos en el Hospital Arnau de Vilanova de Lleida de PTR primaria, por causa artrósica. Todos los pacientes firmaron el consentimiento informado y el estudio fue evaluado positivamente por el Comité Ético Hospitalario. Los casos fueron recogidos consecutivamente y siempre que no cumplieran algún criterio de exclusión: pacientes alérgicos a la penicilina, pacientes con cirugías previas sobre la rodilla a intervenir y pacientes tratados con otra pauta de antibiótico en los 7 días previos a la cirugía.
Se administró una dosis única de 2g de cefonicid EFG® por vía intravenosa en la sala de recepción de quirófano. Se aplicó el manguito de isquemia para extremidad inferior en la raíz del miembro a intervenir, colocando un acolchado blando entre la piel y el manguito para prevenir lesiones cutáneas y fijando el manguito con tiras de velcro y venda de gasa. Siempre se realizó el vaciamiento venoso por declive, con elevación de la extremidad durante el tiempo de preparación del campo quirúrgico, momento en el que hinchamos el torniquete, que está conectado a la toma de aire del quirófano y justo antes de iniciar la intervención. La presión del manguito aplicada en todos los casos osciló entre 350-400mmHg. Se anotó el tiempo de exposición del antibiótico, el tiempo de inicio de la isquemia y de la intervención.
Iniciada la intervención, se recogió una primera muestra de tejido sinovial en el momento de abrir la cápsula articular de la rodilla (M1). Una vez implantada la prótesis y justo antes de cerrar la cápsula articular, se recogió la segunda muestra de tejido sinovial (M2) y se retiró la isquemia al finalizar la intervención. Se anotaron los tiempos de la recogida de cada muestra, así como el tiempo de finalización de la intervención y retirada de la isquemia.
Las muestras se recogieron y manipularon en condiciones de asepsia y fueron pesadas antes de guardarlas congeladas a −80° hasta el momento de su manipulación.
Concentración mínima inhibitoriaReferente a la CMI asociada al cefonicid, en unos estudios10,11 se determinó la CMI para el Staphylococcus aureus (S. aureus) en 6,3μg/ml, mientras que en otro trabajo12 se concluyó que para inhibir el 90% del crecimiento del S. aureus era necesario 8μg/ml de cefonicid.
En este estudio se estableció como referencia el valor de la CMI del cefonicid en 8μg/ml.
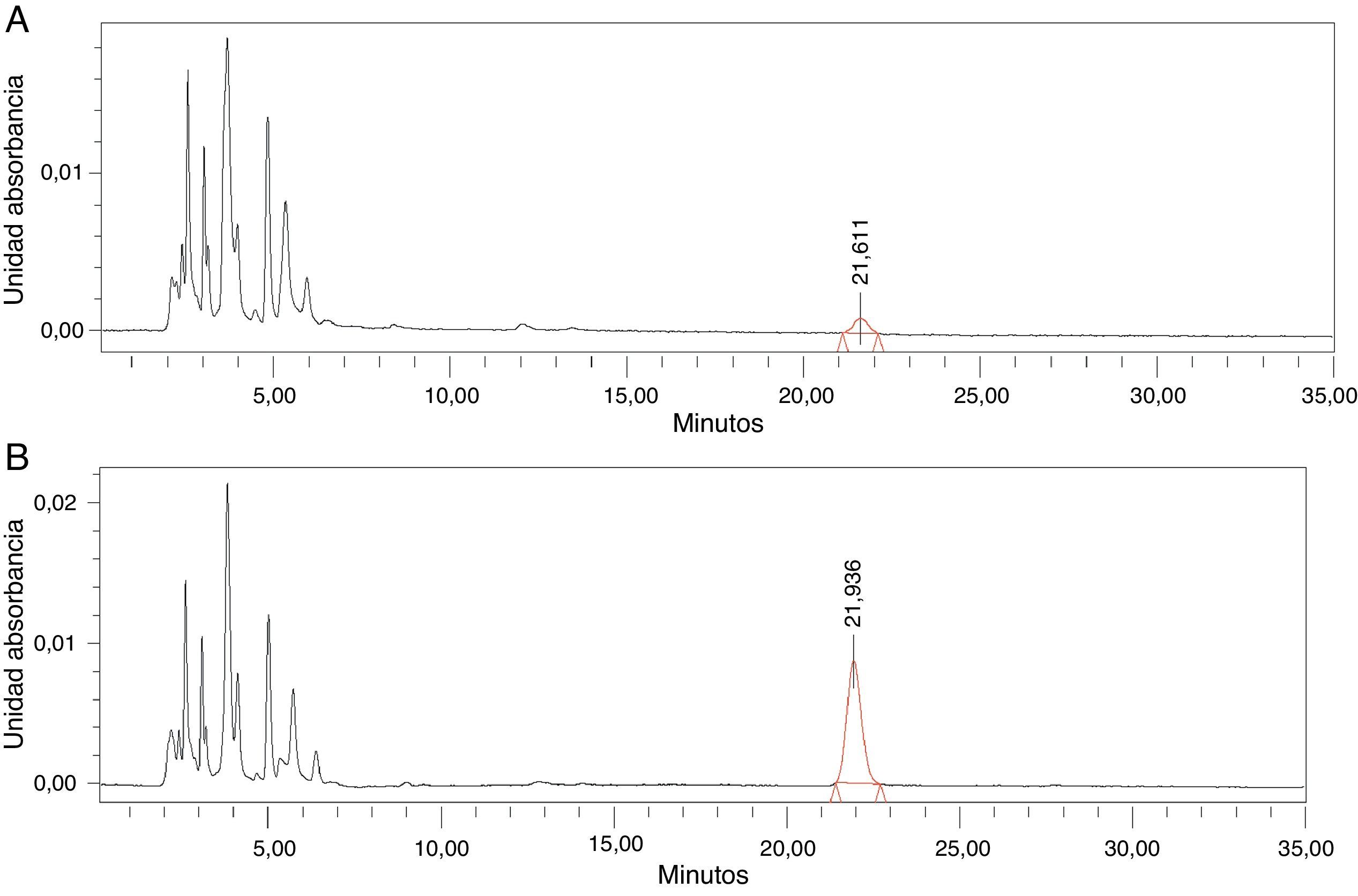
Determinación de la concentración de antibiótico en el tejido sinovialPara determinar la concentración de antibiótico en las muestras de tejido sinovial se utilizó el método de cromatografía líquida de alta resolución (HPLC), siguiendo diferentes referencias de la literatura13-16. Se utilizó como fase móvil una solución acuosa de acetato amónico (0,385%) y metanol (10%). La separación cromatográfica se realizó en una columna Ultrasphere IP 4,6mm × 250mm de 5μ de tamaño de partícula (Beckmann Coulter®). Con el fin de determinar las condiciones óptimas de detección del cefonicid, se utilizó antibiótico puro, resultando los siguientes parámetros: longitud de onda 265nm, tiempo de cromatografía de 35 min, flujo de 1,3ml/min, tiempo de retención del pico entre el minuto 22-28 y el volumen de inyección de las muestras de 10μl.
En segundo lugar, se utilizaron muestras de tejido sinovial de rodilla obtenidas antes de la administración de antibiótico, a las que se les añadió diferentes dosis de cefonicid conocidas en el momento de procesarlas, denominadas muestras de tejido sinovial estándar, con el objetivo doble de validar la técnica de HPLC para la determinación de cefonicid en tejido sinovial (efectuando las correspondientes pruebas de linealidad, precisión del sistema, reproducibilidad, resistencia y estabilidad de la solución analítica) y también estimar una ecuación de referencia para relacionar las áreas de los picos obtenidos en el cromatograma con las dosis de antibiótico conocidas.
En tercer lugar, se procedió a interpolar las concentraciones de antibiótico en el tejido sinovial de las muestras M1 y M2 de los pacientes a partir de las áreas obtenidas en el cromatograma, utilizando para ello la ecuación estimada. Cada muestra se inyectaba en el HPLC por duplicado, la primera inyección, para obtener el área que corresponde al antibiótico estudiado y la segunda inyección, previa administración de una dosis de cefonicid extra, para comprobar que el pico detectado en la primera inyección correspondía al antibiótico estudiado, al objetivar el aumento de su área (fig. 1 A y B).
Métodos estadísticosPara la descripción general de la muestra se calcularon los estadísticos descriptivos habituales, utilizando para ello la media ± desviación típica y el rango, para las variables cuantitativas y las frecuencias absolutas y relativas, en porcentajes, para las variables categóricas. Se utilizó la prueba de Mann-Whitney para estudiar las diferencias del índice de masa corporal (IMC) según sexo y la prueba t de Student y la prueba no paramétrica de Wilcoxon para evaluar si los niveles medios de concentración de antibiótico en tejido sinovial fueron superiores la CMI (8μg/g) en M1 y en M2. Se utilizó el programa estadístico SPSS versión 18, estableciendo la significación estadística en el 5% (α = 0,05).
ResultadosRespecto a la cohorte estudiada, de los 32 pacientes incluidos, 9 fueron hombres (28%) y 23 mujeres (72%), con una edad media ± desviación estándar de 71,5±6,65 años (rango de 54 a 84). La media de peso de los pacientes fue de 80,43±11,38 kg (rango 65 a 125,5), con un IMC medio de 32,55±4,49kg/m2 (rango de 23,59 a 45,36). Dos pacientes presentaban normopeso (6%), 6 pacientes sobrepeso (19%), 18 pacientes obesidad leve (56%), 4 obesidad moderada (13%) y 2 pacientes obesidad mórbida (6%). El IMC medio para hombre y mujeres fue 28,55 y 34,11 respectivamente, alcanzando esta diferencia la significación estadística (p=0,001). Veintidós casos correspondieron al lado derecho (69%) y 10 al lado izquierdo (31%). Según el modelo de prótesis implantado, 26 fueron prótesis totales de rodilla press-fit híbridas (81%), 3 prótesis totales estabilizadas posteriores (9,5%) y 3 prótesis rotacional Endo-model (9,5%). La media de los días de ingreso fue 8,1±2,89 días (rango de 4 a 19). Siete pacientes siguieron control por el servicio de Hospitalización a Domicilio (22%). La media de tiempo de seguimiento fue de 34,84±21,75 meses (rango de 4 a 72). En ningún paciente se diagnosticó infección de la prótesis, aguda ni crónica, durante el tiempo de seguimiento en consulta ni en la revisión posterior de las historias clínicas. La media del tiempo de exposición del antibiótico fue de 47,88±20,84 min (rango de 13 a 113), el tiempo medio de intervención fue de 93,69±17,65 min (rango de 54 a 151) y el tiempo medio de isquemia fue de 96,34±15,84 min (rango de 65 a 124). La media de tiempo desde la administración del antibiótico hasta la recogida de la muestra M1 fue de 56,41±20,41 min (rango de 22 a 119) y para M2 de 121,5±23,61 min (rango de 83 a 192).
Respecto a la validación del método de HPLC para la determinación de cefonicid, los resultados obtenidos indicaron una alta linealidad (coeficiente de determinación R2=0,99), una alta precisión del sistema (coeficiente de variación de las réplicas respecto a la media de 2.76%) y una reproducibilidad aceptable, con unos niveles de dispersión oscilando desde el 4, el 23 y el 34% para concentraciones de antibiótico de 6, 20 y 40μg/g, respectivamente. La resistencia del método analítico intradía e interdiaria presentó un coeficiente de variación inferior al 4 y al 2%, respectivamente, y la estabilidad de la solución analítica tuvo asociado un coeficiente de variación del 7,46, el 5 y el 3,24% para concentraciones de 10, 16 y 20μg/g, respectivamente.
El patrón de referencia obtenido con las muestras de tejido sinovial estándar nos permitió extrapolar las áreas obtenidas de las muestras de los pacientes en concentración de antibiótico.
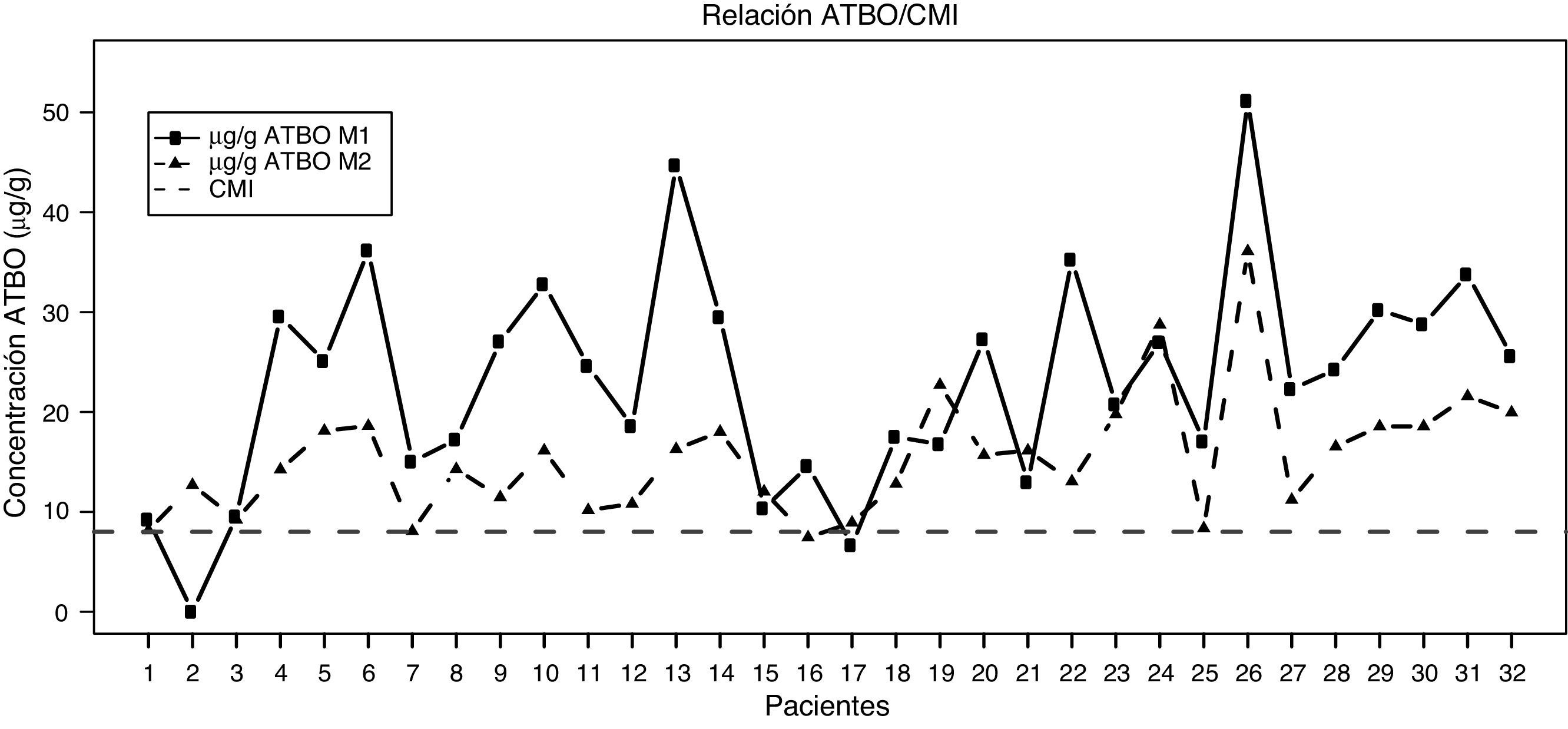
Referente a los resultados de nuestro estudio, en la figura 2 se representan las concentraciones de antibiótico detectadas en las muestras M1 y M2 en el tejido sinovial de los pacientes intervenidos, observándose una clara tendencia de concentraciones más altas en las muestras de M1 frente a las de M2 y un predominio de las concentraciones, en ambos casos, por encima de la CMI. La tabla 1 muestra los estadísticos descriptivos de la concentración de antibiótico en los momentos analizados. Las concentraciones medias fueron de 23,16μg/g (IC del 95%, 19,19-27,13) y de 15,45μg/g (IC del 95%, 13,20-17,69) en M1 y M2, respectivamente, mostrándose superiores a la CMI de cefonicid, establecida en 8μg/g, alcanzando ampliamente estos resultados la significación estadística (p<0,00001 para ambas concentraciones). Además, los niveles de antibiótico observados en M1 son significativamente superiores a los observados en M2 (p=0,00002).
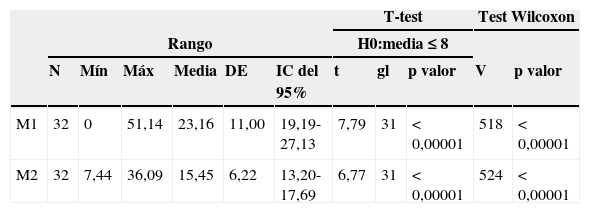
Estadísticos descriptivos para los valores antibióticos de M1 y M2: tamaño muestra (N), mínimo y máximo (Mín, Máx), media y desviación estándar (SD). Intervalos de confianza (IC) al 95%. Resultados de la prueba paramétrica t de Student: estadístico t, grados de libertad (gl) y p valor, y para la prueba no paramétrica de Wilcoxon: estadístico V y p valor. Pruebas estadísticas unilaterales para evaluar las diferencias de los valores medios respecto de la CIM de 8μg/g
| T-test | Test Wilcoxon | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Rango | H0:media ≤ 8 | ||||||||||
| N | Mín | Máx | Media | DE | IC del 95% | t | gl | p valor | V | p valor | |
| M1 | 32 | 0 | 51,14 | 23,16 | 11,00 | 19,19-27,13 | 7,79 | 31 | < 0,00001 | 518 | < 0,00001 |
| M2 | 32 | 7,44 | 36,09 | 15,45 | 6,22 | 13,20-17,69 | 6,77 | 31 | < 0,00001 | 524 | < 0,00001 |
En relación con los niveles de antibiótico en las muestras de M1 y M2 y las diferentes variables clínicas y experimentales estudiadas, no se hallaron asociaciones estadísticamente significativa para las variables tiempo de aplicación de la isquemia, tiempo de exposición del antibiótico, tiempo de recogida de la muestra M1, tiempo de recogida de la muestra M2, tiempo de duración de la intervención, edad, peso de los pacientes, días de ingreso y tiempo de seguimiento en consultas externas. Tampoco se constataron diferencias significativas al analizar los diferentes niveles de antibiótico según el IMC categorizado (normopeso, sobrepeso, obesidad leve, obesidad moderada y obesidad mórbida).
DiscusiónLa implicación clínica directa más relevante de este estudio, eminentemente observacional, es la validación de la profilaxis antibiótica administrada antes de la cirugía y la demostración que los niveles de antibiótico se mantienen durante toda la intervención por encima de la CMI cuando se aplica el manguito de isquemia.
Respecto a otros artículos publicados sobre la detección de cefonicid en tejidos, el más parecido a nuestro estudio en dosis, vía de administración y método de detección de antibiótico es el estudio de Nightingale et al.13 pero difiere en el tejido estudiado (hueso de la cabeza femoral en pacientes intervenidos de prótesis total de cadera), constatándose que las concentraciones medias de cefonicid detectadas (18,7μg/g) son similares a las detectadas en nuestro estudio. También revisamos diferentes investigaciones médicas que han estudiado el efecto de la aplicación del torniquete sobre la acción antibiótica profiláctica, observándose cierta controversia en los resultados publicados. En ningún caso encontramos la profilaxis antibiótica con cefonicid, pero nos ayuda a examinar en que se fundamentan al extraer las conclusiones. En 3 estudios17-19 determinan el efecto de la isquemia sobre la profilaxis antibiótica a partir de la presencia de infección postoperatoria, encontrando en 2 estudios17,19, más incidencia de infección en el grupo con isquemia, si bien en ninguno de estos estudios se determina la concentración de antibiótico en el tejido. Otros trabajos comparan pacientes intervenidos de PTR con prótesis de cadera20-22, relacionando la concentración de antibiótico en los tejidos en función del tiempo desde la administración del antibiótico, obteniendo conclusiones respecto a su concentración con tiempos alrededor de los 90 min desde su administración, creemos que este tiempo no corresponde exactamente a la última etapa de la intervención, que según nuestro juicio es la forma más objetiva para determinar si la isquemia interfiere en la posibilidad de reducir la concentración de antibiótico que sobre todo será más evidente al final de la intervención.
Respecto a la concentración de antibiótico necesaria para prevenir la infección durante la intervención, se encuentran diferentes criterios en la literatura, estableciéndose una concentración de antibiótico requerida igual o superior a la CMI7,23,24, el doble22, o bien hasta 4 veces la CMI25. En este sentido, nosotros también defendemos que la concentración de antibiótico necesaria para evitar la infección es la que iguala o supera la CMI, ya que si aplicamos la premisa de requerir el doble de la CMI en tejido sinovial, en nuestro estudio, obtendríamos 8 casos de muestras de M1 con concentración insuficiente de antibiótico y 16 casos en M2, siendo el riesgo muy elevado como para no encontrar ningún caso de infección.
Destacamos el caso del paciente 2, donde no se detectó antibiótico en la muestra de M1 y 13mg/g en la muestra M2. Este paciente además coincide con un tiempo de exposición del antibiótico de 13 min. El hecho de que en la muestra de M1 no se detectara antibiótico puede ser explicado bien por un tiempo de exposición muy bajo o bien por un error del cromatógrafo. En la mayoría de los pacientes estudiados, se ha detectado una disminución de los niveles de antibiótico al final de la intervención (M2) respecto al inicio; consideramos que es debido al cese del aporte sanguíneo al aplicar la isquemia y la consecuente metabolización del antibiótico. De todos modos, la concentración detectada al final de la intervención es superior a la CMI, con lo que consideramos que se alcanza un nivel de protección frente a la infección clínicamente adecuado.
Como limitaciones del estudio cabe señalar que, aunque el tamaño de la muestra estudiada es claramente suficiente para evaluar la hipótesis principal, para el análisis estratificado según diferentes variables clínicas y experimentales, la potencia estadística es pobre.
Si bien es cierto que los resultados obtenidos no son extrapolables a un marco clínico general, también lo es que nuestra práctica clínica es la habitual en la implantación de una PTR. De esta forma, los resultados obtenidos aportan una visión general para este tipo de intervenciones y pueden ser una referencia para otro tipo de intervenciones donde se utilice el manguito de isquemia. En cualquier caso, los resultados de este estudio demuestran que la isquemia no compromete los niveles del antibiótico profiláctico.
Nivel de evidenciaNivel de evidencia iv.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos están conforme a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito.
Derecho a la privacidad y consentimiento informadoLos autores se responsabilizan de garantizar el derecho a la privacidad de los pacientes protegiendo su identidad tanto en la redacción del artículo como en las imágenes mostradas.
FinanciaciónLos autores declaran que no han recibido ayuda económica de ningún estamento público ni privado para realizar el trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.