El índice de masa ósea preoperatoria ha demostrado ser un factor importante en la remodelación ósea periprotésica en estudios a corto plazo.
Material y métodosSe utilizó DEXA para realizar un estudio de seguimiento de 10 años a 39 pacientes con una artroplastia de cadera no cementada unilateral. Las mediciones de densidad de masa ósea (DMO) se realizaron a los 6 meses, un año, 3 años, 5 años y 10 años después de la cirugía. El coeficiente de correlación de Pearson se utilizó para cuantificar las correlaciones entre DMO preoperatoria y la densidad mineral ósea periprotésica en las 7 zonas de Gruen a los 6 meses, un año, 3 años, 5 años y 10 años.
ResultadosLa DMO preoperatoria fue un buen predictor de DMO periprotésica un año después de la cirugía en las zonas 1, 2, 4, 5 y 6 (índice de Pearson 0,61-0,75). Tres años después de la cirugía mantiene un buen poder predictivo en las zonas 1, 4 y 5 (0,71-0,61), aunque en las zonas 3 y 7 se observó baja correlación un año después de la cirugía (0,51 y 0,57 respectivamente). Al final del seguimiento se evidenció baja correlación en las 7 zonas de Gruen. El sexo y el IMC no tuvieron una influencia estadísticamente significativa en la remodelación ósea periprotésica.
ConclusiónAunque la DMO preoperatoria parece ser un factor importante en la remodelación periprotésica un año después de la implantación de una artroplastia, este factor va perdiendo progresivamente poder predictivo; no siendo un factor determinante en la remodelación periprotésica 10 años después de la cirugía.
Preoperative bone mass index has shown to be an important factor in peri-prosthetic bone remodelling in short follow-up studies.
Material and methodsBone density scans (DXA) were used to perform a 10-year follow-up study of 39 patients with a unilateral, uncemented hip replacement. Bone mass index measurements were made at 6 months, one year, 3 years, 5 years, and 10 years after surgery. Pearson coefficient was used to quantify correlations between preoperative bone mass density (BMD) and peri-prosthetic BMD in the 7 Gruen zones at 6 months, one year, 3 years, 5 years, and 10 years.
ResultsPre-operative BMD was a good predictor of peri-prosthetic BMD one year after surgery in zones 1, 2, 4, 5 and 6 (Pearson index from 0.61 to 0.75). Three years after surgery it has good predictive power in zones 1, 4 and 5 (0.71-0.61), although in zones 3 and 7 low correlation was observed one year after surgery (0.51 and 0.57, respectively). At the end of the follow-up low correlation was observed in the 7 Gruen zones. Sex and BMI were found to not have a statistically significant influence on peri-prosthetic bone remodelling.
ConclusionAlthough preoperative BMD seems to be an important factor in peri-prosthetic remodelling one year after hip replacement, it loses its predictive power progressively, until not being a major factor in peri-prosthetic remodelling ten years after surgery.
La remodelación ósea tras la artroplastia de cadera es un fenómeno comúnmente observado en todos los diseños protésicos. La cuantía de esta remodelación puede variar en función de factores relacionados tanto con el paciente (sexo, peso, masa ósea preoperatoria) como con el implante (geometría, talla, material, recubrimiento de superficie). Es aceptado que la mayoría de los cambios remodelativos alrededor del vástago femoral ocurren en los primeros años tras la intervención quirúrgica1,2, momento a partir del cual los cambios reflejan la respuesta biomecánica del hueso según la ley de Wolff y los cambios asociados al envejecimiento.
En el estudio de las causas multifactoriales de las que depende la remodelación ósea periprotésica, se ha considerado de capital importancia la masa ósea preoperatoria ya que las técnicas de artroplastia no cementada se basan en una buena osteointegración del implante. Coincidiendo con el diseño de implantes biomecánicamente optimizados y los recubrimientos bioactivos que impulsan el crecimiento óseo, la indicación de la implantación de este tipo de implantes se ha ido expandiendo para incluir a pacientes más mayores, y previsiblemente con peor calidad ósea3,4.
La absorciometría dual con rayos X ha sido ampliamente utilizada para cuantificar la extensión de la pérdida ósea periprotésica alrededor de implantes articulares. Este método ha demostrado ser fiable y preciso, y es considerado el ideal para exámenes repetidos en seguimientos seriados por su exactitud y baja radiación5,6.
Por estos motivos se ha utilizado para el estudio de diversos implantes que han mostrado patrones de remodelación diferentes: los vástagos no cementados de primera generación mostraron pérdidas de en torno al 45% de la masa ósea en zonas proximales7, mientras que los vástagos anatómicos de segunda generación consiguieron descender la pérdida hasta cifras del 20-25%8. Los implantes personalizados, realizados a medida del paciente, mostraron pérdidas del 10-15% al tercer año de seguimiento9.
Para conocer la influencia de la masa ósea preoperatoria en remodelación periprotésica femoral se diseñó un estudio prospectivo que analizaba a 39 pacientes que fueron sometidos a la implantación de una artroplastia total de cadera modelo ABG-II debido a una coxopatía primaria unilateral (artrosis o necrosis avascular). Se realizaron determinaciones con absorciometría dual con rayos X con un seguimiento de 10 años tras la intervención. El propósito del estudio es determinar cuantificando los cambios en la densidad mineral ósea en las 7 áreas de Gruen a lo largo del seguimiento, analizando la influencia de masa ósea preoperatoria en la remodelación ósea periprotésica. También se estudió la influencia de sexo e índice de masa corporal.
Material y métodoSe diseñó un estudio prospectivo controlado para estudiar la influencia de la densidad de masa ósea (DMO) preoperatoria en la remodelación periprotésica producida por la implantación del vástago ABG-II no cementado. El tamaño muestral fue calculado según tablas de comparación de medias para obtener una potencia estadística del 95% y un riesgo alfa de 0,05.
Los criterios de inclusión fueron los siguientes: por un lado, los pacientes tenían que tener indicación de la implantación del vástago ABG-II según su enfermedad y calidad ósea (necrosis avascular o artrosis, sin signos de osteoporosis); en segundo lugar, la coxopatía debía ser unilateral y, por último, no debían haber sufrido reintervenciones en la cadera a estudio, ya fuese por recambios o fracturas periprotésicas. Todos los pacientes firmaron el consentimiento informado para participar en el estudio; ratificado por el Comité Ético del centro. El grupo a estudio se compone de 39 pacientes (25 hombres y 14 mujeres), con una media de índice de masa corporal de 30,2kg/m2 (22-50,3kg/m2) y una media de edad de 68 años (51-82 años); que fueron intervenidos en el Hospital Universitario Miguel Servet entre el 1 de febrero del año 2000 y el 1 de febrero del año 2001. Todos los pacientes completaron el seguimiento satisfactoriamente.
El implante usado fue el vástago ABG-II (Stryker, Howmedica) y un cotilo no cementado recubierto de hidroxiapatita modelo ABG-II. El vástago ABG-II es anatómico, no cementado, con fijación metafisaria por ajuste a presión fabricado en aleación de titanio (TM12Z6F2). Posee un recubrimiento de hidroxiapatita de 70 micras de grosor limitado a la zona metafisaria con una pureza del 99,99% y un diseño de escamas en las caras anterior y posterior que convierte las fuerzas de cizallamiento en fuerzas de compresión, aumentando así su estabilidad. La cola del implante es fina y pulida para evitar el contacto con el endostio diafisario.
Todos los pacientes fueron intervenidos usando una vía de abordaje posterolateral por el mismo grupo de 4 cirujanos. El canal femoral fue preparado mediante fresado diafisario 1mm mayor que la cola del vástago. En el postoperatorio, todos los pacientes recibieron profilaxis antitrombótica con heparina de bajo peso molecular y profilaxis antibiótica durante 48h tras la intervención quirúrgica. Los pacientes mantuvieron el apoyo parcial durante 6 semanas, momento en que se retiraba el bastón homolateral y se autorizaba la carga completa. Posteriormente se indicaron ejercicios de fortalecimiento de glúteos según el protocolo de recuperación fisioterapéutica vigente en nuestro servicio en el momento en que se realizaron las cirugías.
El seguimiento clínico se hizo mediante la escala de Merle D¿Aubigné. Se realizaron estudios radiológicos anuales donde no se apreciaron radiolucencias ni imágenes osteolíticas.
El estudio densitométrico se llevó a cabo dividiendo el fémur proximal en cajas de 30×30mm que representaban las 7 zonas de Gruen, tanto en el fémur intervenido como en el contralateral. El densitómetro utilizado fue modelo LUNAR DPX enCORE (General Electrics Healthcare, Madison); utilizando un software de exclusión de metales en todas las mediciones.
Se consideró de capital importancia establecer un protocolo de colocación del paciente en la mesa de exploración del densitómetro para garantizar la fiabilidad de las mediciones, ya que algunos autores han publicado una alteración en la determinación de la DMO de en torno a un −5%9. Los pacientes fueron colocados en posición supina sobre la mesa del densitómetro, con las rodillas en extensión y todo el miembro estabilizado en posición neutra mediante un dispositivo rígido equipado con cintas de velcro.
La realización de determinaciones densitométricas se inició en el preoperatorio. Se hicieron determinaciones adicionales en el fémur intervenido a los 6 meses, al año, a los 3, 5 y a los 10 años de la intervención. Se tomó la cifra de densidad mineral ósea preoperatoria como referencia para establecer las variaciones densitométricas, con objeto de obviar la disminución del stock óseo debido a la intervención quirúrgica, que se ha observado que puede llegar a ser del 10%10.
La comparación de porcentajes se realizó usando el test Chi cuadrado, para la comparación de medias se utilizó el test t-Student con un nivel de significación de 0,025 para analizar la evolución de la DMO en el fémur intervenido. Para cuantificar las correlaciones se utilizó el coeficiente de correlación de Pearson.
ResultadosAl final del seguimiento las imágenes radiológicas demostraron que todos los vástagos eran estables, y no se hallaron líneas reactivas o radiolucencias.
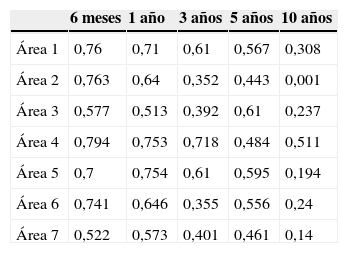
Estudiando la relación entre la DMO inicial y la DMO a lo largo del seguimiento se aprecia que la inicial guarda una buena correlación y se considera un buen factor predictor durante el primer año en las zonas 1, 2, 4 y 6 (índices de correlación de Pearson entre 0,61 y 0,75). A los 3 años tras la cirugía todavía muestra buen poder predictivo en las zonas 1, 4 y 5 (0,71-0,61). En las áreas 3 y 7 se apreció una baja correlación desde la determinación al año de la intervención (0,51 y 0,57 respectivamente). Al final del seguimiento se encontró una baja correlación para las 7 zonas de Gruen. Los resultados se muestran en la tabla 1.
Coeficiente de correlación de Pearson mostrando la capacidad predictiva de la masa ósea preoperatoria para predecir la DMO a lo largo del seguimiento en cada una de las áreas de Gruen
| 6 meses | 1 año | 3 años | 5 años | 10 años | |
|---|---|---|---|---|---|
| Área 1 | 0,76 | 0,71 | 0,61 | 0,567 | 0,308 |
| Área 2 | 0,763 | 0,64 | 0,352 | 0,443 | 0,001 |
| Área 3 | 0,577 | 0,513 | 0,392 | 0,61 | 0,237 |
| Área 4 | 0,794 | 0,753 | 0,718 | 0,484 | 0,511 |
| Área 5 | 0,7 | 0,754 | 0,61 | 0,595 | 0,194 |
| Área 6 | 0,741 | 0,646 | 0,355 | 0,556 | 0,24 |
| Área 7 | 0,522 | 0,573 | 0,401 | 0,461 | 0,14 |
Para el estudio de la influencia del índice de masa corporal en la remodelación ósea se dividió la muestra en 2 grupos, el grupo 1 con un índice de masa corporal menor o igual a 30 (19 pacientes), y el grupo 2 con un índice de masa corporal superior a 30 (20 pacientes). No se halló una influencia estadísticamente significativa entre este factor y el remodelado óseo periprotésico. Datos similares se obtuvieron en el análisis del sexo como factor de influencia en el remodelado óseo, donde no se encontraron diferencias estadísticamente significativas, como se muestra en la tabla 2.
Comparación de la DMO en mg/cm2 en ambos sexos en el fémur intervenido en las diferentes áreas de Gruen
| Pre-IQ | 6 meses | 1 año | 3 años | 5 años | 10 años | |
|---|---|---|---|---|---|---|
| Área 1Hombres% variaciónMujeres% variaciónSignif: | 785650 | 776−1,14%618−4,9%p=0,635 | 752−4,2%621−4,4%p=0,954 | 781−0,5%592−8,9%p=0,074 | 861+3,05%656−0,6%p=0,41 | 757−3,5%621−4,4%p=0,733 |
| Área 2Hombres% variaciónMujeres% variaciónSignif: | 1.2791.147 | 1.349+5,4%1.133+1,2%p=0,351 | 1.294+1,1%1.148+0,08%p=0,761 | 1.493+16,7%1.493+17,1%p=0,869 | 1.720+34,4%1.593+38,8%p=0,954 | 1.529+19%1.320+15,7%p=0,677 |
| Área 3Hombres% variaciónMujeres% variaciónSignif: | 1.7131.460 | 1.709−0,22%1.395−4,4%p=0,882 | 1.658−3,2%1.427−2,2%p=0,224 | 1.930+12,6%1.637+12,1%p=0,828 | 2.256+31,6%1.799+23,2%p=0,012 | 1.793+4,67%1.663+13,9%p=0,782 |
| Área 4Hombres% variaciónMujeres% variaciónSignif: | 1.8871.578 | 1.837−2,64%1.491−5,5%p=0,491 | 1.861−1,3%1.510−4,3%p=0,591 | 1.978+18%1.612+2,1%p=0,79 | 2.129+12,8%1.800+14,2%p=0,7 | 2.038+8%1.799+14%p=0,436 |
| Área 5Hombres% variaciónMujeres% variaciónSignif: | 1.8001.476 | 1.747−2,9%1.427−3,3%p=0,55 | 1.775+1,3%1.420−3,7%p=0,552 | 1.918+6,5%1.576+6,7%p=0,901 | 2.294+27,4%1.875+27%p=0,283 | 1.778−1,2%1.577+6,8%p=0,975 |
| Área 6Hombres% variaciónMujeres% variaciónSignif: | 1.5461.286 | 1.601+3,5%1.298+0,9%p=0,165 | 1.586+2,5%1.340+4,1%p=0,319 | 1.729+11,8%1.622+26,1%p=0,293 | 2.035+31,6%1.843+43,3%p=0,55 | 1.689+9,2%1.361+26,8%p=0,739 |
| Área 7Hombres% variaciónMujeres% variaciónSignif: | 1.1851.106 | 1.107−6,5%949−14,1%p=0,857 | 1.059−10,6%941−14,9%p=0,926 | 1.173−1%1.003−9,3%p=0,435 | 1.183−0,1%974−11,9%p=0,178 | 1.023−13,6%955−13,6%p=0,97 |
Por último, cabe señalar que no hubo complicaciones médicas durante el seguimiento que pudieran ser responsables de alteraciones en la densidad mineral ósea.
DiscusiónEl remodelado óseo después de una artroplastia de cadera tiene un origen multifactorial1,2,7. Se puede detectar una rápida pérdida ósea durante los primeros 6 meses que puede ir del 20% al 50% en función del implante y la metodología del estudio. Esta pérdida ósea está influida por diferentes factores, como la agresión quirúrgica, el reposo en el postoperatorio inmediato y la carga parcial de peso. Las cifras de masa ósea se ven afectadas por el fresado quirúrgico y la preparación del fémur proximal, causando un descenso inmediato del stock óseo de hasta el 10%11.
El reposo postoperatorio y la carga parcial de peso no pueden explicar completamente algunas de las pérdidas de masa ósea que ocurren en las zonas proximales del fémur. La técnica quirúrgica tiene una importante influencia en los cambios ocurridos en el período precoz. La preparación de la metáfisis y el encaje a presión del implante pueden causar microfracturas en el hueso esponjoso, produciendo nuevos descensos de masa ósea detectados en los primeros 6 meses del seguimiento. La cuantía y extensión de estos cambios son debidas a la desigual agresión quirúrgica en las diferentes zonas del fémur proximal.
La preparación femoral de las áreas media y distal causa una importante disrupción de la circulación endostal debido al fresado y puede producir necrosis ósea en la parte más interna de la cortical12. Por el contrario, en el cálcar la exposición quirúrgica del cuello femoral en el momento de la osteotomía daña la vascularización periostal. Además el raspado también afecta a la circulación endostal. Como resultado, al final del proceso esta área puede sufrir una denervación e importante pérdida de vascularización, causando un grado variable de necrosis ósea y resorción. La suma de factores biológicos y mecánicos puede explicar el descenso de masa ósea en esta zona, que llega hasta el 24% en los primeros 6 meses en algunos estudios13, recobrándose paulatinamente en controles a los 18 meses de la intervención14.
Es aceptado que la mayor parte del remodelado se estabiliza al final del primer año de la intervención, cuando la densidad ósea parece alcanzar una meseta en todas las áreas alrededor de la prótesis15,16, momento a partir del cual los cambios reflejan la respuesta biomecánica del hueso según la ley de Wolff.
Otros estudios realizados con TAC cuantitativa17 han objetivado una disminución progresiva de la DMO en la metáfisis, con unas pérdidas del 13,8% en trocánter mayor y del 17,8% en trocánter menor a los 5 años, con mayor afectación en hueso esponjoso que cortical. No se ha observado correlación con factores como sexo, índice de masa corporal o lado afecto. En este estudio se concluye que los factores más importantes para la disminución de la masa ósea periprotésica son la edad, la osteolisis y el efecto stress-shielding.
Respecto a la influencia de otros factores como índice de masa corporal y sexo en la remodelación ósea, varios estudios17–21 han mostrado resultados en consonancia con los obtenidos en este trabajo, según lo cual no se ha encontrado una diferencia significativa en el remodelado cuando se tomaban estos factores como determinantes del estudio.
En cuanto a la potencia predictiva de la masa ósea inicial para determinar la DMO a lo largo del seguimiento, varios autores han llegado a la conclusión de que la DMO preoperatoria es un factor importante para la remodelación ósea periprotésica22–24, hecho que ha sido constatado en este estudio solo durante el primer año de seguimiento, indicando que serían necesarios estudios a más largo plazo para evaluar la capacidad de predicción de la DMO inicial sobre la remodelación periprotésica. Otros autores mantienen que la DMO preoperatoria es un factor menor, que no tiene influencia en otros eventos como el hundimiento del vástago25 o las fracturas periprotésicas26, argumentando que la estabilidad de los componentes press-fit se basa para su estabilidad en el contacto cortical y no en la transferencia de cargas puramente metafisaria27.
Somos conscientes de las limitaciones de este estudio: en primer lugar, el número de sujetos incluido podría ser insuficiente y un mayor número de pacientes podría aportar mayor valor a los análisis estadísticos. En segundo lugar, el período de seguimiento podría ser insuficiente, pues es en los pacientes más mayores en los que los cambios debidos a la remodelación ósea a largo plazo pueden tener un mayor efecto y producir mayores consecuencias para la fijación del implante.
En conclusión, consideramos que la masa ósea preoperatoria no ha mostrado correlación con la masa ósea periprotésica al final del seguimiento. Otros factores valorados en este estudio, como sexo e índice de masa corporal, no mostraron tener una influencia valorable.
Nivel de evidenciaNivel de evidencia iii.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses ni haber recibido ningún tipo de financiación para la realización de este estudio.