Estudiar la integración de una plastia tendinosa en la reparación de un ligamento cruzado anterior (LCA) y el proceso de «ligamentización» con túneles de diferente calibre.
Material y métodosEstudiamos la integración del LCA en 41 ovejas adultas, según los siguientes grupos: grupo A: plastia tendinosa autóloga del tendón flexor superficial de la pezuña en túnel femoral y tibial de 5mm de diámetro; grupo B: en túneles de 7mm de diámetro. Sacrificio a los 3, 6 y 12 meses. Efectuamos un estudio histológico de la plastia en el túnel femoral, en el túnel tibial e intraarticular. También analizamos biomecánicamente el complejo fémur-plastia-tibia, con túneles de diferente diámetro y distintos tiempos de evolución.
ResultadosEn los túneles de 5mm no vimos integración directa de la plastia con el hueso. Observamos un tejido fibroso celular y vascularizado. En los túneles de 7mm tampoco observamos unión directa de la plastia con el hueso. El tejido de interfaz era un tejido fibroso con una estructura fascicular desarrollando la formación de septos y penetración de vasos. Macroscópicamente la plastia seguía recordando al tendón original. Las plastias de túnel de 7mm y con mayor tiempo de evolución necesitaban más fuerza de rotura y presentaban mayor elongación que las plastias de túneles de 5mm.
ConclusiónHistológicamente, al año de evolución, el tendón no se transformó en un ligamento y no había integración de la plastia con el hueso de los túneles, independientemente del diámetro de éstos.
To analyse the bone-ligament integration «ligamentization» of the tendon graft in the reconstruction of anterior cruciate ligament (ACL) performing tunnels of different diameter.
Material and methodsWe performed the same reconstruction procedure using an autologous tendon graft taken from the superficial tendon of the hoof in 41 adult sheep. In Group A the tibial and femoral tunnels were 5mm in diameter and in Group B they were 7mm in diameter. The sheep were sacrificed at 3, 6 and 12 months after the surgery. Histological studies were performed on the graft and the tunnels, as well as a biomechanical analysis of the tibial-femoral complex.
ResultsIn group A we did not observe direct integration of the bone and the tendon graft or any fibres joining both structures, although there was vascularized fibrous tissue. In group B we did not observe any direct binding of the bone and the tendon graft either, although there was abundant fibrous tissue. The tendon graft showed a fascicular structure that increased over time in order to create septa for vascular penetration. Macroscopically the ACL graft had a dense appearance, which was very similar to the original tendon graft. The tendon grafts from group B and with a longer follow up period required a higher strength to produce maximum breakage than the tendon grafts from group A.
ConclusionAfter one year follow up, the histological study shows that the tendon graft is not transformed into a ligament, and there is no integration of the tendon graft in tunnels regardless of their diameter. Therefore, fixation techniques are essential to maintain the orientation and tension of the tendon graft.
La rotura del ligamento cruzado anterior (LCA) es una lesión frecuente en la actividad deportiva. Su tratamiento ha cambiado notablemente en las tres últimas décadas, decantándose hacia la sustitución del mismo en las personas muy activas para disminuir el riesgo de lesiones meniscales o cartilaginosas secundarias1,2. El LCA se compone de dos fascículos, anteromedial, que se tensa durante la flexión y el posterolateral que lo hace con la extensión completa de la rodilla3. Los ligamentos de la articulación de la rodilla humana son estructuras compuestas por colágeno distribuido de forma no homogénea. En los ligamentos cruzados, la porción central contiene más colágeno que la distal o proximal y su densidad es menor en el LCA que en el resto de los ligamentos4, estando compuesto en su mayoría por colágeno tipo I. La función primordial del LCA es impedir el desplazamiento anterior de la tibia con relación al fémur y en menor medida controlar, en carga, la laxitud en varo, en valgo y la rotación5. Las arterias de los ligamentos cruzados proceden de la arteria genicular media que envía 4 ramas al ligamento cruzado posterior y una sola al LCA, pero la inserción de éstos están libres de vasos nutriéndose de los vasos sinoviales que se anastomosan con los vasos del periostio6, de ahí la necesidad de reparación quirúrgica cuando se lesiona este ligamento.
Para reconstruir el LCA se han descrito métodos con injertos autólogos utilizando tendón del músculo semitendinoso o del recto interno o de ambos tendones de la pata de ganso, así como del tracto iliotibial y fascia lata o del tendón rotuliano. Son técnicas que generalmente ofrecen buenos resultados,pero dañan siempre una estructura no lesionada y no están exentos de complicaciones, como por ejemplo lesiones de ramas perforantes, lesión de la rama infrapatelar del nervio safeno y atrofia grasa subcutánea en la zona donante dando lugar a cicatrices retractiles y dolorosas. El autoinjerto de ligamento rotuliano (H-T-H) también ofrece buenos resultados, pero tienen el inconveniente de generar dolor, en algunos casos, en la cara anterior de la rodilla. Utilicemos uno u otro autoinjerto se requiere una fijación estable para evitar el movimiento de la plastia en el interior del túnel siendo cruciales las 12 primeras semanas tras la cirugía.
Las fases de la integración del injerto comienza con necrosis en el centro del injerto e hipocelularidad, después aparece una fase de proliferación donde existe una gran actividad celular con abundante aglomeración de fibroblastos. Seguidamente, la fase de remodelación donde existe menos resistencia de la plastia mientras se va reorganizando estructuralmente7. Por su parte, la ligamentización consiste en la adaptación funcional que tiene lugar en la plastia para transformarse en el ligamento al que sustituye8.
La hipótesis del presente estudio es que la integración osteoligamentaria de las plastias en túneles de mayor diámetro es menor que en túneles del mismo diámetro, debido a la osteólisis que produce el propio líquido sinovial de la articulación, y que una plastia bien adaptada al diámetro del túnel femoral y tibial se integra más rápidamente y con mayores garantías. Los objetivos del presente trabajo es estudiar la integración de una plastia tendinosa en la reparación del LCA con túneles de diferente diámetro, estudiar la transformación estructural de la plastia con túneles de diferente calibre, y analizar la biomecánica del complejo fémur-plastia-tibia con túneles de diferente diámetro y distintos tiempos de evolución.
Material y métodoRealizamos el estudio de la integración del ligamento cruzado anterior en 41 ovejas (raza merino), de tres años de edad y 30kg de peso. Los animales se sacrificaron a los 3, 6 y 12 meses y se agruparon de la siguiente forma:
Grupo 0: animales para el diseño de la metodología o animales fallecidos antes de tiempo.
Grupo A: plastia tendinosa autóloga del tendón del flexor superficial de la pezuña incluida en un túnel, femoral y tibial, de 5mm de diámetro.
Grupo B: plastia tendinosa autóloga del tendón del flexor superficial de la pezuña incluida en un túnel, femoral y tibial, de 7mm de diámetro.
Se utilizó anestesia general con intubación endotraqueal. Para proceder a la administración de la medicación anestésica, se canuló la vena cefálica presente en la extremidad anterior derecha que se conectó a un sistema de gotero, a través del cual se suministró también fluidoterapia de mantenimiento, con suero glucosado al 5%. La inducción anestésica se consiguió mediante la administración por vía intravenosa de tiobarbital® (Abbot) a una dosis de 12mg/kg, atropina® (B. Braun) 0,5mg/kg, fentanil® (Kern), a una dosis de 0,015mg/kg y se mantuvo con tiobarbital® a una dosis de 10mg/kg y fentanil® a una dosis de 0,015mg/kg. El despertado del animal se realizó de forma espontánea.
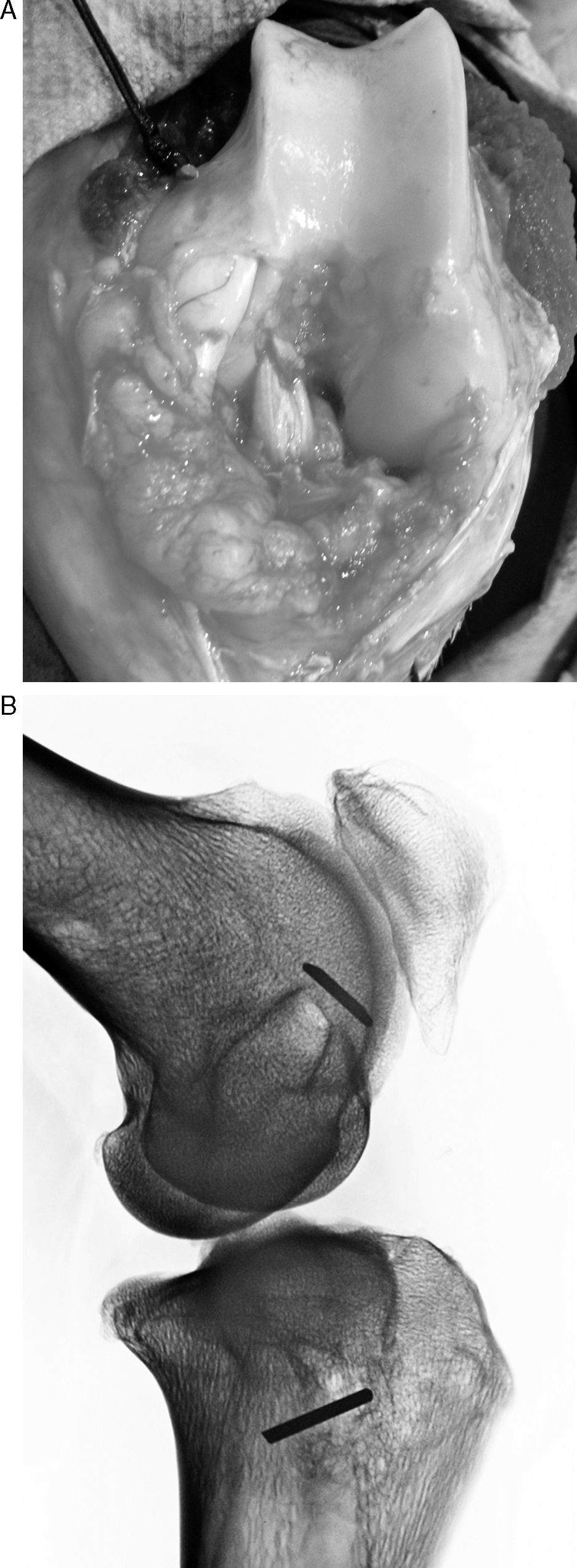
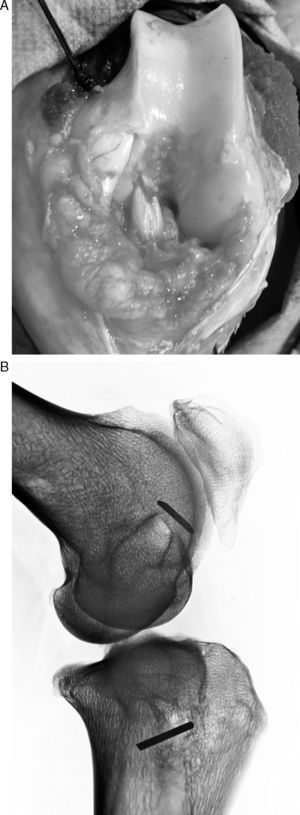
Técnica quirúrgicaSe colocó al animal en decúbito supino y se inmovilizaron ambas extremidades anteriores y la extremidad posterior derecha. Se procedió al rasurado y limpieza cuidadoso de la extremidad izquierda sobre la zona a intervenir. Se efectuó con una artrotomía de la rodilla, con una incisión pararrotuliana interna que nos permitió visualizar la articulación y la entrada y salida de los túneles femoral y tibial. Como plastia autóloga utilizamos el tendón flexor superficial de la pezuña ya que no produjeron alteraciones funcionales importantes en el animal, dejando el tendón profundo intacto (fig. 1). Realizamos un abordaje pararrotuliano medial, desde el tercio distal del muslo hasta dos centímetros distal a la tuberosidad anterior de la tibia. Con el bisturí eléctrico efectuamos una sección de la aponeurosis superficial y parte del músculo vasto interno que nos facilitó luxar la rótula hacia fuera y flexionar completamente la rodilla. Una vez seccionado el ligamento cruzado anterior por sus inserciones limpiamos los restos del ligamento y procedimos a perforar los túneles. Primero efectuamos el túnel femoral, procurando entrar por la unión metafisaria de la diáfisis con el cóndilo externo y salir por el punto de inserción anatómica del LCA. Los túneles se efectuaron con una broca de 5mm o de 7mm de diámetro, según los grupos, de forma aleatoria. Posteriormente, efectuamos el túnel tibial del mismo grosor que el túnel femoral. Perforamos desde la cara interna de la extremidad proximal de la tibia procurando salir por el punto de inserción del LCA en la tibia. Una vez realizados los túneles limpiamos con abundante suero fisiológico para no dejar virutas óseas.
De forma simultánea otro equipo extrajo la plastia del tendón del músculo flexor superficial de la pezuña y, después de medir su longitud (80mm) y grosor (5mm) se confeccionó la plastia mediante suturas en sus extremos con seda 00. Pasamos la plastia con un pasahilos ocupando toda la longitud de los túneles. Una vez colocada la plastia, flexionamos y extendimos la rodilla para observar su correcta colocación y tensión y procedimos a su anclaje con tope cortical mediante una aguja de Kirschner cortada, de 3cm de larga, sobre la que anudamos la sutura de los extremos, dejando a tensión la plastia con la rodilla en flexión de 60°. Evitando interferir en el proceso de integración de la plastia en el túnel. Posteriormente, cerramos por planos sin dejar drenaje intraarticular, ni tampoco realizamos ningún tipo de inmovilización (fig. 2).
Los animales fueron sacrificados según el grupo extrayendo las piezas que fueron decalcificadas y, posteriormente, se deshidrataron mediante alcoholes de gradación creciente (70, 80, 96 y 100%), con cambios cada 12 horas, manteniéndose en agitación constante. Posteriormente se introdujeron en xileno, durante 4 horas, y se incluyeron en parafina, a una temperatura de 60°C. Finalmente, se realizaron cortes de 4μm de grosor con microtomo convencional (Microm®. Modelo HM 340-E, Alemania) y se tiñeron con tricrómico de Masson. Terminado el proceso, seccionamos los túneles, femoral y tibial, transversalmente por su parte media y se desinsertó el ligamento cruzado anterior para proceder a su sección transversal. Las porciones óseas fueron talladas cuidando de no cortar el túnel y posteriormente se hizo una radiografía de los túneles. Los túneles fueron cortados transversalmente procurando hacer los cortes perpendiculares al eje del túnel, se introdujeron en formol y, posteriormente, pasaron a decalcificación. Con las plastias se efectuaron cortes sagitales y fueron teñidas con tricrómico de Masson (TM). Todas las preparaciones se visualizaron después con microscopio óptico y de luz polarizada. Para los estudios biomecánicos disecamos la rodilla dejando únicamente los extremos óseos y la plastia y se guardaron congeladas a -20°C. Se realizó un ensayo mecánico de tensión con la máquina Instron Electropuls 3000 dejando la rodilla a 30° grados de flexión y obteniendo la información necesaria sobre la carga máxima de rotura, la resistencia y el punto de rotura a lo largo del complejo fémur-ligamento-tibia.
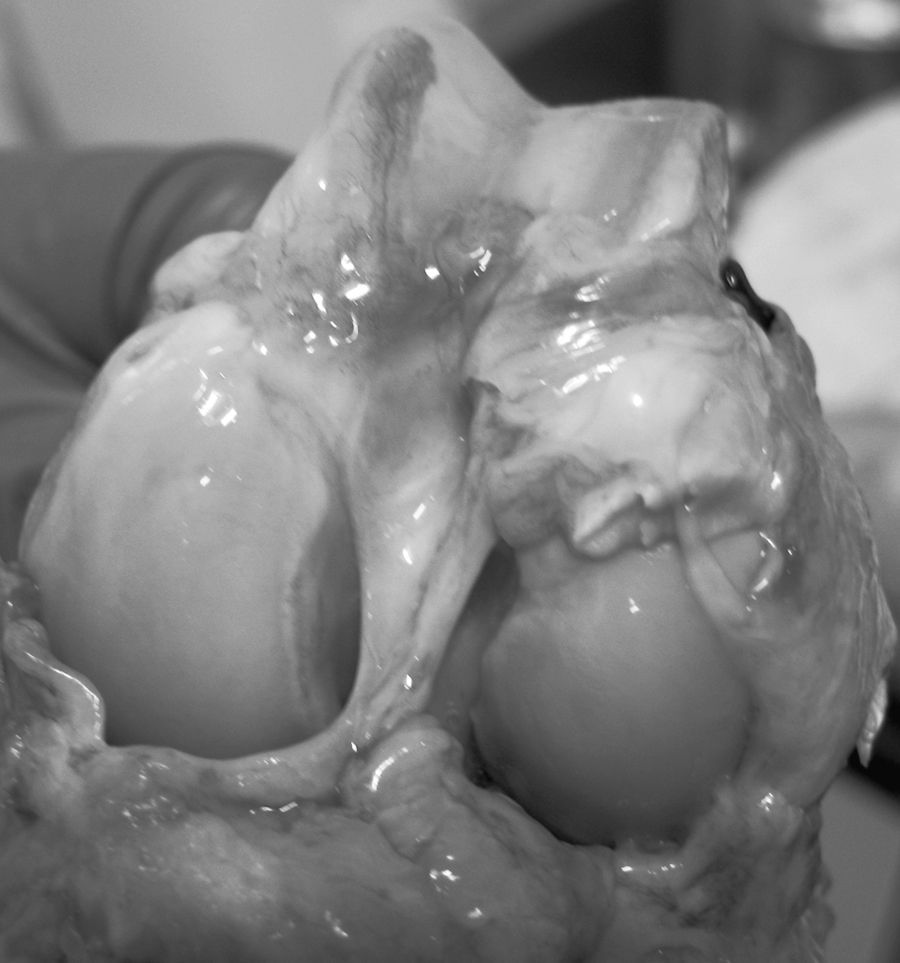
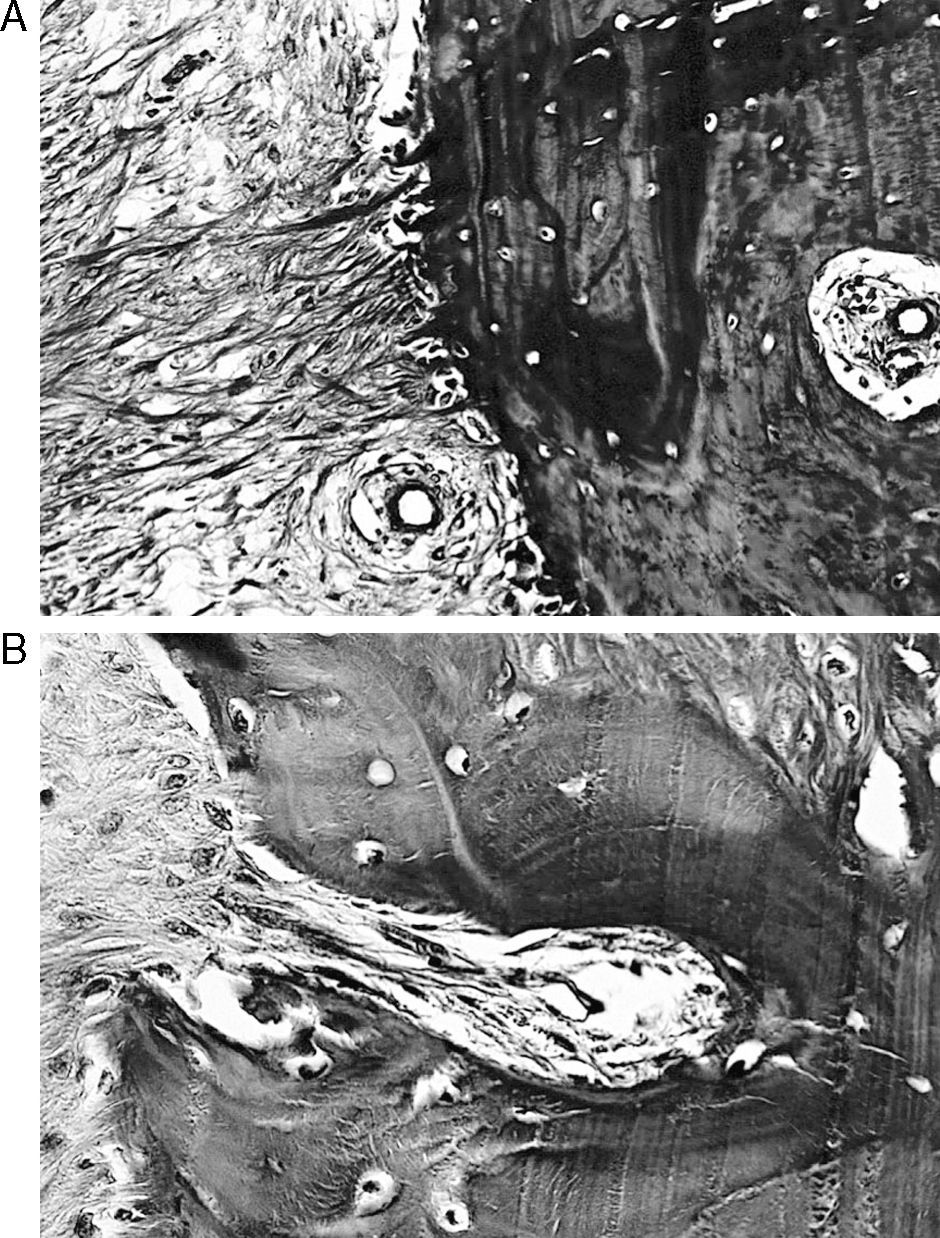
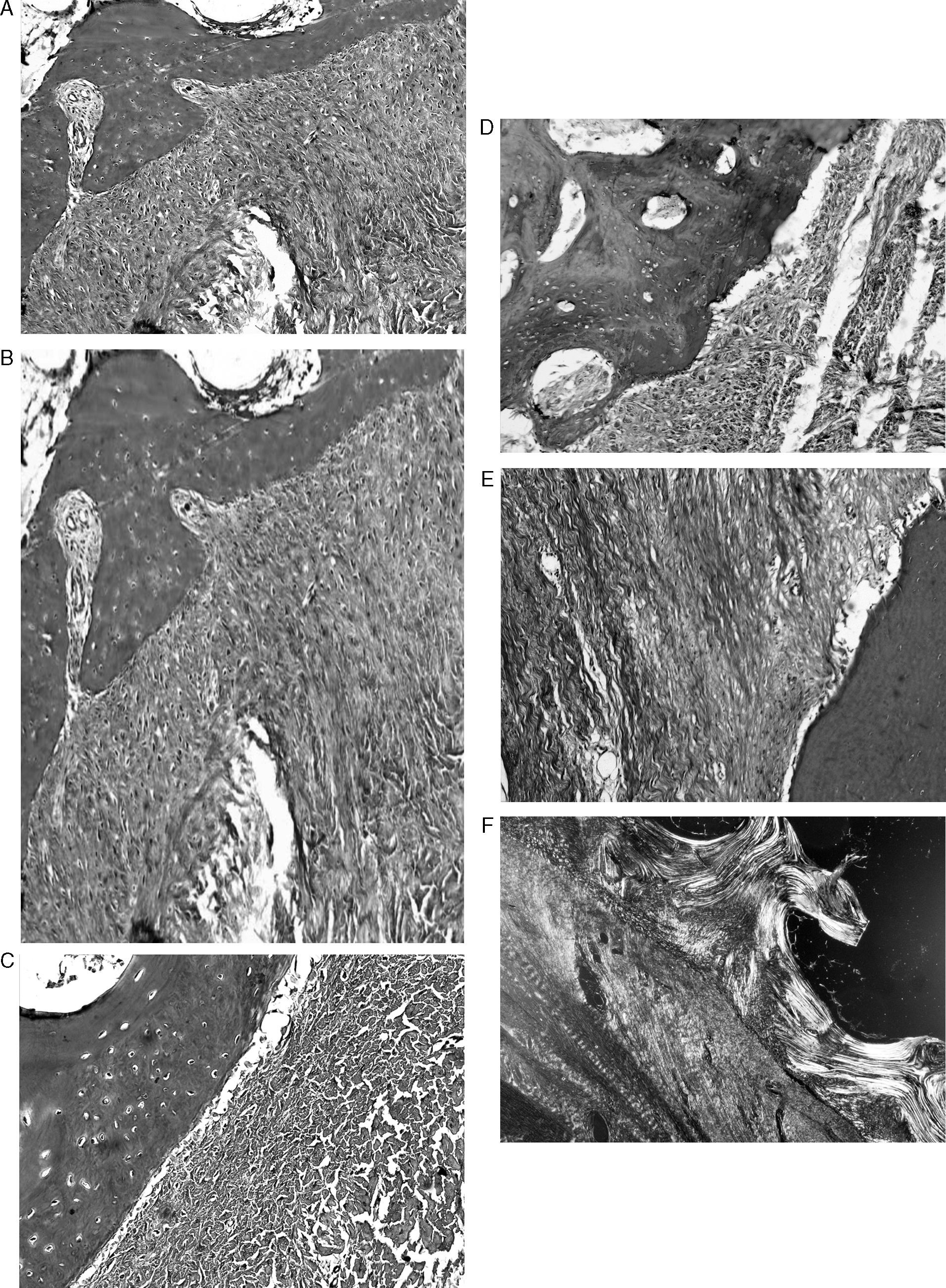
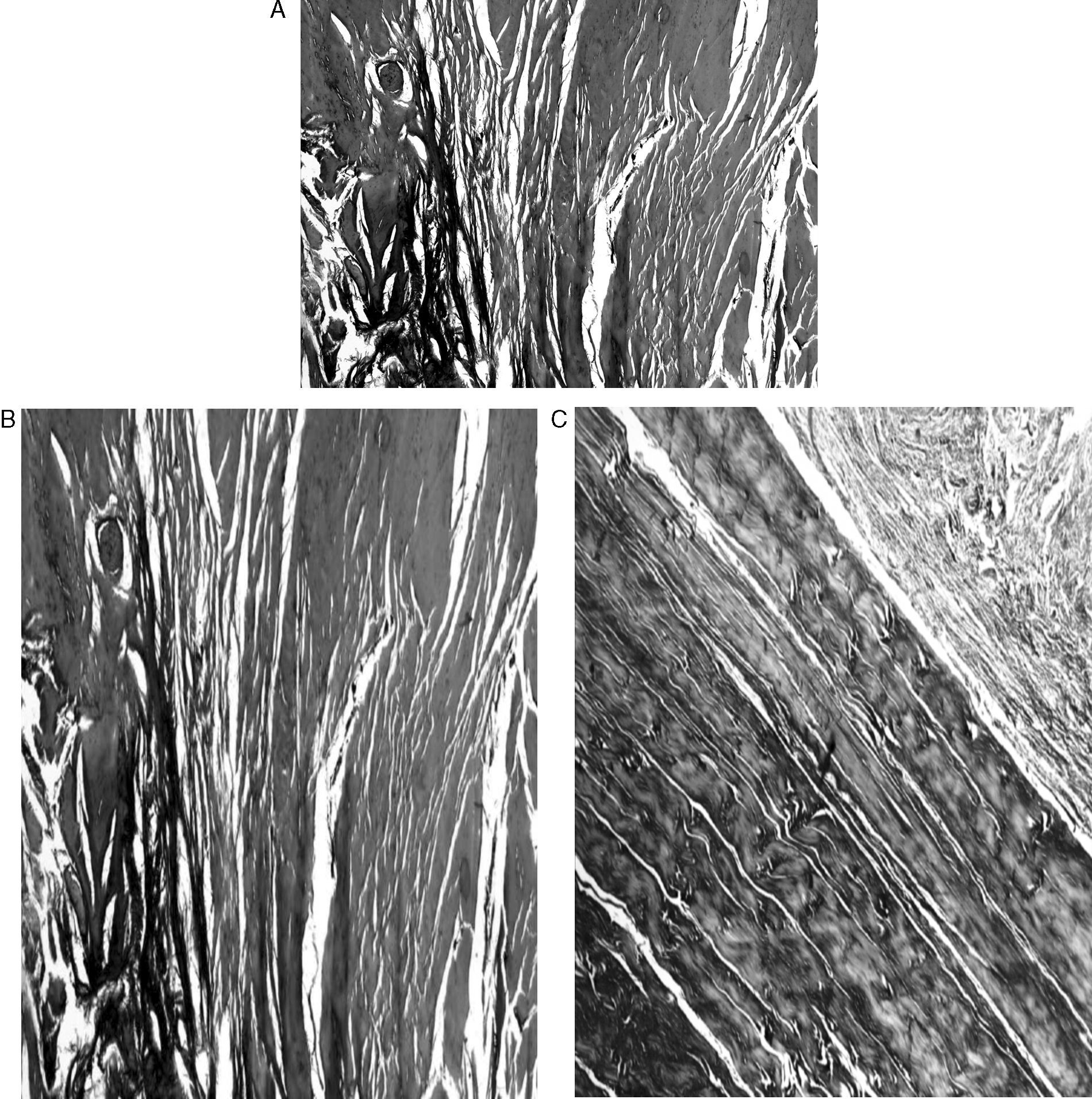
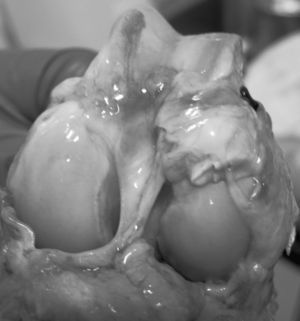
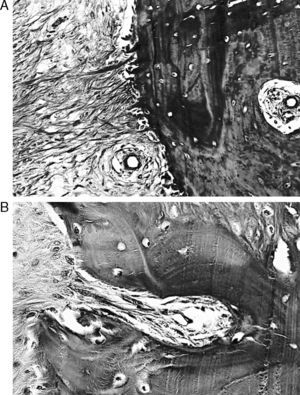
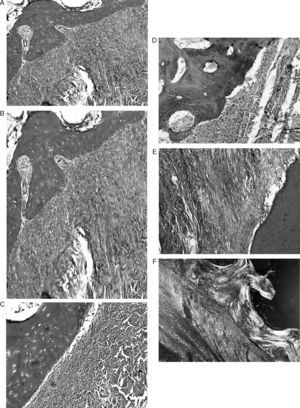
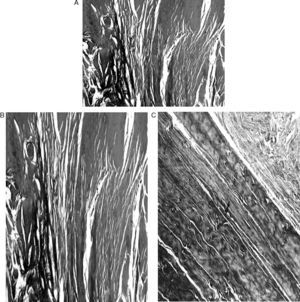
ResultadosMacroscópicamente se observó una reconstrucción de la plastia de LCA con aspecto denso, semejante a un tendón, recubierto de un tejido sinovial, siendo más llamativo a partir de los 6 meses de evolución, tanto en los túneles de 5mm como en los de 7mm (fig. 3). La histología de las plastias alojadas en túneles de 5mm, a pesar de la tensión para introducir la plastia en los túneles y de la completa ocupación de la plastia en el túnel femoral como tibial, no observamos una integración directa de la plastia con el hueso, se vieron pocas fibras de Sharpey (fig. 4) entre ambas estructuras y en todos los casos vimos un tejido fibroso muy celular y vascular. Los resultados histológicos de las plastias alojadas en túneles de 7mm, tampoco mostraron una unión directa de la plastia con el túnel óseo, el tejido fibroso de relleno fue muy abundante (fig. 5) y la plastia presentó una estructura fascicular con formación de septos interfasciculares y penetración de vasos (fig. 6).
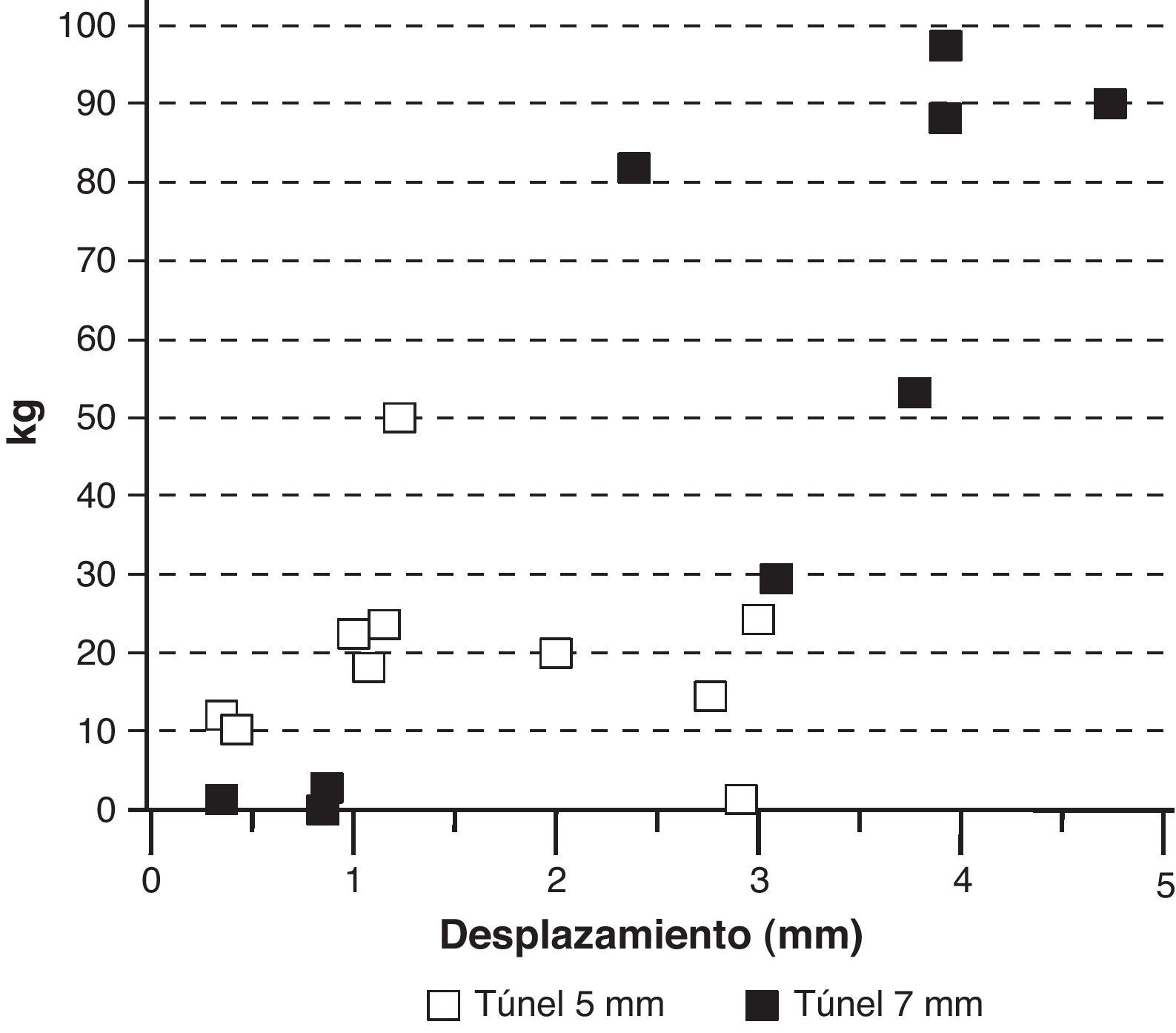
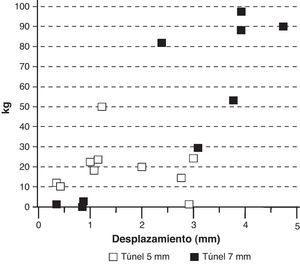
Cuando se realizaron las pruebas de biomecánica había plastias que salían del túnel íntegras, otras se deshilachaban, pero ninguna se rompió ni en la inserción tibial ni tampoco en la femoral, por lo que pensamos que se produce un anclaje elástico constituido por tejido fibroso y que ningún caso se consiguió una integración completa (fig. 7). Agrupamos los resultados de biomecánica según el diámetro del túnel (5mm o 7mm) observando que las plastias alojadas en túneles de 5mm soportaban menos de 30kg de tensión y se elongaban menos de 3cm. Por el contrario, las plastias alojadas en túneles de 7mm soportaban tensiones entre 80 y 100kg y se elongaban por encima de 3cm (fig. 8). Analizando los resultados biomecánicos según el diámetro del túnel y el tiempo de evolución se comprobó que aquellas plastias alojadas en túneles de 7mm que soportaban menos 30kg de tensión eran las que menor tiempo de evolución tenían.
Son conocidas diferentes teorías con respecto al tamaño de la plastia en la reparación del LCA. Algunos autores afirman de una mejor integración cuanto más introducida está en el túnel9 otros, por su parte, recomiendan que la plastia y el túnel sean del mismo diámetro10; incluso algunos artículos dan más importancia a la longitud del injerto que a su grosor para obtener un proceso de integración osteoligamentario óptimo11. También hay quien sugiere realizar un túnel femoral y tibial con un diámetro de túnel un milímetro menor que la plastia, para conseguir una correcta integración12. Se ha defendido que la reparación de la plastia en el túnel es por un crecimiento óseo en la interfaz que forma una esclerosis, produciéndose una osificación encondral y observándose fibras de Sharpey inconstantes y escasas en los primeros meses13, y de hecho, se ha llegado a afirmar que la resistencia del tendón está en relación con la cantidad de hueso neoformado14.
Utilizamos fijaciones de suspensión tibial y femoral para visualizar el comportamiento de la plastia y no impedir la integración con el hueso, como ocurriría con un tornillo interferencial. Sin embargo, en ningún caso, tampoco en los de mayor evolución vimos signos de integración entre la plastia y el hueso.
Tanto en el túnel tibial como en el túnel femoral se forma una esclerosis ósea que separa el hueso trabecular epifisario de la plastia, dejando un espacio entre ambos constituido por un tejido fibroso peritendinoso siendo infrecuentes las fibras de Sharpey uniendo ambas estructuras. En nuestro estudio, en todos los casos observamos una esclerosis de los túneles probablemente también relacionados con la velocidad y temperatura de la perforación y con el tipo y desgaste de la broca, pero que era mayor con el tiempo de evolución. La esclerosis es una reacción trabecular a los movimientos de la plastia en el interior del túnel y que impide una integración entre el hueso y las fibras del tendón. El ensanchamiento del túnel después de una plastia de LCA en ovejas ha demostrado que en los túneles más anchos no se producía mayor traslación anteroposterior. Por el contrario, presentaban mayor rigidez e hipertrofia del injerto y mayor esclerosis en la pared de los túneles.
El proceso de integración de un injerto tiene fases muy bien diferenciadas, necrosis, revitalización, formación de colágeno tipo III y remodelación15. En la literatura se mantiene que la celularidad vuelve a los valores normales entre los tres y 6 meses después de la cirugía16,17 y que las fibras de colágeno se asemejan a las del LCA entre los 6 y 12 meses después de la cirugía18, aunque también se sostiene que la composición de las características fibras de colágeno de diferentes diámetros del LCA nunca se consigue19.
También se ha señalado que las plastias siguen un proceso de adaptación más que de reparación20 y que adquieren un aspecto ligamentoso característico bien diferenciado del tendón original lo que se ha dado en llamar el proceso de «ligamentización» que no se debe entender como la transformación de un tendón en ligamento, sino como un proceso de adecuación de un tendón extrarticular, sometido a deformación continúa por la contracción muscular, a actuar como una estructura de control del desplazamiento de las estructuras óseas, rodeado por un tejido sinovial. Desechamos el término de «ligamentización» como parte del proceso de integración de una plastia.
En nuestro estudio la plastia mantiene en toda su evolución una estructura tendinosa, compuesta por fibras de colágeno onduladas y grandes con espacios intersticiales ocupados por vasos. Por otro lado, hemos comprobado que el aspecto externo de la plastia es muy similar a la del LCA, recubierto por un tejido sinovial incluso con la reconstrucción del ligamento adiposo.
En los ensayos mecánicos, la plastia nunca rompió por sus inserciones óseas ya que se deshilachaba a medida que aumentaba la tensión y encontramos una tendencia al aumento de la resistencia de la plastia con el tiempo y con el grosor del túnel efectuado. Las plastias colocadas en túneles holgados mostraron valores de rotura más altos que aquellas que fueron insertadas a presión en túneles de menor diámetro. Esto se puede producir por una mayor cantidad de tejido fibroso en el túnel que mejora el anclaje de la plastia en el túnel, siendo además más denso cuanto mayor es la evolución. Sin embargo, no hemos encontrado referencias al respecto en la literatura consultada.
Nuestro trabajo es un estudio preliminar para determinar el modelo experimental más adecuado para reparar la rotura del LCA en ovejas que nos permita analizar la integración y evolución de una plastia a nivel celular y molecular. Este estudio presenta, sin embargo, ciertas, limitaciones, como ha sido el número de muestras disponibles para los diferentes grupos y estudios; otra limitación la ha constituido precisar de un anclaje dependiente posiblemente del tipo y tensión de los nudos, aunque hemos procurado hacerlo siempre de la misma forma. Otra limitación ha sido tener que realizar los ensayos biomecánicos con los anclajes. Sin embargo, este ensayo nos ha permitido establecer un modelo experimental homogéneo y rápido, con seguridad en la evolución de los animales, sin ver diferencias histológicas en la integración en los túneles óseos, tibial o femoral, de una plastia introducida a presión u holgada, en la oveja. En todas las muestras observábamos que se producía una esclerosis ósea, como un escudo óseo que protege el hueso trabecular de la agresión del medio articular y de la propia plastia con su reacción mecánica, por los movimientos de la plastia en el interior del túnel, y biológica, por la inflamación y necrosis durante el proceso de remodelación de la plastia.
Nivel de evidenciaNivel de evidencia III.
FinanciaciónFIS PI09/1729.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Isabel Zapero por las preparaciones histológicas y a Purificación Ripalda por las imágenes de luz polarizada.