Cada día se están registrando más manifestaciones neurológicas relacionadas con la infección por SARS-CoV-2. A continuación se presenta un caso de debut de miastenia gravis (MG) en un paciente anciano durante la fase subaguda de esta infección.
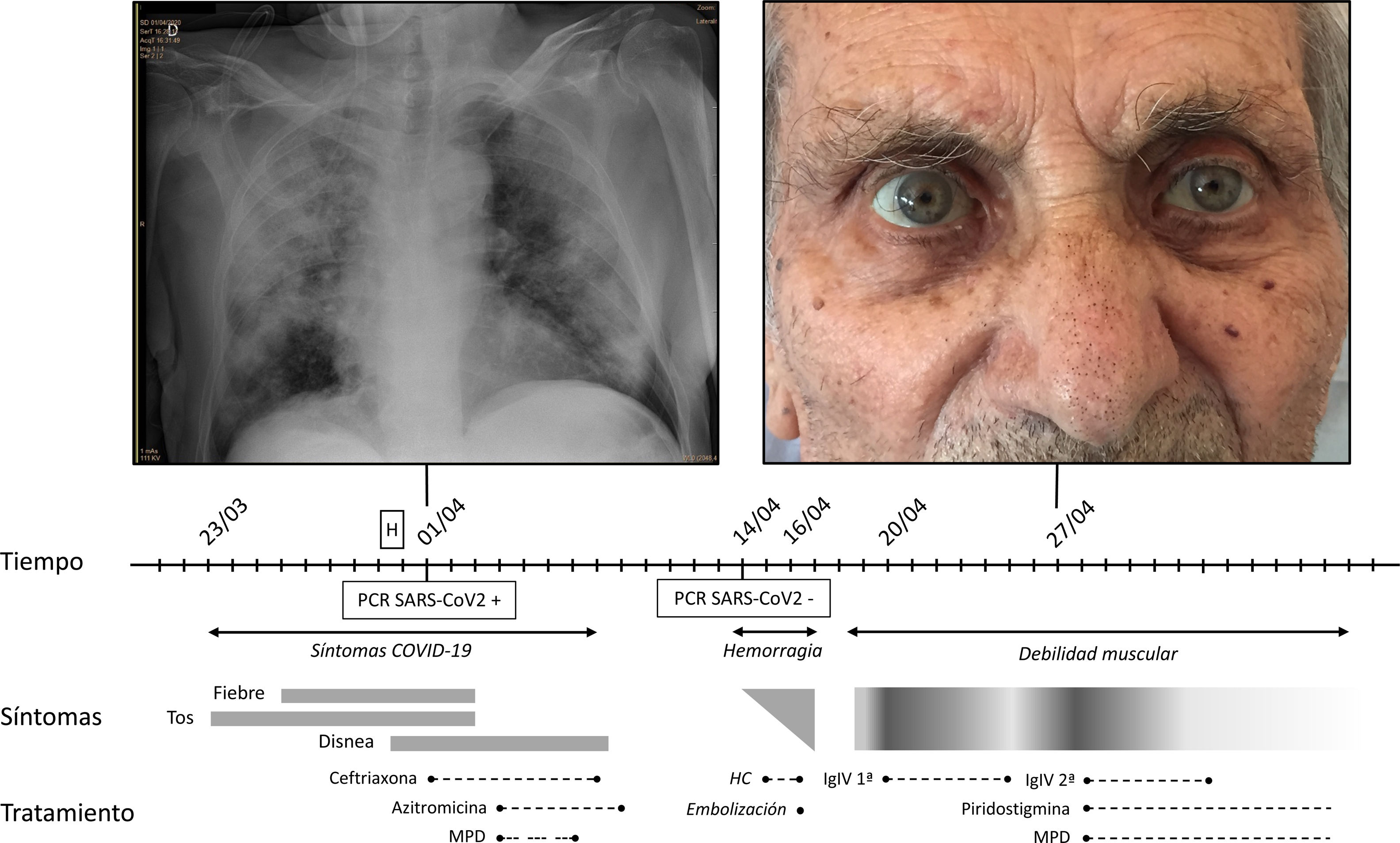
Se trata de un varón de 86 años sin deterioro cognitivo, robusto dentro del espectro de la función física (índice de fragilidad VIG de 0,08) y con los antecedentes a destacar de hipertensión arterial, diabetes mellitus tipo 2, fibrilación auricular no valvular e hiperuricemia. El paciente ingresa por neumonía bilateral secundaria a infección por SARS-CoV-2 confirmada por la prueba de reacción en cadena de la polimerasa, con insuficiencia respiratoria secundaria. Presenta buena evolución tras completar tratamiento con ceftriaxona, azitromicina y pulsos de corticoides sistémicos (sin emplear hidroxicloroquina ante un QT alargado, ni precisar lopinavir/ritonavir ni tocilizumab). Analíticamente destacan unos valores máximos de ferritina de 1391,4 ng/mL, LDH 435 U/l y D-dímero de 33.153 ng/mL. El día previsto del alta presenta empeoramiento clínico con inestabilidad hemodinámica, identificándose un hematoma intramuscular espontáneo dorsolumbar en contexto de la descoagulación con heparina de bajo peso molecular. Requiere embolización urgente del sangrado arterial, así como soporte con fluidos y transfusión de hemoconcentrados, con mejoría hemodinámica progresiva. A los cuatro días presenta debilidad generalizada de predominio proximal con imposibilidad para bipedestar. Además, en la exploración física destaca ptosis palpebral leve de predominio izquierdo, fatigabilidad mandibular y palpebral a los 20 segundos, disfonía severa con voz bulbar, diplopía vertical e hiporreflexia global, sin disfagia ni compromiso respiratorio. Se orienta como un debut de MG, estadio de severidad IVa por la MGFA, seronegativa (para anti-AChR y anti-MuSK), iniciándose tratamiento mediante tanda de inmunoglobulinas intravenosas, corticoides sistémicos y piridostigmina, observando buena respuesta al mismo. Del resto de parámetros de autoinmunidad destacan unos anticuerpos anti-Ro/SSA y unos anticuerpos antiperoxidasa tiroidea y antitiroglobulina positivos, con una correcta función tiroidea, y unos anticuerpos ANA negativos. Finalmente es trasladado a la Unidad de Convalecencia para completar la rehabilitación. No se identificaron circunstancias predisponentes a desarrollar la MG; sin antecedentes familiares de enfermedades autoinmunes, nunca antes manifestó clínica miasteniforme y no hubo hallazgos de tejido tímico en la TC de tórax (fig. 1).
Aunque clásicamente no se haya considerado una entidad geriátrica, no es inusual en el anciano. Estudios recientes identifican incidencias globales altas a expensas de los pacientes más mayores, determinando un 50% de los casos MG por encima de los 75 años, alcanzando los 170 casos por millón de habitantes en mayores de 85 años1.
En cuanto a la fisiopatología, la similitud entre un antígeno del virus y un autoantígeno conduce a una reactividad cruzada de las células T, células B y anticuerpos por un fenómeno de imitación. Si bien este mecanismo ya se ha establecido en enfermedades neuroautoinmunes postinfecciosas como el síndrome de Guillain-Barré y la encefalitis autoinmune, no se ha demostrado que ocurra así en la MG.
En aproximadamente un 30% de los episodios de MG se identifica una infección como evento desencadenante2. En la literatura se describen debuts de MG en contexto de infecciones virales activas por el virus del Nilo Occidental3 y el virus del Zika4. No se ha reportado ningún caso de debut de MG en relación con el nuevo coronavirus, si bien, un estudio reciente expone el impacto de la infección por SARS-CoV-2 en cinco individuos con diagnóstico previo de MG y en uno de ellos condiciona su exacerbación5. También se han descrito episodios de síndrome de Guillan-Barré6 y alguna de sus variantes7. Respecto a otros coronavirus humanos (HCoV) como desencadenantes de síndromes de debilidad muscular aguda, solamente se detalla un caso de parálisis flácida aguda en un paciente pediátrico en contexto de una infección respiratoria baja por el HCoV-229E y el HCoV-OC438.
En nuestro caso, planteamos la infección por SARS-CoV-2 como posible evento desencadenante de la MG. No obstante, existen otros factores que podrían ser, de forma independiente o asociados, responsables del evento. En primer lugar, la propia situación de estrés físico secundaria a la complicación hemorrágica grave, y por otro lado, el tratamiento con azitromicina, ya que han sido descritas crisis miasténicas asociadas a macrólidos9. Aunque las infecciones se relacionan claramente como desencadenantes de crisis miasténicas en los pacientes con esta enfermedad10, este caso se distingue de los anteriormente descritos en la literatura por tratarse de un debut en un paciente sin diagnóstico previo de MG.
Pese a que a menudo establecer la relación de causalidad resulta complicado, en este escenario novedoso por la infección por SARS-CoV-2 resulta fundamental compartir nuestras experiencias con la reseña de estos fenómenos colaterales.