Después de la inyección del radiofármaco se observa con frecuencia una concentración incrementada de 123I-MIBG en el lóbulo hepático izquierdo en comparación con el derecho, pero la razón de este hallazgo sigue siendo desconocida. Nuestro objetivo fue analizar retrospectivamente el patrón de absorción de 123I-MIBG entre los 2 lóbulos hepáticos y correlacionar nuestros resultados con algunas características epidemiológicas/clínicas.
Material y métodosSe seleccionaron 94 gammagrafías 123I-MIBG de 71 pacientes. Las regiones de interés se dibujaron en los lóbulos derecho e izquierdo utilizando secciones tomográficas transversales y se calcularon relaciones de actividad de izquierda a derecha (relación I/D) a las 6 y 24horas de la administración del radiofármaco.
ResultadosVeintisiete exámenes fueron positivos para lesiones hipermetabólicas, mientras que los 67 restantes fueron negativos. En todos los casos las relaciones medias de I/D temprana y tardía fueron superiores a 1; la relación I/D temprana media fue de 1,37 y la relación I/D tardía de 1,52. La relación I/D tardía fue significativamente mayor que la precoz. No hubo diferencias en la relación I/D con respecto a la edad, sexo, enfermedad primaria y resultado de la gammagrafía.
ConclusionesLa absorción de 123I-MIBG fue mayor en el lóbulo hepático izquierdo en comparación con el derecho, y esta relación no se correlacionó con ninguna característica epidemiológica o clínica. La razón de este metabolismo todavía no se ha explicado, y algunas hipótesis biomoleculares podrían ser probadas en modelos 3D dinámicos in vitro.
After radiopharmaceutical injection, a heightened 123I-MIBG concentration is frequently observed in the left hepatic lobe compared to the right one, but the reason of this finding remains unknown. Our aim was to retrospectively analyze the different 123I-MIBG uptake pattern between the two hepatic lobes and correlate our results with some epidemiological/clinical features.
Material and methodsNinety-four 123I-MIBG scintigraphies from 71 patients were selected. Regions of interest were drawn in the right and left lobes using transverse tomographic sections and left to right activity ratios (L/R ratio) were calculated at 6 and 24h after radiotracer administration.
ResultsTwenty-seven examinations were positive for hypermetabolic lesions while the remaining 67 were negative. In all cases mean early and delayed L/R ratios were greater than 1.00; average early L/R ratio was 1.37 and delayed L/R ratio 1.52. The delayed L/R ratio was significantly higher than the early one. There was no difference in the L/R ratios with regard to age, gender, primary disease and result of scintigraphy.
Conclusions123I-MIBG uptake was higher in left hepatic lobe compared to right and this ratio did not correlate with any epidemiological or clinical feature. The reason of this metabolic is not yet explained and some biomolecular hypotheses could be tested in 3D dynamic in vitro models.
La metayodobencilguanidina (MIBG) es una molécula noradrenalina-like utilizada en medicina nuclear, habitualmente marcada con yodo-123 (123I), para evaluar los tumores de la cresta neural como los carcinoides, feocromocitomas, neuroblastomas, paragangliomas y carcinomas medulares de tiroides1–3.
Se detecta frecuentemente una intensa captación fisiológica de 123I-MIBG en hígado, tiroides, bazo, corazón, médula adrenal normal (con un grado de captación variable) y glándulas salivares; la vejiga se visualiza habitualmente debido a la excreción urinaria del radiofármaco. Excepcionalmente, también se ha descrito la detección de glándulas lagrimales, riñones, pulmones y colon4–7. El estudio con 123I-MIBG normalmente consiste en imágenes planares integradas en el estudio por tomografía computarizada por emisión de fotón único-tomografía computarizada (SPECT/TC) del área anatómica con afectación por la enfermedad, normalmente el abdomen, pero potencialmente cualquier localización. El estudio incluye una adquisición precoz a las 6horas y un rastreo tardío a las 24horas tras la administración del radiofármaco, respectivamente. En la práctica clínica es frecuente observar una concentración creciente de 123I-MIBG en el lóbulo hepático izquierdo; este hallazgo ha sido evaluado en estudios previos8–10, pero estos estudios se basan en un pequeño número de pacientes. Este patrón de distribución ha sido descrito solo para la 123I-MIBG y no para otros radiotrazadores, sugiriendo una inervación noradrenérgica diferente entre los 2 lóbulos hepáticos principales que puede implicar diferencias fisiológicas funcionales.
Nuestro objetivo fue analizar retrospectivamente la diferente captación de 123I-MIBG entre los lóbulos hepáticos izquierdo y derecho y correlacionar nuestros resultados con las características epidemiológicas y clínicas (edad, género, tipo de enfermedad neoplásica, resultados de la exploración física), intentando explicar la distribución metabólica de este radiofármaco en el hígado.
Material y métodosPacientesSe realizaron 94 estudios con 123I-MIBG en 71 pacientes desde enero de 2014 hasta marzo de 2017, seleccionados en función de los siguientes criterios de inclusión: 1) un estudio con SPECT/TC del abdomen que no muestra captación patológica en el hígado; 2) hallazgos normales en el hígado en otras técnicas de imagen, como una TC o una RM realizada en los 30 días previos a la SPECT/TC; 3) un lóbulo hepático izquierdo con características morfológicas adecuadas para ser evaluado; y 4) análisis sanguíneos hepáticos normales realizados en los 30 días previos a la SPECT/TC cuando estaban disponibles. En 7 pacientes se realizó la exploración 2 veces, en 2 pacientes se realizó 3 veces, 2 pacientes se sometieron a 4 exploraciones y un paciente se sometió a 7 exploraciones. Ninguno de los pacientes tomaba medicación que pudiera influir en la actividad hepática.
Revisamos los registros médicos y los informes anatomopatológicos de las 94 exploraciones: se recogieron las características epidemiológicas (edad y sexo), el tipo de neoplasia y los resultados de la gammagrafía con 123I-MIBG que fueron analizados para todos los pacientes. La edad se consideró como un valor absoluto y la población se dividió en 2 grupos utilizando los 18 años como punto de corte (≤18 años y >18 años), elegido para separar la población pediátrica y la población adulta.
Imagen SPECT/TC con 123I-MIBGLos pacientes recibieron una inyección endovenosa de 123I-MIBG; las actividades fueron reducidas en función del peso en los pacientes pediátricos11 y se administraron 370MBq en los adultos.
La imagen precoz se realizó 6horas después de la inyección y la imagen tardía a las 24horas. Las imágenes se adquirieron en una Discovery NM/CT 670 pro (GE Healthcare, Haifa, Israel) y con una Infinia Hawkeye 2024 (GE Healthcare, Haifa, Israel).
Todas las gammacámaras estaban equipadas con colimadores de agujeros paralelos de baja energía y baja resolución. La velocidad del rastreo para la imagen de cuerpo entero fue de 12cm/min a las 6horas y 10cm/min a las 24horas, usando una matriz de 256×1.024. Para las adquisiciones de SPECT/TC se utilizaron los siguientes parámetros: 120 proyecciones, matriz de 128×128, 20segundos de tiempo de adquisición por proyección. Se centró una ventana de energía del 10% alrededor del pico de 159-keV para ambos rastreos corporales y la adquisición de SPECT/TC. Se adquirió un mapa de atenuación con TCf. Los parámetros de adquisición de la imagen TC fueron los siguientes: 120kV, 80mA, tiempo de rotación del tubo de 0,8, pitch 1.375, grosor de corte 2,5mm. Los parámetros de adquisición TC para la gammacámara Infinia Hawkeye 2024 fueron los siguientes: 140kV, 2,5mA, axial, grosor de corte de 10mm. Los datos de la SPECT/TC se reconstruyeron en una estación de trabajo Xeleris 3.1 (GE Healthcare) mediante maximización de la esperanza de subconjuntos ordenados (OSEM) en 3 dimensiones (3D) con un filtro Butterworth, corrección de atenuación basada en TC (attenuation correction) y corrección de dispersión (scatter correction). Se dibujaron regiones de interés (ROI) de 5cm para los pacientes con más de 10 años y de 2,5cm para niños ≤10 años en los lóbulos derecho e izquierdo, que se dividieron por un plano vertical representado con la vena hepática media (línea de Cantlie) utilizando cortes axiales; se evitaron los bordes, indentaciones y la fosa de la vesícula biliar. Los índices de concentración de actividad entre los lóbulos izquierdo y derecho (índice I/D) se calcularon: en todos los estudios a las 24horas tras la administración (índice I/D tardío) y en 41 casos también a las 6horas tras la inyección (índice I/D precoz) cuando se realizó SPECT/TC.
Análisis estadísticoTodo el análisis estadístico se llevó a cabo utilizando el paquete estadístico para ciencias sociales (SPSS) versión 23.0 para Windows (IBM, Chicago, Illinois, EE. UU.) y el Software MedCalc versión 17.1 para Windows (Ostend, Bélgica). El análisis descriptivo de las variables categóricas incluyó el cálculo de las frecuencias simples y relativas. Las variables numéricas se describieron como media, desviación estándar, mínimo y máximo.
La relación entre los índices I/D precoz y tardío y las características epidemiológicas (edad, sexo) y clínicas (tipo de lesión primaria, resultado del estudio) se calcularon usando un test de Anova y un «t» test independiente. Se consideró como estadísticamente significativo un valor de p<0,05.
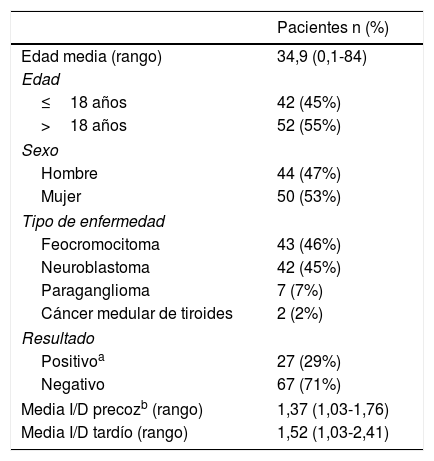
ResultadosEntre las 94 exploraciones incluidas en el estudio 44 pacientes (47%) eran hombres y 50 (53%) mujeres; la edad media fue 34,9 años (rango un mes-84 años). Cuarenta y dos pacientes (45%) eran menores de 18 años, mientras que el resto, 52 (55%) eran adultos. Había 43 pacientes con feocromocitoma, 42 con neuroblastoma, 7 con paraganglioma y 2 con cáncer medular de tiroides; todos estos tumores se confirmaron histológicamente durante el curso de la enfermedad (datos no mostrados). Las características basales de los pacientes se resumen en la tabla 1. Entre todas las exploraciones 27 (29%) tuvieron una gammagrafía con 123I-MIBG positiva que mostraron la presencia de lesiones hipermetabólicas; mientras que las restantes 67 (71%) tenían una gammagrafía con 123I-MIBG negativa. En todas las exploraciones la media de los índices de actividad I/D de ambos estudios, precoz y tardío, fue superior a 1,00; para la SPECT/TC precoz la media±DE índice I/D fue 1,37±0,19 (rango 1,03-1,76) y para la SPECT/TC tardía fue 1,52±0,33 (rango 1,03-2,41) (tabla 1). Teniendo en cuenta las gammagrafías con ambos índices I/D precoz y tardío disponibles, el índice I/D tardío fue significativamente superior comparado con el índice I/D (p<0,01); solo en 5 (12%) casos el índice precoz fue superior al índice tardío.
Características basales de 94 pacientes
| Pacientes n (%) | |
|---|---|
| Edad media (rango) | 34,9 (0,1-84) |
| Edad | |
| ≤18 años | 42 (45%) |
| >18 años | 52 (55%) |
| Sexo | |
| Hombre | 44 (47%) |
| Mujer | 50 (53%) |
| Tipo de enfermedad | |
| Feocromocitoma | 43 (46%) |
| Neuroblastoma | 42 (45%) |
| Paraganglioma | 7 (7%) |
| Cáncer medular de tiroides | 2 (2%) |
| Resultado | |
| Positivoa | 27 (29%) |
| Negativo | 67 (71%) |
| Media I/D precozb (rango) | 1,37 (1,03-1,76) |
| Media I/D tardío (rango) | 1,52 (1,03-2,41) |
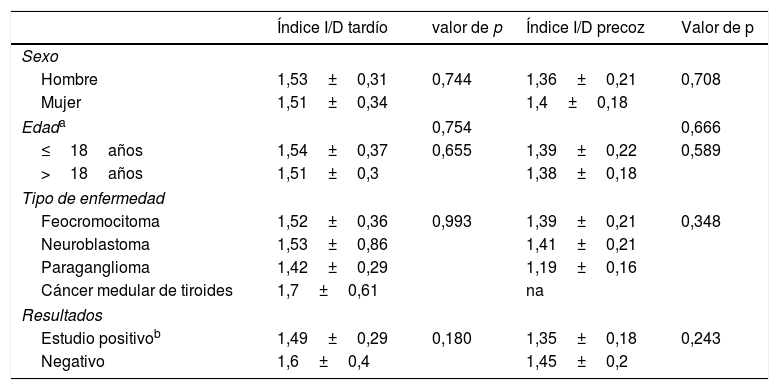
No hubo diferencias en el índice I/D tardío respecto a la edad, teniéndola en cuenta tanto como una variable continua como con un punto de corte en 18 años, respecto al género, la enfermedad primaria y el resultado de la gammagrafía (tabla 2). Este resultado se confirmó también al analizar la relación entre el índice I/D precoz y las variables antes mencionadas (tabla 2).
Análisis de correlación entre los índices I/D y otros parámetros
| Índice I/D tardío | valor de p | Índice I/D precoz | Valor de p | |
|---|---|---|---|---|
| Sexo | ||||
| Hombre | 1,53±0,31 | 0,744 | 1,36±0,21 | 0,708 |
| Mujer | 1,51±0,34 | 1,4±0,18 | ||
| Edada | 0,754 | 0,666 | ||
| ≤18años | 1,54±0,37 | 0,655 | 1,39±0,22 | 0,589 |
| >18años | 1,51±0,3 | 1,38±0,18 | ||
| Tipo de enfermedad | ||||
| Feocromocitoma | 1,52±0,36 | 0,993 | 1,39±0,21 | 0,348 |
| Neuroblastoma | 1,53±0,86 | 1,41±0,21 | ||
| Paraganglioma | 1,42±0,29 | 1,19±0,16 | ||
| Cáncer medular de tiroides | 1,7±0,61 | na | ||
| Resultados | ||||
| Estudio positivob | 1,49±0,29 | 0,180 | 1,35±0,18 | 0,243 |
| Negativo | 1,6±0,4 | 1,45±0,2 | ||
Índice I/D: índice izquierdo/derecho; na: no disponible.
No hubo diferencias significativas en el análisis cualitativo o semicuantitativo en la evaluación de los pacientes que se sometieron a más de una exploración.
DiscusiónLa gammagrafía con MIBG marcada con yodo radiactivo constituye un procedimiento útil en pacientes con tumores derivados de la cresta neural, especialmente en tumores de origen neuroendocrino. Su captación depende de la excreción de catecolaminas o la inervación adrenérgica. La MIBG es un análogo de la guanidina cuya captación por los tejidos neurales está mediada principalmente por un mecanismo específico activo dependiente de sodio (captación por receptor de amina tipo 1) y, en menor grado, a través de difusión pasiva (captación por receptor de amina tipo 2)12. En la localización extraneuronal, como la hepática, se han implicado otros sistemas en la captación de catecolaminas; por ejemplo, es conocido que los transportadores de monoaminas (transportadores de cationes orgánicos u organic cation transporters [OCT]) aceptan las catecolaminas, noradrenalina y adrenalina como sustratos. En los tejidos extraneuronales los OCT son esenciales para el aclaramiento de las catecolaminas de la sangre y los tejidos no neuronales13. La captación de 123I-MIBG por hepatocitos aislados parece depender de este mecanismo de transporte activo que implica los OCT extraneuronales. La MIBG se excreta principalmente por la orina, mientras que la excreción biliar es escasa, sin visualización de tractos biliares13,14. En la práctica clínica frecuentemente observamos una concentración diferente de 123I-MIBG entre el lóbulo derecho e izquierdo (mayor en el izquierdo) (fig. 1). Se han propuesto varios posibles mecanismos para explicar la concentración hepática asimétrica de 123I-MIBG, pero el verdadero procedimiento todavía no se conoce.
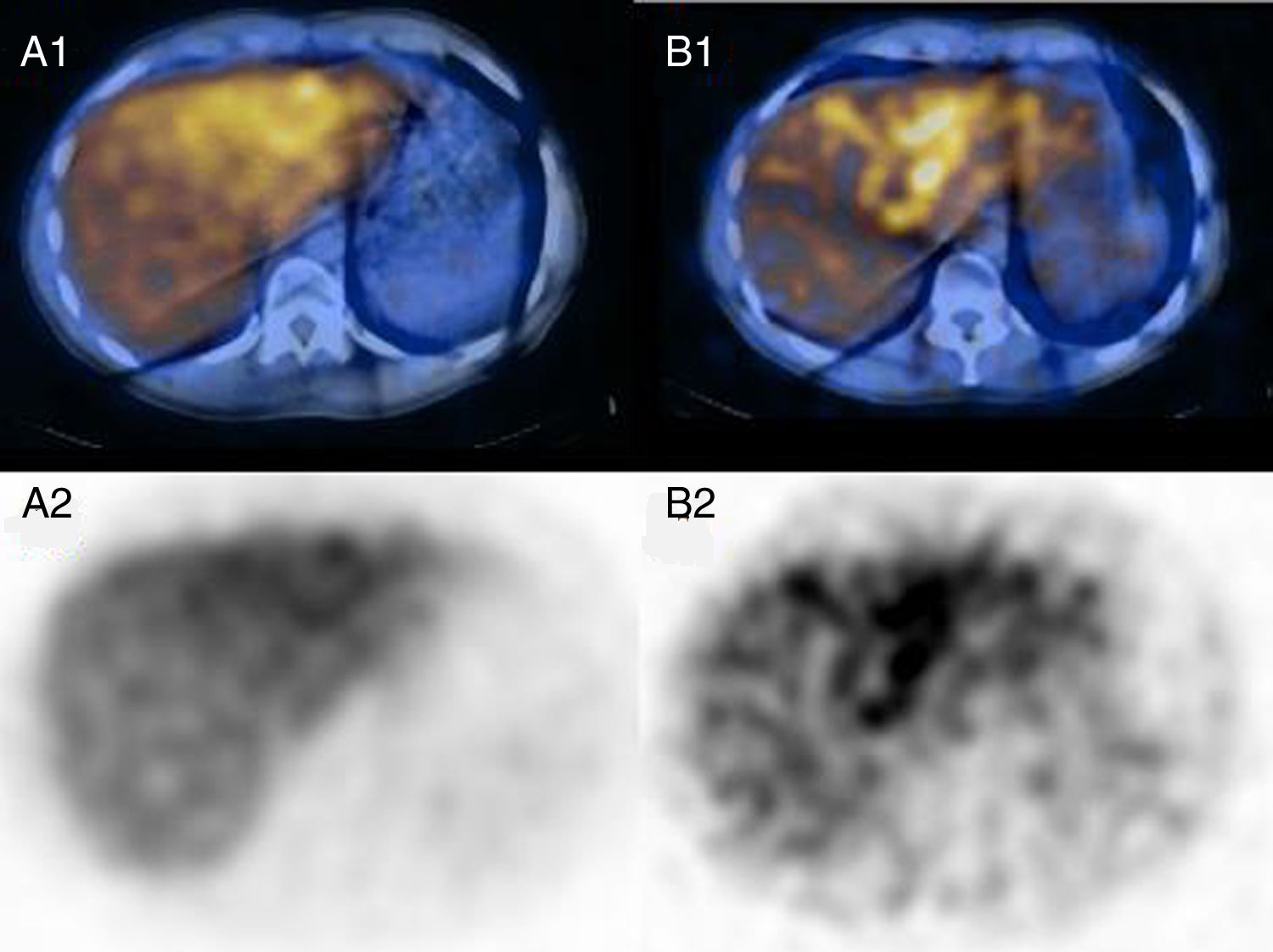
Caso representativo con un incremento de captación de 123I-MIBG en el lóbulo hepático izquierdo. Caso representativo de un paciente estudiado por feocromocitoma probado histológicamente, con una captación aumentada de 123I-MIBG en el lóbulo hepático izquierdo comparado con el lóbulo derecho, ambos en el rastreo precoz (índice D/I=1,41) y rastreo tardío (índice D/I=1,58). Las imágenes de fusión SPECT/TC (A1, B1) e imágenes SPECT (A2, B2) confirmaron la captación asimétrica entre el lóbulo hepático izquierdo y derecho.
Las principales hipótesis para explicar este fenómeno podrían ser: 1) la diferencia de flujo entre los lóbulos hepáticos izquierdo y derecho; 2) una mayor densidad de nervios en el lóbulo izquierdo en comparación con el derecho; 3) una mayor presencia de catecolaminas; y 4) la teoría filogenética que tiene en cuenta la organización más antigua y constante del lóbulo izquierdo respecto al derecho que es, estructuralmente y quizás funcionalmente, más variable. La diferente captación de 123I-MIBG entre el lóbulo derecho e izquierdo (mayor en el izquierdo) fue descrita por primera vez por Jacobsson et al.8 que estudiaron un número de 27 estudios de 123I-MIBG y concluyeron que estas ratios diferentes entre los 2 lóbulos hepáticos deben considerarse como eventos fisiológicos, pero no hemos hallado explicación para este hecho. Estos mismos autores en 2 artículos posteriores9,10 confirmaron esta tendencia del índice I/D. Además, mientras otros trazadores, como el 111In-pentetreótido o el 99mTc-ácido dimetiliminodiacético, sustancias con elevada tasa de extracción, mostraron un índice hepático invertido, con una captación superior del radiofármaco en el lóbulo hepático derecho en comparación con el izquierdo, la 123I-MIBG, que también presenta una elevada tasa de extracción, muestra captación mayor en el lóbulo hepático izquierdo que excluye la diferencia del flujo sanguíneo como justificación de esta disparidad. La captación hepática de yoduro libre es frecuente (35-44% de los pacientes que se someten a un tratamiento con 131I para el cáncer diferenciado de tiroides) y es homogéneo entre los lóbulos hepáticos15, por lo que el índice de captación lobar I/D no puede ser explicada con las diferencias en la captación de 123I libre. Otra hipótesis puede ser la diferente densidad de inervación simpática entre los 2 lóbulos hepáticos, pero se necesitan estudios in vitro para verificar esta teoría. El hígado está completamente inervado por fibras nerviosas aferentes y eferentes de origen simpático y parasimpático que engloban las vías aminérgica, colinérgica y el neuroefecto peptidérgico16–18. Mientras que en el hígado del humano adulto las fibras nerviosas se evidencian en la zona portal e intra-acinar, la red neural fetal se desarrolla a partir de tejido pobremente inervado sin neuronas intrínsecas a un tracto portal para alcanzar finalmente un nivel de inervación intra-acinar adicional a término. Sin embargo, no se ha demostrado una distribución lobar específica, y su implicación en la captación de 123MIBG en el hígado sigue sin explicación.
El objetivo de este estudio retrospectivo fue comprobar los resultados previos8–10 en una serie larga de pacientes y buscar una posible correlación con las características epidemiológicas y clínicas, que fueran útiles para aclarar el comportamiento metabólico de la 123I-MIBG en el hígado. Confirmamos un índice de captación hepático I/D superior a 1,00 en todos los casos; además, esta evidencia estuvo presente en los índices I/D precoz y tardío. Este resultado no se ha evidenciado en otros trabajos en los que solo se ha realizado una SPECT a las 20-24h. De nuestros pacientes en 41 se realizó también una SPECT/TC 6horas después de la inyección del radiotrazador, que aportó una valoración precoz respecto a la tardía. El índice I/D se incrementó en el estudio tardío pero estuvo presente también a las 6horas tras la administración del radiofármaco; este resultado refuerza la evidencia de las diferentes características entre los 2 lóbulos hepáticos principales, que podría implicar mecanismos subyacentes de captación/retención intracelular que causen el lavado tardío del radiofármaco.
En nuestro análisis los índices I/D precoz y tardío parecen ser completamente independientes de cualquiera de los factores analizados, sin tener relación con la edad, género, tipo de neoplasia y resultado de la exploración. Sin embargo, se conoce muy poco sobre la inervación específica lobar. Las principales diferencias entre los dos lóbulos se observan en casos de daño tóxico o enfermedades hepáticas (toxicidad por paracetamol, carcinogénesis química o cirrosis, colestasis)19–24. Estudios previos han demostrado progresivamente que la captación de catecolaminas (CA) es diferente en el sistema nervioso que en los hepatocitos (o de forma más general en el sistema extraneuronal). En esos últimos casos la captación de CA no está mediada por los sistemas tipo 1 y tipo 2, sino por los transportadores de cationes orgánicos OCT-110,24, y esta diferencia puede implicar una respuesta funcional específica de los hepatocitos a la estimulación simpática. Sin embargo, deben tenerse en cuenta los transportadores de noradrenalina como transportadores activos, debido a la elevada inervación funcional del hígado. Además, no solo deben considerarse los sistemas de captación de transportadores, sino también los mecanismos que implican la retención intracelular. Los pacientes que han mostrado una elevada captación de 123MIBG en el rastreo precoz pueden tener ambas, una captación máxima de CA en condiciones basales o un grado de retención intracelular diferente.
Jacobsson et al.8 propusieron la teoría filogénetica por la cual el lóbulo izquierdo es más antiguo, mientras que el lóbulo derecho ha evolucionado más recientemente, siendo más variable en su organización. El lóbulo izquierdo está llamado a representar la herencia filogénetica con una organización constante, mientras que el lóbulo derecho es más variable y reciente. Nuestros resultados pueden explicar esta diferencia filogenética funcional, a pesar de que estudios in vitro ayudarían a clarificarla. Esta teoría se ve reforzada por múltiples estudios que han publicado las diferencias entre los 2 lóbulos en cuanto a inervación y propiedades de aclaramiento de fármacos en modelos murinos. Un estudio comparativo de la inervación hepática entre diferentes especies de mamíferos, incluido el ser humano, demostró una mayor inervación aminérgica entre las especies más evolucionadas, y esto podría demostrar un papel evolutivo en la inervación noradrenérgica hepática22,25–27. Para finalizar, es bien conocido que el hígado es un órgano muy complejo, cuya homeostasis y funciones depende de sutiles «macro» regulaciones mediadas principalmente por la circulación sanguínea/macrocirculación y la inervación, pero también a nivel «micro» por la interacción de la microcirculación, las más pequeñas ramificaciones nerviosas (que directamente cooperan con los hepatocitos) y otros componentes como las células hepáticas. Los hepatocitos, las células endoteliales y sinusoides endoteliales, colangiocitos, células glandulares, células estrelladas, células de Kupffer y células progenitoras hepáticas representan las principales células del hígado. Todos estos tipos celulares colaboran en mantener la homeostasis del hígado28. Además, las interacciones entre estas células y las ramificaciones terminales de los nervios intrahepáticos y con la microcirculación podrían contribuir también a la explicación de la asimetría lobar. Sin embargo, mientras que hay muchas referencias sobre la heterogeneidad intralobar hepática (anatómica, funcional y bioquímica), se han realizado escasas investigaciones (tanto básicas como clínicas) centradas en las diferencias entre los 2 lóbulos principales del hígado, lo que dificulta la interpretación de la asimetría hepática sin posteriores estudios anatomofuncionales.
ConclusionesLa captación de 123I-MIBG fue superior en el lóbulo hepático izquierdo comparado con el derecho, y este índice no se correlacionó con ningún parámetro epidemiológico ni clínico. La razón de este comportamiento metabólico es todavía desconocido; por ello sería útil realizar estudios in vitro para explicar las diferentes propiedades entre los 2 lóbulos hepáticos principales.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.