Como hay poca literatura sobre el tema, nos propusimos comparar la utilidad diagnóstica del análisis semicuantitativo versus el análisis visual en la escintigrafía de glóbulos blancos etiquetados (WBCS) para la infección osteoarticular. Se evaluaron protocolos de uno y dos días, en particular en los dispositivos ortopédicos.
Material y métodosEstudio prospectivo de 79 pacientes consecutivos con sospecha de infección osteoarticular. En todos los pacientes, la SCBM se realizó a los 30 min, 4 h, 8 h y 24 h. Las imágenes se analizaron agrupándolas en dos protocolos: protocolo de un día (los expertos evaluaron imágenes planas de 30 min, 4 h y 8 h) y protocolo de dos días (los expertos evaluaron imágenes planas de 30 min, 4 h y 24 h). Las imágenes planas se interpretaron cualitativa y semicuantitativamente y también se compararon agrupando a los pacientes con y sin dispositivos ortopédicos. Para determinar qué valor de corte de la variación porcentual podía predecir la infección osteoarticular, se calcularon múltiples valores de corte en ambos protocolos a partir del índice de Youden. Tres lectores ciegos analizaron las imágenes.
ResultadosComparando el diagnóstico final, el análisis visual del protocolo de un día proporcionó mejores resultados con una sensibilidad del 95,5%, una especificidad del 93% y una precisión diagnóstica del 93,7% (p < 0,01) que el protocolo de dos días con valores del 86,4%, 94,7% y 92,4%, respectivamente (p < 0,01). Para el análisis semicuantitativo, el protocolo de un día también obtuvo mejores resultados con una sensibilidad del 72,7%, una especificidad del 78,9% y una precisión del 77,2% (p < 0,01) que el protocolo de dos días (sin resultados significativos; p = 0,14), especialmente en el grupo de pacientes con aparatos ortopédicos (sensibilidad del 100%, especificidad del 79,5% y precisión del 82,7%; p < 0,01).
ConclusionesEl enfoque más preciso en el diagnóstico de la infección osteoarticular correspondió al análisis visual en protocolo de un día que mostró mayor sensibilidad y especificidad que el análisis semicuantitativo. El análisis semicuantitativo sólo podría ser útil cuando el análisis visual es dudoso. En los pacientes con prótesis articulares, un aumento de la variación porcentual por encima del 9% obtuvo una sensibilidad máxima y un valor predictivo negativo.
As scarce literature on the topic is available, we aimed to compare diagnostic utility of semi-quantitative versus visual analysis in labelled white blood cell scintigraphy (WBCS) for osteoarticular infection. One-day and two-day protocols were assessed, particularly in orthopaedic devices.
Material and methodsProspective study of 79 consecutive patients with suspected osteoarticular infection. In all patients, WBCS were performed at 30min, 4h, 8h and 24h. Images were analysed by grouping in two protocols: one-day-protocol (experts evaluated 30min, 4h and 8h planar images) and two-day-protocol (experts evaluated 30min, 4h and 24h planar images). Planar images were interpreted qualitative and semiquantitatively and also were compared grouping patients with and without orthopaedic devices. To find which cut-off value of the percentage variation could predict of osteoarticular infection, multiple cut-off values were calculated in both protocols from the Youden index. Three blinded readers analysed the images.
ResultsComparing final diagnosis visual analysis of the one-day-protocol provided better results with sensitivity of 95.5%, specificity of 93% and diagnostic accuracy of 93.7% (P<.01) than the two-day-protocol with values of 86.4%, 94.7% and 92.4%, respectively (P<.01). For semi-quantitative analysis, the one-day-protocol also obtained better results with sensitivity of 72.7%, specificity of 78.9% and accuracy of 77.2% (P<.01) than two-day-protocol (no significant results; P=.14), especially in the group of patients with orthopaedic devices (sensitivity of 100%, specificity of 79.5% and accuracy of 82.7%; P<.01).
ConclusionsMost accurate approach in the diagnosis of osteoarticular infection corresponded to visual analysis in one-day-protocol that showed greater sensitivity and specificity than semi-quantitative analysis. Semi-quantitative analysis only could be useful when visual analysis is doubtful. In patients with joint prostheses, an increase in percentage variation above 9% obtained maximum sensitivity and negative predictive value.
Diferenciar entre inflamación e infección ósea constituye un reto importante en la práctica clínica diaria, y las técnicas de imagen forman parte del manejo diagnóstico del paciente. El retraso en la instauración del tratamiento antibiótico o quirúrgico conlleva un impacto negativo sobre su resolución clínica. Por ello, resulta crucial llegar a un diagnóstico preciso en el menor tiempo posible1.
Teniendo en cuenta la relativa inespecificidad de las pruebas de laboratorio, las técnicas de imagen desempeñan un papel en la obtención del diagnóstico correcto. Los cambios morfológicos tardan un tiempo en reflejarse en las técnicas radiológicas, de forma que estos estudios no resultan útiles para conseguir un diagnóstico de infección precoz1–3. La radiografía presenta una sensibilidad (S) y especificidad (E) limitadas para la detección de la osteomielitis aguda, con resultados que oscilan entre el 50% y el 75%, y entre el 75% y el 83%, respectivamente4. La tomografía computarizada (TC) proporciona una excelente delimitación de las áreas infectadas, pero la presencia de artefactos inducidos por material metálico puede limitar su uso. La resonancia magnética (RM) resulta útil para el diagnóstico de la osteomielitis, especialmente a nivel vertebral, pero se ve limitada por los elementos ortopédicos y, en muchas ocasiones, no puede diferenciar entre la osteomielitis y otras afecciones como el traumatismo, la artropatía de Charcot o los cambios posquirúrgicos. El hueso no se visualiza adecuadamente mediante ecografía, debido a que la superficie cortical es muy reflectante a los ultrasonidos empleados en generar la imagen1,4,5.
Los estudios isotópicos desempeñan un papel importante en la determinación del diagnóstico correcto ante la sospecha de una infección osteoarticular. Habitualmente se realiza una gammagrafía ósea en 3 fases utilizando un difosfonatos marcado con 99mTc. La presencia de hiperperfusión e hiperemia focales, así como de una hipercaptación ósea focal es la representación clásica de la osteomielitis. Se trata de una técnica muy sensible, pero con una baja especificidad4,5, debido a la imposibilidad por sí sola de diferenciar entre infección e inflamación6–10.
La gammagrafía con leucocitos marcados in vitro (GLM) con (99mTc)-hexametil-propilenamin-oxima o exametazima (HMPAO) constituye la técnica más útil para identificar los procesos inflamatorios/infecciosos mediados por neutrófilos y, consecuentemente, para diferenciar entre enfermedad séptica y aséptica. A excepción de la columna vertebral, la GLM con (99mTc)Tc-HMPAO es la técnica de elección de medicina nuclear convencional para el diagnóstico de las infecciones del sistema musculoesquelético, y especialmente en la osteomielitis complicada como el pie diabético y la infección de las prótesis articulares3.
En la mayoría de los casos el análisis visual (AV) de las imágenes de la GLM, empleando la adquisición corregida por tiempo de decay (TDCA por sus siglas en inglés) resulta suficiente. Cuando las imágenes planares de la GLM-TDCA no muestran un incremento/reducción significativos en la intensidad de la captación del radiotrazador, la interpretación visual ofrece más dudas, por lo que el análisis semicuantitativo (AS) y el cálculo del índice entre lesión y fondo (L/F) pueden ser de ayuda para el diagnóstico diferencial entre infección e inflamación. Pelosi et al. fueron los primeros autores que abordaron este planteamiento, y encontraron que la adición del AS conducía a una mejoría en los valores de S y E11.
En este estudio nuestro objetivo fue comparar la utilidad diagnóstica del AS frente al AV de la GLM con (99mTc)Tc-HMPAO en la infección osteoarticular, empleando los protocolos de uno y 2 días, especialmente en aquellos pacientes con dispositivos ortopédicos.
Material y métodosEste estudio fue autorizado por el Comité de Ética del Hospital Universitario de Bellvitge el 6 de junio de 2014, dirigido por el Dr. Francesc Esteve Urbano y con el número de protocolo asignado PR331/13. Todos los pacientes leyeron y firmaron el consentimiento informado.
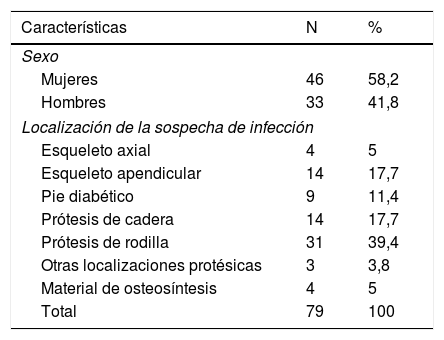
PoblaciónSe trata de un estudio prospectivo realizado con 79 pacientes consecutivos (46 mujeres con edades comprendidas entre los 22 y 86 años), con sospecha de infección ósea en el esqueleto periférico, cráneo, pie diabético y prótesis u otro material de osteosíntesis, con un intervalo medio de tiempo de 3 años desde la artroplastia en el grupo de pacientes con dispositivos ortopédicos (aunque este intervalo fue inferior a un año en 5 pacientes [9%]) como se muestra en la tabla 1.
Características de los 79 pacientes
| Características | N | % |
|---|---|---|
| Sexo | ||
| Mujeres | 46 | 58,2 |
| Hombres | 33 | 41,8 |
| Localización de la sospecha de infección | ||
| Esqueleto axial | 4 | 5 |
| Esqueleto apendicular | 14 | 17,7 |
| Pie diabético | 9 | 11,4 |
| Prótesis de cadera | 14 | 17,7 |
| Prótesis de rodilla | 31 | 39,4 |
| Otras localizaciones protésicas | 3 | 3,8 |
| Material de osteosíntesis | 4 | 5 |
| Total | 79 | 100 |
n: número de pacientes; %: porcentaje.
Los leucocitos autólogos se marcaron de acuerdo con las recomendaciones emitidas por la Sociedad Europea de Medicina Nuclear (European Association of Nuclear Medicine [EANM])12.
La actividad promedio de (99mTc)Tc-HMPAO-leucocitos autólogos administrada a los pacientes fue de 303,4±77,7MBq, con una eficiencia media del marcaje del 80% (rango: 73-89%).
Se adquirieron imágenes planares (matriz de 128×128) con una gammacámara Phillips Brightview XCT (Phillips Medical Systems, Cleveland, Ohio, EE. UU.) equipada con colimadores de baja energía y alta resolución, con una ventana de energía centrada en el fotopico del 99mTc (140keV) y con una amplitud del 20%.
Después de la reinyección de los leucocitos marcados se obtuvieron imágenes planares a los 30min, 4h, 8h y 24h. La duración de la adquisición fue de 5min a los 30min. Para determinar el tiempo de adquisición del resto de imágenes se aplicó la corrección del tiempo de decay del radiotrazador. En función de las recomendaciones de las guías de la EANM12,13, los tiempos calculados para las adquisiciones de las 4, 8 y 24h fueron respectivamente de 8, 12 y 20min. Las imágenes TDCA fueron presentadas en número de cuentas utilizando la misma intensidad, evitando de este modo el sesgo del operador al modificar la escala de intensidades13.
Análisis visualEn todos los pacientes se obtuvieron imágenes planares de la GLM a los 30min, 4h, 8h y 24h tras la reinyección de los leucocitos autólogos marcados. Las imágenes se analizaron agrupándolas en 2 protocolos:
- -
Protocolo de un solo día (1D): los expertos evaluaron las imágenes planares obtenidas a los 30min, 4h y 8h.
- -
Protocolo de 2 días (2D): los expertos evaluaron las imágenes planares obtenidas a los 30min, 4h y 24h.
Ambos grupos fueron analizados por 2 médicos nucleares con experiencia, de forma aleatoria, por separado y sin tener acceso a los resultados de otras pruebas diagnósticas y/o resultados clínicos. Cuando hubo desacuerdo entre los 2 expertos un tercer profesional revisó las imágenes y su decisión se consideró definitiva para la clasificación del paciente.
En el AV los 2 grupos se clasificaron siguiendo los mismos criterios expuestos en las recomendaciones de la EANM. Las imágenes se clasificaron por lo tanto como: a) negativa cuando no hubo captación, o se observó una disminución evidente de la actividad entre las imágenes retardadas y tardías en la región de interés; b) positiva cuando hubo un incremento evidente en la intensidad o extensión de la captación en la región de interés con el tiempo; y c) dudoso en el resto de situaciones12.
Análisis semicuantitativoExceptuando la imagen de la GLM de los 30min, el AS se llevó a cabo en el resto de imágenes. Dicho análisis consistió en dibujar una región de interés (ROI) en el área de máxima intensidad de captación en la zona sospechosa, y dicha ROI se copió en un tejido de referencia presumiblemente normal en la médula ósea ipsilateral. Se anotaron las cuentas de estas ROI y se calculó el índice L/F en las imágenes de las 4h, 8h y 24h. A continuación, cada grupo del protocolo se clasificó según:
- •
Negativo: índice L/F similar (porcentaje de variación inferior al 10%) o disminución del índice a las 8h (o 24h) en comparación con el de las 4h.
- •
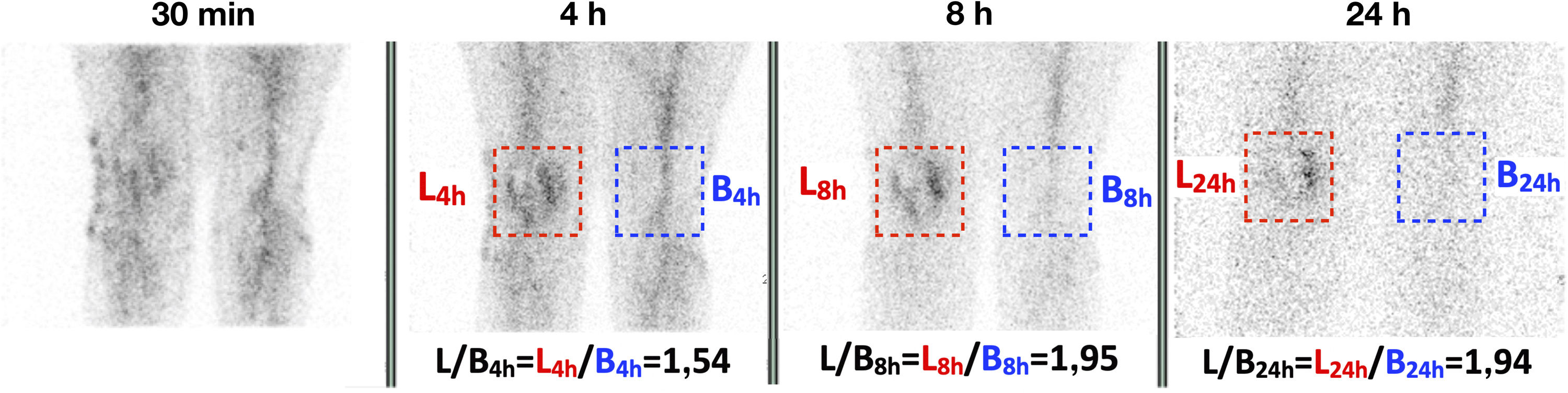
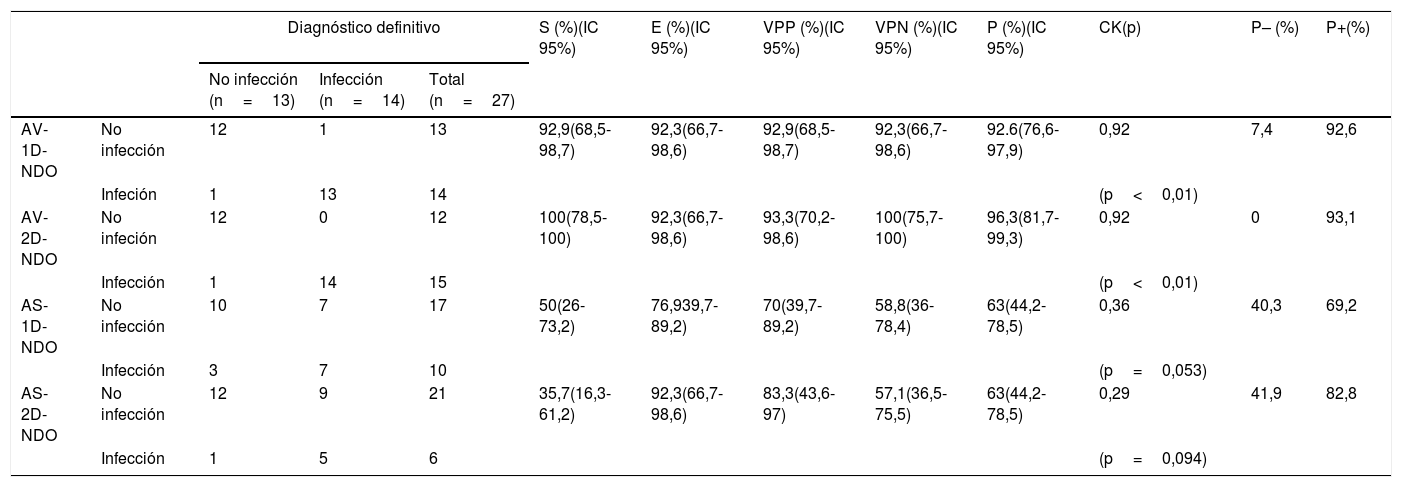
Positivo: cuando el índice L/F mostró un incremento superior al 10% en el porcentaje de variación a las 8h (o 24h), en comparación con el índice de las 4h (fig. 1).
Figura 1.Gammagrafía con leucocitos marcados en un paciente de 62 años con prótesis de rodilla izquierda implantada 4 años antes y dolorosa. Para el análisis semicuantitativo se dibujó una ROI en la lesión (recuadro rojo) y otra en el tejido contralateral a modo de área de referencia (recuadro azul) para el cálculo del índice L/F. Dicho índice mostró un incremento a las 8h (o 24h) respecto a las 4h (L/F4h=1,54, L/F8h=1,95 y L/F24h=1,94), lo cual indica que el paciente era positivo para infección. La biopsia de la prótesis de rodilla izquierda confirmó una infección por Staphylococcus aureus.
(0.28MB).
El AS lo llevaron a cabo 2 médicos nucleares expertos. Además, se calcularon múltiples valores de corte del porcentaje de variación (Δ%) para el índice L/F en ambos protocolos, con el fin de encontrar aquel umbral de porcentaje que podría ser pronóstico de infección ósea. El Δ% se calculó aplicando las siguientes fórmulas:
- •
Δ%1D=(L/F8h–L/F4h)/L/F4h para 1D.
- •
Δ%2D=(L/F24h–L/F4h)/L/F4h para 2D.
El diagnóstico definitivo se determinó mediante cultivo/biopsia o, en su ausencia, mediante un seguimiento clínico mínimo de 12 meses.
Análisis estadísticoSe estudió la relación entre el resultado de la GLM y el diagnóstico clínico definitivo. Para cada protocolo diagnóstico (1D y 2D) se calcularon los valores de S, E, valor predictivo negativo (VPN), valor predictivo positivo (VPP), precisión (P), probabilidad postest positiva (P+), probabilidad postest negativa (P–) y sus respectivos intervalos de confianza del 95%. Se analizó el acuerdo entre ambos protocolos y con el diagnóstico definitivo mediante el coeficiente kappa de Cohen (CK). Se emplearon las curvas de eficacia diagnóstica (ROC) para comparar la capacidad diagnóstica del AV y el AS de ambos protocolos, teniendo en cuenta el diagnóstico definitivo. Además, a partir del índice de Youden se determinaron los valores de corte del Δ% en el índice L/F para ambos protocolos.
Toda la evaluación estadística se realizó utilizando el SPSS (versión 24.0, SPSS, Chicago, IL) para Windows, considerando significativo un valor de la p<0,05.
ResultadosEn este estudio en 38 pacientes el diagnóstico definitivo se confirmó mediante cultivo y/o biopsia, y en los restantes 41 mediante su seguimiento clínico mínimo de 12 meses.
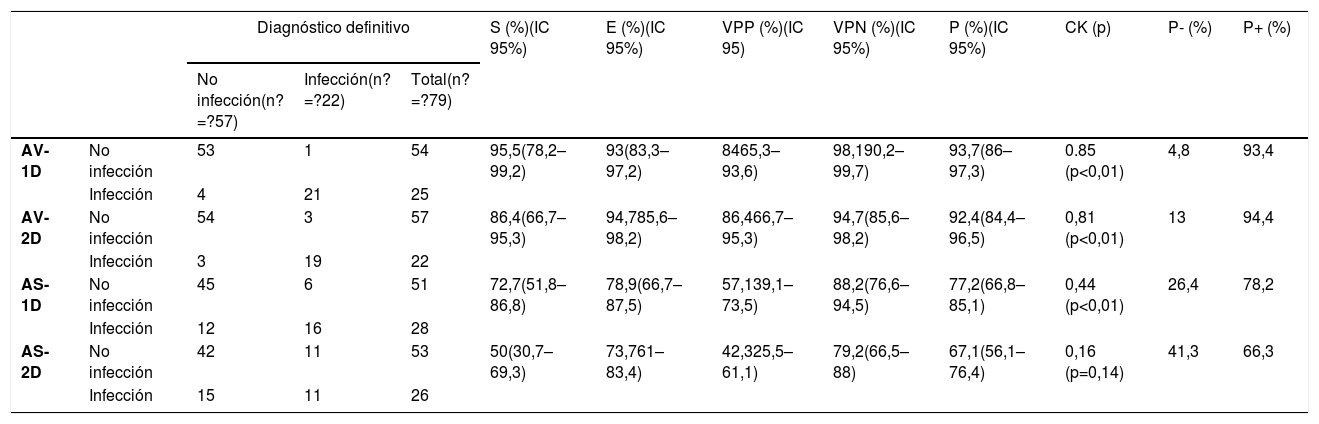
En 22 pacientes (27,8%) se confirmó infección, y en 57 casos (72,2%) se descartó, como se muestra en la tabla 2.
Comparación entre el análisis visual y semicuantitativo (con una Δ% ≥10%) respecto al diagnóstico definitivo con ambos protocolos
| Diagnóstico definitivo | S (%)(IC 95%) | E (%)(IC 95%) | VPP (%)(IC 95) | VPN (%)(IC 95%) | P (%)(IC 95%) | CK (p) | P- (%) | P+ (%) | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| No infección(n?=?57) | Infección(n?=?22) | Total(n?=?79) | ||||||||||
| AV-1D | No infección | 53 | 1 | 54 | 95,5(78,2–99,2) | 93(83,3–97,2) | 8465,3–93,6) | 98,190,2–99,7) | 93,7(86–97,3) | 0.85 (p<0,01) | 4,8 | 93,4 |
| Infección | 4 | 21 | 25 | |||||||||
| AV-2D | No infección | 54 | 3 | 57 | 86,4(66,7–95,3) | 94,785,6–98,2) | 86,466,7–95,3) | 94,7(85,6–98,2) | 92,4(84,4–96,5) | 0,81 (p<0,01) | 13 | 94,4 |
| Infección | 3 | 19 | 22 | |||||||||
| AS-1D | No infección | 45 | 6 | 51 | 72,7(51,8–86,8) | 78,9(66,7–87,5) | 57,139,1–73,5) | 88,2(76,6–94,5) | 77,2(66,8–85,1) | 0,44 (p<0,01) | 26,4 | 78,2 |
| Infección | 12 | 16 | 28 | |||||||||
| AS-2D | No infección | 42 | 11 | 53 | 50(30,7–69,3) | 73,761–83,4) | 42,325,5–61,1) | 79,2(66,5–88) | 67,1(56,1–76,4) | 0,16 (p=0,14) | 41,3 | 66,3 |
| Infección | 15 | 11 | 26 | |||||||||
AV-1D: análisis visual en el protocolo de 1 día; AV-2D: análisis visual en el protocolo de 2 días; AS-1D: análisis semicuantitativo en el protocolo de 1 día; AS-2D: análisis semicuantitativo en el protocolo de 2 días; Δ%: porcentaje de variación; n: número de pacientes; IC: intervalo de confianza; S: sensibilidad; E: especificidad; VPP: valor predictivo positivo; VPN: valor predictivo negativo; P: precisión; CK: coeficiente kappa de Cohen; P-: probabilidad post-test negativa; P+: probabilidad post-test positiva.
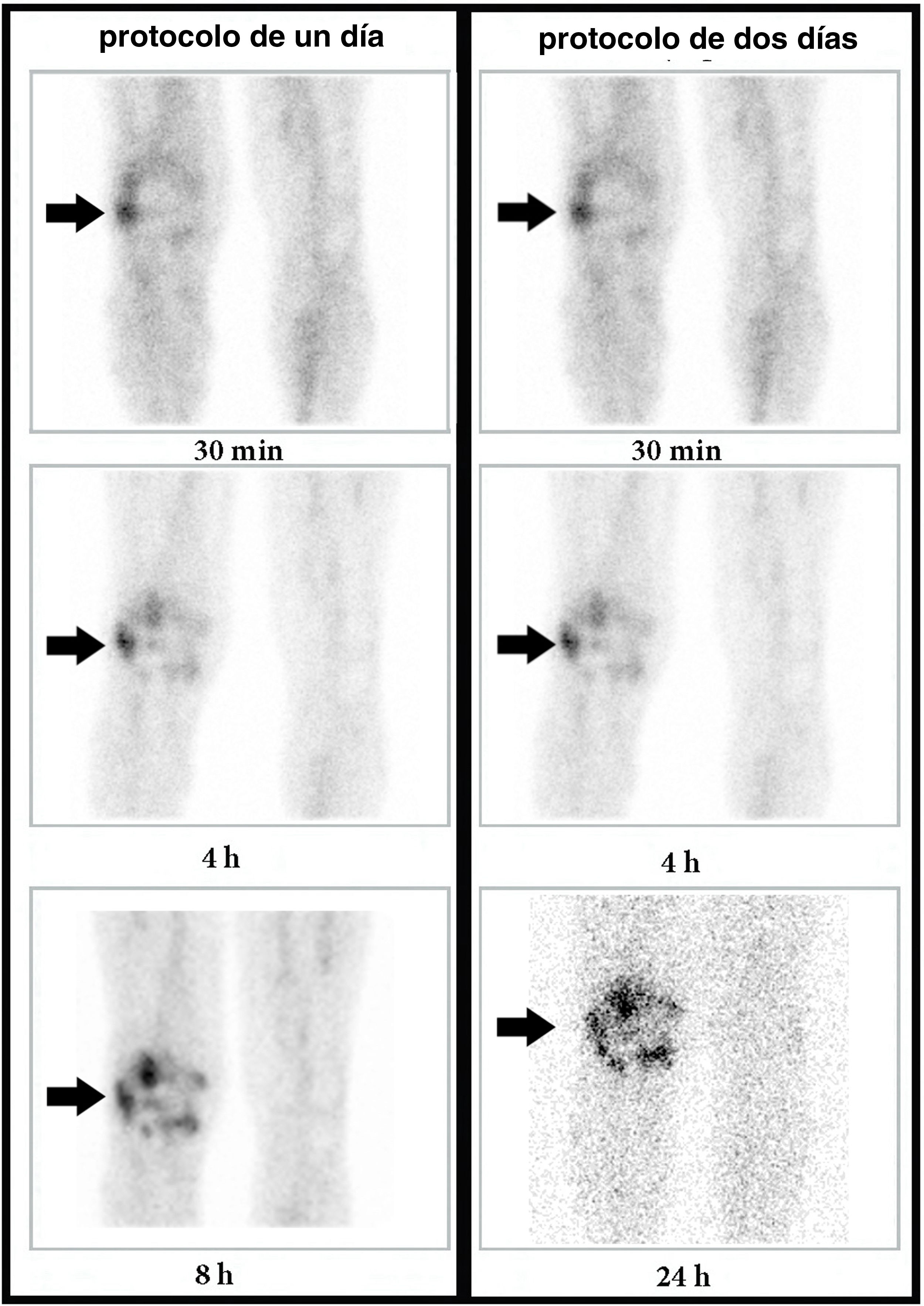
Después del AV 19 de los 22 casos infectados (86,4%) fueron positivos en ambos protocolos (fig. 2). Hubo un caso falso negativo en ambos protocolos, correspondiendo a un paciente con infección crónica en una prótesis de cadera derecha (la biopsia describió infección por Propionibacterium acnes). Los 2 pacientes restantes mostraron una hipercaptación en la GLM a las 8h, disminuyendo en intensidad a las 24h. Consecuentemente, fueron casos falsos negativos únicamente en el protocolo de 2D y verdaderos positivos en el protocolo de 1D. El primero era un paciente con varias intervenciones quirúrgicas y pseudoartrosis femorotibial con tumefacción severa, y el segundo era un paciente con prótesis de rodilla bilateral y sospecha de infección en la izquierda.
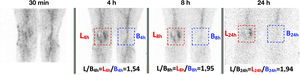
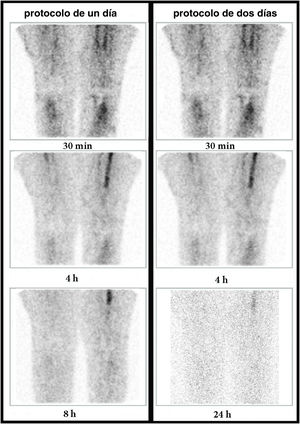
Varón de 70 años con prótesis de rodilla derecha implantada 8 años antes. Antecedentes de osteomielitis y sinovitis. Aparición de dolor de 6 meses de evolución. Imágenes de la GLM adquiridas a los 30min, 4h, y 8h o 24h (columna de la izquierda: protocolo de un día; columna de la derecha: protocolo de 2 días). Se observa que la captación periprotésica aumenta progresivamente en intensidad y extensión (flechas) entre los 30min, 4h y 8h o 24h. Por lo tanto, este comportamiento es compatible con enfermedad infecciosa en ambos protocolos. Se obtuvo una artrocentesis con cultivo positivo para Staphylococcus warneri.
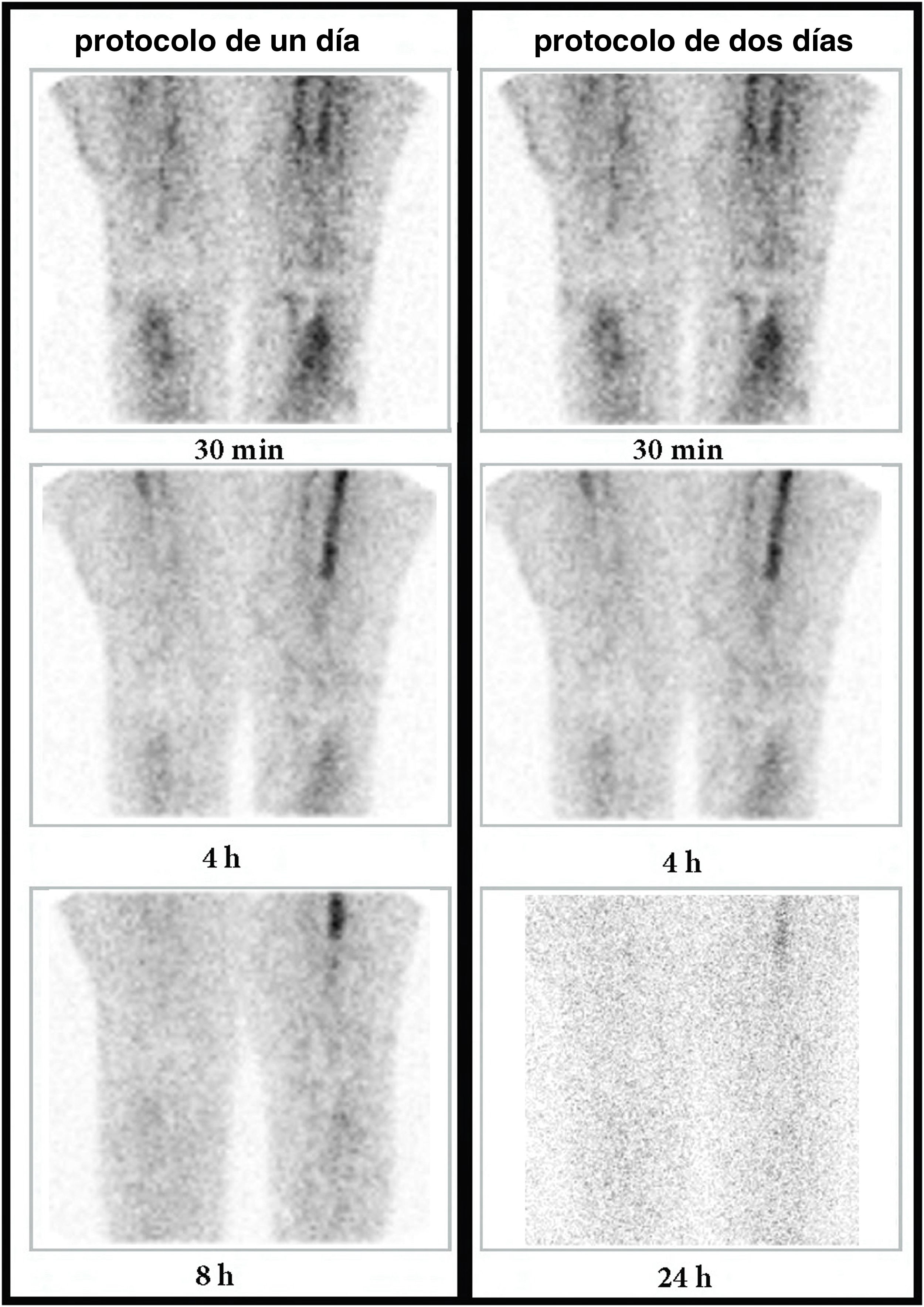
Cincuenta y tres de los 57 pacientes sin infección fueron casos verdaderos positivos en ambos protocolos. En 35 de 53 pacientes (66%) la GLM mostró inflamación (disminución de la captación con el tiempo, y todos ellos se correspondieron con una inflamación aséptica). Los restantes 18 de 53 casos (34%) no presentaron captación y se mantuvieron asintomáticos durante el seguimiento (fig. 3). Hubo 3 casos falsos positivos en ambos protocolos, que correspondieron con un paciente con inflamación aguda tras sufrir una mordedura de perro y los 2 pacientes restantes presentaron una inflamación muy aguda tras cirugía reciente de recambio protésico (inferior a un año de evolución). Tras una cirugía ortopédica agresiva se desarrollan cambios inflamatorios en la zona, por lo que es previsible que aparezca depósito de leucocitos14,15. Dicho infiltrado de granulocitos es significativo y puede inducir a la aparición de resultados falsos positivos. Existe el consenso general de esperar algunas semanas para permitir que la reacción inflamatoria disminuya.
Mujer de 64 años con prótesis de rodilla derecha implantada 10 años atrás (asintomática) y prótesis de rodilla izquierda desde hacía 3 años (muy dolorosa en la actualidad, con sospecha de infección de la prótesis). Imágenes de la GLM (rodillas, proyecciones anteriores) a los 30min, 4h y 8h o 24h (columna de la izquierda: protocolo de un día; columna de la derecha: protocolo de 2 días). Se observa que la captación periprotésica en la rodilla izquierda va disminuyendo progresivamente en intensidad (flechas) entre los 30min, 4h y 8h o 24h. Este comportamiento es compatible con una inflamación aséptica en ambos protocolos. Se obtuvo un cultivo negativo.
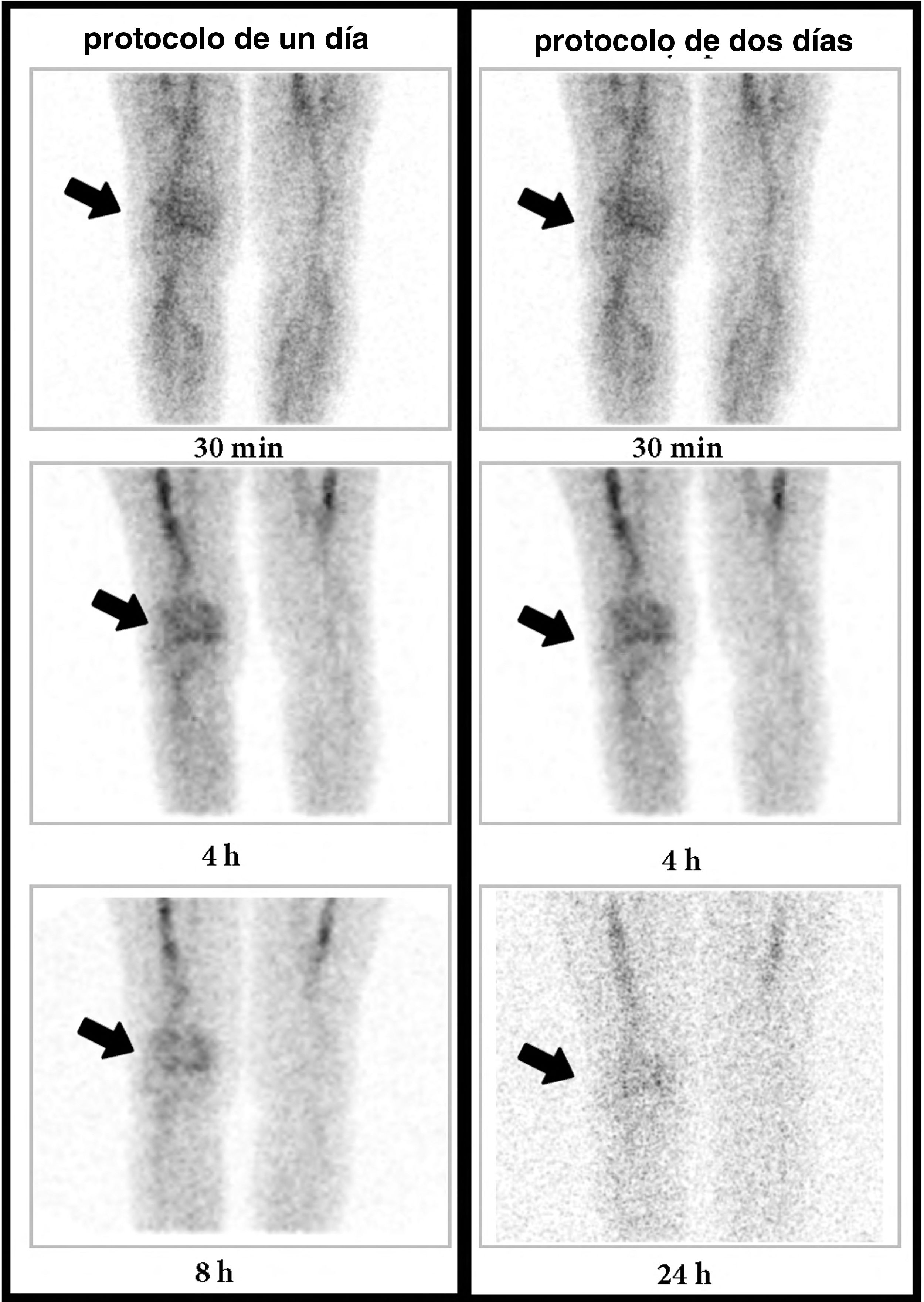
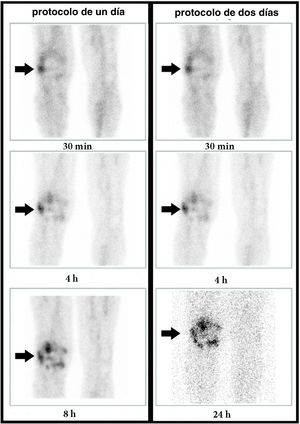
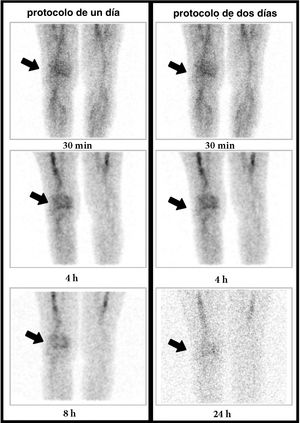
El último caso discordante fue el de una mujer con antecedentes de artritis séptica en la rodilla derecha, intervenida con desbridamiento 6 meses antes. En el protocolo de 1D se observó una captación progresivamente aumentada en la imagen de las 8h y, por el contario, en el protocolo de 2D se observó una disminución de la actividad en la imagen de las 24h, compatible con un proceso inflamatorio agudo (fig. 4).
Mujer de 67 años con cirugía de la rodilla derecha un año antes. Imágenes de la GLM (rodillas, proyección anterior) a los 30min, 4h y 8h o 24h (columna izquierda: protocolo de un día; columna derecha: protocolo de 2 días). En el protocolo de un día se observa un aumento progresivo en la intensidad de la captación. Por el contrario, en el protocolo de 2 días se observa una disminución de la captación entre las 4 y 24h. La biopsia describió una inflamación aguda; por tanto, se trata de un falso positivo en el protocolo de un día y un verdadero negativo en el de 2 días.
La tabla 2 muestra los resultados de S, E, VPP, VPN, P, CK, P– y P+para los protocolos de 1D y 2D. La asociación entre los protocolos y el diagnóstico definitivo mostró una relación significativa para ambos protocolos, pero con un valor de la CK ligeramente superior en el AV del protocolo 1D.
Más de la mitad de nuestra muestra correspondió a pacientes con prótesis articular o con material de osteosíntesis (65,8%), por lo que decidimos comparar los resultados del AV en 52 pacientes con material ortopédico (grupo DO) frente a 27 pacientes (34,2%) sin dicho material (grupo NDO).
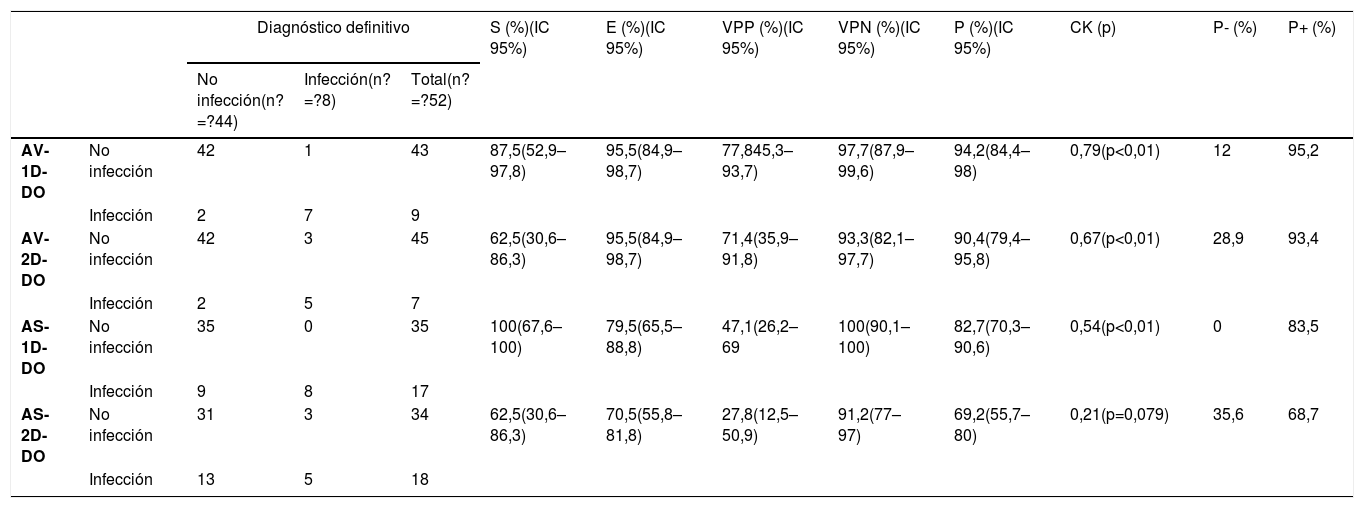
En el grupo DO se confirmó infección en 8 pacientes (14,5%), descartándose en los 44 restantes (84,6%). La tabla 3 muestra los resultados del AV respecto al diagnóstico definitivo en los grupos DO para 1D y 2D, mostrando una relación significativa en ambos protocolos, con un valor de la CK ligeramente superior para el AV del protocolo 1D.
Comparación de los resultados del análisis estadístico visual y semicuantitativo (con una Δ% ≥10%) con ambos protocolos en pacientes con dispositivo ortopédico
| Diagnóstico definitivo | S (%)(IC 95%) | E (%)(IC 95%) | VPP (%)(IC 95%) | VPN (%)(IC 95%) | P (%)(IC 95%) | CK (p) | P- (%) | P+ (%) | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| No infección(n?=?44) | Infección(n?=?8) | Total(n?=?52) | ||||||||||
| AV-1D-DO | No infección | 42 | 1 | 43 | 87,5(52,9–97,8) | 95,5(84,9–98,7) | 77,845,3–93,7) | 97,7(87,9–99,6) | 94,2(84,4–98) | 0,79(p<0,01) | 12 | 95,2 |
| Infección | 2 | 7 | 9 | |||||||||
| AV-2D-DO | No infección | 42 | 3 | 45 | 62,5(30,6–86,3) | 95,5(84,9–98,7) | 71,4(35,9–91,8) | 93,3(82,1–97,7) | 90,4(79,4–95,8) | 0,67(p<0,01) | 28,9 | 93,4 |
| Infección | 2 | 5 | 7 | |||||||||
| AS-1D-DO | No infección | 35 | 0 | 35 | 100(67,6–100) | 79,5(65,5–88,8) | 47,1(26,2–69 | 100(90,1–100) | 82,7(70,3–90,6) | 0,54(p<0,01) | 0 | 83,5 |
| Infección | 9 | 8 | 17 | |||||||||
| AS-2D-DO | No infección | 31 | 3 | 34 | 62,5(30,6–86,3) | 70,5(55,8–81,8) | 27,8(12,5–50,9) | 91,2(77–97) | 69,2(55,7–80) | 0,21(p=0,079) | 35,6 | 68,7 |
| Infección | 13 | 5 | 18 | |||||||||
AV-1D: análisis visual en el protocolo de 1 día; AV-2D: análisis visual en el protocolo de 2 días; AS-1D: análisis semicuantitativo en el protocolo de 1 día; AS-2D: análisis semicuantitativo en el protocolo de 2 días; Δ%: porcentaje de variación; DO: grupo con dispositivos ortopédicos; n: número de pacientes; IC: intervalo de confianza; S: sensibilidad; E: especificidad; VPP: valor predictivo positivo; VPN: valor predictivo negativo; P: precisión; CK: coeficiente kappa de Cohen; P-: probabilidad post-test negativa; P+: probabilidad post-test positiva.
Por otra parte, en el grupo NDO 14 (51,9%) de los 27 pacientes fueron diagnosticados de infección, descartándose en los 13 pacientes restantes (48,1%). La tabla 4 muestra los resultados del AV respecto al diagnóstico definitivo en los grupos NDO con 1D y 2D, mostrando una relación significativa entre ambos protocolos, con el mismo valor elevado de la CK.
Comparación de los resultados del análisis estadístico visual y semicuantitativo (con una Δ%≥10%) en ambos protocolos en pacientes sin dispositivo ortopédico
| Diagnóstico definitivo | S (%)(IC 95%) | E (%)(IC 95%) | VPP (%)(IC 95%) | VPN (%)(IC 95%) | P (%)(IC 95%) | CK(p) | P– (%) | P+(%) | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| No infección (n=13) | Infección (n=14) | Total (n=27) | ||||||||||
| AV-1D-NDO | No infección | 12 | 1 | 13 | 92,9(68,5-98,7) | 92,3(66,7-98,6) | 92,9(68,5-98,7) | 92,3(66,7-98,6) | 92.6(76,6-97,9) | 0,92 | 7,4 | 92,6 |
| Infeción | 1 | 13 | 14 | (p<0,01) | ||||||||
| AV-2D-NDO | No infeción | 12 | 0 | 12 | 100(78,5-100) | 92,3(66,7-98,6) | 93,3(70,2-98,6) | 100(75,7-100) | 96,3(81,7-99,3) | 0,92 | 0 | 93,1 |
| Infección | 1 | 14 | 15 | (p<0,01) | ||||||||
| AS-1D-NDO | No infección | 10 | 7 | 17 | 50(26-73,2) | 76,939,7-89,2) | 70(39,7-89,2) | 58,8(36-78,4) | 63(44,2-78,5) | 0,36 | 40,3 | 69,2 |
| Infección | 3 | 7 | 10 | (p=0,053) | ||||||||
| AS-2D-NDO | No infección | 12 | 9 | 21 | 35,7(16,3-61,2) | 92,3(66,7-98,6) | 83,3(43,6-97) | 57,1(36,5-75,5) | 63(44,2-78,5) | 0,29 | 41,9 | 82,8 |
| Infección | 1 | 5 | 6 | (p=0,094) | ||||||||
Δ%: porcentaje de variación; AS-1D: análisis semicuantitativo en el protocolo de un día; AS-2D: análisis semicuantitativo en el protocolo de 2 días; AV-1D: análisis visual en el protocolo de un día; AV-2D: análisis visual en el protocolo de 2 días; CK: coeficiente kappa de Cohen; E: especificidad; IC: intervalo de confianza; n: número de pacientes; NDO: grupo sin dispositivo ortopédico; P–: probabilidad post-test negativa; P: precisión; P+ probabilidad postest positiva; S: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
El AS se llevó a cabo en todos los pacientes, utilizando una Δ%≥10% como valor de corte. La tabla 2 muestra el número de pacientes con y sin infección en el AS, en relación con el diagnóstico definitivo con los protocolos de 1D y 2D.
En el grupo DO la tabla 3 muestra los resultados estadísticos del AS-1D y del AS-2D respecto al diagnóstico definitivo. Los mejores resultados correspondieron con el AS-1D, con una S y un VPN del 100%. Además, en el AS-1D y el AS-2D detectamos un acuerdo moderado y leve, con valores de CK de 0,54 y 0,21, respectivamente.
Por otra parte, la tabla 4 muestra los resultados del AS respecto al diagnóstico definitivo en los grupos NDO en 1D y 2D, apreciándose diferencias estadísticamente significativas en ambos protocolos con un mismo valor elevado del CK. Todos los resultados del análisis estadístico del AS fueron inferiores a los del AV.
Además, con el fin de encontrar el mejor valor de corte del Δ% que pudiera pronosticar la infección ósea, se calcularon múltiples valores de corte de dicho parámetro para el índice L/F de ambos protocolos.
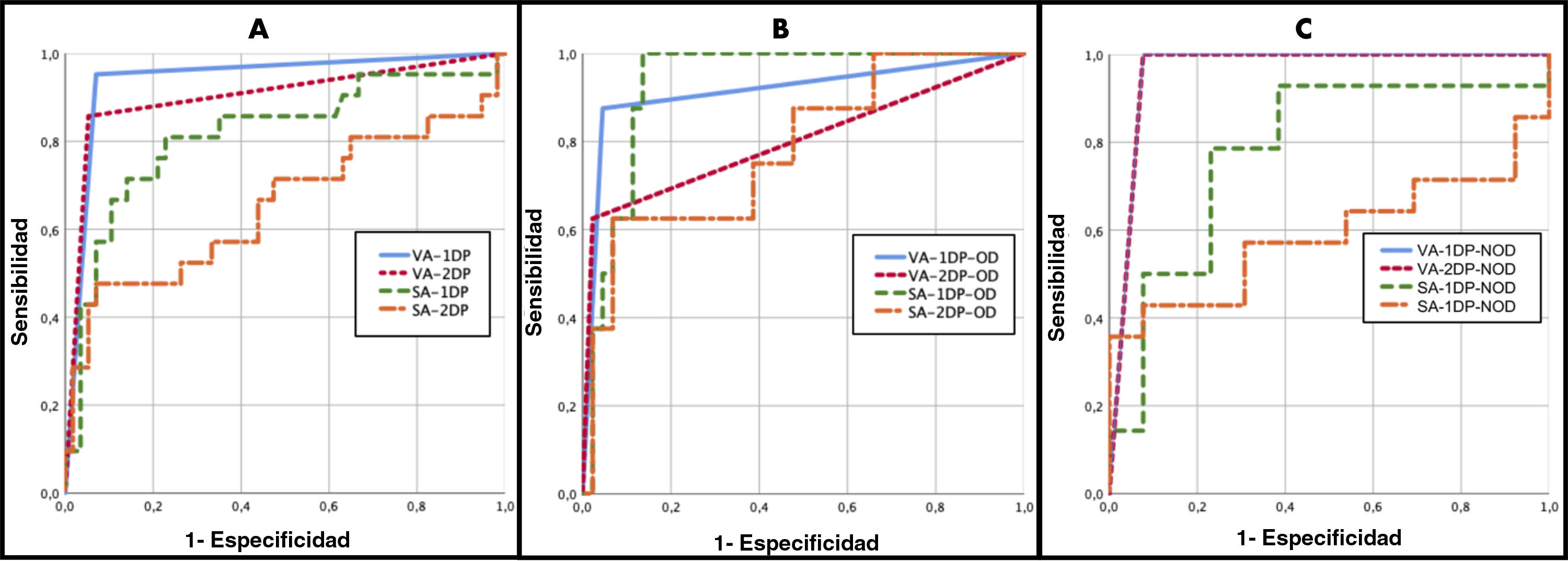
Análisis de eficacia diagnóstica (curvas ROC)A continuación se llevó a cabo el análisis ROC para ambos protocolos y los valores relativos de la p constituyen el resultado del ROC frente a un valor de corte de 0,5. La fig. 5 muestra dichas curvas ROC, en las que puede observarse una mayor área bajo la curva (AUC) con el protocolo 1D, tanto para el AV (AUC=0,942; p<0,01;) como para el AS (AUC=0,815; p<0,01) (fig. 5A). La tabla 5 muestra los detalles de las curvas ROC para los resultados del AV y el AS con ambos protocolos.
Análisis ROC para ambos protocolos en todos los pacientes (A), en el grupo con DO (B) y en el grupo NDO (C). AV-1D: análisis visual en el protocolo de un día; AV-2D: análisis visual en el protocolo de 2 días; AS-1D: análisis semicuantitativo en el protocolo de un día; AS-2D: análisis semicuantitativo en el protocolo de 2 días; grupo DO: con dispositivo ortopédico; grupo NDO: sin dispositivo ortopédico.
Resultados de las curvas ROC para el análisis visual y semicuantitativo con ambos protocolos en todos los pacientes y por separado en los grupos de pacientes con y sin dispositivo ortopédico
| Todos los pacientes | Grupo con dispositivo ortopédico | Grupo sin dispositivo ortopédico | |||||||
|---|---|---|---|---|---|---|---|---|---|
| AUC | (IC 95%) | p | AUC | (IC 95%) | p | AUC | (IC 95%) | p | |
| AV-1D | 0,942 | (0,878-1) | p<0,01 | 0,914 | (0,775-1) | p<0,01 | 0,962 | (0,875-1) | p<0,01 |
| AV-2D | 0,906 | (0,815-0,996) | p<0,01 | 0,801 | (0,590-1) | p<0,01 | 0,962 | (0,875-1) | p<0,01 |
| AS-1D | 0,815 | (0,699-0,931) | p<0,01 | 0,929 | (0,860-0,998) | p<0,01 | 0,780 | (0,594-0,967) | p<0,013 |
| AS-2D | 0,659 | (0,506-0,812) | p<0,01 | 0,773 | (0,585-0,961) | p<0,015 | 0,588 | (0,360-0,816) | p<0,438 |
AUC: área bajo la curva; AS-1D: análisis semicuantitativo en el protocolo de un día; AS-2D: análisis semicuantitativo en el protocolo de 2 días; AV-1D: análisis visual en el protocolo de un día; AV-2D: análisis visual en el protocolo de 2 días; IC: intervalo de confianza.
Comparando los resultados de las curvas ROC en el grupo DO con ambos protocolos (fig. 5B) se observa una mejor AUC con diferencias estadísticamente significativas en el AV-1D (AUC=0,914; p<0,01). De forma similar, el AS-1D tuvo una mayor AUC, estadísticamente significativa (AUC=0,929; p<0,01).
Además, también comparamos los resultados de las curvas ROC en el grupo NDO para ambos protocolos (fig. 5C). En el AV observamos los mismos resultados para los 2 protocolos 1D y 2D (AUC=0,875; p>0,01), pero en relación con el AS el protocolo 1D obtuvo mejores resultados que el AS-2D (AUC=0,780; p=0,013). La tabla 5 muestra también los detalles de las curvas ROC para el AV y el AS de los grupos DO y NDO con ambos protocolos.
DiscusiónLa gammagrafía ósea puede ser de utilidad para el diagnóstico preciso de osteomielitis en el hueso sin enfermedad subyacente. Las alteraciones visibles reflejan la velocidad de neoformación ósea en general, no específicamente de infección. Consecuentemente, la enfermedad previa existente como fracturas, dispositivos ortopédicos e infección de partes blandas adyacentes disminuyen la especificidad de las imágenes4,5. Estas circunstancias proporcionan resultados falsos positivos y disminuyen la especificidad de la gammagrafía ósea5. Algunos estudios6–9 se han centrado en el valor predictivo negativo de la gammagrafía ósea en 3 fases. Si dicha gammagrafía era negativa, se excluía la infección y ya no se realizaba la gammagrafía con leucocitos marcados. Utilizando este algoritmo se ha observado una sensibilidad del 80%, con una especificidad del 99,5%10.
Sin embargo, en una estructura ósea previamente manipulada y con sospecha de infección, una opción habitual en medicina nuclear es la realización de una GLM, con la evaluación secuencial de las imágenes mediante su AV. Sin embargo, también puede llevarse a cabo un AS adicional, debido a su potencial valor añadido en aquellos casos dudosos, siendo un complemento para diferenciar entre infección e inflamación óseas.
Análisis visualEl método «convencional» propuesto por la EANM tras la reinyección de los leucocitos autólogos marcados consiste en la adquisición de imágenes planares a los 30min, 4h y 24h. De este modo, el proceso completo puede implicar 2 días de duración y, obviamente, ello implica una molestia para el paciente. Por lo general, las imágenes precoces de los 30min se adquieren para proporcionar un mapa precoz de la distribución de la médula ósea, pero no son estrictamente necesarias16. Debe considerarse como una imagen cualitativa y no se considera para su análisis cuantitativo, en comparación con las imágenes retardadas a las 4h y tardías a las 24h12. Además, puede realizarse una adquisición híbrida SPECT/TC para aumentar la precisión diagnóstica. En otras enfermedades está bien establecido que la adición de la SPECT/TC a la imagen planar conlleva una mayor precisión diagnóstica por el aumento de la resolución y por la información morfológica añadida10, con una precisión global que varía entre el 88% y el 98%12. Según las directrices de la EANM, si se considera oportuno, la SPECT (o la SPECT/TC) deben realizarse en las imágenes retardadas y tardías. Lamentablemente, no todos los pacientes de este estudio fueron sometidos a una SPECT/TC, aunque ello no constituye el objetivo principal de este estudio.
En el caso de una GLM planar positiva a las 3-4h, resulta vital obtener imágenes más tardías (a las 7-8h1 o a las 20-24h) en el protocolo de adquisición, para mejorar su rendimiento diagnóstico y para establecer el diagnóstico diferencial entre infección e inflamación.
Glaudemans et al. en 2013 sugirieron la importancia de utilizar un protocolo de adquisición doble con imágenes a las 4h y 20-24h. Con el uso de este protocolo en 217 pacientes se obtuvo una S del 85,1% y una E del 97,1%17 en el AV. Al año siguiente Erba et al.16 también realizaron imágenes a las 4 y 20-24h con TDCA en 105 pacientes, obteniendo una S del 94% y un E del 100%. En nuestra experiencia de 2018, comparamos el protocolo de «2 días» con el de «un día», obteniendo resultados de precisión del 96,4% y 98,7%, respectivamente, mostrando la equivalencia diagnóstica de ambos protocolos1. En ese estudio también confirmamos que con ambos protocolos 1D y 2D se obtenían resultados similares, si bien el protocolo de 1D acortaba la exploración y era más cómodo para el paciente.
Por otra parte, el radiotrazador sufre un decay, lo cual puede inducir a errores de interpretación en el AV y el AS, con la consecuente disminución de la E. En nuestro estudio hemos intentado resolver este problema aplicando el TDCA en todas las imágenes planares de la GLM. Al compensar el decay radiactivo con el aumento en el tiempo de adquisición, puede compararse directamente la actividad en las imágenes retardadas y tardías. Existen pocos estudios en la literatura que han empleado el TDCA en las imágenes tardías de la GLM1,13,16,17. Todos estos estudios proporcionan mejores resultados que la utilización de una adquisición a tiempo fijo en las imágenes planares de la GLM, porque el TDCA permite diferenciar entre infección e inflamación. Por ejemplo, Glaudemans et al. observaron una precisión del 94,5% utilizando el TDCA en el protocolo de 2 días10. De forma similar, nuestro equipo en 2018 utilizó esta metodología obteniendo muy buenos resultados1. En este estudio hemos obtenido resultados de precisión similares a los descritos más arriba utilizando el TDCA e imágenes planares retardadas en los protocolos de 1D y 2D.
Además, la mayoría de estudios previos han utilizado exploraciones combinadas, como la GLM con la gammagrafía ósea, o la GLM con la gammagrafía de médula ósea18–20, con una mayor duración en el proceso de diagnóstico y mayor radiación para el paciente. En nuestro estudio solamente fue necesaria una única exploración (GLM) para obtener resultados precisos.
Respecto a las posibles diferencias en pacientes con y sin dispositivos ortopédicos, según el metaanálisis realizado por Verbene et al.21, se obtuvo una S y E conjuntas estimadas del 88% y 77% en el AV de la GLM. En nuestro estudio los resultados en el grupo DO obtuvieron una mayor E (95,5% en el protocolo 1D y 2D), con una P+elevada del 95,2% y 93,4%, así como una precisión del 94,2% y 90,4%, para 1D y 2D, respectivamente.
Por otra parte, Glaudemans et al.17 estudiaron a 83 pacientes sin dispositivo ortopédico, obteniendo una S del 85% y una E del 100%, respectivamente. Nuestros resultados de S, E y P obtenidos con ambos protocolos en el grupo NDO fueron similares a los primeros, destacando nuestros valores de S y E (por este motivo la GLM puede ser útil como prueba de cribado para descartar infección en este grupo de pacientes).
Análisis semicuantitativoPelosi et al. llevaron a cabo un AS en pacientes con artroplastia total de cadera o rodilla sintomática, utilizando la cresta ilíaca izquierda como tejido de referencia (incluso cuando la prótesis se localizó en este lado)11. Los autores sugirieron algunos inconvenientes asociados a este método de interpretación, como que las imágenes debían incluir siempre la cresta ilíaca, lo que conlleva un aumento en el tiempo de exploración. Habitualmente, el dibujo de las ROI de la lesión y del tejido de referencia es dependiente del operador. Además, la selección de la localización de referencia puede influir significativamente sobre los resultados. Además, se decidió determinar arbitrariamente un umbral del 10% debido a que todavía no existen estudios que hayan proporcionado una definición de umbral para el aumento de la captación con el tiempo, y que debería aplicarse para considerar a un paciente positivo para la infección. Dicho umbral puede verse significativamente afectado por varios parámetros como son el tipo de infección (aguda vs. crónica), el tipo de enfermedad (grupos de indicación) y el tipo de organismo infeccioso11.
Aunque existen muy pocos artículos sobre este tema Glaudemans et al.17 plantearon la hipótesis de que el AS puede ser útil para interpretar aquellas GLM dudosas; sin embargo, los autores concluyeron que su aplicación no mejoraba la interpretación visual, ya que obtenían mejores resultados y una mayor precisión diagnóstica con el AV respecto al AS. Únicamente se observó una mayor S con el AS respecto al AV en aquellas GLM dudosas (87,5% vs. 82%), pero con una menor E (89,5 vs. 94,9%). Por otra parte, Erba et al.16 clasificaron las imágenes de la GLM utilizando diferentes umbrales en el porcentaje de variación con el tiempo del índice L/F: ≤5, ≤10, ≤20 y ≤25%. En el AS se obtuvieron los mejores resultados de precisión (82% en el TCDA), S y VPN cuando se consideró un estudio positivo para infección con cualquier incremento en el porcentaje de radiactividad en la lesión sospechosa a lo largo del tiempo, con adquisiciones a tiempo fijo y corregidas por TDCA. Por el contrario, los valores de E y VPP fueron directamente proporcionales al valor del umbral. De esta forma, el índice de concordancia entre el análisis visual y semicuantitativo fue mejor para cualquier incremento en el porcentaje de radiactividad a lo largo del tiempo, considerando a todos los pacientes conjuntamente, así como separadamente pacientes con osteomielitis o prótesis infectada.
En nuestro estudio, después de analizar todos los posibles valores de corte del Δ% en el índice L/F para los protocolos 1D y 2D se quiso determinar qué umbral podría predecir la infección ósea. El mejor valor de Δ% para diagnosticar una infección fue del 9% para el protocolo 1D y del 8% para el 2D. Además, comparando ambos protocolos en relación con la utilidad del AS, obtuvimos mejores resultados en el protocolo 1D (especialmente en la infección de prótesis articular). Simultáneamente, el protocolo 1D obtuvo una P+superior a la del 2D (78% vs. 66%), lo cual implica una mayor posibilidad de detectar una infección en el 1D, con un AS positivo en las imágenes de la GLM.
También quisimos analizar posibles diferencias existentes en pacientes con dispositivos ortopédicos. Revisando la literatura Rubello et al., en 2008, realizaron un estudio de gammagrafía con anticuerpos antigranulocitos en prótesis de cadera infectada. En el AV los autores describieron una S del 94% y una E del 83%, mientras que con el AS la S se mantuvo en un 94% y la E aumentó ligeramente hasta el 90%22. Por el contrario, Erba et al. obtuvieron valores de S y E de alrededor del 93% y el 68%, respectivamente con el AS16.
Cuando la prevalencia de infección es baja (como sucede en la infección periprotésica), una exploración diagnóstica negativa puede descartarla con un elevado VPN. Por el contrario, un resultado positivo no va a confirmar el diagnóstico, debido a su bajo VPP. Por lo tanto, teniendo en cuenta nuestros resultados de AS en el grupo de 1D con DO (Δ%=10), podemos considerarla como una prueba de cribado debido a su elevado valor de S y de VPN (ambos del 100%), presentando además una p=0%, lo cual significa una alta posibilidad de enfermedad no infecciosa cuando hay un AS negativo. Los resultados en el protocolo 2D fueron peores, por lo que no constituye una prueba de cribado para descartar la infección ósea con fiabilidad. En relación con nuestro grupo NDO, el AS no mostró ningún resultado significativo.
Limitaciones del estudioDestacamos la heterogeneidad existente en las localizaciones con sospecha de infección. Quizás el TDCA pueda tener una influencia negativa sobre el AV, considerando el hecho de que debemos aplicar un tiempo de adquisición de 20min en lugar de los correspondientes 40min en las imágenes de las 24h, con el fin de evitar posibles artefactos de movimiento e incomodidad para el paciente. Además, en el AS hemos encontrado posibles deficiencias como la delimitación de ROI irregulares en lugar de una forma predefinida. Ello podría haber influido en los resultados finales del índice L/F. También podría afectar el hecho de que este análisis lo realizó más de un observador, lo cual podría introducir una variabilidad interobservador.
ConclusionesEste estudio demostró que el AV en la GLM con TDCA e imágenes planares tardías a las 8h o 24h (mayor precisión en el protocolo 1D) facilita el diagnóstico diferencial entre infección e inflamación, con mejores resultados que el AS. Cuando el AV es dudoso el AS podría tener un valor añadido para el diagnóstico diferencial entre infección y captación inespecífica.
En relación con el AS, en el protocolo de 1D cualquier incremento en la Δ% puede considerarse positivo para infección, con un elevado VPP. Concretamente, en el grupo con DO, aplicando un valor de Δ% superior al 9%, los valores de S y de VPN son máximos. Por lo tanto, la obtención de un resultado negativo descarta la infección con una mayor P–.
Como recomendación final para conseguir un análisis óptimo en la GLM, en primer lugar es imprescindible realizar el AV (utilizando preferiblemente el protocolo de 1D) y, en caso de obtener resultados dudosos, debe llevarse a cabo el AS (especialmente para descartar la infección ósea).
Contribución de los diferentes autoresEdel Noriega-Álvarez (autor principal), Ana M. García Vicente y Ángel M. Soriano Castrejón: contribuyeron al diseño del estudio, al análisis de los datos, revisión y redacción del manuscrito.
Francisco J. Pena Pardo y Germán A. Jiménez Londoño: contribuyeron al análisis de los datos, revisión y redacción del manuscrito.
Mariano Amo-Salas: contribuyó al análisis estadístico.
Ana M. Benítez Segura, María T. Bajén Lázaro, Jaime Mora Salvadó y Cristina Gámez Cenzano: contribuyeron al análisis de los datos y a la redacción del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Grupo de trabajo de Patología Musculoesquelética (SEMNIM)/Inflammation & Infection Committee of the European Association of Nuclear Medicine (EANM).