Analizar la eficacia terapéutica, seguridad y valor pronóstico de diferentes biomarcadores de la radioembolización transarterial con esferas de itrio-90 (TARE) en pacientes con metástasis hepáticas de cáncer colorrectal.
Material y métodosEstudio prospectivo que incluye los pacientes con metástasis hepáticas de cancer colorrectal tratados con TARE entre noviembre de 2015 y junio de 2020. Se analizó la respuesta terapéutica (3 y 6 meses, criterios RECIST v1.1) mediante el cálculo de las tasas de respuesta tumoral objetiva (ORR) y de control de la enfermedad (DCR), así como la asociación de los biomarcadores con la respuesta terapéutica y la supervivencia global (SG) y libre de progresión (SLP).
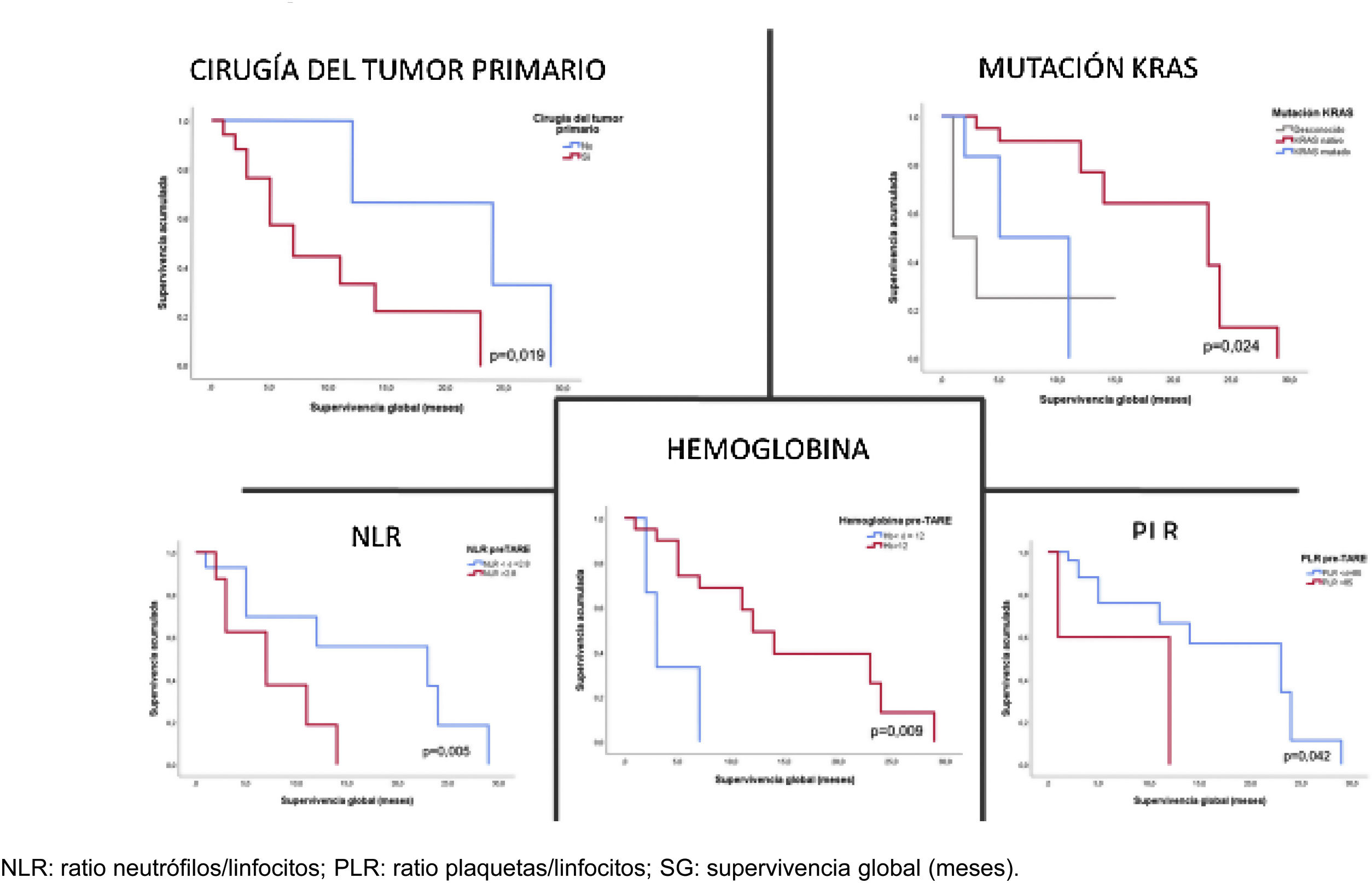
ResultadosTreinta TARE en 23 pacientes (edad media 61,61±9,13 años; 56,5% varones). La ORR a los 3 meses fue del 16,7% y el DCR del 53,3%. A los 6 meses progresaron el 80% de los pacientes. La ORR y DCR se asociaron con la edad (p=0,047), tratamiento con bevacizumab (p=0,008), hemoglobina (p=0,008), NLR (p=0,040), albúmina (p=0,012) y GPT (p=0,023) previas a la TARE, y la dosis absorbida tumoral estimada>115Gy (p=0,033). La mediana de SG fue de 12 meses (IC 95%: 4,75-19,25 meses) y de SLP 3 meses (IC 95%: 2,41-3,59 meses). La SG se asoció con la cirugía del tumor primario (p=0,019), mutación KRAS (p=0,024), hemoglobina (p=0,009), NLR (p=0,005) y PLR (p=0,042) previos a la TARE.
ConclusiónLos biomarcadores con capacidad para predecir el pronóstico y respuesta terapéutica a la TARE incluyen desde parámetros bioquímicos a factores relacionados con la dosimetría tumoral estimada.
To determine the therapeutic effectiveness and safety of transarterial radioembolization (TARE) with Yttrium-90 in patients with colorectal cancer (CRC) liver metastases and to evaluate the prognostic value of different biomarkers.
Material and methodsThis prospective longitudinal study enrolled consecutive patients with CRC liver metastases treated with TARE between November 2015 and june 2020. The therapeutic response at three and six months (RECIST1.1 criteria) and the relationship of biomarkers with therapeutic response, by calculating objective tumor response rates (ORR) and disease control (DCR), and overall survival (OS) and progression-free (PFS).
ResultsThirty TAREs were performed in 23 patients (mean age, 61,61±9,13 years; 56,5% male). At three months, the objective response rate (ORR) was 16,7% and the disease control rate (DCR) 53,3%. At six months, the disease progressed in 80%. The ORR and DCR were significantly associated with age at diagnosis (P=.047), previous bevacizumab treatment (P=.008), pre-TARE haemoglobin (P=.008), NLR (P=.040), pre-TARE albumin (P=.012), pre-TARE ALT (P=.023) and tumour-absorbed dose>115Gy (P=.033). Median overall survival (OS) was 12 months (95% CI, 4.75-19.25 months) and median progression-free survival (PFS) 3 months (95% CI, 2.41-3.59). OS was significantly associated with primary tumour resection (P=.019), KRAS mutation (HR: 5.15; P=.024), pre-TARE haemoglobin (HR: .50; p=.009), pre-TARE NLR (HR: 1.65; P=.005) and PLR (HR: 1.01; P=.042).
ConclusionTARE prognosis and therapeutic response were predicted by different biomarkers, ranging from biochemical parameters to tumour dosimetrics.
El carcinoma colorrectal (CCR) constituye la segunda causa de cáncer y la cuarta causa de mortalidad por cáncer en el mundo occidental1. Alrededor del 20% de los pacientes con CCR tendrán metástasis en el momento del diagnóstico, siendo el hígado el lugar donde metastatiza con mayor frecuencia. La afectación metastásica hepática se considera responsable de la mayoría de las muertes en los pacientes con CCR metastásico2,3, asociándose con una tasa de supervivencia a los 5 años de tan solo el 11,7%4.
El único tratamiento curativo de las metástasis hepáticas del CCR es la resección quirúrgica. Las técnicas que han mostrado una asociación con una mayor supervivencia incluyen la metastasectomía hepática y la ablación térmica5, aunque solamente el 20-30% de los casos se consideran candidatos a este tipo de terapias6,7. El resto de los casos se consideran irresecables o no tratables bajo las técnicas anteriores, debido a múltiples factores como la localización de estas, la proximidad a estructuras críticas, el tamaño tumoral, el número de lesiones, el volumen hepático residual insuficiente o la presencia enfermedad extrahepática8. En este grupo de pacientes la implementación de los comités multidisciplinares ha sido uno de los aspectos más relevantes a la hora de indicar la terapia más adecuada9.
En las últimas 2 décadas se han desarrollado las terapias locales para el tratamiento de la enfermedad hepática metastásica, que están irrumpiendo como una opción de tratamiento, tanto de rescate, en el proceso de disminución de la enfermedad para permitir la resección curativa, como tratamiento paliativo de las metástasis hepáticas no resecables. Este es el caso de la terapia de radioembolización transarterial, más conocida por sus siglas en inglés TARE (transarterial radioembolization), que ha demostrado resultados prometedores como herramienta en el manejo de metástasis hepáticas no resecables del CCR10. Esta terapia está indicada en pacientes quimiorrefractarios, con enfermedad hepática dominante, de forma exclusiva o en combinación con quimioterapia, en aquellos pacientes que desean evitar el tratamiento con quimioterapia sistémica o como lobectomía rádica para hipertrofia de remanente hepático en pacientes potencialmente resecables11.
La TARE es una terapia local para el tratamiento de las metástasis hepáticas del CCR quimiorrefractarias cada vez más utilizada, lo que ha llevado a su inclusión en las guías de práctica clínica de la Sociedad Europea de Oncología Médica12. La radioembolización se basa en el hecho de que el suministro de sangre a los tumores hepáticos es diferente del parénquima hepático normal. Los tumores hepáticos primarios y metastásicos reciben la mayor parte del aporte sanguíneo de las arterias hepáticas, a diferencia del parénquima hepático normal que es predominantemente portal. Como consecuencia de ello, la inyección de microesferas radiactivas en la arteria hepática que irriga las lesiones metastásicas condiciona que la mayor proporción de microesferas queden alojadas en la microvasculatura tumoral y, por tanto, sea el tejido tumoral quien recibe una mayor dosis de radiación respecto al tejido no tumoral13,14. Esto también se debe en parte al tamaño de las microesferas, suficientemente pequeño como para acceder a los vasos tumorales, pero demasiado grande como para atravesar el lecho capilar y llegar a la circulación venosa. El daño tisular generado por la radiación beta del 90Y es la causa fundamental tanto de la eficacia del tratamiento como de su toxicidad14.
Los resultados obtenidos en los diferentes estudios que evalúan la TARE muestran una supervivencia global (SG) que varía entre 8 y 13 meses14,15. Presenta una serie de ventajas derivadas de las propiedades físicas del radionúclido, como son su corta vida media y su baja profundidad de penetración media de unos pocos milímetros que permite que la radiación sea atrapada dentro del lecho tumoral, respetando el parénquima circundante sano. Los datos establecidos con respecto a la seguridad a largo plazo son limitados, aunque los estudios previos han descrito el daño biliar como una posible complicación.
La selección de los pacientes óptimos para el tratamiento con TARE es clave, ya que condiciona la obtención de los mejores resultados posibles con el mínimo coste de atención médica, al evitar terapias no beneficiosas. Es por ello, que estudios previos han centrado su investigación en la identificación de estos parámetros o biomarcadores que guíen la selección del paciente candidato a TARE, con resultados controvertidos10.
El objetivo del presente estudio ha sido analizar la eficacia terapéutica y seguridad de la radioembolización transarterial con esferas de itrio-90 (TARE) en pacientes con metástasis hepáticas de cáncer colorrectal (CCR) y estudiar el valor pronóstico de diferentes biomarcadores.
Material y métodosPacientesEstudio observacional, longitudinal y prospectivo que incluye a 23 pacientes con metástasis hepáticas de CCR, a los que se les realizó un total de 30 tratamientos mediante TARE, de forma consecutiva, entre noviembre de 2015 y junio de 2020.
En todos los casos los pacientes fueron valorados y propuestos como candidatos para la TARE por un equipo multidisciplinar formado por médicos oncólogos, radiólogos, medicina nuclear y cirujanos especializados en cirugía hepatobiliar.
Los criterios de inclusión fueron: edad>18años, enfermedad hepática metastásica diagnosticada por técnicas de imagen (TC o RM), Eastern Cooperative Oncology Group (ECOG) entre 0 y 1, enfermedad metastásica dominante hepática, rechazo de la cirugía y capacidad para dar consentimiento. Todos los pacientes habían sido sometidos a tratamiento para el CCR y la enfermedad metastásica, incluyendo: cirugía del tumor primario, quimioterapia sistémica, quimioembolización transarterial y/o técnicas de ablación local.
Los criterios de exclusión fueron: tratamiento previo con irradiación externa del hígado, presencia de ascitis o insuficiencia hepática (bilirrubina sérica por encima de 2mg/dl), shunt hepatopulmonar>20% o dosis absorbida en pulmón superior a 30Gy, anomalías vasculares no subsidiarias de embolización que puedan condicionar la migración de partículas cargadas con 90Y a otras localizaciones (vesícula, estómago, etc.) y volumen tumoral calculado por TC o RM>70% del volumen hepático total. Antes de planificar el procedimiento se constató, en todos los sujetos, mediante analítica en los 30 días previos a la TARE, una función hepática conservada (límite máximo de aminotransferasa de aspartato [AST]/alanina aminotransferasa [ALT] hasta 5 veces el valor máximo de laboratorio y una bilirrubina≤2mg/dl). El estudio se llevó a cabo de conformidad con la Declaración de Helsinki, y todos los pacientes firmaron su consentimiento informado.
ProcedimientoUna vez que el paciente ha sido evaluado por un equipo multidisciplinar y propuesto como candidato a TARE, se llevó a cabo la planificación precisa del procedimiento junto con el Servicio de Radiología intervencionista, con el objetivo de realizar una administración segura y eficaz del tratamiento. Dicho procedimiento constó, en todos los casos, de los siguientes pasos:
- -
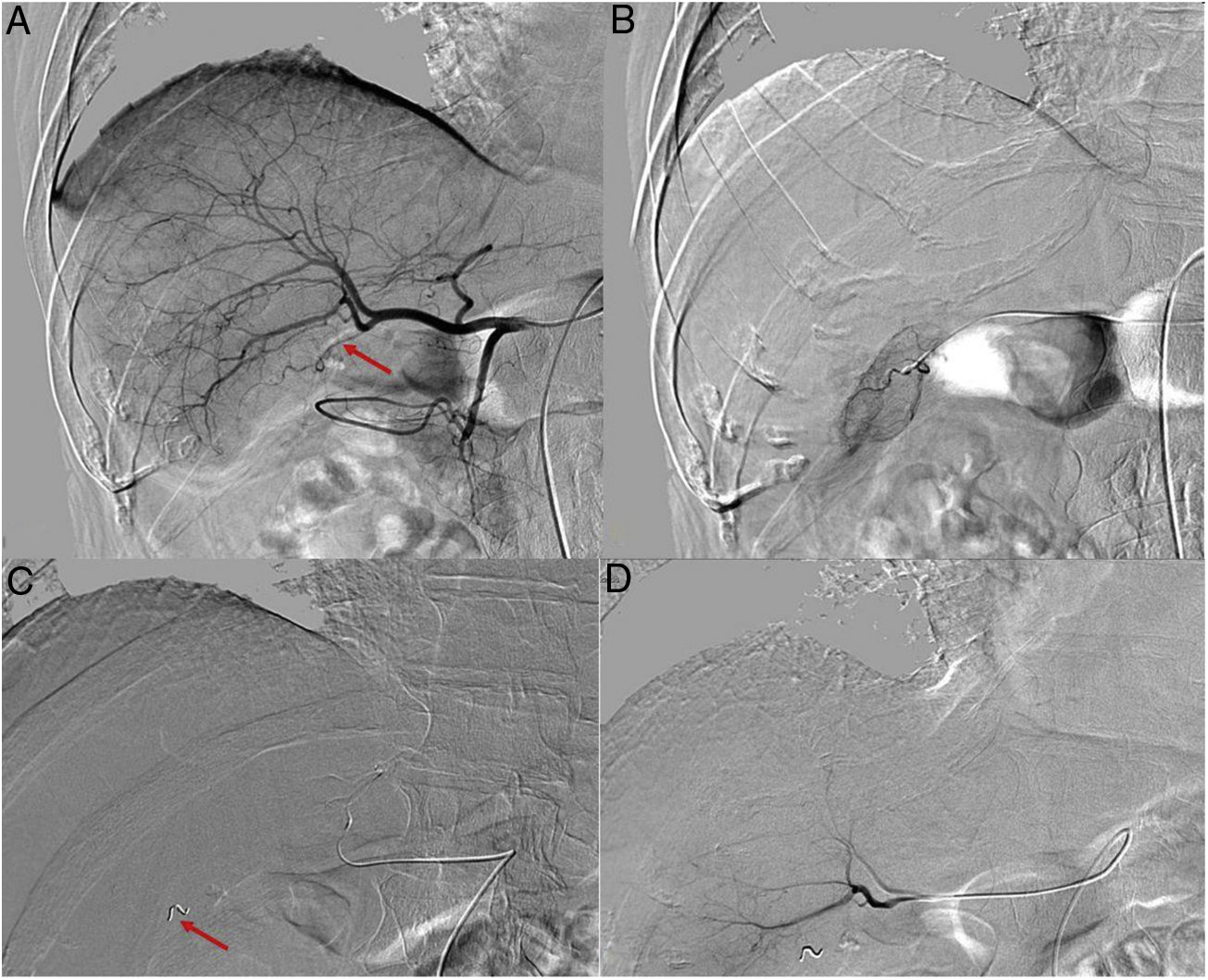
En primer lugar 2-3 semanas antes de la TARE, y previa valoración en el estudio TC del árbol arterial, se realizó la arteriografía hepática para evaluar la anatomía arterial y definir la vascularización hepática y tumoral, y en caso de ser preciso, embolizar los vasos arteriales que pudieran condicionar que las esferas cargadas de 90Y alcanzaran órganos extrahepáticos (fundamentalmente la vesícula biliar y la región gástrica antropilórica) (fig. 1).
Figura 1.(A) Arteriografía desde la arteria hepática común, donde se observa la dependencia de la arteria cística (flecha) que nace del origen de la arteria que nutre las metástasis hepáticas a tratar en el lóbulo hepático derecho. Canalización selectiva de la arteria cística (B) y posterior colocación de un coil (flecha) (C). Arteriografía hepática (D) tras la embolización de la arteria cística, que permite evitar su irradiación.
(0.24MB). - -
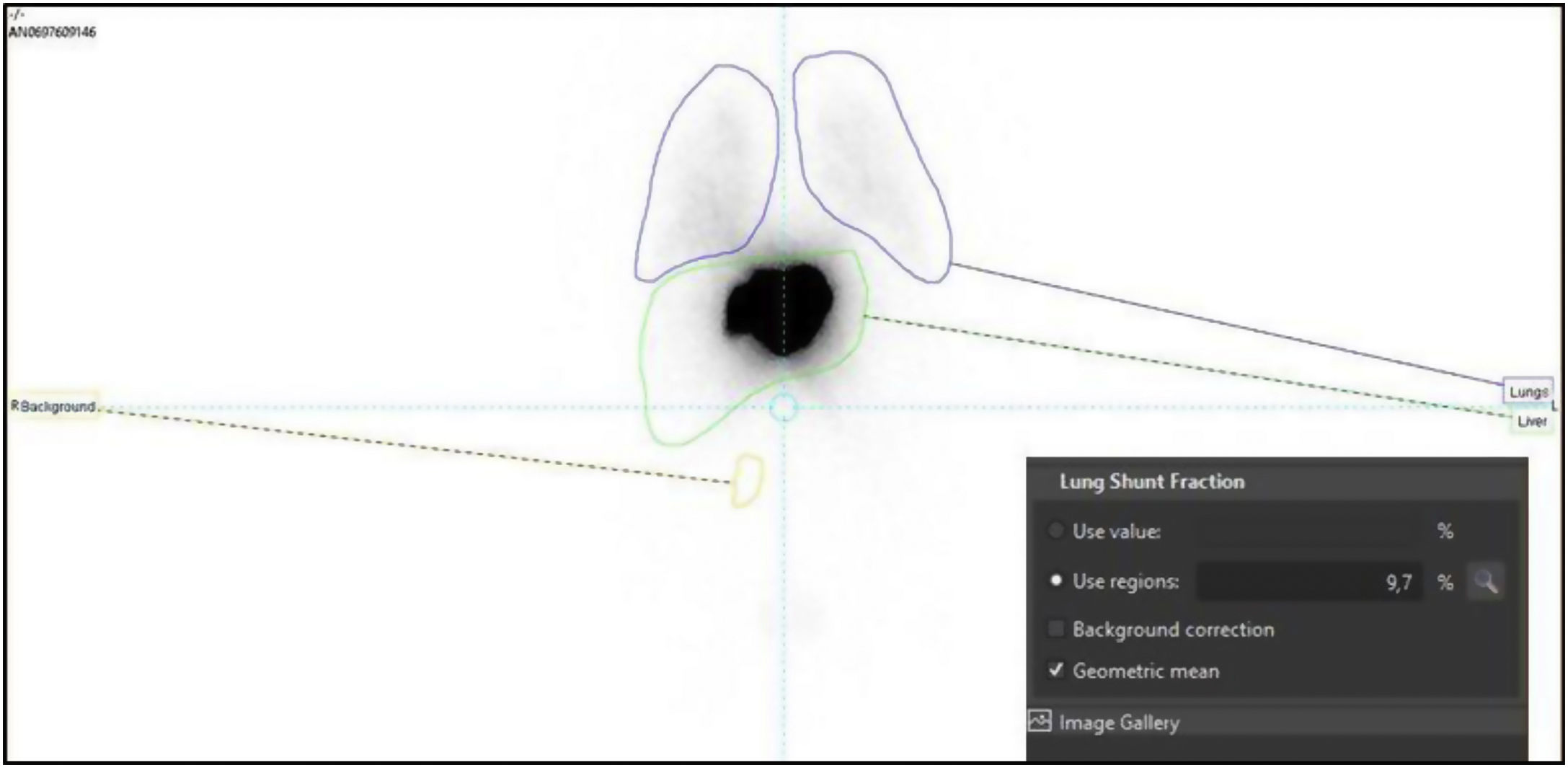
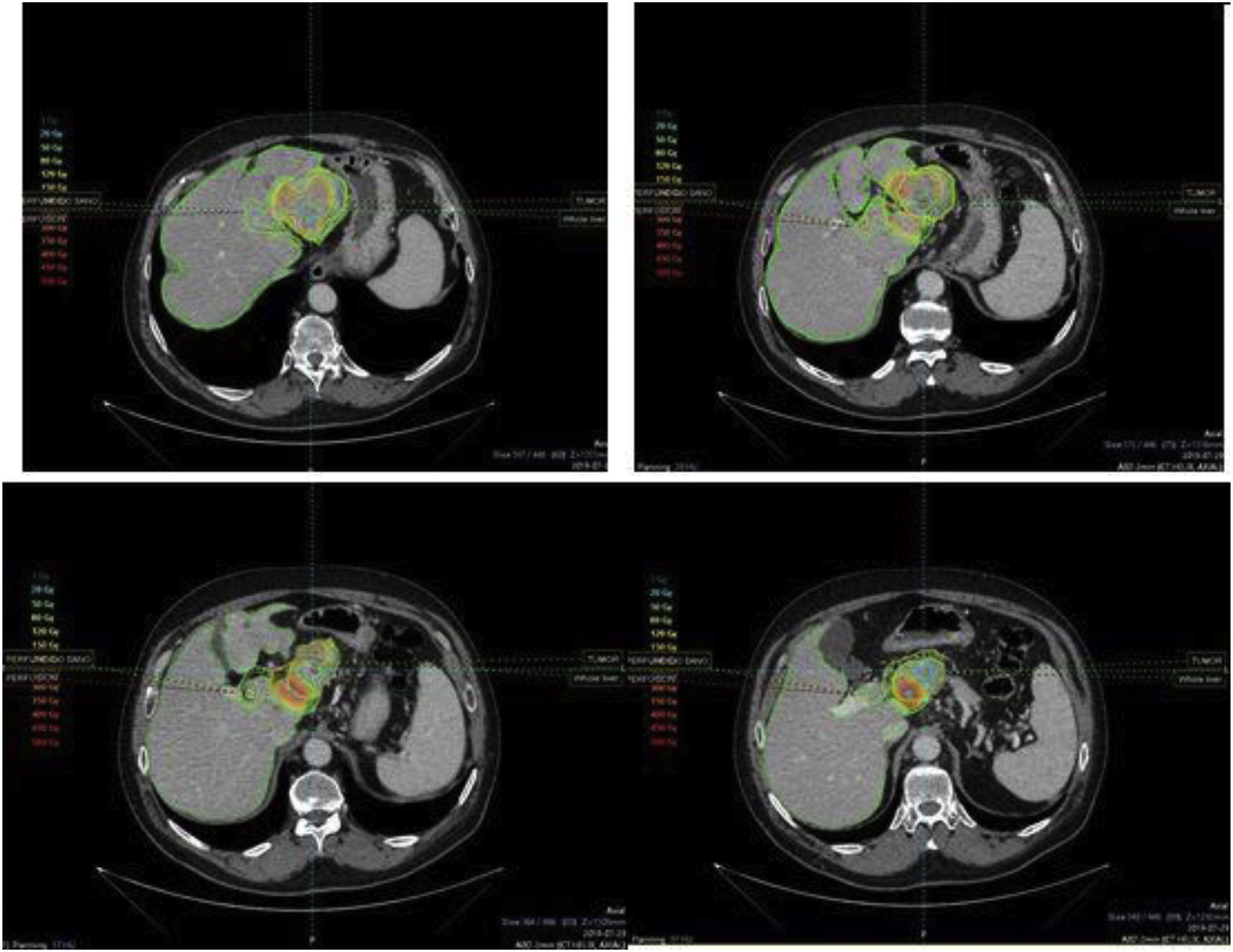
A continuación, en el mismo procedimiento, se inyectaron 148MBq (4mCi) de 99mTc-macroagregados de albúmina (99mTc-MAA) a través de arterias seleccionadas para la administración del tratamiento, obteniendo imágenes gammagráficas de cuerpo completo y SPECT/TC de abdomen en las 2horas posteriores a la inyección para evitar la aparición de tecnecio libre. Se utilizaron las imágenes gammagráficas planares y SPECT/TC para calcular el porcentaje de shunt hepatopulmonar y valorar la distribución intra y extrahepática de las partículas, para detectar comunicaciones arteriales extrahepáticas no identificadas en la arteriografía hepática, evaluar la perfusión del volumen hepático a tratar (objetivo), calcular la relación tumoral/no tumoral (TNR) y para la estimación de la dosis absorbida por el pulmón (fig. 2). La dosis de esferas cargadas de 90Y se estimó para alcanzar una dosis absorbida por el hígado a tratar ≥120Gy. La dosimetría personalizada ha sido calculada mediante el software Simplicity® (Mirada Medical) (fig. 3). Se consideró un shunt hepatopulmonar>20% o dosis absorbida en el pulmón>30Gy (50Gy si la dosis se acumula en tratamientos consecutivos) como contraindicación relativa para realizar el procedimiento por riesgo de neumonitis rádica. Puede ser necesario repetir el procedimiento para la planificación de tratamientos posteriores, estimar la dosis acumulada a nivel pulmonar o para reevaluar la derivación gastrointestinal. Los pacientes fueron evaluados y dados de alta después de 24-48horas con indicación de analgesia basada en régimen alterno de paracetamol y fármacos antiinflamartorios no esteroideos condicional a la presencia de dolor. En los casos de pacientes con afectación bilobar fueron planificados para realizar tratamiento de manera secuencial, tratando en primer lugar el lóbulo con mayor carga tumoral.
- -
Posteriormente, a los 14-21 días, se realizó la TARE con microesferas de vidrio cargadas con 90Y (Therasphere®; Boston Scientific. Massachusetts, EE. UU.). La dosimetría se basó en las características de los tumores de acuerdo con las directrices institucionales de seguridad radiológica. El enfoque del tratamiento podía ser lobar o selectivo. Los pacientes con enfermedad unilobar se sometieron a una sola TARE, y aquellos con enfermedad bilobar se sometieron a 2 sesiones de TARE separadas por 2 semanas. Por lo general, los pacientes fueron dados de alta después de 24-48horas.
- -
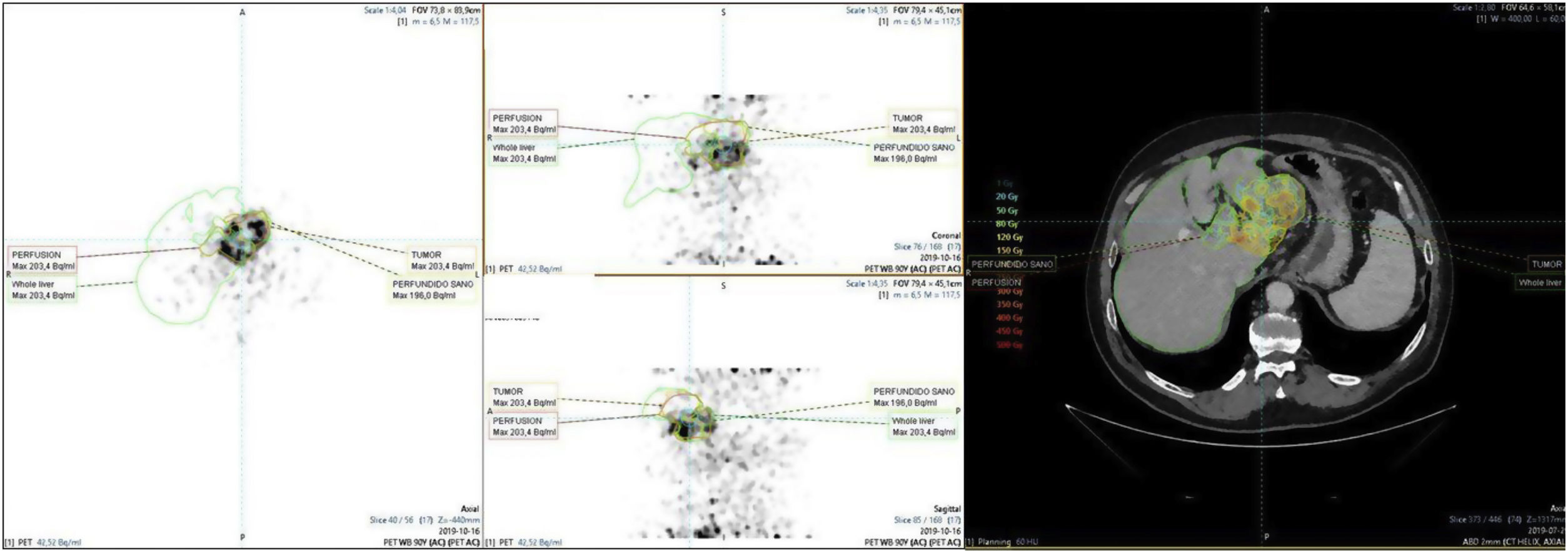
Finalmente, se realizó en todos los casos un estudio PET/TC (90Y PET/TC) que permite visualizar la distribución de las esferas cargadas con 90Y sobre el volumen hepático a tartar y descartar la presencia de focos extrahepáticos (fig. 4).
Todos los pacientes fueron evaluados desde el inicio del tratamiento con la TARE hasta la fecha de su última revisión clínica o fallecimiento. Los antecedentes clínicos y los datos de laboratorio previos a la TARE se recopilaron a partir del registro electrónico de la historia de salud de los pacientes. El seguimiento en consulta se llevó a cabo a los 30 días posteriores a completar la TARE, incluyendo TC y analítica completa con perfil hepático. Posteriormente, se evaluó al paciente en consulta a los 3, 6 y 12 meses. Se estudiaron los niveles séricos de AST, ALT, fosfatasa alcalina, bilirrubina total y albúmina, hemograma completo que permitió el cálculo de la ratio neutrófilos/linfocitos (Neutrophil to Lymphocyte Ratio [NLR]) y plaquetas/linfocitos (Platelet to Lymphocyte Ratio [PLR]) antes y después de la TARE. Las toxicidades serológicas se registraron y evaluaron utilizando los criterios terminológicos comunes para eventos adversos (CTCAE versión 5.0)16 del Programa de Evaluación de Terapia Común de cinco grados, definiendo el grado 3 como hepatotoxicidad grave (AST, ALT o fosofatasa alcalina≥5 veces superior al límite superior del rango normal o elevación de la bilirrubina total≥3 veces el límite superior).
A la hora de evaluar la respuesta del tratamiento con la TARE los criterios tradicionales de respuesta radiológica (WHO y RECIST 1.1) basados en la reducción del número y tamaño tumoral muestran una utilidad limitada17. Por ello, para valorar la respuesta a TARE emplearemos tanto los criterios RECIST 1.1 (reducción del número) como los mRECIST (reducción de la captación de contraste)18. La respuesta a la TARE puede extenderse hasta 6 meses desde su administración, por ello en el seguimiento se obtuvieron TC o RM hepáticas a los 3 y 6 meses posteriores a la TARE y se compararon con las exploraciones previas a la TARE (pre-TARE), aplicando criterios de evaluación de respuesta en tumores sólidos (RECIST) 1.1 y mRECIST18. Las pruebas de imagen radiológicas fueron revisadas por 2 radiólogos capacitados (PPM, JJCD), resolviendo las discrepancias por consenso en los casos necesarios.
Variables de eficaciaLas variables respuesta incluyeron: a) la supervivencia global (OS) definida como la supervivencia, en meses, desde la TARE hasta la última revisión clínica o fallecimiento del paciente; b) supervivencia libre de progresión (SLP) definida como el tiempo, en meses, desde la TARE hasta la evidencia de progresión de la enfermedad hepática en las técnicas de imagen; c) tasa de respuesta objetiva (Objetive Response Rate), más conocida como ORR y definida como la proporción de pacientes que logran una respuesta completa o parcial en función de los criterios de repuesta RECIST 1.1 y mRECIST y; d) la tasa de control de la enfermedad, conocida como Disease Control Rate (DCR), definida como la proporción de pacientes que logran como mejor respuesta tumoral durante el estudio una respuesta completa, parcial o estabilización de la enfermedad, en función de los criterios de repuesta RECIST 1.1 y mRECIST18.
Análisis estadísticoEn el análisis descriptivo se emplearon medidas de tendencia central (media) y dispersión (desviación estándar, rango) para las variables continuas, y la distribución de frecuencias absolutas y relativas para variables categóricas. Para la comparación de datos cuantitativos entre los 2 grupos de la ORR y DCR se utilizó la prueba de la «t» de Student para datos independientes paramétricos y la U de Mann-Whitney para los datos no paramétricos, mientras que la asociación con las variables categóricas se evaluó por medio de tablas de contingencia, aplicando la prueba de la Chi cuadrado o Fisher. Las probabilidades de OS y SLP se generaron aplicando el método de Kaplan-Meier. La regresión de Cox se utilizó para estudiar la asociación de las distintas variables independientes con la supervivencia global y libre de progresión. Los datos se procesaron para su análisis mediante el software IBM SPSS Versión 24.0 (IBM Corp, Armonk, Nueva York). El valor de p≤0,05 se consideró estadísticamente significativo.
ResultadosPoblación de estudioEl estudio incluyó 23 pacientes a los que se les realizó un total de 30 procedimientos de radioembolización con esferas cargadas de itrio-90 o TARE. La edad media fue de 61,61±9,13 años (rango de 45 a 74 años), 13 hombres y 10 mujeres. El seguimiento medio fue de 10,07±7,54 meses (rango 1,0-29,0 meses). Dieciséis pacientes (69,6%) se encontraban en estadio funcional ECOG 0. De los 30 procedimientos realizados 23 (76,7%) trataron metástasis hepáticas sincrónicas, con una carga tumoral hepática<50% en el 86,9% de los casos. El intervalo medio entre el diagnóstico del CCR y la TARE fue de 25 meses (rango de 10 a 66 meses). Dieciséis pacientes (69,6%) fueron tratados en una sola sesión de TARE, mientras que los 7 restantes (30,4%) precisaron 2 sesiones por lesiones en ambos lóbulos hepáticos. Tan solo un caso fue sometido a retratamiento. La tabla 1 muestra las características basales demográficas, clínicas y relacionadas con el tratamiento de la población de estudio.
Características demográficas, clínicas y de tratamiento de la población de estudio
| Característica | n (media±DE o %) |
|---|---|
| Edad (años) | 61,61±9,13 |
| Sexo | |
| Hombre | 13/23 (56,5) |
| Mujer | 10/23 (43,5) |
| Tiempo de seguimiento (meses) | 10,07±7,54 |
| ECOG | |
| 0 | 16 (69,6) |
| 1 | 6 (26,1) |
| 2 | 1 (4,3) |
| Enfermedad hepática síncrónica | |
| Sí | 17 (73,9) |
| No | 6 (26,1) |
| Resección del tumor primario | |
| Sí | 17 (73,9) |
| No | 6 (26,1) |
| Kras mutación | |
| Mutado | 6 (26,1) |
| Nativo | 14 (60,9) |
| Desconocido | 3 (13) |
| Tratamiento previo con QT | |
| Sí | 22/23 (95,7) |
| No | 1/23 (4,3) |
| Tratamiento previo con bevacizumab | |
| Sí | 3/23 (13) |
| No | 20/23 (87) |
| Carga hepática tumoral | |
| <25% | 11/23 (47,8) |
| 25-50% | 9/23 (39,1) |
| >50% | 3/23 (13) |
| Tiempo desde la TARE (meses) | 33,1±18,7 |
| Tipo de tratamiento | |
| Segmentectomía | 2 (8,7) |
| Unilobar | 14 (60,9) |
| Bilobar | 7 (30,4) |
| Actividad administrada de Y-90 (mCi) | 76,61±50,54 |
| Volumen perfundico (cm3) | 894,68±519,62 |
| Dosis absorbida tumoral (Gy) | 163,97±83,88 |
| TNR | 25,32±54,81 |
| Tratamiento QT post-TARE | |
| Sí | 2/23 (8,7) |
| No | 21/23 (91,3) |
QT: quimioterapia sistémica; TARE: radioembolización transarterial; TNR: ratio tumor/no tumor.
La respuesta tumoral evaluada a las 10-12 semanas posteriores a la TARE, en función de los criterios RECIST v.1.1 y mRECIST, mostraron estabilización en el 36,7% de las lesiones tratadas, respuesta parcial en el 13,3%, respuesta completa en el 3,3% y progresión de la enfermedad en el 46,7% restante. Por lo tanto, la ORR (respuesta completa o parcial) a las 12 semanas fue del 16,7% y la DCR (respuesta parcial/completa o enfermedad estabilizada) fue del 53,3%. A los 6 meses de la TARE mostraron estabilización el 20% de las lesiones tratadas, mientras que el 80% restante progresaron, no observándose respuestas parciales ni completas. Así pues, la DCR a los 6 meses fue del 20% (ver el detalle de la respuesta tumoral en la tabla 2).
Respuesta tumoral local a los 3 y 6 meses post-TARE (criterios RECIST v.1.1)
| Respuesta | 3 meses, n (%) | 6 meses, n (%) |
|---|---|---|
| RC | 1/30 (3,3) | 0 |
| RP | 4/30 (13,3) | 0 |
| EE | 11/30 (36,7) | 6/30 (20,0) |
| PE | 14/30 (46,7) | 15/30 (50,0) |
| ORR (RC+RP) | 5/30 (16,7) | 0 |
| DCR (RC+RP+EE) | 16/30 (53,3) | 6/30 (20,0) |
DCR: tasa de control de la enfermedad; EE: enfermedad estable; ORR: tasa de respuesta objetiva, PE: progresión de la enfermedad, RC: respuesta competa; RP: respuesta parcial en función de los criterios RECIST versión 1.1.
La ORR a los 3 meses, codificada como variable dicotómica (sí/no) se asoció significativamente con la edad al diagnóstico (49,50±3,54 vs. 62,76±8,66 años; p=0,047), tratamiento previo con bevacizumab (OR=0,028; p=0,009) y hemoglobina (13,96±0,84 vs. 13,87±1,39mg/dl; p=0,044) y NLR (1,17±0,52 vs. 2,70±1,99; p=0,04) previas a la TARE. La DCR a los 3 y 6 meses se asoció significativamente con: tratamiento previo con bevacizumab (p=0,019), albúmina (4,06±0,25 vs. 4,46±0,22; p=0,012), NLR (1,21±0,23 vs. 2,55±1,27; p<0,001) y ALT (25,17±14,55 vs. 30,06±12,04; p=0,023) previas a la TARE y con una dosis absorbida tumoral estimada>115Gy (OR: 2,6; p=0,033).
Factores asociados con la supervivencia (global y libre de progresión)La mediana de SG fue de 12 meses (IC del 95%: 4,75 a 19,25 meses). Las tasas de supervivencia a los 6 meses, 12 meses y 24 meses fueron del 69%, 42% y 11%, respectivamente. Quince pacientes fallecieron durante el período de estudio (65,2%). No hubo muertes en los 30 días posteriores a la TARE.
La SG se asoció significativamente en el análisis de supervivencia univariante con: la resección del tumor primario (HR: 7,89; p=0,019), mutación KRAS (HR: 5,15; p=0,024), hemoglobina (HR: 0,50; p=0,009), NLR (HR: 1,65; p=0,005) y PLR (HR: 1,01; p=0,042) previas a la TARE, así como con los niveles de bilirrubina total (HR: 2,31; p=0,004), NLR (HR: 1,03; p=0,002), PLR (HR: 0,91; p=0,003) posteriores a la TARE y la DCR a los 3 meses (HR: 8,66; p=0,006) (fig. 5).
La mediana de la SLP fue de 3 meses (IC 95%: 2,41-3,59 meses). La enfermedad progresó en 24 pacientes (80%). Los biomarcadores asociados con la SLP en el análisis univariante fueron metástasis hepáticas sincrónicas (HR: 3,34; p=0,050), enfermedad extrahepática en el momento de TARE (HR: 4,0; p=0,006), el desarrollo de complicaciones posteriores a la TARE (HR: 6,46; p=0,022), bilirrubina total posterior a la TARE (HR: 1,18; p=0,001) y la DCR a los 3 y 6 meses (HR: 5,14 y 4,86; p=0,002 y 0,039 respectivamente) (tabla 3).
Análisis univariante de los biomarcadores asociados con la supervivencia (global y libre de progresión)
| Tipo de variable | Variable | SG | SLP | ||
|---|---|---|---|---|---|
| Valor de p | HR | Valor de p | HR | ||
| Paciente | Edad | 0,,210 | 1,05 | 0,064 | 0,95 |
| Sexo | 0,,163 | 2,34 | 0,856 | 1,08 | |
| Tumor primario | Resección del tumor primario (sí/no) | 0,019 | 7,89 | 0,304 | 1,57 |
| Enfermedad hepática sincrónica (sí/no) | 0,410 | 1,93 | 0,050 | 3,34 | |
| Enfermedad extrahepática en el momento de la TARE (sí/no) | 0,056 | 3,22 | 0,006 | 4,06 | |
| Variables relacionadas con la enfermedad en el momento de la TARE | Carga tumoral (<25% vs. ≥25%) | 0,942 | 0,96 | 0,990 | 1,01 |
| KRAS (positivo/negativo) | 0,024 | 5,15 | 0,871 | 1,41 | |
| QT previa (sí/no) | 0,711 | 21,29 | 0,423 | 22,49 | |
| Tratamiento previo con bevacizumab (sí/no) | 0,217 | 0,34 | 0,742 | 0,82 | |
| Parámetros de laboratorio pre-TARE | Aspartato aminotransferasa (AST) | 0,274 | 1,02 | 0,105 | 1,02 |
| Alanino aminotransferasa (ALT) | 0,312 | 1,02 | 0,119 | 1,03 | |
| Albúmina | 0,507 | 0,51 | 0,508 | 1,83 | |
| Bilirubina total | 0,924 | 0,97 | 0,919 | 0,99 | |
| Hemoglobina | 0,009 | 0,50 | 0,419 | 1,15 | |
| NLR | 0,005 | 1,65 | 0,463 | 1,09 | |
| PLR | 0,042 | 1,01 | 0,222 | 1,00 | |
| Variables relacionadas con el procedimiento (TARE) | Shunt HP | 0,102 | 0,81 | 0,536 | 0,94 |
| Actividad total administrada Y-90 (mCi) | 0,568 | 1,00 | 0,091 | 1,01 | |
| Dosis tumoral absorbida (Gy) | 0,708 | 1,00 | 0,845 | 1,00 | |
| TNR | 0,861 | 1,00 | 0,838 | 1,00 | |
| Complicaciones post-TARE | 0,448 | 2,26 | 0,022 | 6,46 | |
| Parámetros de laboratorio post-TARE | Bilirubina total | 0,004 | 2,31 | 0,001 | 1,18 |
| Hemoglobina | 0,639 | 0,91 | 0,280 | 1,19 | |
| NLR | 0,002 | 1,03 | 0,110 | 1,01 | |
| PLR | 0,003 | 0,91 | 0,079 | 0,98 | |
| ORR a los 3 meses | 0,226 | 2,31 | 0,885 | 1,08 | |
| DCR a los 3 meses | 0,006 | 8,66 | 0,002 | 5,14 | |
| DCR a los 6 meses | 0,264 | 2,57 | 0,039 | 4,86 | |
DCR: tasa de control de la enfermedad; HP: hepatopulmonar; NLR: ratio neutrofilos/linfocitos; ORR: tasa de respuesta objetiva; PLR: ratio plaquetas/linfocitos; QT: quimioterapia sistémica; SG: supervivencia global; SLP: supervivencia libre de progresión; TARE: radioembolización transarterial.
No se observaron complicaciones agudas durante el procedimiento de TARE. Se documentó la presencia de complicaciones tardías en 2 pacientes (8,7%); un caso desarrolló una neutropenia afebril grado 3 resuelta con éxito y en otro se evidenció un fallo hepático inducido por la TARE que se resolvió a las 72horas.
DiscusiónEste trabajo proporciona un análisis de los distintos biomarcadores clínicos, analíticos, genéticos y de imagen relacionados con la enfermedad metastásica hepática del CCR y la terapia con TARE que se asocian con la respuesta terapéutica, la SG y SLP.
El rol de la TARE en el manejo de las metástasis hepáticas del CCR se encuentra en pleno desarrollo19. En la literatura podemos encontrar varios ensayos clínicos que estudian la combinación de la TARE con diferentes líneas de quimioterapia, apreciando discreta mejoría de la supervivencia global dependiendo de la fase de inclusión, logrando incrementos de hasta 2 meses. Actualmente sigue sin quedar claro el momento ideal para la inclusión de la TARE en la combinación con la quimioterapia sistémica20,21. Adicionalmente, hay investigaciones que señalan que la inclusión de la TARE junto con la primera línea de quimioterapia mFOLFOX6, en pacientes con tumoraciones hepáticas derechas, logra un aumento significativo de la supervivencia superior a los 4 meses frente a la quimioterapia sola22. Está por ver los biomarcadores pronósticos a tener en cuenta para una mejor selección de los pacientes que se beneficiarían de la combinación de ambas terapias en términos de aumento del tiempo de supervivencia.
Son escasos los estudios sobre los biomarcadores de respuesta a la TARE y en la mayoría se describen para el tratamiento del carcinoma hepatocelular. Los resultados obtenidos en diferentes estudios y con poblaciones diversas son bastante heterogéneos en cuanto a la tasas de ORR a los 3 meses, que oscilan entre 0-71%20,21,23–25, probablemente derivado de la heterogeneidad en la población de inclusión y el momento en el que se indicó la TARE. En nuestro caso la ORR a los 3 meses fue del 16,7%, situándose en el límite inferior a la descrita en otros estudios. Los biomarcadores que mostraron una asociación estadísticamente significativa con la ORR a los 3 meses fueron la edad al diagnóstico, el tratamiento previo con bevacizumab, los niveles de hemoglobina plasmática previa al procedimiento y NLR previo, mientras que para la DCR a los 3 y 6 meses se incluye el tratamiento previo con bevacizumab, albúmina, NLR previos a la TARE y dosis absorbida por el tumor>115Gy. La mayoría de estos biomarcadores se han asociado en estudios previos como biomarcadores de respuesta terapéutica. En este sentido destaca la revisión realizada por Dendy et al.10, en la que se describe que la dosis absorbida tumoral, así como la depleción de linfocitos (que conlleva un incremento de la NLR) y niveles elevados de amilasa sérica se asocian a peor respuesta. Estos resultados contribuyen a sustentar la evidencia científica sobre los factores pronósticos clínicos a tener en cuenta para mejorar la selección de pacientes candidatos a la TARE.Y-90.
En cuanto a la supervivencia, los resultados que arrojan los distintos estudios y revisiones sistemáticas de la literatura son más homogéneos, con una mediana de SG entre 8 y 13 meses y de SLP entre 3-16 meses23. En este sentido, nuestros resultados se encuentran en consonancia con lo descrito previamente, con una mediana de SG de 12 meses y SLP de 3 meses. Nuestros resultados sugieren que la resección del tumor primario, la ausencia de mutaciones del oncogén KRAS, el estatus hematológico previo a la TARE y la DCR precoz a los 3 meses se asocian con una mayor supervivencia global, mientras que los biomarcadores asociados con la SLP incluyen la presencia de metástasis hepáticas sincrónicas en el momento del diagnóstico del CCR, enfermedad extrahepática en el momento de TARE, el desarrollo de complicaciones posteriores a la TARE, bilirrubina total posterior a la TARE y la DCR a los 3 y 6 meses. Estos hallazgos están en consonancia con los informados en estudios previos e incluso en otros tipos de tumores, como el caso del colangiocarcinoma, ya que traducen la existencia de una enfermedad más avanzada y probablemente más agresiva13,26,27.
La elección de protocolos apropiados de tratamiento está por establecerse, siendo necesario concretar tanto el momento de la inclusión de la terapia con TARE como el tipo de tratamiento. Así lo demuestran algunos estudios multicéntricos que valoran el efecto combinado del tratamiento con TARE con segundas líneas de quimioterapia28 o estudios que valoran el tratamiento selectivo (segmentectomía)29. A pesar de ello, el momento idóneo para tratar las metástasis hepáticas del CCR mediante la TARE dentro del algoritmo terapéutico del CCR continúa siendo incierto.
No se registraron complicaciones agudas durante el procedimiento de la TARE. Tras el procedimiento 2/23 pacientes (8,7%) presentaron una complicación tardía derivada del mismo. En un caso se desarrolló una neutropenia afebril grado 3 que se resolvió sin consecuencias, mientras que el otro paciente desarrolló un cuadro síndrome posradioembolización (REILD) autolimitado a las 72horas, reflejando esto la seguridad de la técnica y siendo similar a otros estudios de la literatura30.
La principal limitación de este estudio radica en el limitado número de casos incluidos y la ausencia de un grupo control. Por esta razón nuestro estudio se centró en los resultados menos propensos a malas interpretaciones y sesgos, a saber, la supervivencia, la respuesta terapéutica y la seguridad del tratamiento. Los resultados del estudio pueden estar confundidos por la variabilidad en el número y líneas de tratamiento previos a la TARE. Sin embargo, y a pesar de las diferencias en el manejo oncológico de la enfermedad de base, los resultados de supervivencia y tasa de respuesta terapéutica son concordantes con los reportados por estudios previos. Otra limitación del estudio sería la relativa al corto periodo de seguimiento que limita la valoración de la supervivencia a largo plazo. No obstante, los resultados de este estudio pueden ser de utilidad para establecer las bases de próximos estudios con series más amplias, que permitan esclarecer el impacto de biomarcadores con vistas a seleccionar el subgrupo de pacientes que más se puedan beneficiar de la TARE.
En conclusión, la TARE en la enfermedad metastásica hepática del CCR es una técnica segura y eficaz. En nuestro estudio los biomarcadores con capacidad para predecir el pronóstico y respuesta terapéutica a la TARE incluyen desde parámetros bioquímicos a factores relacionados con el tumor primario y con la dosimetría tumoral estimada. El estudio de estos biomarcadores puede tener un impacto en la selección de los pacientes candidatos a la TARE.
Conflicto de interesesLos autores no tienen conflicto de intereses financieros o comerciales.