La infección fúngica invasiva (IFI) es una entidad que engloba diferentes tipos de infecciones por hongos patógenos habituales en el ser humano. En el entorno del paciente crítico, con múltiples y muchas veces simultáneos factores de riesgo y comorbilidades, las más frecuentes son las causadas por especies de Candida y Aspergillus. Entre las particularidades de la IFI en pacientes críticos podemos destacar tres aspectos: a) el relacionado con el huésped (por ejemplo, factores de riesgo, gravedad clínica); b) el relacionado con el patógeno (sensibilidad, virulencia), o c) el relacionado con el tratamiento antifúngico (espectro de actividad, características PK/PD, seguridad e interacciones). Candida es el género fúngico que de modo más frecuente causa IFI en pacientes críticos, y la candidemia, la peritonitis candidiásica y la infección secundaria a catéter son los tipos de infección más comunes. En los últimos años los nuevos tratamientos antifúngicos han ampliado las posibilidades de tratamiento y actualmente las candinas son una clara opción en los pacientes graves con IFI, que en la mayoría de las guías terapéuticas publicadas se han convertido en la primera opción terapéutica.
Caso clínicoSe presenta un caso de un paciente crítico, con los factores de riesgo más habituales, disfunción multiorgánica (DMO) y desarrollo de IFI. Se comenta la dificultad para establecer un tratamiento antifúngico desde el inicio, su ajuste y se consideran las diferentes posibilidades terapéuticas según la DMO del paciente. Además, se valoran y discuten las opciones del tratamiento antifúngico según las actuales guías y recomendaciones.
ConclusionesLa candidiasis invasora es la infección fúngica más habitual en los pacientes críticos; las presentaciones clínicas más comunes son la candidemia y la peritonitis candidiásica. Las candinas, gracias a su eficacia y seguridad clínica, han abierto nuevas posibilidades terapéuticas en el tratamiento de estas infecciones en este tipo de pacientes.
Invasive fungal infection (IFI) is an entity that encompasses different types of infections caused by different types of those fungi pathogenic for humans. In the setting of critically ill patients with multiple and oftenconcurrent risk factors and comorbidities the most common are those caused by the Candida and Aspergillus species. Among the characteristics of IFI in critically ill patients, three aspects can be highlighted: those related to the host (e.g.: risk factors, clinical severity), those related with the pathogen (sensitivity, virulence), or those concerning antifungal treatment (spectrum, features PK / PD, safety, interactions). The fungus that most often causes an IFI in critically ill patients is Candida; the most common type infections are candidemia, Candida peritonitis and catheter-related infections. In recent years new antifungal treatments have expanded the therapeutic options, with echinocandins as a clear choice, often the first in the latest guidelines in critically ill patients with IFI.
Case reportWe report the case of a critically ill patient having the most common risk factors, multiple organ dysfunction and development of an IFI. The complexity of establishing an antifungal treatment from the moment of its inception, its setting, and the considerations of the different therapeutic possibilities according to organ dysfunction of the patient are discussed. The antifungal treatment options mentioned in the current guidelines and recommendations are also evaluated.
ConclusionsThe most common fungal infection in critically ill patients is invasive candidiasis, with candidemia or candida peritonitis being the most frequent clinical presentations. Candins have brought new possibilities for treating these complex patients due to their good safety profile and clinical efficacy.
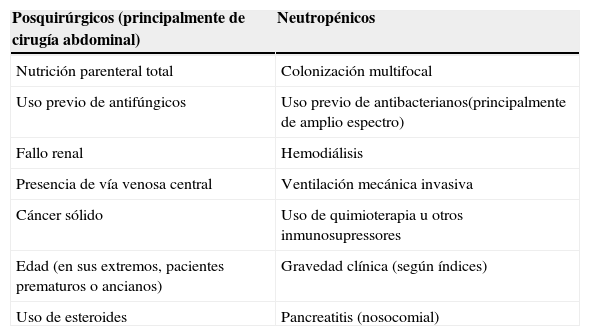
En un amplio estudio europeo sobre candidemia, los pacientes críticos constituyen el segundo grupo en frecuencia (40,2%), tan sólo por detrás de los pacientes quirúrgicos (44,7%), muchas veces ingresados en unidades de cuidados intensivos (UCI)23,30. El porcentaje de aislamientos de hongos en infecciones graves depende de las características de los pacientes, sus factores de riesgos y del tipo de UCI. En una UCI general, alrededor del 15-20% de estas infecciones son secundarias a una IFI2,6,10,17,24,26,27. En el estudio ENVIN-HELICS del año 2010, los aislamientos fúngicos (mayoritariamente levaduras) representaron el 12,15%, por detrás de los bacilos gramnegativos (58,9%) y de los cocos grampositivos (27,5%). Candida albicans es el quinto patógeno en frecuencia aislado como causa de las principales infecciones intra-UCI (6,54% del total. Datos no publicados). En este mismo estudio, Candida es la segunda causa de infección urinaria (25,3%) y C. albicans el segundo patógeno causal (15,1%), sólo por detrás de Escherichia coli. En varias series, distintas especies de Candida constituyen la tercera o cuarta causa más frecuente de infección en aislamientos de sangre2,6,10,17,24,26,27. En el último estudio ENVIN-HELICS, los hongos causaron el 9,8% de las infecciones del torrente sanguíneo, tanto primarias como secundarias a catéter, siendo C. albicans el cuarto agente etiológico (6,3%)4,6,10,18,19,24–27.En la tabla 1 se detallan los principales factores de riesgo asociados a IFI en los pacientes críticos, entre los cuales destaca el uso previo de antibióticos, la cirugía (principalmente abdominal), la presencia de catéter venoso central, la nutrición parenteral, la ventilación mecánica invasiva, la presencia de fallo renal o hepático, o la colonización multifocal10,19,23–26,32
Factores de riesgo para una infección fúngica invasiva en pacientes críticos
| Posquirúrgicos (principalmente de cirugía abdominal) | Neutropénicos |
| Nutrición parenteral total | Colonización multifocal |
| Uso previo de antifúngicos | Uso previo de antibacterianos(principalmente de amplio espectro) |
| Fallo renal | Hemodiálisis |
| Presencia de vía venosa central | Ventilación mecánica invasiva |
| Cáncer sólido | Uso de quimioterapia u otros inmunosupressores |
| Edad (en sus extremos, pacientes prematuros o ancianos) | Gravedad clínica (según índices) |
| Uso de esteroides | Pancreatitis (nosocomial) |
Adaptada de Guery et al11.
Factores a considerar en el momento de instaurar un tratamiento antifúngico en un paciente crítico
| Comorbilidades |
| Situación inmunitaria en el momento |
| Tipo y localización de la infección |
| Gravedad de la sepsis según índices |
| Tipo y gravedad de la(s) disfunción(es) orgánica(s) |
| Situación hemodinámica (incluida la presión arterial, los valores del lactato |
| plasmático, la necesidad de drogas vasoactivas) |
| Si tiene algún método de depuración extrarrenal o hepática |
| Parámetros PK-PD |
| Espectro y actividad intrínseca del antifúngico |
| Epidemiología local (actualizada) |
| Incidencia de cepas de Candida potencialmente resistentes |
| Efectos secundarios |
| Potenciales interacciones medicamentosas |
Las principales características de los pacientes críticos en comparación con otros hospitalizados se relacionan con su gravedad, evaluada por diferentes índices, y con ello de las diferentes disfunciones orgánicas y que se relacionan directamente con el pronóstico31.
La mortalidad secundaria referida a una candidiasis invasiva (CI) varía mucho, dependiendo de factores como las características clínicas de los pacientes, su estancia en la UCI, así como de los diseños de los propios estudios. Por ejemplo, la mortalidad de la candidemia varía del 25-55%, mientras que la de la peritonitis candidiásica (PC) del 25-75%2–4,6,10,17–20,23,24,30.
Diferentes factores se han asociado a mayor mortalidad de los pacientes con CI:
- –
la especie de Candida: en un estudio multicéntrico la mortalidad asociada a IFI por C. albicans era del 38%, mientras que por Candida glabrata era del 45%, y de Candida krusei, del 55%30.
- –
el tratamiento inadecuado de una CI se relaciona con un pronóstico peor8,13,25. En un estudio sobre sepsis en UCI, las CI fueron las infecciones asociadas de forma más frecuente a un tratamiento inadecuado y tenían una mortalidad mayor en comparación con las infecciones bacterianas13. Otro estudio demostró que el tratamiento antifúngico empírico inadecuado en CI tenía asociada una mortalidad significativamente mayor en comparación con los pacientes tratados de forma adecuada (el 46 frente al 27%; p = 0,02)25.
- –
el retraso en el inicio del tratamiento antifúngico adecuado se asocia con una mortalidad mayor7,8,13,16,22,25.
- –
los pacientes con mayores valores APACHE II tienen un pronóstico peor7,10,23,24.
Varón de 63 años con buena calidad de vida, antecedentes de tabaquismo, enolismo leve, hipertensión arterial (en tratamiento con enalapril), obesidad moderada y criterios de enfermedad pulmonar obstructiva crónica moderada. El paciente ingresa en el hospital parauna intervención reglada tras el diagnóstico de cáncer de colon derecho (T2N0M0). En la analítica destacan valores bajos de albúmina y proteínas totales en el seno de una desnutrición leve-moderada. Antes del procedimiento quirúrgico, se procede a la colocación de una vía central para administrar nutrición parenteral. Se realizó una resección tumoral y ganglionar con sutura término-terminal. La intervención no presentó complicaciones intraoperatorias ni en el postoperatorio (PO), y se pudo extubar al paciente a la segunda hora de salir de quirófano. Se instauró profilaxis quirúrgica con dos
dosis de cefuroxima y se mantuvo la nutrición parenteral total durante 4 días. Los primeros días el paciente permaneció estable, salvo por episodios aislados de febrícula (37,7°C) sin repercusión clínica. El paciente comenzó a presentar problemas de tolerancia por vía oral a partir del 8.° día después de la cirugía.
En el 10.° día PO el paciente presenta cuadro de fiebre de 38,8°C con tiritonas, taquicardia (125 latidos por minuto), taquipnea (30 respiraciones por minuto), vómitos, dolor abdominal difuso con leves ruidos hidroaéreos, presión arterial de 110/55mmHg, frialdad y mala perfusión periférica, tendencia a la somnolencia y SatO2 del 90%. Ante la sospecha de una infección con criterios de gravedad, se incluye al paciente en el Protocolo de Manejo Integral de Sepsis Grave del hospital y se extrae sangre para hemocultivos, urocultivo y una analítica completa. Entre los resultados de la analítica destacaban los siguientes: glucemia de 199 mg/dl, creatinina de 2,5 mg/dl, urea de 88 mg/dl, leucocitos de 29.000/l (90% de neutrófilos), hemoglobina de 12 g/dl, plaquetas 90.000/l, coagulopatía con cociente internacional normalizado de 2,4, proteína C reactiva de 270 mg/l, procalcitonina de 23 mg/l, lactato plasmático de 3,1 mmol/l, bilirrubina total de 2,3 mg/dl, bilirrubina directa de 1,9 mg/dl, transaminasa glutamicoxalacética de 145 U/l, gammaglutamil transpeptidasa de 200 U/l y fosfatasa alcalina de 300 U/l.
La radiografía de tórax presentaba un discreto derrame pleural en ambas bases pulmonares con pérdida de volumen. En la exploración realizada por el cirujano de guardia, en el paciente destacaba palidez y frialdad cutáneas, somnolencia, pero sin focalidad motora, auscultación cardíaca con taquicardia, pero sin soplos aparentes, y murmullo vesicular disminuido en ambas bases pulmonares. En la exploración abdominal se apreció dolor difuso, ausencia de ruidos hidroaéreos, palpación timpánica, signos de irritación peritoneal difusa, ausencia de masas y herida quirúrgica con mal aspecto y supurante (no tenía drenajes). Se inicia tratamiento antibiótico con meropenem, fluidoterapia y oxigenoterapia con FiO2 del 40%.
Con estos hallazgos se decide realizar una tomografía computarizada (TC) abdominal urgente, en la que se observa la presencia de gran cantidad de líquido peritoneal distribuido de forma difusa, aire extraluminal y dudosa colección subhepática. Con esta información el paciente pasa directamente al quirófano llegando con marcada hipotensión
arterial (80/55 mmHg) y saturación de oxígeno (SatO2) del 90% con una fracción inspiratoria de oxígeno (FiO2) de 0,5. Antes de la intubación presenta un cuadro compatible con nueva bacteriemia, con temperatura de 39,8°C.
En la intervención quirúrgica con laparotomía media, se observa gran cantidad de pus en el peritoneo que se envía para cultivo. Se observa también colección purulenta subhepática, dehiscencia de la sutura término-terminal del colon derecho y lesión en una asa intestinal con solución de continuidad. Se realiza limpieza con lavado abundante, colostomía derecha y sutura de la lesión intestinal.
El paciente (con oliguria e hipotermia de 35°C) llega a la UCI desde quirófano muy inestable, precisando noradrenalina a 0,6μg/kg/min, fluidoterapia, ventilación mecánica con FiO2 de 0,7 y presión positiva al final de la expiración de 7 cmH2O . Se decide retirar la vía central (aunque visualmente no había signos de infección) y se envía para cultivo, extrayendo sangre para nuevos hemocultivos. El tratamiento antibiótico pautado antes de entrar en quirófano (meropenem, 1g cada 8 h por vía intravenosa [i.v.]) se amplió con linezolid (600mg cada 12 h i.v.).
Se calculó el índice SOFA total que fue de 9, con fracaso de cinco órganos, un índice APACHE II de 24 y un SAPS II de 59 puntos. La puntuación del Candida score fue de 4 (2 puntos por sepsis grave, 1 por nutrición parenteral y 1 punto por cirugía abdominal). En la sesión clínica se discute la validez de éste, ya que el paciente no había estado ingresado más de una semana en UCI y no había estudio de colonización multifocal.
En las horas siguientes el paciente presentó una discreta estabilización hemodinámica, con noradrenalina a razón de 0,45μg/kg/min, la concentración de lactato desciende hasta 2,3 mmol/l (aclaramiento superior al 10%), inicio de la diuresis y normalización de la acidosis metabólica. Seguía presente un gradiente alvéolo/arterial elevado con algunos infiltrados algodonosos bilaterales. En los hemocultivos y en el cultivo del líquido peritoneal se aíslan abundantes bacilos gramnegativos (dos estirpes distintas), cocos grampositivos en cadena y levaduras. En el urocultivo también se aislaron levaduras. Sin embargo, el cultivo del broncoaspirado y del catéter venoso central fueron negativos. Con estos hallazgos se decide mantener la misma pauta antibiótica empírica con meropenem, linezolid y añadir anidulafungina. El examen de fondo de ojo realizado esa misma mañana no reveló hallazgos significativos.
En los días siguientes el paciente mejora. Se disminuye progresivamente la noradrenalina, se normaliza el lactato y mejoran los parámetros de ventilación mecánica invasiva y las funciones renal, hematológica y hepática.
Al tercer día, después de la segunda cirugía, se conoce el aislamiento en líquido peritoneal y hemocultivos de Escherichia coli y Klebsiella pneumoniae productora de betalactamasa de espectro ampliado, Enterococcus faecium (sensible a carbapenem) y C. glabrata. Se decide mantener el tratamiento antibiótico con meropenem y anidulafungina
y suspender el linezolid. El aislamiento de C. glabrata es sensible a equinocandinas, anfotericina B y voriconazol, y sensible dependiente de la dosis a fluconazol. Tras mantener un debate en la unidad de sepsis y en la UCI, se decide mantener la anidulafungina por varias razones: la situación de inestabilidad clínica del paciente (que aunque hubiera mejorado seguía con disfunción de cuatro órganos), y que la dosis adecuada de fluconazol para una candidemia y PC por C. glabrata no está claramente definida (hay antecedentes en la bibliografía de mayor incidencia de fallo terapéutico con esta especie con fluconazol).
Los hemocultivos de control realizados al 6.° día de tratamiento fueron negativos, por lo que se mantuvo el tratamiento con anidulafungina hasta completar 14 días desde esta fecha. La evolución del paciente fue muy buena, por lo que fue dado de alta de la UCI tras 12 días de ingreso y luego dado de alta hospitalaria a los 18 días de lasegunda intervención.
DiscusiónEl caso presentado es un caso típico de CI grave en paciente crítico. La mayoría de los estudios con pacientes en UCI describen los casos de estos pacientes y aquéllos con candidemia o sepsis por catéter, estos últimos generalmente menos graves. Nuestro paciente es un enfermo crítico con fracaso multiorgánico grave, con un shock séptico abdominal de etiología polimicrobiana, en la que destaca una PC y candidemia secundaria por C. glabrata sensible dependiente de la dosis a fluconazol. El paciente presentaba muchos de los clásicos factores de riesgo para una CI: cirugía abdominal previa, nutrición parenteral, catéter venoso central y neoplasia sólida.
El aislamiento de Candida en el cultivo de líquido peritoneal debe evaluarse en el contexto clínico de cada paciente, ya que puede tratarse de una colonización o ser la causa de una infección1,4–6,10,20,23–25,32. Lógicamente, en un paciente sin indicios de infección/sepsis, su aislamiento correspondería a una colonización. Para poder diferenciar entre colonización o infección, hay que considerar aspectos como la localización de la lesión digestiva (perforación, dehiscencia, etc.), el tiempo de desarrollo de ésta, si se trata de una sepsis abdominal comunitaria o nosocomial, así como si el paciente tiene uno o varios factores de riesgo.
En la inmensa mayoría de los estudios, C. albicans es el agente causal más frecuente de CI1–5,10,23–28,30,32, y C. glabrata es la segunda especie en frecuencia en muchos estudios, principalmente europeos1–5,7,23–27,30,32. Aunque siempre se debe considerar la epidemiología local en el momento de iniciar un tratamiento antifúngico ante la sospecha de una CI, en un paciente con sepsis grave de origen nosocomial hay que valorar una cobertura antifúngica de amplio espectro, con actividad frente a C. glabrata. En un interesante estudio multicéntrico australiano, se identificaron dos variables como factores de riesgo independientes para el aislamiento de especies de Candida no C. albicans o potencialmente resistentes a fluconazol: a) el tratamiento previo con azoles, y b) el antecedente de cirugía abdominal28.
En un reciente estudio prospectivo y multicéntrico con 271 pacientes con CI, y en el que había 93 PC, C. albicans se aisló en el 58% de los casos seguida de C. glabrata (20%). La tasa de resistencia o de sensibilidad dependiente de la dosis a fluconazol en este estudio fue del 28%, mayoritariamente presente en C. glabrata y C. krusei20. En este mismo estudio, al evaluar a los pacientes con PC, se concluyó que el tratamiento antifúngico había sido inadecuado en el 20% de los casos, por lo que se precisó sustituir el fluconazol por una candina o por voriconazol en el 32% de los casos.
En nuestro paciente se ha procedido al manejo integral de la sepsis grave con el control del foco (cirugía abdominal urgente y retirada del catéter venoso central), resucitación con fluidoterapia, noradrenalina, esteroides a dosis de insuficiencia suprarrenal relativa y el inicio con un antibacteriano de amplio espectro en la primera hora. Pero, al final, el inicio de tratamiento empírico antifúngico en un paciente con factores de riesgo, con un Candida score en un punto de corte de riesgo para CI y con elevada gravedad, se retrasó 6 horas1,3,11,12,16,24,33. Este retraso probablemente sea uno de los principales factores modificables asociados al peor pronóstico de los pacientes críticos con CI, tal como han descrito varios autores.
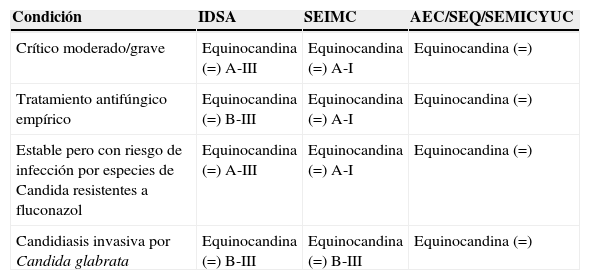
En las últimas guías publicadas de tratamiento empírico de infecciones fúngicas invasivas, como las de la Infectious Diseases Society of America o la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica, se ha modificado el planteamiento inicial del tratamiento antifúngico y, principalmente, las indicaciones de cada antifúngico (tablas 3 y 4)1,3,4,9,11,12,24,33. A la hora de instaurar un tratam iento antifúngico en este tipo de pacientes, deben considerarse aspectos como el tratamiento previo con un azol (generalmente fluconazol) por el riesgo de tratarse de una especie de Candida resistente a éste. Otro aspecto sería el caso de riesgo o infección probada por C. glabrata, ya que es una especie potencialmente resistente a fluconazol y con una probabilidad mayor de fallo terapéutico1,11,25,34. Por último, también debe valorarse la epidemiología local y la gravedad del paciente.
Adaptado desde recomendaciones IDSA 2009, SEIMC 2011 y de las recomendaciones españolas de tratamiento de infecciones abdominales 2009
| Condición | IDSA | SEIMC | AEC/SEQ/SEMICYUC |
| Crítico moderado/grave | Equinocandina (=) A-III | Equinocandina (=) A-I | Equinocandina (=) |
| Tratamiento antifúngico empírico | Equinocandina (=) B-III | Equinocandina (=) A-I | Equinocandina (=) |
| Estable pero con riesgo de infección por especies de Candida resistentes a fluconazol | Equinocandina (=) A-III | Equinocandina (=) A-I | Equinocandina (=) |
| Candidiasis invasiva por Candida glabrata | Equinocandina (=) B-III | Equinocandina (=) B-III | Equinocandina (=) |
=: similar eficacia/indicación; AEC: Asociación Española de Cirujanos; IDSA: Infectious Diseases Society of America; SEIMC: Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica; SEMICYUC: Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias; SEQ: Sociedad Española de Quimioterapia.
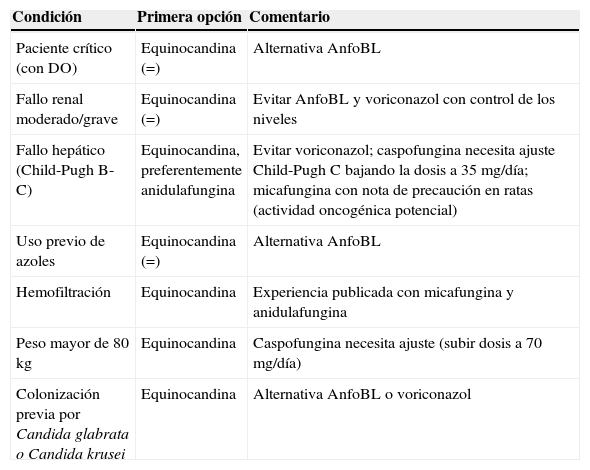
| Condición | Primera opción | Comentario |
| Paciente crítico (con DO) | Equinocandina (=) | Alternativa AnfoBL |
| Fallo renal moderado/grave | Equinocandina (=) | Evitar AnfoBL y voriconazol con control de los niveles |
| Fallo hepático (Child-Pugh B-C) | Equinocandina, preferentemente anidulafungina | Evitar voriconazol; caspofungina necesita ajuste Child-Pugh C bajando la dosis a 35 mg/día; micafungina con nota de precaución en ratas (actividad oncogénica potencial) |
| Uso previo de azoles | Equinocandina (=) | Alternativa AnfoBL |
| Hemofiltración | Equinocandina | Experiencia publicada con micafungina y anidulafungina |
| Peso mayor de 80 kg | Equinocandina | Caspofungina necesita ajuste (subir dosis a 70 mg/día) |
| Colonización previa por Candida glabrata o Candida krusei | Equinocandina | Alternativa AnfoBL o voriconazol |
=: similar eficacia/indicación; AnfoBL: anfotericina B formulación lipídica/liposomal; DO: disfunción orgánica; IDSA: Infectious Diseases Society of America; SEIMC: Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica.
Otro factor que se ha incorporado en citadas recomendaciones/ guías es la presencia de la denominada inestabilidad clínica del paciente, situación habitual en la mayoría de los pacientes críticos1,3,9,12,24. La inestabilidad suele referirse a fallo hemodinámico en términos generales, sin considerar otras variables, como por ejemplo la hiperlacticemia plasmática, que suele ser mejor marcador de perfusión tisular que la propia presión arterial. En general, el impacto de presentar las otras disfunciones orgánicas no están claramente definidas en las guías en el momento de plantear iniciar uno u otro tratamiento antifúngico, salvo el fracaso renal o hepático por su implicación en la necesidad potencial de ajuste de dosis o contraindicación. Por ejemplo, en el momento del diagnóstico del abdomen agudo secundario a la peritonitis nosocomial, nuestro paciente tenía elevados valores en índices indicativos de gravedad que implican una mayor morbimortalidad y desarrollo de fallo multiorgánico: shock (con hiperlacticemia), insuficiencia respiratoria aguda (con criterios de SDRA), fracaso renal agudo oligúrico, coagulopatía de consumo
con trombopenia, insuficiencia hepática leve y encefalopatía séptica. Por ello, en líneas generales, lo más adecuado sería probablementevalorar la presencia y la gravedad de estas diferentes disfunciones orgánicas, y no sólo la hemodinámica, para iniciar el tratamiento con un antifúngico de espectro y seguridad mayores, como exigía nuestro
paciente.
En las recientes recomendaciones españolas de tratamiento empírico de la infección abdominal realizadas por varias sociedades científicas nacionales, se clasifica al paciente según el tipo de peritonitis (comunitaria o nosocomial), la presencia/ausencia de factores de riesgo de mala evolución y criterios de gravedad (incluidos biomarcadores y ciertos índices), y se plantean las diferentes opciones de tratamiento antibacteriano y antifúngico12. Así, en el caso de PC comunitaria grave o nosocomial (incluida aquella después de una endoscopia terapéutica) sin factores de riesgo de mala evolución, la primera opción sería fluconazol. Pero en estos mismos grupos, o en los pacientes con peritonitis recidivante-persistente (terciaria) con factores de riesgo de mala evolución, las opciones serían equinocandina o fluconazol. La elección de uno u otro antifúngico estará condicionada por una exposición previa a fluconazol y de si se trata de un paciente con criterios de sepsis grave o shock séptico, donde se utilizaría empíricamente una equinocandina (fig. 1)
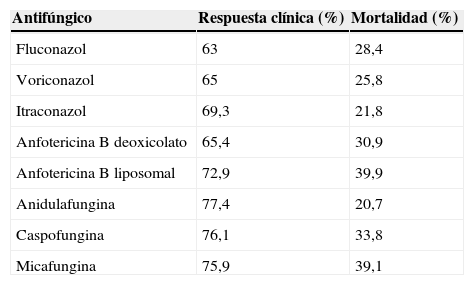
Los estudios prospectivos, aleatorizados, de doble ciego que comparaban diferentes tratamientos antifúngicos en CI, principalmente candidemia, no presentaban diferencias significativas en la eficacia clínica o erradicación microbiológica entre las distintas pautas hasta el estudio de no-inferioridad de Reboli et al29, que comparaba la ani-dulafungina frente al fluconazol (tabla 5). En este estudio, la anidulafungina presentaba ventajas significativas en los análisis siguientes: la eficacia global (el 75,6 frente al 60,2%; p < 0,05), eficacia frente a infecciones por C. albicans (el 81 frente al 62%; p < 0,05) y cirugía reciente (el 83 frente al 59%; p < 0,01). Este estudio no definía bien los subgrupos ni la estratificación de gravedad, por lo que es complejo extrapolar a los pacientes críticos. En 2011, en un subanálisis de este estudio se valora su impacto en los pacientes graves, clasificados como tal si presentaban al menos una de estas variables: pacientes con APACHE II ≥ 15, ingreso en la UCI o evidencia de sepsis grave (sepsis más alguna disfunción orgánica)14. Se clasifican como pacientes graves 163 pacientes del total de 245 incluidos en el ensayo (66,5%). Cuando se compara la tasa de eficacia global al final del tratamiento con anidulafungina o fluconazol, se obtienen mejores resultados con la equinocandina: pacientes con gravedad moderada/grave (el 70,8 frente al 54,1%; p = 0,03; odds ratio [OR] = 16,7%; intervalo de confianza [IC] del 95%, 2-31,5), pacientes con APACHE II ≥ 15 (el 68,3 frente al 46%; p = 0,02; OR = 22,3%; IC del 95%, 4,3-40,2) o pacientes con sepsis grave y fracaso multiorgánico (el 76,3 frente al 29,2%; p = 0,003; OR = 47%; IC del 95%, 21,3-72,8)14.
Eficacia global y mortalidad de la candidiasis invasiva en el metaanálisis de los diferentes estudios con antifúngicos
| Antifúngico | Respuesta clínica (%) | Mortalidad (%) |
| Fluconazol | 63 | 28,4 |
| Voriconazol | 65 | 25,8 |
| Itraconazol | 69,3 | 21,8 |
| Anfotericina B deoxicolato | 65,4 | 30,9 |
| Anfotericina B liposomal | 72,9 | 39,9 |
| Anidulafungina | 77,4 | 20,7 |
| Caspofungina | 76,1 | 33,8 |
| Micafungina | 75,9 | 39,1 |
Adaptada de Mills et al18.
A la vista de las enseñanzas de este caso de CI en UCI y de las recientes evidencias, en todo paciente con sospecha de PC con varios factores de riesgo, criterios de elevada gravedad, incluidas múltiples disfunciones orgánicas, el tratamiento antifúngico debe instaurarse del modo más temprano posible, siendo las equinocandinas la principal opción terapéutica por su perfil de eficacia clínica y seguridad. Debido a la falta de evidencia comparativa entre ellas, la elección de la equinocandina a utilizar en estos pacientes no es tan sencilla. Para su elección actualmente se utilizan varios criterios, desde clínicos hasta económicos: características PK/PD, necesidad de ajuste de la dosis (muy complicado en un paciente crítico), experiencia publicada en determinada situación (por ejemplo, pacientes sometidos con hemofiltración o neutropénicos), riesgo potencial de interacciones farmacológicas o de efectos secundarios y su coste1,3,11,15,20,24,33.
ConclusionesLa candidiasis invasora es la infección fúngica más habitual en los pacientes críticos; las presentaciones clínicas más comunes son la candidemia y la peritonitis candidiásica. Las candinas, gracias a su eficacia y seguridad clínica, han abierto nuevas posibilidades terapéuticas en el tratamiento de estas infecciones en este tipo de pacientes
Conflicto de interesesLos autores han recibido honorarios de Pfizer en relación con el desarrollo de este manuscrito.
Referencia no citada