Los pacientes críticos con candidiasis invasiva (CI) suelen presentar con frecuencia insuficiencia renal, por lo que en ocasiones requieren técnicas continuas de reemplazo renal (TCRR). Las equinocandinas son la primera opción en el tratamiento de la CI en el paciente crítico con enfermedad moderada o grave. Debido a su perfil farmacocinético y farmacodinámico (FC/FD), su eliminación durante las TCRR debe ser despreciable, sin que sea necesario ajustar sus dosis, como así lo indican los escasos estudios clínicos que hay al respecto.
Caso clínicoVarón de 66 años intervenido por peritonitis secundaria a dehiscencia de sutura intestinal, que ingresa en la unidad de cuidados intensivos con cuadro clínico compatible con shock séptico y síndrome de disfunción multiorgánica (SDMO), por lo que se inicia TCRR. Al presentar factores de riesgo de CI, y al haberse observado levaduras en el líquido peritoneal, se pauta anidulafungina a dosis habituales. Se opta por anidulafungina debido a la insuficiencia hepática del paciente. En los cultivos del líquido peritoneal y exudado anal, se aísla Candida albicans sensible a fluconazol. No obstante, se decide mantener la anidulafungina debido al SDMO y al aclaramiento que presenta el fluconazol durante las TCRR. La evolución del paciente es favorable, y es trasladado a sala de hospitalización a los 20 días de la cirugía.
ConclusionesDado su perfil FC/FD, las equinocandinas podrían administrarse con seguridad a dosis habituales en el paciente crítico con CI sometido a TCRR. No obstante, se requieren nuevos estudios que aporten más información para reforzar esta recomendación. El metabolismo extrahepático de la anidulafungina la hace especialmente interesante frente al resto de equinocandinas y otros antifúngicos en pacientes con diferentes grados de insuficiencia hepática.
Critically ill patients with invasive candidiasis (IC) often suffer renal failure, which sometimes requires continuous renal replacement techniques (CRRT). Echinocandins are the first line treatment for IC in critically ill patients with mild or severe illness. Their elimination during CRRT should be negligible due to their pharmacokinetic and pharmacodynamic (PK/PD) profile, and dose adjustment are not needed, as suggested by the few reported clinical studies.
Clinical caseThis is the case of a 66 year old male who underwent surgery due to peritonitis secondary to intestinal suture dehiscence. The patient was admitted to ICU with septic shock symptoms and multiple organ dysfunction syndrome (MODS), and CRRT was started. Anidulafungin was prescribed at the usual dosage due to the IC risk factors present, and the observation of yeasts in the peritoneal fluid. Anidulafungin was selected due to the hepatic failure suffered by the patient. An isolate of Candida albicans susceptible to fluconazole was cultured from peritoneal fluid and rectal exudates. However, anidulafungin was maintained due to the MODS and observing the clearance of fluconazole during CRRT. The patient's condition improved favourably, being moved to the surgical ward 20 days after the surgery.
ConclusionsEchinocandins, due to their PK/PD profile, could be safely given at usual doses to critically ill patients undergoing CRRT. However, new studies are required to strengthen this recommendation. Its extrahepatic metabolism makes anidulafungin a more attractive option among echinocandins and other antifungals when used in patients with different degrees of hepatic failure
Se estima que la incidencia actual de insuficiencia renal aguda en unidades de cuidados intensivos (UCI) es del 5,7%, y el shock séptico es una de las causas más frecuentes17. En los últimos años, las técnicas continuas de reemplazo renal (TCRR) se utilizan cada vez con más frecuencia y precocidad en el tratamiento de la insuficiencia renal del paciente crítico. Las TCRR evitan el desplazamiento rápido de líquidos y electrolitos, y son más toleradas y más efectivas en el paciente hemodinámicamente inestable que las técnicas intermitentes convencionales4,15.
Los pacientes críticos con factores de riesgo para desarrollar candidiasis invasiva (CI) presentan con frecuencia insuficiencia renal que requiere el tratamiento con TCRR. Además estos pacientes también pueden presentar diferentes grados de insuficiencia hepática, dentro del llamado síndrome de disfunción multiorgánica (SDMO). La elección del tratamiento antifúngico ideal en estas situaciones continúa siendo objeto de debate.
Presentamos el caso de un paciente en shock séptico con CI que asociaba insuficiencia renal (en tratamiento con TCRR) e insuficiencia hepática en el contexto de SDMO. Respecto al tratamiento antifúngico administrado, se discuten los puntos que generan más controversia e interés en la práctica clínica habitual, a partir de la bibliografía publicada hasta el momento actual.
Caso clínicoVarón de 66 años con antecedentes de hipertensión arterial, dislipemia y diabetes mellitus de tipo 2. Se le diagnostica neoplasia de colon, y se le realiza laparotomía electiva (día 0, hemicolectomía derecha con anastomosis término-terminal). En la sala de hospitalización (días 2-3) presentó agitación, tendencia a la hipoxemia y dolor abdominal difuso. Continuó con progresivo deterioro general y desarrolló un abdomen agudo, insuficiencia respiratoria, hipotensión y oliguria (día 5). En la tomografía abdominal se detectó abundante líquido libre en peritoneo, por lo que se indicó realizar una laparotomía urgente (día 5), en la que se apreció peritonitis fecaloidea difusa, y se llevaron a cabo resección intestinal, colostomía tipo Hartmann y lavado de cavidad abdominal. Como incidencias intraoperatorias destacaron inestabilidad hemodinámica que precisó tratamiento con vasopresores, oliguria e hipoxemia. En el quirófano se retiró el antibiótico pautado desde la cirugía previa (amoxicilina-ácido clavulánico durante 5 días) y se inició un tratamiento con meropenem. Tras finalizar la intervención, se trasladó al paciente a nuestra UCI quirúrgica.
A su ingreso en UCI (día 5), el paciente presentaba un SDMO (disfunción hemodinámica, respiratoria, renal, hematológica y hepática) con marcadores de gravedad elevados: SOFA (Sequential Organ Failure Assessment) de 12 puntos y APACHE II (Acute Physiology And Chronic Health Evaluation) de 24 puntos. El seguimiento hemodinámico avanzado con PiCCO2 (Pulsion Medical Systems [Alemania]) a través de la arteria femoral izquierda mostró un patrón distributivo compatible con shock séptico. En cuanto al análisis microbiológico, además del líquido peritoneal extraído en quirófano, se pidieron cultivos de sangre, de aspirado traqueal, orina y exudado anal.
Las medidas generales de tratamiento (día 5) consistieron en: sedación, ventilación mecánica de protección pulmonar, soporte hemodinámico con fármacos vasoactivos y soporte renal con TCRR. La técnica utilizada fue la hemodialfiltración venovenosa continua (HDFVVC) a través de la vena femoral derecha mediante la máquina Fresenius Multifiltrate con filtros Ultraflux AV6005® de polisulfona (Fresenius Medical Care [Alemania]). Los flujos ajustados durante la HDFVVC fueron: flujo de sangre, 120ml/min; flujo de diálisis, 1.000ml/h, y flujo de ultrafiltración, 1.300ml/h. Asimismo, a las 12 horas de la cirugía se inició tratamiento con proteína C activada recombinante a dosis de 24μg/kg/h durante 96 horas. Finalmente, dado que el paciente había acumulado durante los últimos 5 días factores de riesgo para desarrollar candidiasis invasiva (catéter venoso central, nutrición parenteral, cirugía abdominal, antibioterapia, shock séptico), así como la observación directa de levaduras en líquido peritoneal, se decidió asociar al meropenem tratamiento antifúngico con anidulafungina a dosis habituales (200mg/ por vía intravenosa [i.v.] de carga el primer día y 100mg/i.v. en días posteriores).
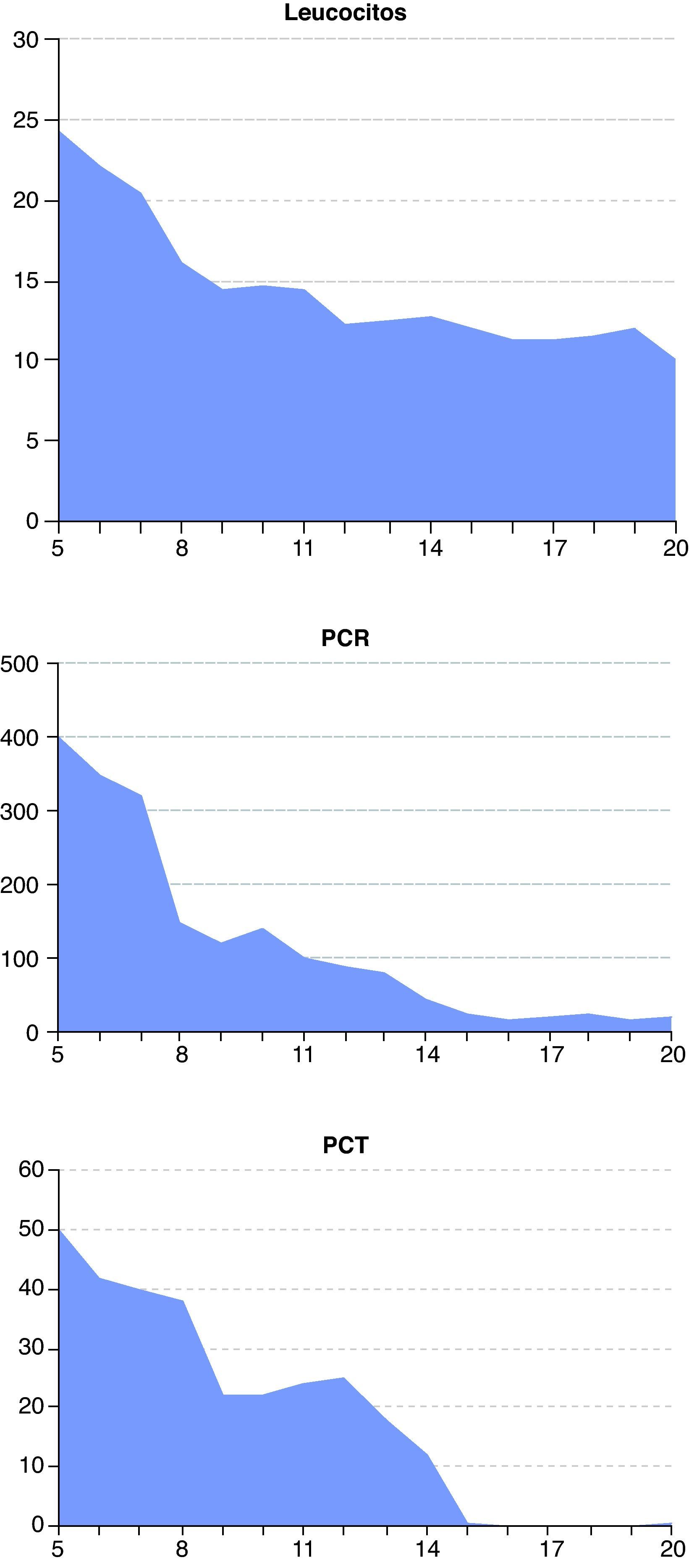
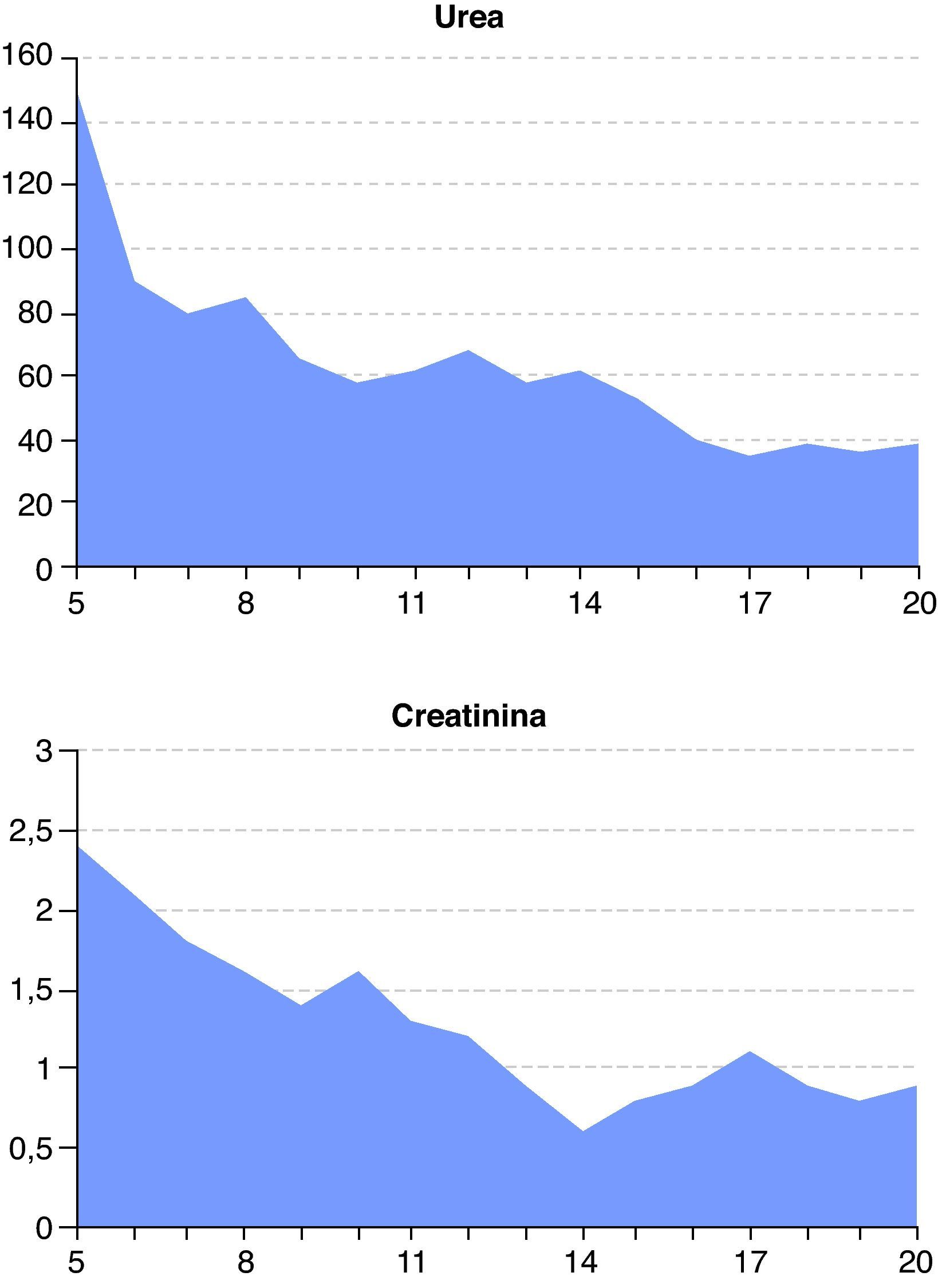
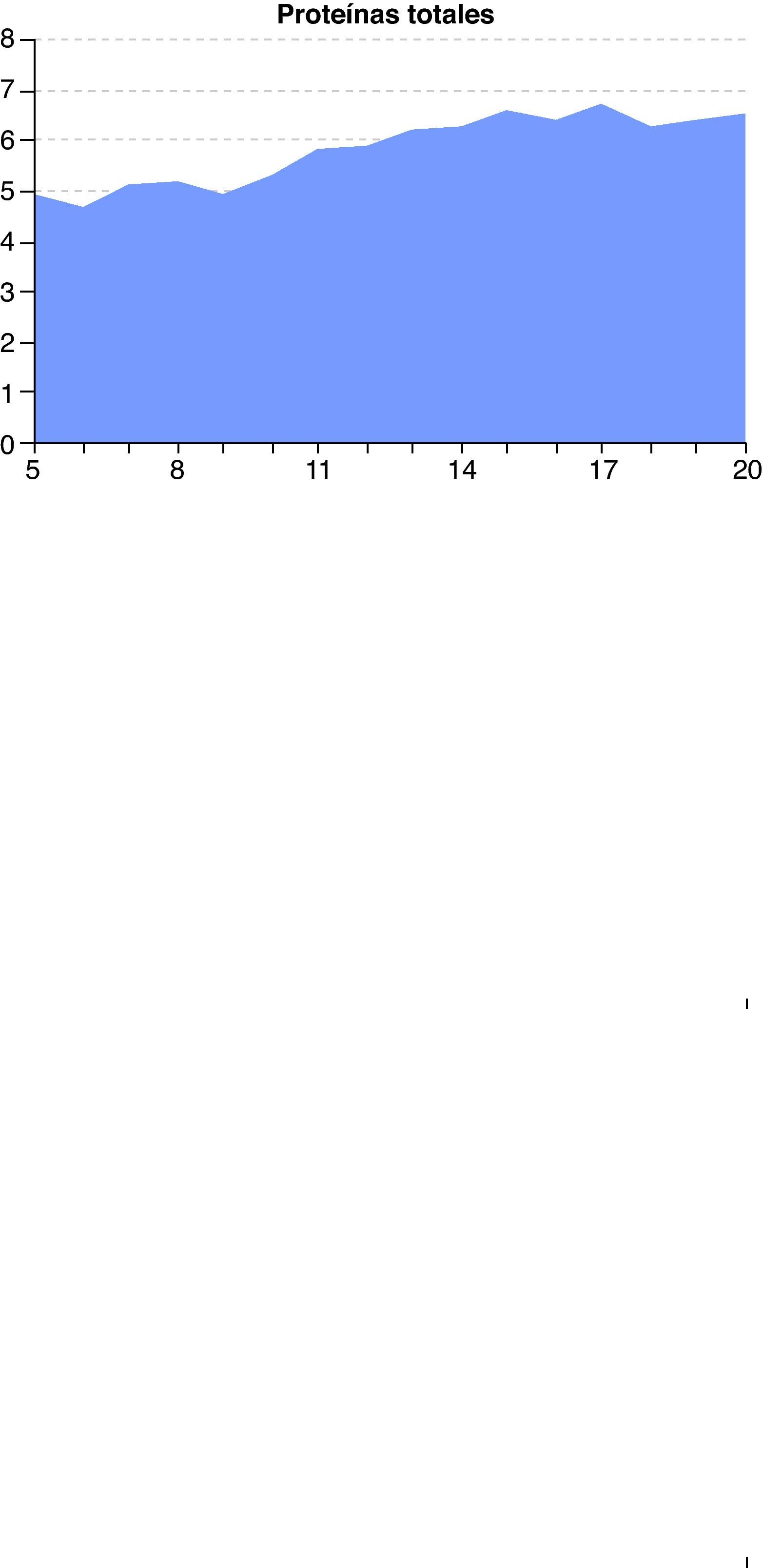
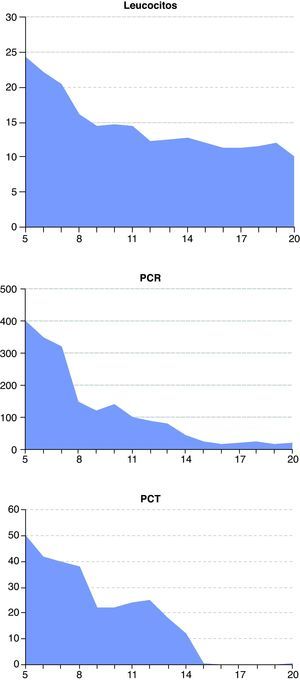
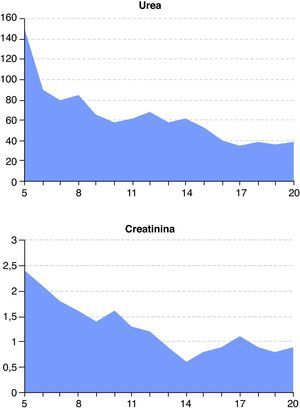
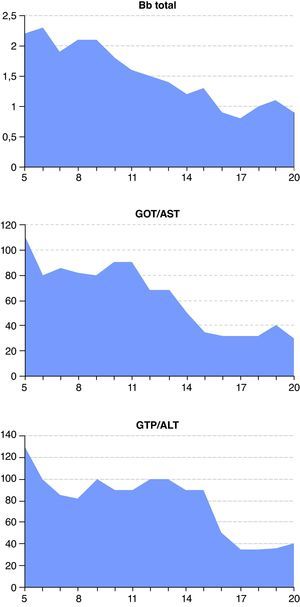
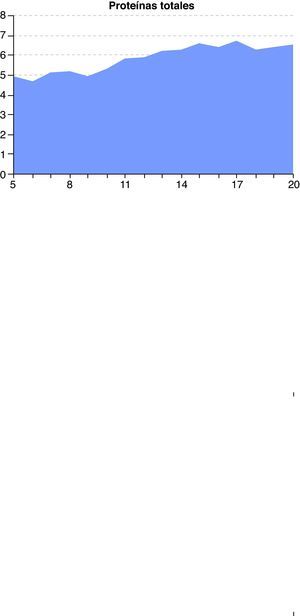
A las 48 horas (día 7) se recibieron los resultados de los cultivos de orina y exudado anal. Se aisló una cepa de C. albicans multisensible, mientras que del líquido peritoneal se aisló una cepa de Escherichia coli también multisensible. El resto de cultivos fueron negativos. El día 8, el paciente presentaba ostensible descenso de los biomarcadores de infección (fig. 1) y mejora de la función renal y hepática (figs. 2 y 3). Igualmente, la hemodinámica era estable sin catecolaminas y había recuperado el tránsito intestinal, por lo que se inició la nutrición enteral. Las proteínas totales que inicialmente tenían valores bajos progresivamente fueron aumentando hasta normalizarse (fig. 4). No obstante, el día 11 el paciente seguía precisando soporte ventilatorio, por lo que se realizó una traqueotomía percutánea bajo visión fibroscópica. El día 14 los biomarcadores de infección eran normales (fig. 1), por lo que se retiraron el meropenem y la anidulafungina. El día 20, tras conseguirse la desconexión de la ventilación mecánica y presentar estabilidad clínica (SOFA 3), se trasladó a la sala de hospitalización.
Evolución de los biomarcadores de infección desde el día de ingreso del paciente en la unidad de cuidados intensivos (día 5) hasta su traslado a la sala de hospitalización (día 20). De izquierda a derecha: leucocitos (células × 109/l), proteína C reactiva (PCR, mg/l) y procalcitonina (PCT, ng/ml).
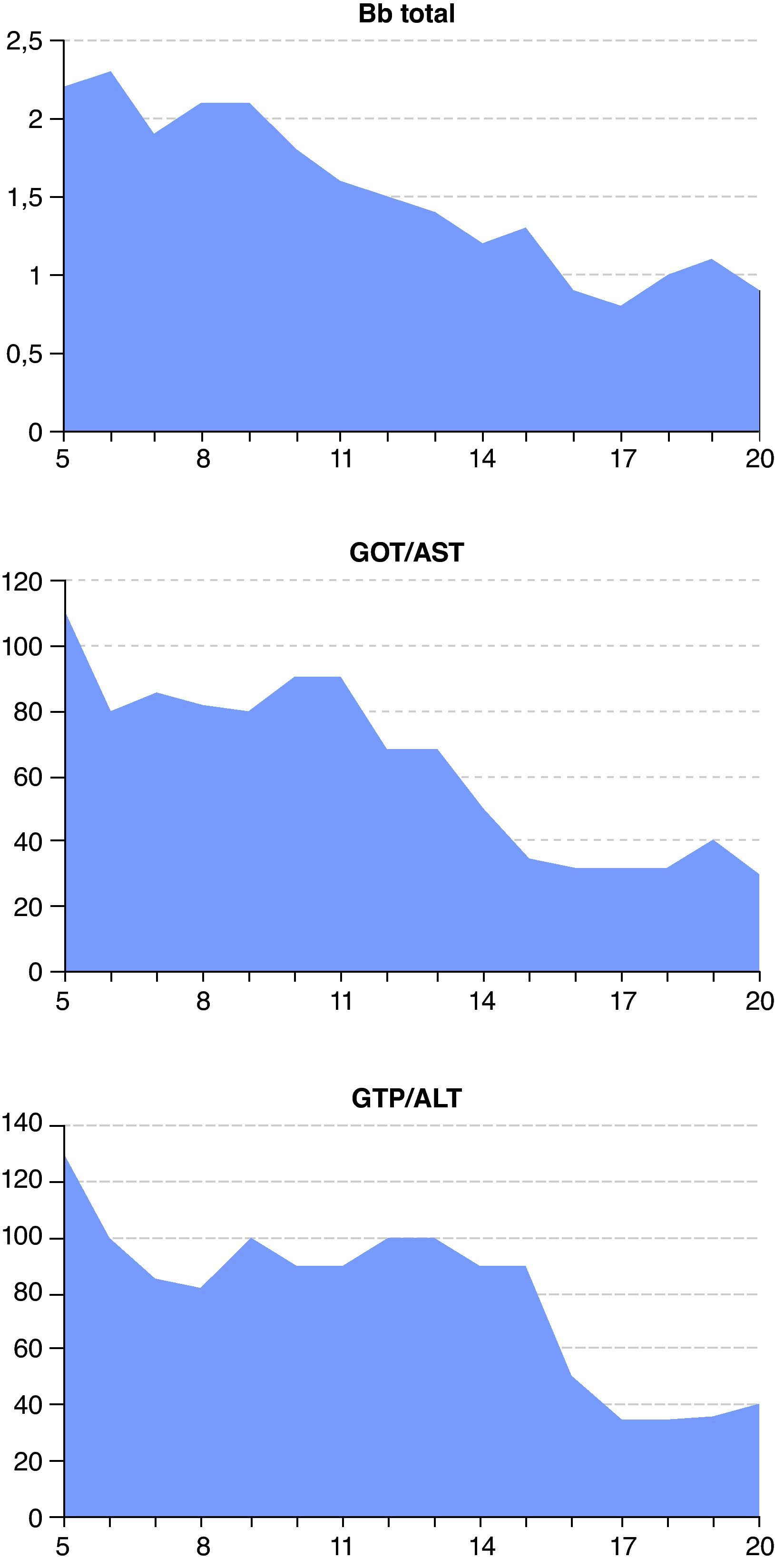
Evolución de los marcadores de función y citólisis hepática desde el día de ingreso del paciente en la unidad de cuidados intensivos (día 5) hasta su traslado a la sala de hospitalización (día 20). De izquierda a derecha: bilirrubina (Bb) total (mg/dl), aspartato aminotransferasa (GOT/AST, U/l) y alanina aminotransferasa (GPT/ALT, U/l).
Cada vez son más frecuentes los pacientes críticos en los que se inicia tratamiento antifúngico y se encuentran bajo TCRR. Aunque no hay un registro específico, el informe nacional ENVIN-UCI ofrece un porcentaje de uso de técnicas de reemplazo renal del 5,13% en 2010, y hay un aumento de éste en los últimos años8. En nuestra unidad también hemos observado esta tendencia, y nuestra tasa actual de utilización se encuentra en el 6,64%.
Las técnicas de reemplazo renal tienen como objetivo sustituir las dos funciones básicas del riñón: la eliminación de tóxicos y el control del equilibrio de fluidos. Como ya se ha comentado con anterioridad, las técnicas continuas evitan el desplazamiento rápido de líquidos y electrolitos, siendo mejor toleradas y más efectivas en el paciente hemodinámicamente inestable que las técnicas intermitentes convencionales4,15. A través de un catéter venoso central, y mediante una bomba peristáltica, se extrae sangre del paciente y se la hace circular por un circuito extracorpóreo, devolviéndola nuevamente al paciente después de haber pasado por el filtro que hace las veces de glomérulo. El filtro se compone de una membrana semipermeable que permite el paso libre al agua y a todas las moléculas con peso molecular (PM) < 60.000 daltons2.
El intercambio de solutos y agua a través de la membrana se puede realizar mediante tres mecanismos. El primer mecanismo sería la ultrafiltración o convección, que consiste en el paso simultáneo de agua y solutos a través de la membrana por presión hidrostática. Se eliminan moléculas con PM medio-alto. El segundo mecanismo sería la difusión o diálisis, que consiste en el movimiento pasivo de solutos a través de la membrana por gradiente de concentración entre la sangre y el líquido de diálisis hasta igualar las concentraciones entre la sangre y el líquido. Se eliminan moléculas con PM bajo. Finalmente, en ambos casos puede actuar un tercer mecanismo físico, que es la adsorción, en virtud de la cual se adhieren ciertos solutos y moléculas a la membrana. La mayor o menor adsorción dependerá de las características y el tipo de membrana. Así, la adsorción es mayor en las membranas sintéticas que en las celulósicas2,5.
Entre las TCRR hay diferentes modalidades. Las más frecuentemente utilizadas en la UCI son la hemofiltración venovenosa continua (HFVVC), la hemodiálisis venovenosa continua (HDVVC) y la combinación de ambas o hemodiafiltración venovenosa continua (HDFVVC).
Es esencial conocer qué factores afectan al aclaramiento de antibióticos y antifúngicos durante las TCRR para poder realizar su adecuada dosificación. Hay factores dependientes del fármaco y dependientes de la técnica. Entre los factores dependientes del fármaco, destacan la vía de eliminación, la unión a proteínas plasmáticas, el peso molecular y el volumen de distribución. En primer lugar, cuanto mayor sea su eliminación renal, más probable es que se elimine mediante las TCRR. En segundo lugar, cuanto mayor sea la unión a proteínas plasmáticas (fundamentalmente albúmina) y mayor sea el peso molecular, menor será la pérdida de éste a través de los poros de la membrana. En tercer lugar, cuanto mayor sea el volumen de distribución, menor será la proporción del fármaco en el compartimento central, y menos significativa será la cantidad eliminada mediante estas técnicas. En cuanto a los factores dependientes de la técnica, como acabamos de ver, se encuentran el tipo de técnica empleada (hemofiltración, diálisis o ambas) y las características y el tipo de membrana5.
Teniendo en cuenta las características ideales para que un fármaco no se elimine mediante las TCRR, las equinocandinas tienen un perfil bastante favorable. Así, se trata de antifúngicos con elevada unión a proteínas plasmáticas, elevado volumen de distribución y escasa eliminación renal. En cuanto al PM, siendo alto, está muy por debajo de los 60.000 daltons, por lo que la fracción libre de fármaco teóricamente se perderá a través de los poros de la membrana, sobre todo durante las técnicas de hemofiltración.
Respecto a los estudios clínicos en los que se evalúan los parámetros FC/FD de las candinas durante las TCRR, son escasos y no aportan suficiente información. Tanto los trabajos publicados con micafungina9,10 como con anidulafungina11, en los que se midieron las concentraciones de candina en plasma y en el ultrafiltrado, concluyen que no es necesario ajustar la dosis de estas candinas durante las TCRR, dado que la pérdida de fármaco no es significativa. Sin embargo, estos estudios no son comparables, ya que las TCRR y las membranas utilizadas son diferentes. Por otra parte, en ninguno de los estudios se menciona las concentraciones de proteínas plasmáticas que tenían los pacientes. La hipoproteinemia es muy frecuente en los pacientes críticos (40-50%), y su presencia, así como su magnitud, es crucial al aumentar el porcentaje de fármaco libre, que teóricamente se perdería a través de los poros de la membrana18.
Por lo tanto, teniendo en cuenta que las tres equinocandinas tienen teóricamente un buen perfil FC/FD3,6,13 para su uso durante las TCRR, basándonos en los estudios clínicos actuales, no se puede concluir que ninguna de ellas tenga ventajas respecto a las otras.
En el caso que presentamos, se planteó el tratamiento antifúngico anticipado, dado que el paciente venía acumulando factores de riesgo de CI7,12 durante los 5 días previos a su ingreso en la UCI, se encontraba en shock séptico y, además, se observaron levaduras en el líquido peritoneal. Al tratarse de un paciente crítico con enfermedad grave y siguiendo las recomendaciones actuales1,14, se decidió iniciar un tratamiento con equinocandina. Respecto a qué equinocandina era la idónea para este paciente estando en tratamiento con TCRR, como ya se ha comentado, no hay evidencia científica que permita recomendar una en concreto. Por otra parte, la hipoproteinemia inicial del paciente (fig. 4), sin ser grave, incrementaría la fracción libre de la candina elegida, lo que podría haber contribuido a la eliminación del fármaco, sobre todo por hemofiltración o convección. No se ha estudiado la importancia de este fenómeno y desconocemos si en nuestro paciente pudo ser relevante, ya que no se determinaron las concentraciones de la equinocandina en plasma o ultrafiltrado.
La presencia de insuficiencia hepática (fig. 3) fue la que hizo que finalmente optáramos por la anidulafungina, única equinocandina con metabolismo extrahepático. Aunque tanto micafungina como caspofungina pueden utilizarse en insuficiencia hepática leve y moderada6,13, la anidulafungina ofrece la ventaja de no precisar ajuste de dosis en ningún grado de insuficiencia hepática3. Una vez obtenidos los cultivos, a pesar de que el aislamiento de C. albicans era sensible a fluconazol, se decidió mantener la anidulafungina. Los motivos fueron que el paciente continuaba en SDMO y que el fluconazol, dado su perfil FC/FD, presenta un aclaramiento significativo durante las TCRR16.
ConclusionesDado su perfil FC/FD, las equinocandinas podrían administrarse con seguridad a dosis habituales en el paciente crítico con CI sometido a TCRR. No obstante, se requieren nuevos estudios en los que se tengan en cuenta factores como las concentraciones de proteínas plasmáticas y que utilicen TCRR y membranas similares.
Además, el metabolismo extrahepático de la anidulafungina la hace especialmente interesante frente al resto de equinocandinas y otros antifúngicos en pacientes con diferentes grados de insuficiencia hepática.
Conflicto de interesesLos autores han recibido honorarios de Pfizer en relación con el desarrollo de este manuscrito.