El término histiocitosis hace referencia a un grupo heterogéneo de enfermedades caracterizadas por la infiltración de células de Langerhans (CL) en diferentes órganos. La histiocitosis pulmonar (HP) es una enfermedad poco frecuente que afecta típicamente a adultos jóvenes. Su patogenia no es bien conocida, aunque se ha observado una relación con el tabaquismo, por lo que la primera medida de tratamiento que se debe realizar es el abandono de éste. Presentamos un caso de histiocitosis pulmonar que evolucionó en seis meses de forma favorable, clínica, funcional y radiológicamente como consecuencia del abandono del tabaco como único tratamiento.
The term histiocytosis refers to a heterogeneous group of diseases characterized by the infiltration of Langerhans cells (LC) in different organs. Pulmonary Histiocytosis (PH) is an uncommon disease that typically affects young adults. Its pathogeny is not well known, although a relationship with smoking has been observed. Thus, the first treatment measure should be smoking cessation. We present a case of pulmonary histiocytosis that showed a favorable clinical, functional and radiological course in six months as a consequence of using smoking cessation as the only treatment.
La histiocitosis pulmonar es una enfermedad poco frecuente, que afecta con mayor frecuencia a los adultos jóvenes. Su causa aún no se conoce, pero se ha observado repetidamente que tiene una importante relación con el consumo de tabaco. Las manifestaciones clínicas más habituales son la tos y la disnea, aunque también muchas veces es asintomática. El diagnóstico se sugiere por los hallazgos encontrados en la tomografía computarizada torácica y se confirma con la identificación de células de Langerhans en el lavado broncoalveolar o en la biopsia transbronquial. En los enfermos en los que se sospecha la existencia de una histiocitosis X y los resultados de las muestras fibrobroncoscópicas son negativas puede recurrirse a una biopsia pulmonar por videotoracoscopia. El pronóstico es variable. Puede resolverse de forma espontánea, evolucionar hacia una fibrosis pulmonar o mantenerse con un curso estable poco progresivo. Se presenta el caso de un enfermo que tuvo una rápida evolución favorable tras abandonar el consumo de tabaco.
Observación clínicaSe trata de un varón de 26 años de edad, administrativo de profesión, fumador de 10 cigarrillos al día, consumidor ocasional de hachís, sin otros antecedentes médico-quirúrgicos de interés. Acudió al servicio de urgencias por un cuadro de febrícula y tos sin expectoración de unas seis semanas de duración. No refería dolor torácico, disnea ni síndrome constitucional alguno. Había realizado viajes a Inglaterra y Portugal en el mes previo al comienzo de los síntomas. Negaba relaciones sexuales de riesgo. Había tenido dos hámsters en su casa, que precisamente habían fallecido en los quince días previos a su ingreso actual. También reconocía tener contacto con palomas, que se posaban en el alfeizar de su ventana. En el examen físico destacaba una cierta palidez cutánea y una temperatura de 37,7°C. Estaba eupneico en reposo, con una saturación de oxígeno basal del 97%. En la auscultación pulmonar se evidenciaba una disminución generalizada del murmullo vesicular. El resto de la exploración era normal.
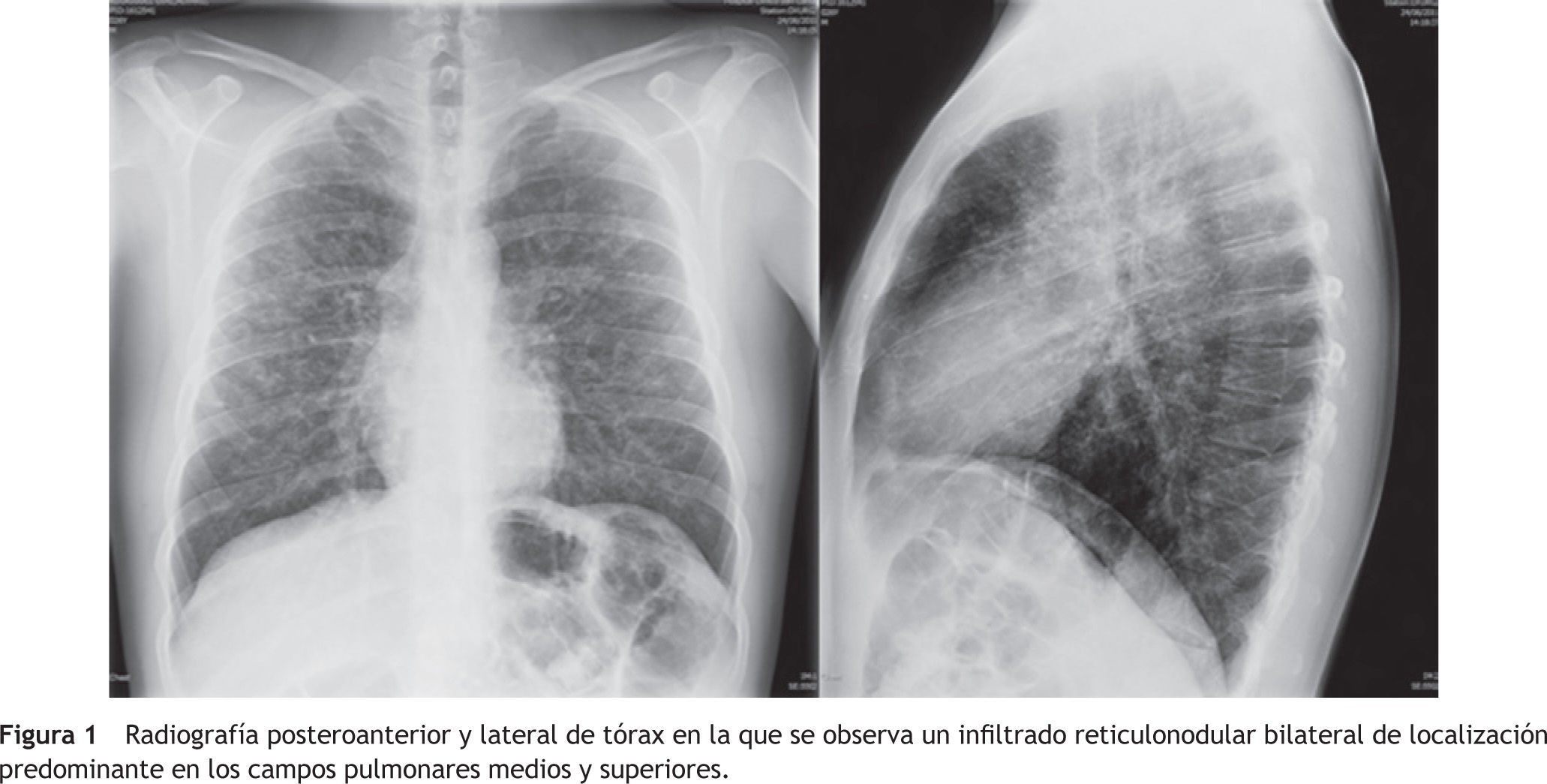
En el hemograma se observaba una hemoglobina de 14,4g/dl, un volumen corpuscular medio (VCM) de 88 fl, 9.100 leucocitos/mm3 (neutrófilos 79% y linfocitos 13%) y 321.000 plaquetas/mm3. El estudio de coagulación era normal. La bioquímica sérica mostró los siguientes hallazgos: glucosa 85mg/dl, urea 26mg/dl, creatinina 1,1mg/dl, sodio 140mmol/l, potasio 4,3mmol/l, gamma-glutamiltrans-ferasa 130UI/l, transaminasa glutámico-oxalacética 83U/L, transaminasa glutámico-pirúvica 39UI/l, fosfatasa alcalina 106UI/l, bilirrubina total 0,7mg/dl, fibrinógeno 660mg/dl y proteína C reactiva 8mg/l. En la radiografía de tórax se evidenciaba un patrón micronodular bilateral (fig.1).
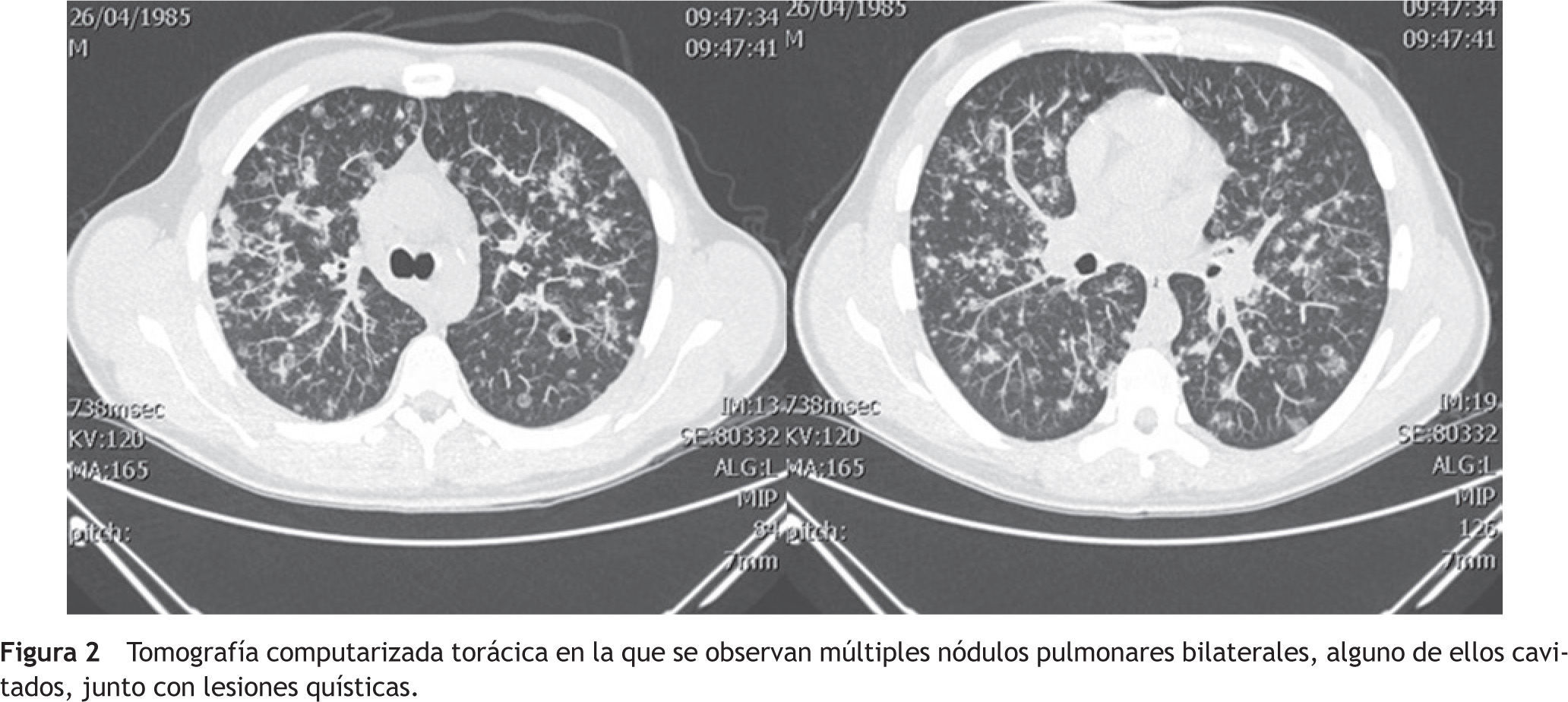
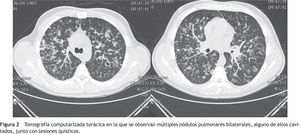
El enfermo ingresó en el Servicio de Neumología con el juicio diagnóstico de neumonía adquirida en la comunidad y la sospecha de una tuberculosis pulmonar. Se inició un tratamiento con amoxicilina-clavulánico (1g/8 horas) y azitromicina (500mg/24 horas). La tinción de Ziehl-Neelsen de esputo realizada urgentemente fue negativa. También lo fueron el test de Mantoux y el análisis serológico del virus de la inmunodeficiencia humana (VIH). En la tomografía computarizada (TC) torácica se apreciaron unas lesiones quísticas y unos nódulos pulmonares bilaterales, alguno de ellos cavitados, de localización predominante en los campos pulmonares medios y superiores. No existían adenopatías mediastínicas, hiliares, supraclaviculares ni axilares de tamaño significativo (fig. 2). Los hallazgos eran compatibles con una histiocitosis X, una micosis pulmonar y, menos probablemente, con una vasculitis. El estudio del complemento, de las inmunoglobulinas y de los autoanticuerpos en suero fue normal o negativo. En la exploración funcional respiratoria los resultados fueron los siguientes: capacidad vital forzada (FVC) 5.260ml (94%), volumen espiratorio forzado en el primer segundo (FEV1) 4.490ml (96%), cociente FEV1/FVC 85,4%, volumen residual (RV) 111%, capacidad pulmonar total (TLC) 86%, cociente RV/TLC 122%, test de transferencia del monóxido de carbono (DLCO) 74%, índice de Krogh (KCO) 88%.
En la fibrobroncoscopia no se encontraron lesiones endobronquiales. La tinción de Ziehl-Neelsen y el análisis microbiológico de hongos y Pneumocystis jiroveci de las muestras procedentes del broncoaspirado, el lavado broncoalveolar realizado en el lóbulo medio y las biopsias transbronquiales fueron negativos. En el estudio citológico del broncoaspirado y del lavado broncoalveolar no se observaron células malignas. La fórmula celular del lavado broncoalveolar mostró un 63% de macrófagos, un 31% de linfocitos y un 7% de neutrófilos. En las biopsias transbronquiales se evidenció una fibrosis escasa, con algunos macrófagos intraalveolares con hemosiderina y neutrófilos ocasionales.
Ante la sospecha de una histiocitosis pulmonar, no confirmada histológicamente, se decidió la realización de una biopsia pulmonar por videotoracoscopia. En las muestras obtenidas se observaron múltiples nódulos de contorno irregular, constituidos por células con un citoplasma eosinófilo amplio y con núcleos ovales, algunos hendidos con fibrosis, así como por eosinófilos en el estroma subyacente. Las células eran positivas para la proteína S100 y para el antígeno CD-1a. En el resto del parénquima pulmonar se apreciaba una discreta fibrosis intersticial. El diagnóstico anatomopatológico fue de histiocitosis de células de Langerhans pulmonar.
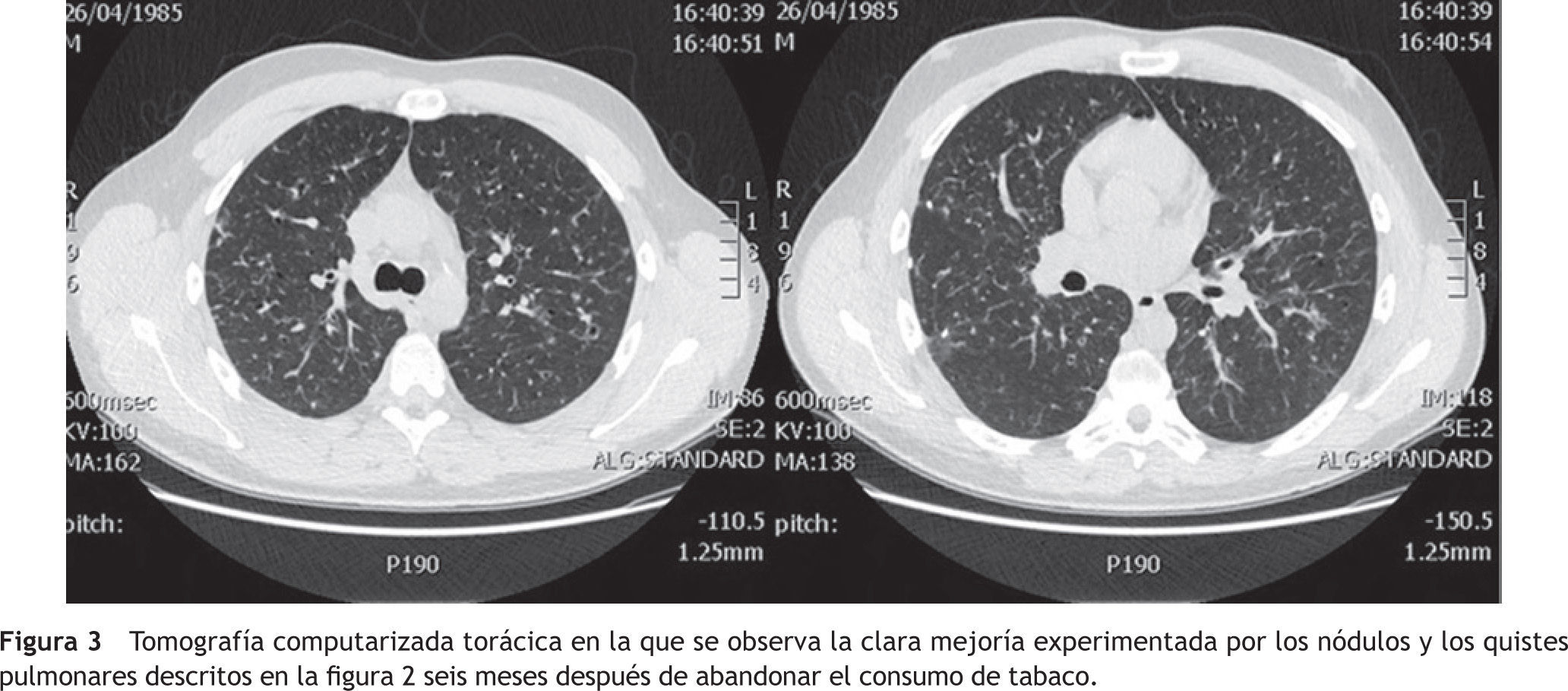
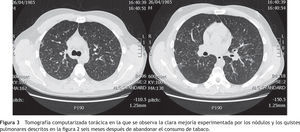
Como único tratamiento se instó al enfermo a abandonar el consumo de tabaco y, además, a evitar los lugares polucionados con humo de cigarrillos. A los seis meses el paciente estaba asintomático. No había vuelto a fumar. En las nuevas pruebas funcionales respiratorias efectuadas la DLCO fue del 85%. En la TC torácica también se evidenció, con respecto a la previa, una importante mejoría radiológica, habiendo desaparecido las lesiones nodulares cavitadas y la mayoría de las imágenes quísticas (fig.3).
Tomografía computarizada torácica en la que se observa la clara mejoría experimentada por los nódulos y los quistes pulmonares descritos en la figura 2 seis meses después de abandonar el consumo de tabaco.
La histiocitosis de células de Langerhans, histiocitosis X o histiocitosis de Hand-Schüller-Christian comprende un conjunto de enfermedades de origen desconocido, que aparecen bajo una amplia gama de formas clínicas, caracterizadas todas ellas por la infiltración por células de Langerhans, formando granulomas de los órganos y tejidos implicados1. Se incluyen en este síndrome una forma aguda diseminada, que afecta a los lactantes (enfermedad de Letterer-Siwe), el granuloma eosinófilo multifocal infantil (enfermedad de Hand-Schüller-Christian) y la histiocitosis X o granulomatosis de células de Langerhans del adulto, que es la forma tardía de la enfermedad, de localización pulmonar preferente2. Ésta es la forma que padecía el enfermo descrito. Se trata de una neumopatía intersticial poco frecuente, que se observa más en individuos caucásicos de edad comprendida entre los 20 y los 40 años. Su patogenia es desconocida. No se han encontrado factores genéticos predisponentes ni asociación familiar alguna3. Se relaciona con el consumo de tabaco, circunstancia que quizás explique el aumento en mujeres que se ha hallado en las últimas series publicadas. En este sentido, Vasallo et al4 refirieron un predominio en el genero femenino (61%) en un grupo de 102 enfermos con histiocitosis X pulmonar. Este hecho se ha atribuido a los cambios que se han producido en los últimos años en la epidemiología mundial del tabaquismo5.
La histiocitosis x de células de Langerhans (LC) abarca un grupo de desórdenes de origen desconocido con una amplia gama de presentaciones clínicas y desenlaces caracterizada por infiltración de un gran número de LC comúnmente organizadas como gránulo. Las células de Langerhans forman parte del sistema inmunitario y se encargan de presentar el antígeno, induciendo una proliferación de los linfocitos6. En el pulmón normal se localizan en el epitelio traqueobronquial, actuando como una primera línea de defensa contra los antígenos intraluminares. El tabaco incrementa su número en el pulmón7.
Las manifestaciones clínicas de la histiocitosis de células de Langerhans son variables. La enfermedad es asintomática en un 25% de los casos, planteándose el diagnóstico ante un hallazgo casual en la radiografía de tórax. Aveces predominan los síntomas respiratorios, como la tos, la disnea o el dolor torácico, que pueden acompañarse de pérdida de peso o fiebre. Otros síntomas pueden deberse a la aparición de complicaciones torácicas (neumotórax espontáneo, hemoptisis) o extratorácicas (diabetes insípida por una afectación hipotalámica o por neoplasias)8. En la radiografía de tórax suelen apreciarse infiltrados reticulonodulares o micronodulares, que predominan en los campos pulmonares medios y superiores, respetando los senos costodiafragmáticos9. La TC torácica de alta resolución tiene importancia diagnóstica. En las fases tempranas de la enfermedad se observan nódulos pulmonares de bordes irregulares y de distribución peribroncovascular principalmente. La evolución de la enfermedad da lugar a la aparición de quistes de pared fina o gruesa, por lo general irregulares10. Los quistes pueden progresar finalmente a una fibrosis y ocasionar un patrón pulmonar en panal11. Las anomalías halladas en la exploración funcional respiratoria dependen de la extensión del proceso. Pueden ser normales o evidenciar una alteración ventilatoria restrictiva de distintos grados de gravedad, aunque también se ha descrito la posibilidad de alteraciones obstructivas. La disminución de la DLCO es el trastorno más frecuente12. En este caso la DLCO inicial fue del 74%, que aumentó a un 85% a los seis meses de abandonar el consumo de tabaco.
El diagnóstico puede realizarse si se identifican las células de Langerhans en muestras histológicas procedentes de una biopsia transbronquial. El lavado broncoalveolar también tiene interés en este sentido, si se demuestra la positividad del antígeno de membrana CD1a y de la proteína intracitoplasmática S100, o se visualizan ultramicroscópicamente los característicos gránulos de Birbeck13. El diagnóstico puede establecerse si se observan, como mínimo, un 3 a 5% de células de Langerhans. Si estas pruebas son negativas puede recurrirse a una biopsia pulmonar por videotoracoscopia.
El pronóstico de la histiocitosis de células de Langerhans es variable y puede oscilar entre la estabilización, la regresión espontánea al suspender el tabaco y la evolución hacia una fibrosis pulmonar. Hasta la fecha no se cuenta con evidencia científica suficiente como para definir con seguridad cuál debe ser el mejor tratamiento para estos enfermos. Los datos de los que se dispone derivan de estudios observacio-nales y de las opiniones de expertos. El cese del consumo de tabaco es esencial y se asocia con la estabilización de los síntomas en la mayoría de los casos. Aveces basta como intervención terapeútica4. Así ocurrió en el caso que se presenta, que sólo con ello experimentó una importante mejoría clínica y radiológica. En los pacientes sintomáticos, en los que el curso evolutivo no es bueno y se produce empeoramiento de la función pulmonar se ha propuesto la utilización de corticosteroides, pero no existen estudios aleatorizados al respecto5. Los agentes quimioterápicos, como la vinblastina, el metotrexate y la ciclofosfamida se han empleado en los individuos con una enfermedad progresiva, que no responde a la corticoterapia, o que sufren una afectación multiorgánica2. En los casos más graves, que se acompañan de una insuficiencia respiratoria o de hipertensión pulmonar, puede valorarse la posibilidad de un trasplante pulmonar8.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.