A diabetes mellitus (DM) está associada a um maior risco de diversos tipos de infeção, sendo umas das comorbilidades mais comuns nos adultos com doença invasiva pneumocócica (DIP). Segundo a Organização Mundial de Saúde, a DIP é a principal causa de morte prevenível pela vacinação, pelo que a adoção de medidas que visem atenuar o impacto dos respetivos fatores de risco constitui uma preocupação das autoridades de saúde. Este artigo revê a DIP nos adultos com DM tipo 2, com especial destaque para as estratégias de prevenção nesta população.
MétodosPesquisa de publicações originais e de revisão recentes, relatórios epidemiológicos sobre DM e DIP e recomendações sobre vacinação pneumocócica pelas principais entidades de saúde pública e sociedades médicas nacionais e internacionais.
ConclusõesAs vacinas pneumocócicas, e em particular as vacinas de tecnologia conjugada, representaram um avanço muito relevante na prevenção da DIP. Assim, no âmbito da infeção pneumocócica em pessoas com doenças crónicas como a DM, a vacinação pneumocócica pode revelar‐se como uma importante medida de prevenção. Atualmente, a cobertura da vacinação pneumocócica nos doentes com DM é baixa, tornando‐se essencial o papel das sociedades médicas e das autoridades de saúde no delineamento de estratégias que visem a imunização mais abrangente desta população.
Diabetes mellitus (DM) is associated with increased risk of several types of infection and is one of the most common comorbidities in the adult population with Invasive Pneumococcal Disease (IPD). According to the World Health Organization (WHO), IPD is the leading cause of vaccine‐preventable deaths, making the implementation of measures to minimize the impact of this disease's underlying risk factors, a concern for health authorities. In the present work, we review IPD among adults with type 2 DM, with emphasis in the immunization strategies in this population.
MethodsSearch for recent research and review papers, epidemiological reports related to DM and DIP and recommendations regarding pneumococcal immunization from national and international public health entities and medical societies.
ConclusionsPneumococcal vaccines, particularly the conjugated ones, represent a marked progress in the prevention of IPD. Therefore, in individuals with chronic diseases such as DM, pneumococcal vaccination can constitute an important preventive measure. However, currently pneumococcal vaccination coverage in this specific population is low, hence, the role of medical societies and health authorities is essential to the adoption of broader immunization strategies.
A diabetes mellitus (DM) está associada a um maior risco de vários tipos de infeção, sendo umas das comorbilidades mais frequentes nos adultos com doença pneumocócica1. A DM está também associada a um risco aumentado de hospitalizações e mortalidade por infeção pneumocócica2,3.
Em 2013, a prevalência estimada da DM em Portugal no grupo etário entre 20‐79 anos foi de 13,0%. As patologias respiratórias foram responsáveis por 12,0% dos internamentos nos doentes com DM e por 16,2% da letalidade intra‐hospitalar registada4.
Segundo a Organização Mundial de Saúde (OMS), a doença invasiva pneumocócica (DIP) constitui a principal causa de morte prevenível pela vacinação. Deste modo, a adoção de medidas de saúde pública com vista a atenuar o impacto dos fatores de risco de DIP é uma preocupação das autoridades de saúde em todo mundo5.
Este trabalho consiste numa revisão bibliográfica sobre a DIP na população adulta com DM tipo 2, com especial destaque para as estratégias de prevenção da doença.
MétodosEste trabalho teve por base publicações originais e de revisão recentes sobre o tema. Foram ainda pesquisados relatórios com dados epidemiológicos sobre DM e DIP, recomendações sobre vacinação pneumocócica das principais entidades de saúde pública e sociedades médicas nacionais e internacionais, bem como documentos da OMS, da Agência Europeia do Medicamento (EMA) e da Autoridade Nacional do Medicamento e Produtos de Saúde I.P. (INFARMED, I.P.).
A diabetes mellitus e as doenças infecciosasO aumento da prevalência da DM constitui uma preocupação de saúde pública. Estima‐se que atualmente existam cerca de 371 milhões de pessoas com DM, correspondendo a 8,3% da população mundial, projetando‐se que este número atinja os 552 milhões em 20306,7.
As doenças infecciosas são, de uma forma geral, mais frequentes e/ou mais graves nos doentes com DM, situação que potencia a morbilidade e mortalidade nesta população8,9. Esta maior suscetibilidade dos doentes com DM inclui não apenas as infeções em geral, mas também infeções consideradas exclusivas da DM, como por exemplo a mucormicose rinocerebral8,10.
A maior prevalência de infeções na DM é evidenciada por alguns estudos populacionais11. Um estudo canadiano, no qual foram incluídos indivíduos com DM diagnosticada até 1999, mostrou que cerca de metade dessa população notificou, pelo menos, uma doença infecciosa ou hospitalização por esse motivo. O risco de hospitalização e mortalidade devido a infeções foi aproximadamente 2 vezes superior nos doentes com DM, comparativamente a uma coorte de indivíduos sem DM1. Um estudo prospetivo conduzido na Holanda, entre 2000‐2002, em indivíduos com DM tipo 1 e 2, mostrou que este grupo apresenta um risco médio aumentado de cerca de 30 a 40% para o desenvolvimento de infeções do trato respiratório inferior, trato urinário, pele e mucosas, quando comparado com uma coorte controlo de hipertensos sem DM3.
Diversos mecanismos fisiopatológicos podem explicar a maior suscetibilidade dos doentes com diabetes à infeção, nomeadamente o ambiente hiperglicémico que propicia alterações no sistema imunitário (ex. alterações funcionais dos neutrófilos, depressão do sistema antioxidante e disfunção da imunidade humoral), micro e macro‐angiopatias, neuropatia, diminuição da atividade antibacteriana na urina, dismotilidade gastrointestinal e urinária, bem como um maior número de intervenções médicas8.
A diabetes mellitus e as infeções respiratóriasA DM constitui, por si só, um fator de risco para o desenvolvimento de infeções do trato respiratório12.
Globalmente, as infeções do trato respiratório mais frequentes nos doentes com DM são as infeções por Streptococcus pneumoniae (S. pneumoniae), pelo vírus influenza A, vírus H1N113 e a tuberculose14,15 constituindo‐se, as 2 primeiras, como as infeções com maior incidência nesta população16,17.
Existem poucos estudos que descrevam taxas de morbilidade e mortalidade resultantes de infeções por S. pneumoniae e pelo vírus influenza em doentes com DM. Geralmente, esses estudos reportam simultaneamente resultados sobre estes 2 tipos de infeção. Para além disso, os estudos observacionais disponíveis apresentam uma grande heterogeneidade entre si na população e outcomes analisados, facto que dificulta a síntese dos dados através de meta‐análises. Fatores de enviesamento, como a idade e a presença de doenças cardiopulmonares, também dificultam a avaliação do impacto da DM neste tipo de infeções respiratórias9.
A evidência disponível permite concluir que algumas doenças crónicas, incluindo a DM, aumentam o risco de morbilidade, hospitalização e mortalidade devido a infeção por S. pneumoniae e vírus influenza2,11. Valdez et al.18 avaliaram o impacto da DM na mortalidade por pneumonia e influenza entre 1987‐1989, utilizando a base de dados de vigilância norte‐americana. Os autores observaram que a morbilidade e mortalidade foram significativamente mais elevadas na população com DM durante os surtos epidémicos destas infeções. Este risco foi particularmente elevado nas mulheres e no grupo etário dos 25 aos 64 anos. Estudos que caracterizaram a epidemiologia da doença pneumocócica em diversos países mostraram que a DM é uma das comorbilidades mais comuns neste tipo de infeção19–24.
A diabetes mellitus como fator de risco da doença invasiva pneumocócicaA DIP é definida pelo isolamento do S. pneumoniae no sangue, líquido céfalorraquidiano, líquido pleural ou peritoneal, ou noutro local do organismo habitualmente estéril25–27. O espectro clínico da DIP engloba diversas patologias, tais como bacteriemia, meningite, pneumonia complicada (com bacteriemia, com derrame pleural e/ou empiema) ou, mais raramente, endocardite e peritonite, entre outras infeções causadas pelo S. pneumoniae. Na população adulta total ou com mais de 65 anos de idade, respetivamente 75 a 80% dos casos de DIP correspondem a quadros de pneumonia com bacteriemia28,29.
O S. pneumoniae é a principal causa de pneumonia em todo o mundo, estimando‐se que seja responsável por cerca de 30 a 50% dos casos de pneumonia adquirida na comunidade (PAC) com necessidade de hospitalização30–32.
Froes et al.33, num estudo retrospetivo promovido pela Sociedade Portuguesa de Pneumologia, estimaram a incidência de internamentos por PAC na população adulta em Portugal Continental entre 2000‐2009. Este estudo demonstrou que as hospitalizações por PAC corresponderam a 3,7% do total de hospitalizações registadas na base de dados da Administração Central do Sistema de Saúde (ACSS) nesse período. Observou‐se uma incidência anual de hospitalização por PAC de 3,61 casos por 1.000 habitantes. Comparando as faixas etárias <50 e ≥50 anos, esta incidência aumentou de 0,66 para 7,49 casos por 1.000 habitantes, tendo atingido 13,4 casos por 1.000 habitantes no grupo etário acima dos 65 anos. Entre 2005‐2009 a taxa anual de internamentos por PAC aumentou 28,2% comparativamente aos 5 anos anteriores. A letalidade intra‐hospitalar média no período total em estudo foi de 20,4%34.
Os principais fatores de risco de DIP incluem a idade, doenças crónicas, imunossupressão e fatores socioeconómicos, ambientais e relacionados com estilos de vida35–40 (tabela 1).
Principais fatores de risco de doença invasiva pneumocócica na população adulta
| Fatores intrínsecos | Fatores externos | Estilos de vida | ||
|---|---|---|---|---|
| Idade | IndivíduosImunocompetentes | IndivíduosImunocomprometidos | ||
| ≥65 anos | • Doença cardíaca crónica• Doença pulmonar crónicaa• Asplenia anatómica ou funcional• Diabetes mellitus• Doença hepática crónica• Fístula do líquido céfalo‐raquidiano | • Infeção por VIH• Insuficiência renal crónica, síndrome nefrótico• Neoplasia (de órgão sólido ou hematológica)• Transplante de órgão sólido• Doença autoimune• Terapêutica imunossupressora• Imunodeficiência primária | SocioeconómicosAmbientais:• Infeção viral das vias respiratórias prévia (ex: influenza)• Residência em lares ou unidades de cuidados continuados | • Tabagismo• Alcoolismo |
Kyaw et al.21 observaram que a incidência de DIP na população adulta nos Estados Unidos da América (EUA), entre 1999‐2000, foi superior nos indivíduos com comorbilidades específicas comparativamente à população saudável (definida pelos autores). A taxa de incidência de DIP por 100.000 habitantes variou entre 8,8 casos na população saudável e 503,1 casos em indivíduos com neoplasias hematológicas (risco relativo [RR] ajustado 38,3; IC95% 15,5‐92,2). A incidência de DIP associada a DM foi de 51,4 casos por 100.000 habitantes (RR ajustado 3,4; IC95% 1,8‐6,4).
Num estudo populacional conduzido em Inglaterra, van Hoek et al.41 avaliaram indivíduos hospitalizados por DIP entre 2002‐2009 e estabeleceram o aumento de risco desta entidade em determinadas comorbilidades relativamente ao da população em geral, considerada saudável. Quer a incidência de DIP, quer a mortalidade associada aumentaram consideravelmente nos indivíduos com comorbilidades, em especial nos doentes imunocomprometidos, com doença respiratória crónica ou com doença hepática. Também no grupo de indivíduos com DM, o risco de hospitalização por DIP foi superior ao da população em geral, sendo mais acentuado no grupo etário entre 16‐64 anos de idade (odds ratio [OR] 4,6; IC95% 4,2‐5,0).
Tendo por base dados populacionais e laboratoriais relativos a casos de DIP observados no ano de 2009 em adultos nos EUA, Muhammad et al28 observaram que a infeção por VIH/SIDA, alcoolismo e DM foram as comorbilidades mais frequentes no grupo etário entre 18‐49 anos, sendo a DM a comorbilidade mais frequente no grupo etário dos 50 aos 64 anos. As comorbilidades mais prevalentes no grupo acima dos 65 anos foram as doenças cardíacas, doença pulmonar obstrutiva crónica e DM. Apesar da prevalência dos fatores de risco analisados ter variado em função do grupo etário, a DM foi único fator que apresentou uma frequência elevada em todos os grupos etários analisados.
Outros estudos confirmaram que a DM é uma comorbilidade frequente em adultos hospitalizados por PAC42–44 e pneumonia com bacteriemia45,46, constituindo‐se também como um fator de risco independente deste tipo de infeções47.
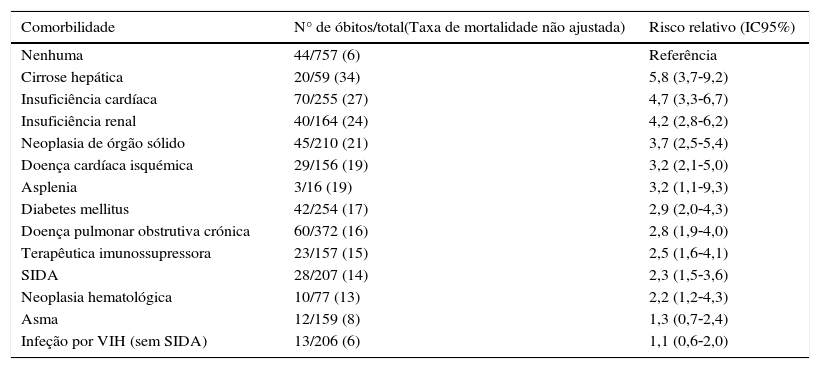
Vários estudos avaliaram a mortalidade da DIP em doentes com fatores de risco48–50. Fekin et al.48 reportaram as taxas de mortalidade nos doentes internados por DIP nos EUA, entre 1995‐1997, em função das comorbilidades. A cirrose hepática, insuficiência cardíaca congestiva e insuficiência renal foram as comorbilidades que mais significativamente aumentaram o risco de mortalidade nesta população. A DM foi identificada em cerca de 17% dos casos de mortalidade nos doentes internados por DIP (RR 2,9; IC95% 2,0‐4,3) (tabela 2).
Estratificação por comorbilidade da taxa de mortalidade em doentes internados por doença invasiva pneumocócica nos Estados Unidos da América entre 1995‐199748
| Comorbilidade | N° de óbitos/total(Taxa de mortalidade não ajustada) | Risco relativo (IC95%) |
|---|---|---|
| Nenhuma | 44/757 (6) | Referência |
| Cirrose hepática | 20/59 (34) | 5,8 (3,7‐9,2) |
| Insuficiência cardíaca | 70/255 (27) | 4,7 (3,3‐6,7) |
| Insuficiência renal | 40/164 (24) | 4,2 (2,8‐6,2) |
| Neoplasia de órgão sólido | 45/210 (21) | 3,7 (2,5‐5,4) |
| Doença cardíaca isquémica | 29/156 (19) | 3,2 (2,1‐5,0) |
| Asplenia | 3/16 (19) | 3,2 (1,1‐9,3) |
| Diabetes mellitus | 42/254 (17) | 2,9 (2,0‐4,3) |
| Doença pulmonar obstrutiva crónica | 60/372 (16) | 2,8 (1,9‐4,0) |
| Terapêutica imunossupressora | 23/157 (15) | 2,5 (1,6‐4,1) |
| SIDA | 28/207 (14) | 2,3 (1,5‐3,6) |
| Neoplasia hematológica | 10/77 (13) | 2,2 (1,2‐4,3) |
| Asma | 12/159 (8) | 1,3 (0,7‐2,4) |
| Infeção por VIH (sem SIDA) | 13/206 (6) | 1,1 (0,6‐2,0) |
Van Hoek et al.41 mostraram que o risco de mortalidade por DIP nos indivíduos com pelo menos um fator de risco foi mais elevado em todos os grupos etários analisados, sendo mais notório no grupo dos 16 aos 64 anos de idade (OR 3,9; IC95% 3,4‐4,4). O risco de mortalidade nos indivíduos com DM foi mais acentuado no grupo etário entre 16‐64 anos (OR 4,6; IC95% 4,2‐5,0).
O diagnóstico laboratorial da DIP é estabelecido através de cultura e/ou outras técnicas laboratoriais que permitam a identificação do S. pneumoniae. É provável que, para uma parte significativa das populações analisadas nesses estudos, não tenham sido obtidas amostras para confirmação do agente infeccioso ou que o microrganismo não tenha sido identificado. Outras limitações dos estudos disponíveis incluem o número de indivíduos analisados em alguns grupos populacionais, as técnicas de amostragem e a identificação do grupo de controlo9. No entanto, o risco acrescido de incidência e mortalidade por DIP nos doentes com DM constitui a base para o potencial benefício da utilização de vacinas, com o objetivo de prevenir a infeção por S. pneumoniae.
Tipos de vacinas pneumocócicas e sua efetividadeAtualmente estão disponíveis 2 tipos de vacinas pneumocócicas: a vacina pneumocócica polissacárida 23‐valente (VPP23) e as vacinas pneumocócicas polissacáridas conjugadas com um número progressivamente crescente, ao longo dos últimos anos, de polissacáridos capsulares de diferentes serotipos: 7‐valente (VPC7), 10‐valente (VPC10) e 13‐valente (VPC13)25.
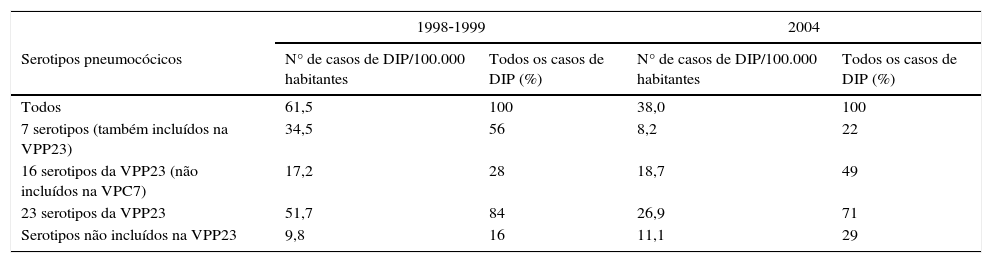
A VPP23 contém polissacáridos capsulares de 23 serotipos de S. pneumoniae e está disponível em Portugal desde 1996, com indicação para a imunização ativa em indivíduos de alto risco a partir dos 2 anos de idade51,52. No entanto, a proporção de serotipos incluídos na VPP23 causadores de DIP na população adulta tem‐se mantido estável e acima dos 80% desde a introdução desta vacina53. Dois fatores poderão explicar esta situação: a reduzida utilização desta vacina na população portuguesa54 e a sua efetividade modesta55. Nos EUA, um país com uma taxa de cobertura de VPP23 superior a Portugal, comparando 2 períodos de tempo (1998‐1999 e 2004) em que a utilização da VPP23 em idades acima dos 65 anos aumentou de 54 para 65%, a incidência da DIP nessa população reduziu de forma significativa após a introdução da VPC7 na população pediátrica. No entanto, a incidência devido aos serotipos exclusivos da VPP23 aumentou de 17,2/100.000 habitantes para 18,7/100.000 habitantes56 (tabela 3).
Epidemiologia da doença invasiva pneumocócica na população adulta ≥65 anos de idade antes (1998‐1999) e após (2004) a introdução da vacina pneumocócica conjugada 7‐valente na população pediátrica em 2000 (adaptado de Jackson et al.56)
| 1998‐1999 | 2004 | |||
|---|---|---|---|---|
| Serotipos pneumocócicos | N° de casos de DIP/100.000 habitantes | Todos os casos de DIP (%) | N° de casos de DIP/100.000 habitantes | Todos os casos de DIP (%) |
| Todos | 61,5 | 100 | 38,0 | 100 |
| 7 serotipos (também incluídos na VPP23) | 34,5 | 56 | 8,2 | 22 |
| 16 serotipos da VPP23 (não incluídos na VPC7) | 17,2 | 28 | 18,7 | 49 |
| 23 serotipos da VPP23 | 51,7 | 84 | 26,9 | 71 |
| Serotipos não incluídos na VPP23 | 9,8 | 16 | 11,1 | 29 |
DIP: doença invasiva pneumocócica; VPC13: vacinas pneumocócicas conjugadas; VPP23: vacina pneumocócica polissacárida 23‐valente.
Relativamente à efetividade da VPP23, uma revisão sistemática mostrou um efeito protetor desta vacina na prevenção da DIP e pneumonia por todas as causas em adultos saudáveis. Contudo, em adultos com risco acrescido de DIP esta vacina não tem demonstrado de forma consistente um efeito protetor55.
Os polissacáridos pneumocócicos per se são antigénios T‐independentes, traduzindo‐se num envolvimento limitado dos linfócitos T, na geração de anticorpos essencialmente do tipo IgM na resposta imunitária primária, e na baixa produção de linfócitos B de memória, o que resulta na baixa persistência de memória imunológica25,55,57,58. Nos 2 primeiros anos de vida, altura em que o risco de infeção por S. pneumoniae é muito elevado, uma baixa resposta imunitária aos antigénios polissacáridos simples contraindica a utilização deste tipo de vacina5.
A tecnologia conjugada consiste na ligação química dos polissacáridos isolados das cápsulas dos vários serotipos a uma proteína transportadora, o que possibilita a ativação e envolvimento dos linfócitos T na resposta imunitária, na geração de anticorpos essencialmente do tipo IgG na resposta imunitária primária e na formação de linfócitos B de memória. As vacinas conjugadas permitem uma proteção mais prolongada, comparativamente às vacinas polissacáridas simples, e conferem uma resposta anamnésica à revacinação59,60. Para além disso, as vacinas conjugadas, por modificarem o estado de portador nasofaríngeo, potencialmente possibilitam uma proteção indireta de indivíduos não vacinados de outros grupos etários61.
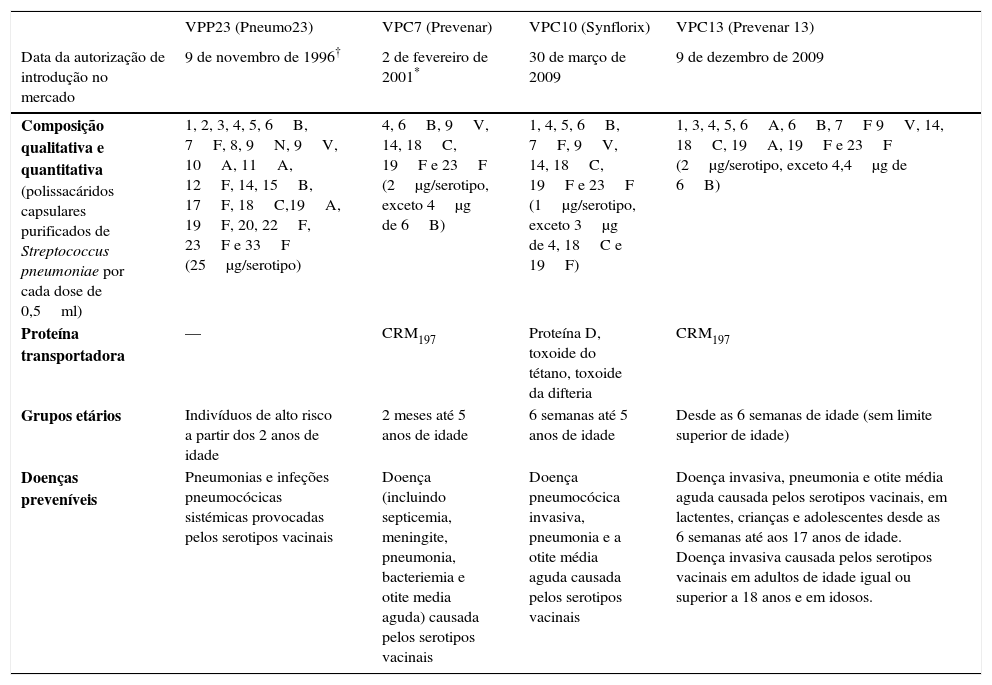
A tabela 4 resume as características das vacinas pneumocócicas autorizadas em Portugal.
Principais características das vacinas pneumocócicas autorizadas em Portugal52,62–64
| VPP23 (Pneumo23) | VPC7 (Prevenar) | VPC10 (Synflorix) | VPC13 (Prevenar 13) | |
|---|---|---|---|---|
| Data da autorização de introdução no mercado | 9 de novembro de 1996† | 2 de fevereiro de 2001* | 30 de março de 2009 | 9 de dezembro de 2009 |
| Composição qualitativa e quantitativa (polissacáridos capsulares purificados de Streptococcus pneumoniae por cada dose de 0,5ml) | 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C,19A, 19F, 20, 22F, 23F e 33F (25μg/serotipo) | 4, 6B, 9V, 14, 18C, 19F e 23F (2μg/serotipo, exceto 4μg de 6B) | 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F e 23F (1μg/serotipo, exceto 3μg de 4, 18C e 19F) | 1, 3, 4, 5, 6A, 6B, 7F 9V, 14, 18C, 19A, 19F e 23F (2μg/serotipo, exceto 4,4μg de 6B) |
| Proteína transportadora | — | CRM197 | Proteína D, toxoide do tétano, toxoide da difteria | CRM197 |
| Grupos etários | Indivíduos de alto risco a partir dos 2 anos de idade | 2 meses até 5 anos de idade | 6 semanas até 5 anos de idade | Desde as 6 semanas de idade (sem limite superior de idade) |
| Doenças preveníveis | Pneumonias e infeções pneumocócicas sistémicas provocadas pelos serotipos vacinais | Doença (incluindo septicemia, meningite, pneumonia, bacteriemia e otite media aguda) causada pelos serotipos vacinais | Doença pneumocócica invasiva, pneumonia e a otite média aguda causada pelos serotipos vacinais | Doença invasiva, pneumonia e otite média aguda causada pelos serotipos vacinais, em lactentes, crianças e adolescentes desde as 6 semanas até aos 17 anos de idade. Doença invasiva causada pelos serotipos vacinais em adultos de idade igual ou superior a 18 anos e em idosos. |
A VPC7 foi introduzida em Portugal em 2001, tendo sido utilizada até ao início de 2010 com indicação para a imunização de crianças a partir dos 2 meses até aos 5 anos de idade58,65. Em virtude da comprovada eficácia, efetividade e segurança da VPC7, a OMS passou a recomendar a sua inclusão nos programas de imunização de rotina, sobretudo nos países com mortalidade elevada no grupo etário abaixo dos 5 anos25,66.
Após a introdução da VPC7 no programa de imunização de rotina dos EUA, foi possível observar um decréscimo acentuado da incidência de DIP, não apenas na população pediátrica alvo, mas também na população não imunizada com esta vacina. Em 2007, a redução do número de casos de DIP causados pelos serotipos da VPC7 foi de 94% em todos os grupos etários e de 100% nas crianças com idade inferior a 5 anos, comparativamente a valores registados entre 1998‐1999. Foi também observada uma redução da incidência da DIP pelos 7 serotipos incluídos na vacina na população adulta não imunizada, sugerindo que as crianças constituem um veículo importante de transmissão desta bactéria na população em geral56,67–69. Reduções acentuadas na incidência de DIP foram igualmente observadas na Europa após a introdução da VPC7, sobretudo nos países que introduziram esta vacina nos programas de imunização de rotina25,70–72.
Em Portugal, estudos conduzidos na população pediátrica permitem traçar a evolução epidemiológica da DIP, desde a introdução da VPC7 em 2001, tendo‐se observado um decréscimo da incidência de DIP em cerca de 40% nas crianças abaixo dos 2 anos de idade73–75.
Em 2009, foram aprovadas pela EMA duas vacinas pneumocócicas conjugadas. A VPC10, que contém os 7 serotipos de VPC7 e os serotipos 1, 5 e 7F. A VPC13 foi aprovada para utilização em lactentes e crianças pequenas (até aos 5 anos de idade, inclusive). Esta vacina foi desenvolvida com base na VPC7, tendo sido incluídos 6 serotipos adicionais (1, 3, 5, 6A, 7F e 19A). Estima‐se que os 13 serotipos incluídos na VPC13 sejam responsáveis por 73 a 100% dos casos de DIP na população pediátrica na Europa65; em Portugal causaram cerca de 76,7% dos casos em crianças de idade inferior a 2 anos e 86,9% nas crianças entre 2‐5 anos de idade, no período de 2006 a 200873.
A efetividade da VPC13 na população pediátrica foi demonstrada nos EUA, tendo sido observada entre 2004‐2012 uma redução de 88% da incidência de DIP pelos serotipos vacinais 1, 3, 5, 7F e 19A76. Esta efetividade também foi demonstrada na Europa, onde a incidência de DIP em crianças <12 meses de idade pelos 13 serotipos incluídos na VPC13 diminuiu em cerca de 75% em Inglaterra, País de Gales e Irlanda do Norte, desde a introdução desta vacina em 2010 nestes países77. Na Noruega, a diminuição da incidência de DIP pelos serotipos vacinais em crianças <2 anos de idade atingiu 100% em 2012, comparativamente a 201078.
Em dezembro de 2011, a EMA aprovou a extensão da indicação da VPC13 para a prevenção da DIP por S. pneumoniae, em adultos com idade igual ou superior a 50 anos65,79. Estima‐se que na Europa os serotipos incluídos na VPC13 sejam responsáveis por 50‐76% dos casos de DIP em adultos acima dos 50 anos79,80. Em Portugal, estes 13 serotipos causaram 70,2% dos casos de DIP em toda a população adulta, em 200853.
Em dezembro de 2012, a indicação terapêutica da VPC13 foi estendida para o grupo etário dos 6 aos 17 anos inclusive e posteriormente para o grupo dos 18 aos 49 anos, sendo que, em Portugal, a concordância de serotipos para estas faixas etárias é de 87,9 e 68%, respetivamente53,64,73.
Recentemente, um ensaio clínico para avaliar a eficácia da VPC13 (CAPiTA, Community‐Acquired Pneumonia Immunization Trials in Adults), conduzido na Holanda entre 2008‐2013, envolvendo 84.496 residentes na comunidade com idade igual ou superior a 65 anos, mostrou uma redução estatisticamente significativa de 45,6% dos primeiros episódios de PAC pneumocócica e uma redução de 75,0% de primeiros episódios de DIP, pelos serotipos vacinais, em indivíduos que receberam esta vacina comparativamente ao placebo81. Os resultados deste estudo sustentaram a indicação da VPC13 para a prevenção da pneumonia pneumocócica para a população adulta (≥18 anos) na União Europeia.
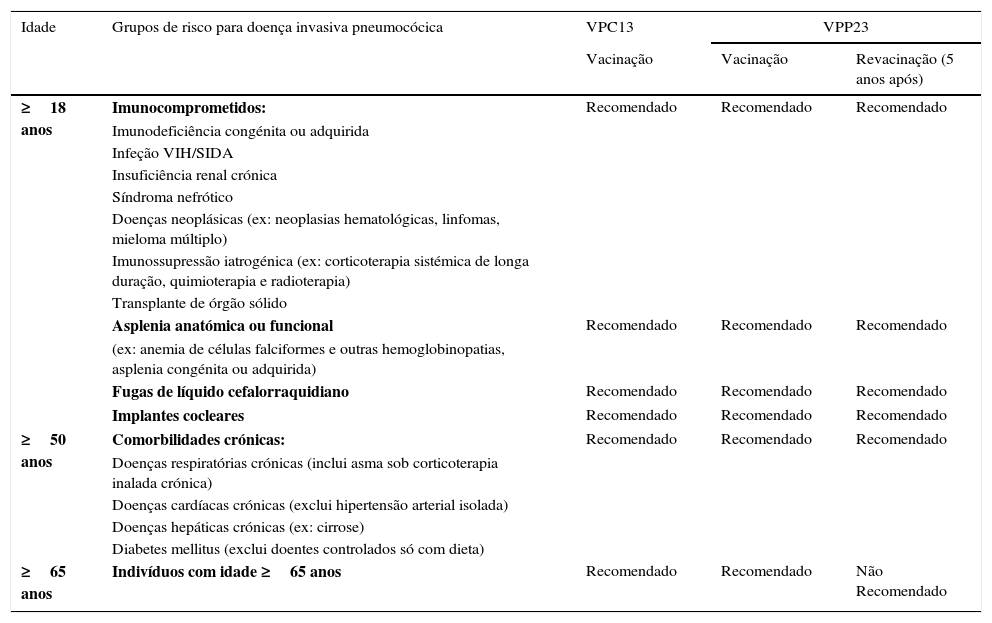
Situação atual da vacinação pneumocócica na população adulta em PortugalO grupo de trabalho da Comissão de Infecciologia Respiratória da Sociedade Portuguesa de Pneumologia, no recente Documento de Consenso para a Prevenção das Infeções Respiratórias no Adulto, recomenda a vacinação pneumocócica em todas as pessoas com idade igual ou superior a 65 anos, a vacinação dos adultos com patologias crónicas com idade igual ou superior a 50 anos e ainda a vacinação dos indivíduos com idade igual ou superior a 18 anos, caso se enquadrem num dos grupos de risco definidos na tabela 582.
Recomendações de vacinação antipneumocócica no adulto de acordo com o risco de doença invasiva pneumocócica (adaptado de Froes e colegas82)
| Idade | Grupos de risco para doença invasiva pneumocócica | VPC13 | VPP23 | |
|---|---|---|---|---|
| Vacinação | Vacinação | Revacinação (5 anos após) | ||
| ≥18 anos | Imunocomprometidos: | Recomendado | Recomendado | Recomendado |
| Imunodeficiência congénita ou adquirida | ||||
| Infeção VIH/SIDA | ||||
| Insuficiência renal crónica | ||||
| Síndroma nefrótico | ||||
| Doenças neoplásicas (ex: neoplasias hematológicas, linfomas, mieloma múltiplo) | ||||
| Imunossupressão iatrogénica (ex: corticoterapia sistémica de longa duração, quimioterapia e radioterapia) | ||||
| Transplante de órgão sólido | ||||
| Asplenia anatómica ou funcional | Recomendado | Recomendado | Recomendado | |
| (ex: anemia de células falciformes e outras hemoglobinopatias, asplenia congénita ou adquirida) | ||||
| Fugas de líquido cefalorraquidiano | Recomendado | Recomendado | Recomendado | |
| Implantes cocleares | Recomendado | Recomendado | Recomendado | |
| ≥50 anos | Comorbilidades crónicas: | Recomendado | Recomendado | Recomendado |
| Doenças respiratórias crónicas (inclui asma sob corticoterapia inalada crónica) | ||||
| Doenças cardíacas crónicas (exclui hipertensão arterial isolada) | ||||
| Doenças hepáticas crónicas (ex: cirrose) | ||||
| Diabetes mellitus (exclui doentes controlados só com dieta) | ||||
| ≥65 anos | Indivíduos com idade ≥65 anos | Recomendado | Recomendado | Não Recomendado |
VPC13: vacina pneumocócicas conjugadas; VPP23: vacina pneumocócica polissacárida 23‐valente.
São igualmente propostos neste documento esquemas de administração sequencial entre as vacinas pneumocócicas, recomendando‐se nos adultos não previamente vacinados, administrar primeiro a VPC13, seguida de uma dose de VPP23 pelo menos 8 semanas mais tarde82.
O grupo de trabalho recomenda a vacinação pneumocócica em condições específicas em indivíduos não vacinados (tabela 6).
Recomendações de vacinação antipneumocócica em condições específicas (adaptado de Froes et al.82)
| Condição | Recomendação de vacinação (indivíduos não vacinados) |
|---|---|
| Infeção VIH/SIDA | ‐ precocemente, preferencialmente com linfócitos TCD4+≥200/mm3; se TCD4+<200/mm3, vacinar sem necessidade de aguardar reconstituição imunitária e considerar revacinação após TCD4+≥200/mm3; |
| Esplenectomia cirúrgica | ‐ na cirurgia eletiva, pelo menos 2 semanas antes da cirurgia; |
| ‐ na cirurgia não‐programada, vacinar 2 semanas após a cirurgia; | |
| Doenças autoimunes | ‐ precocemente e antes do início da terapêutica imunossupressora |
| Em espera para transplante de órgão sólido | ‐ precocemente, no mínimo 2 a 4 semanas antes do transplante |
| Transplante de órgão sólido | ‐ iniciar vacinação 6 meses após o transplante |
| Transplante de células hematopoiéticas | ‐ iniciar vacinação 3 a 6 meses após o transplante |
| Doenças neoplásicas em quimioterapia e/ou radioterapia | ‐ 10 a 14 dias antes do tratamento ou 3 meses após conclusão da quimioterapia ou radioterapia. Se a vacina for administrada no decurso da quimioterapia, ponderar revacinar 3 meses após conclusão do tratamento |
Recentemente, a Direcção‐Geral da Saúde (DGS) emitiu recomendações para a vacinação pneumocócica (VPC13 e VPP23) em adultos (≥18 anos de idade) com risco acrescido para DIP, no qual se incluem doentes com DM requerendo tratamento farmacológico (tabela 7)83.
Grupos com risco acrescido para DIP na população adulta (≥18 anos de idade), para os quais a vacinação (VPC13 e VPP23) contra a infeção por S. pneumoniae é recomendada (adaptado da Norma 11/2015 da Direcção‐Geral da Saúde83)
| Condições abrangidas em adultos imunocompetentes | • Doença cardíaca crónica |
| ∘ Insuficiência cardíaca crónica | |
| ∘ Doença cardíaca isquémica | |
| ∘ Hipertensão arterial pulmonar | |
| ∘ Cardiomiopatias | |
| • Doença hepática crónica | |
| • Insuficiência renal crónica | |
| • Doença respiratória crónica | |
| ∘ Insuficiência respiratória crónica | |
| ∘ Doença pulmonar obstrutiva crónica | |
| ∘ Enfisema | |
| ∘ Asma brônquica (sob corticoterapia sistémica ou inalada crónica) | |
| ∘ Bronquiectasias | |
| ∘ Doença intersticial pulmonar | |
| ∘ Fibrose quística | |
| ∘ Pneumoconioses | |
| ∘ Doenças neuromusculares | |
| • Pré‐transplantação de órgão | |
| • Dador de medula óssea (antes da doação) | |
| • Fístulas de líquido cefalorraquidiano | |
| • Implantes cocleares (candidatos e portadores) | |
| • Diabetes mellitus requerendo tratamento farmacológico | |
| Condições abrangidas em adultos imunocomprometidos | • Asplenia ou disfunção esplénica |
| ∘ Asplenia congénita ou adquirida | |
| ∘ Doença de células falciformes | |
| ∘ Outras hemoglobinopatias com disfunção esplénica | |
| • Imunodeficiência primáriaa | |
| • Infeção por VIH | |
| • Recetor de transplante | |
| ∘ Células precursoras hematopoiéticas | |
| ∘ Órgãos sólidos | |
| • Doença neoplásica ativa | |
| ∘ Leucemias | |
| ∘ Linfomas | |
| ∘ Mieloma múltiplo | |
| ∘ Outros tumores malignos | |
| • Imunossupressão iatrogénica | |
| ∘ Terapêutica com fármacos biológicos ou DMARDs (Disease Modifying AntiRheumatic Drugs) | |
| ∘ Corticoterapia sistémica | |
| ∘ Quimioterapia | |
| ∘ Radioterapia | |
| • Síndrome de Down | |
| • Síndrome nefrótico |
De entre os grupos de risco, a vacinação pneumocócica passou a ser gratuita em adultos com determinadas patologias, enunciadas na tabela 8.
Grupos com risco acrescido para DIP na população adulta (≥18 anos de idade), para os quais a vacinação com VPC13 contra a infeção por S. pneumoniae é recomendada e gratuita (adaptado da Norma 11/2015 da Direcção‐Geral da Saúde83)
| Condições abrangidas em adultos imunocompetentes | • Fístulas de líquido cefalorraquidiano |
| • Implantes cocleares (candidatos e portadores) | |
| Condições abrangidas em adultos imunocomprometidos | • Asplenia ou disfunção esplénica |
| ∘ Asplenia congénita ou adquirida | |
| ∘ Doença de células falciformes | |
| • Imunodeficiência primáriaa | |
| • Infeção por VIH com valores de linfócitos T CD4+<500 células/mm3 | |
| • Recetor de transplante | |
| • Células precursoras hematopoiéticas | |
| • Órgãos sólidos | |
| • Doença neoplásica ativa | |
| • Leucemias | |
| • Linfomas | |
| • Mieloma múltiplo | |
| • Síndrome nefrótico |
Foram igualmente propostos esquemas de vacinação, de acordo com o status vacinal prévio destes doentes83. Para adultos sem qualquer dose prévia de VPC13 ou VPP23, é recomendada uma dose de VPC13, seguida de uma dose de VPP23 após 6‐12 meses (com um intervalo mínimo de 8 semanas). São descritos os grupos em que é recomendada a revacinação com VPP23 5 anos após a 1a dose desta vacina. Na população adulta previamente vacinada com pelo menos uma dose de VPP23, é recomendada uma dose de VPC13 12 meses após a última dose de VPP23 e são enunciados os grupos em que se aconselha a revacinação com VPP23.
Adicionalmente, na população pediátrica, a VPC13 passou a integrar o Programa Nacional de Vacinação para crianças nascidas a partir de 1 de janeiro de 2015, sendo ainda recomendada e gratuita na idade pediátrica (<18 anos de idade) em certas situações com risco acrescido de DIP, incluindo DM84.
Apesar do comprovado benefício da vacinação pneumocócica e das recomendações existentes, a taxa de utilização destas vacinas na população de doentes com DM continua a ser reduzida85,86. Em Portugal, apenas foram identificados 2 estudos que avaliaram a vacinação pneumocócica na população de doentes com DM. Um estudo observacional foi conduzido numa unidade de saúde familiar na região norte e avaliou a prescrição da VPP23 aos doentes com DM seguidos nesta instituição entre 2005‐2010. Do total de 114 processos analisados, somente em 6 casos (5,3%) foi encontrado registo de prescrição de vacina pneumocócica. A idade da população total analisada variou entre 32‐92 anos e as prescrições da vacina abrangeram o grupo etário entre 60‐79 anos de idade. O ano com maior número de prescrições foi o de 201054.
Um outro estudo retrospetivo avaliou a qualidade da imunização por tétano e difteria, gripe sazonal e DIP, numa população de doentes com DM seguidos nas consultas de vigilância de 2 centros de saúde no ano de 2008. A idade dos 102 indivíduos incluídos no estudo variou entre 30‐99 anos de idade, não tendo sido encontrado qualquer registo de prescrição de vacina pneumocócica87.
ConclusõesEstima‐se que nas próximas décadas a prevalência de DM continue a aumentar. Constituindo a DM um fator de risco importante de DIP na população adulta, esta tendência poderá também conduzir a um aumento de casos de infeção pneumocócica. Assim, a imunização pneumocócica poderá constituir‐se como uma medida essencial na prevenção deste tipo de infeção na população adulta com DM.
Com base na larga e bem‐sucedida experiência adquirida em mais de 100 países com a VPC7 e, mais recentemente, com a VPC13 na imunização da população pediátrica, é expectável que este benefício se estenda à população adulta, quer através da imunização direta, quer através de um efeito protetor indireto, nos países em que a cobertura vacinal na idade infantil é muito elevada. É por isso determinante o papel das sociedades médicas e autoridades de saúde, no sentido de se atingir uma maior abrangência de crianças e adultos vacinados, mediante campanhas de sensibilização, recomendações clínicas e políticas que dinamizem a imunização destas populações no nosso país.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesSusana Castro Marques e Ana Maia exercem funções na Pfizer Biofarmacêutica Sociedade Unipessoal, Lda. Os autores declaram que a informação, opiniões e conclusões reportados neste trabalho foram expressos de forma imparcial e isenta de enviesamento.