A hiperprolactinémia é a alteração endócrina mais comum do eixo hipotálamo‐hipofisário, apesar da sua prevalência na população infanto‐juvenil ainda não estar claramente definida.
Na rapariga os sintomas mais frequentes são oligomenorreia, amenorreia, galactorreia e infertilidade. No rapaz pode cursar com ginecomastia, galactorreia, bem como com sintomas neuro‐oftalmológicos (alterações visuais e cefaleias), devido à maior frequência de macroadenomas.
As etiologias da hiperprolactinémia são várias, sendo o uso de fármacos uma causa comum.
Uma história clínica detalhada associada a exame físico completo, determinação da bioquímica básica, hormona estimuladora da tiróide (TSH) e teste de gravidez, permitem excluir todas as causas de hiperprolactinémia, exceto as secundárias, como a patologia hipotálamo‐hipofisária.
Quando não se identifica a causa da hiperprolactinémia deverá realizar‐se uma ressonância magnética da área hipotálamo‐hipofisária, e no caso de esta ser negativa é feito o diagnóstico de hiperprolactinémia idiopática.
Nas hiperprolactinémias secundárias o tratamento deve ser etiológico.
O tratamento médico com agonistas dopaminérgicos constitui a terapêutica de eleição nos prolactinomas e na presença de hipogonadismo ou outros sintomas causados pela hiperprolactinémia.
A cirurgia transesfenoidal só está indicada quando há resistência ou intolerância aos agonistas dopaminérgicos.
Os autores apresentam quatro casos clínicos de hiperprolactinémia com etiologias diversas.
Hyperprolactinemia is the most common endocrine alteration of the pituitary‐hypothalamic axis, although its prevalence in the pediatric and adolescent population is not clearly defined yet.
In girls the main symptoms are the association of oligomenorrhea, amenorrhea, galactorrhea and infertility. The clinical picture in boys includes gynecomastia, galactorrhea, as well as neuro‐ophthalmologic findings (impaired vision and headache) due to a higher frequency of macroadenomas.
There are several etiologies of hyperprolactinemia and medication use is a common cause.
A thorough history and physical examination, routine laboratory investigations, thyroid‐stimulating hormone (TSH) determination, and pregnancy test can rule out all causes of hyperprolactinemia except hypothalamus‐pituitary disease.
When no evident cause of secondary hyperprolactinemia is found, hypothalamus‐pituitary magnetic resonance imaging (MRI) should be performed. If the MRI is negative the most probable diagnosis is idiopathic hyperprolactinemia.
In secondary hyperprolactinemia treatment should be etiologic.
Medical treatment with dopamine agonists is currently the treatment of choice for prolactinomas and hypogonadism or other symptoms due to hyperprolactinemia.
Transsphenoidal surgery is suitable only when there is resistance or intolerance to dopamine agonists.
The autors report four cases of hyperprolactinemia with different etiologies.
A hiperprolactinémia é a alteração endócrina mais comum do eixo hipotálamo‐hipofisário, com uma prevalência de 0,4% na população adulta. Em idade pediátrica, os dados disponíveis são escassos, pelo que a sua prevalência ainda não está definida1,2.
Um valor sérico de prolactina acima do limite superior da normalidade confirma o diagnóstico de hiperprolactinémia3.
As etiologias são variadas e podem dividir‐se em três grupos principais: fisiológicas, farmacológicas e patológicas. Quando não é possível identificar uma causa provável, a hiperprolactinémia é considerada de natureza idiopática2,4,5.
Dentro das manifestações clínicas da hiperprolactinémia temos a galactorreia e sintomatologia decorrente do hipogonadismo. No caso de etiologia tumoral, poderemos ter sintomas neuro‐oftalmológicos, pelo efeito de massa6,7.
Assim, a presença de clínica sugestiva de hiperprolactinémia deve ser confirmada com a avaliação laboratorial da prolactina. Salienta‐se a importância da história clínica detalhada e do exame objetivo para o correto diagnóstico diferencial e seleção dos exames auxiliares de diagnóstico necessários.
Descrevem‐se quatro casos clínicos de hiperprolactinémia enviados à consulta de Endocrinologia Pediátrica de um hospital de nível 3 com diferentes fatores etiológicos, realçando a importância do correto diagnóstico, uma vez que as implicações terapêuticas são bastante distintas.
Descrição dos casosCaso clínico 1Adolescente de 15 anos, sexo feminino, enviada à consulta por galactorreia catamenial com três meses de evolução e hiperprolactinémia de 70,2 ng/mL (valor de referência [VR]: 4,79‐23,3 ng/mL), sem outras queixas associadas.
Relativamente aos antecedentes pessoais fisiológicos teve menarca aos 12 anos com cataménios regulares, estando medicada com contracetivo oral (etinilestradiol e acetato de ciproterona) desde há seis meses para tratamento da acne. Antecedentes patológicos e familiares irrelevantes.
Ao exame objetivo apresentava um peso de 51,6kg (percentil 25‐50) e estatura de 156,5cm (percentil 10‐25), exame mamário normal, sem galactorreia. Sem alterações de relevo ao exame objetivo.
Tinha realizado anteriormente estudo analítico com hemograma e bioquímica no médico assistente que foi normal.
Dada indicação para suspender o contracetivo oral (CO) e pedido estudo endócrino com função tiroideia e β‐HCG que foram normais. Realizou ecografia mamária que não tinha alterações. Além disso, apesar de não ser indispensável nesta fase da investigação, optou‐se por realizar ressonância magnética crâneo‐encefálica (RM‐CE) atendendo ao valor da prolactinémia e à situação clínica, que se revelou normal.
Em reavaliação posterior, após 3 meses, com normalização da prolactina e resolução da galactorreia.
No contexto de cataménios abundantes, irregulares e dismenorreia foi introduzido outro CO (etinilestradiol + dienogest), tendo reaparecido a galactorreia coincidente com os cataménios, pelo que se suspendeu a terapêutica com desaparecimento da clínica.
Caso clínico 2Adolescente de 16 anos, sexo feminino, enviada à consulta por galactorreia com quatro meses de evolução e hiperprolactinémia de 99 ng/mL, sem outras queixas associadas.
Relativamente aos antecedentes pessoais fisiológicos teve menarca aos 12 anos com cataménios regulares, e estava medicada com CO desde os 13 anos.
Seguida em consulta de pedopsiquiatria por perturbação da hiperatividade e défice de atenção tendo sido medicada em Outubro de 2010 com risperidona.
À data da primeira consulta já tinha realizado ecografia mamária, que foi normal, e tinha suspendido a risperidona por iniciativa própria há duas semanas atrás, com resolução da galactorreia. No controlo analítico realizado cinco dias após a suspensão da medicação apresentava prolactina de 25,9 ng/mL.
Ao exame objetivo apresentava um peso de 64,9kg (percentil 75‐90) e estatura de 168cm (percentil 75‐90), exame mamário normal, sem galactorreia. Sem alterações de relevo ao exame objetivo.
Programada nova consulta de pedopsiquiatria para orientação.
Caso clínico 3Adolescente de 14 anos, sexo masculino, enviado à consulta por desaceleração da velocidade de crescimento e obesidade.
Relativamente aos antecedentes neonatais salienta‐se que a gestação foi de termo, com somatometria adequada à idade gestacional.
Dos antecedentes patológicos destaca‐se epifisiólise femoral proximal direita em 2008, e segundo o jovem foi a partir dessa data que aumentou progressivamente de peso. Antecedentes familiares irrelevantes. Estatura alvo familiar de 170cm (percentil 10‐25).
Ao exame objetivo apresentava um peso de 69kg (percentil 90‐95), estatura de 137cm (inferior ao percentil 5) e IMC de 36,8kg/m2, adipomastia, pseudohipogenitalismo, estadio pubertário de Tanner GIII PIII. Sem outras alterações ao exame objectivo.
Estudo analítico com hemograma normal e elevação das transaminases. O estudo endócrino revelou TSH 806,6 uUI/mL (VR: 0,27‐4,2 uUI/mL), T4L 0,08 ng/dL (VR: 0,93‐1,70 ng/dL), Anticorpo anti‐tiroglobulina 67,8 UI/mL (VR: 0‐40 UI/mL), prolactina 39,2 ng/mL, colesterol total 287mg/dL, colesterol LDL 200mg/dL e triglicerídeos 337mg/dL. Realizou radiografia do punho e mão esquerda com idade óssea compatível com 11 anos (3 anos inferior à idade cronológica).
Perante o diagnóstico de hipotiroidismo primário iniciou terapêutica de substituição com levotiroxina 0,1mg/dia e realizou ecografia tiroideia que revelou padrão de tiroidite. Nos controlos analíticos posteriores apresentou normalização da função tiroideia, transaminases, prolactina e ficha lipídica.
Ao longo das consultas verificou‐se uma perda gradual de peso e recuperação da velocidade de crescimento. Assim, na última consulta em Dezembro de 2012 tinha perdido um total de 14kg e apresentava uma velocidade de crescimento no último ano de 8cm.
Caso clínico 4Adolescente de 15 anos, sexo feminino, enviada à consulta por suspeita de síndrome do ovário poliquístico.
Apresentava história de irregularidades menstruais no último ano (menarca aos 12 anos) e galactorreia com quatro meses de evolução, sem outras queixas associadas. Previamente saudável e não fazia qualquer medicação.
Relativamente aos antecedentes familiares, a mãe apresentava hipotiroidismo, hipertensão arterial e dislipidémia controladas com terapêutica.
Ao exame objetivo apresentava um peso de 77,8kg (percentil 90‐95), estatura de 170cm (percentil 75‐90) e IMC de 26,9kg/m2 (percentil 90‐95), acne facial, hiperpigmentação axilar e infra‐umbilical e galactorreia. Sem outras alterações ao exame objetivo.
Pedido estudo analítico com hemograma e bioquímica que foi normal. Estudo endócrino com prolactina 64,7 ng/mL, ACTH 53,4 pg/mL (VR: 0‐46 pg/mL), cortisol sérico e 17α‐OH‐progesterona normais. Realizou ecografia pélvica que foi normal e RM‐CE que revelou «adenohipófise com altura aumentada projetando‐se na cisterna supra‐selar, onde “toca” o quiasma óptico. Na vertente inferior paramediana direita da adenohipófise identifica‐se formação arredondada, que tem cerca de 2mm de diâmetro transversal e 4mm de diâmetro crâneo‐caudal, sugestiva de microadenoma hipofisário.»
Após esclarecimento dos pais acerca da relação custo/tolerância das opções terapêuticas disponíveis (bromocriptina versus cabergolina), optou‐se por iniciar cabergolina 0,25mg/semana. Após um mês de tratamento, clinicamente melhor e analiticamente com ACTH e prolactina normalizados, cortisol urinário de 24 horas normal. Na reavaliação seguinte, após três meses de tratamento, já sem galactorreia e ciclos menstruais regularizados, melhoria da hiperpigmentação e estudo visual por campimetria normal. Analiticamente, voltou a objetivar‐se aumento da ACTH (69,2 pg/mL), mantendo‐se a prolactina dentro de valores normais, pelo que repetiu RM‐CE (6 meses após a primeira RM) que se mantinha sobreponível. Controlo analítico posterior com normalização da ACTH. Na RM‐CE de controlo, um ano depois, já sem evidência de adenoma hipofisário, pelo que a terapêutica com cabergolina foi suspensa.
ComentáriosA prolactina é uma hormona secretada de forma pulsátil pelas células lactotróficas da hipófise anterior, que tem como principal função a indução e manutenção da lactação. O hipotálamo controla os seus níveis séricos através da dopamina, que se liga aos recetores D2 dos lactotrofos, inibindo a sua secreção3. Deste modo, qualquer processo que interfira com a síntese, transporte à glândula pituitária ou ação sobre os recetores da dopamina na hipófise, produz hiperprolactinémia1,7. Dentro dos fatores que induzem a secreção da prolactina encontram‐se: os estrogénios, a hormona libertadora de tirotropina (TRH), o fator de crescimento epidérmico e o peptídeo intestinal vasoativo (VIP)3,4.
As manifestações clínicas da hiperprolactinémia podem ser devidas à ação direta desta hormona nos tecidos ou resultantes da sua ação no eixo hipotálamo‐hipófise‐gónadas6. Na rapariga, os achados clínicos incluem oligomenorreia, amenorreia, galactorreia e infertilidade1,6. Enquanto no rapaz pode cursar com ginecomastia, galactorreia, disfunção eréctil, diminuição da líbido e infertilidade1,6. Pode também manifestar‐se como atraso pubertário em ambos os sexos6. Devido à maior incidência de macroadenomas em idade pediátrica, principalmente no sexo masculino, os prolactinomas acompanham‐se mais frequentemente de sintomas neuro‐oftalmológicos (alterações visuais e cefaleias)1,6,8,9.
A sintomatologia causada pela hiperprolactinémia é explicada pela ação da prolactina na interrupção da secreção de hormona libertadora de gonadotrofina (GnRH), que leva à diminuição da hormona luteinizante (LH) e da hormona folículo‐estimulante (FSH), e consequentemente das hormonas sexuais5,6. A longo prazo, a supressão mantida da secreção de estrogénios poderá inibir o processo de mineralização óssea, conduzindo a osteopenia, osteoporose e a risco aumentado de fraturas3,5,6,10. Como já foi referido, as causas de hiperprolactinémia são várias, sendo necessário realizar um adequado diagnóstico diferencial (tabela 1).
Causas de hiperprolactinémia
| Fisiológicas |
| Gravidez e amamentação |
| Exercício |
| Sono |
| Stress |
| Farmacológicas |
| Antipsicóticos/Neurolépticos |
| Antidepressivos |
| Anti‐hipertensores |
| Anti‐histamínicos H2 |
| Agonistas colinérgicos |
| Bloqueadores dopaminérgicos |
| Cocaína |
| Estrogénios |
| Fármacos depletores de catecolaminas |
| Inibidores da síntese de dopamina |
| Inibidores das proteases |
| Opióides |
| Patológicas |
| Compressão/lesão da haste hipotálamo‐hipofisária |
| Granulomas |
| Infiltrações |
| Irradiação |
| Trauma |
| secção da haste hipofisária, cirurgia supra‐selar |
| Tumores |
| craniofaringioma, germinoma, meningioma, extensão supra‐selar de massa hipofisária, metástases hipotalâmicas |
| Hipófise |
| Acromegália |
| Hipofisite linfocítica ou massa para‐selar |
| Macroadenoma |
| Adenoma plurihormonal |
| Prolactinoma |
| Cirurgia |
| Trauma |
| Doenças sistémicas |
| Trauma ou cirurgia torácica, herpes zoster |
| Insuficiência renal crónica |
| Cirrose |
| Convulsões |
| Síndrome do ovário poliquístico |
| Pseudociese |
| Idiopática |
| Macroprolactinémia |
Adaptado da Melmed et al.3.
Dentro das causas fisiológicas encontram‐se: a gravidez e a amamentação, o sono, o exercício e o stress físico ou emocional1–3.
A iatrogenia também é bastante comum, sendo os fármacos mais frequentemente implicados os antipsicóticos, pela sua ação antagonista dos recetores da dopamina3. Nos dois primeiros casos clínicos apresentados, a hiperprolactinémia foi causada por fármacos de duas classes distintas – os CO no caso clínico 1 e a risperidona no caso clínico 2. Os efeitos deste último fármaco na elevação dos níveis de prolactina são bem conhecidos; no entanto, o papel dos estrogénios na hiperprolactinémia ainda permanece controverso11. Alguns estudos mostram que 12‐30% das mulheres a tomar CO contendo estrogénios podem apresentar elevações ligeiras da prolactina sérica3,4,11. A pista diagnóstica essencial, em ambos os casos, foi estabelecida pela relação temporal estreita entre o início da medicação e o surgimento dos sintomas, bem como pela resolução da clínica e normalização dos níveis de prolactina após a suspensão do fármaco.
Como causas patológicas temos: a insuficiência renal crónica e a cirrose hepática, pela diminuição da clearance da prolactina; o hipotiroidismo primário, como ilustrado no caso clínico 3; a síndrome do ovário poliquístico; as lesões da parede torácica, por provável mecanismo de estimulação neuronal; entre outras1,3,6. Nestes casos, o tratamento da patologia de base irá reverter a hiperprolactinémia1,3,6.
Na ausência de qualquer uma destas situações, devemos pensar numa patologia hipotálamo‐hipofisária, que não necessariamente um prolactinoma, uma vez que qualquer massa selar ou para‐selar que comprima a haste hipofisária pode causar elevação da prolactina1,3,4,6. Se a RM‐CE mostrar uma anatomia hipotálamo‐hipofisária normal e não for identificada nenhuma causa secundária de hiperprolactinémia, é feito o diagnóstico de hiperprolactinémia idiopática1,3,4,6. Pensa‐se que nalguns destes casos, esta situação seja explicada pela presença de microadenomas muito pequenos que não foram visualizados no exame de imagem1,2,6.
Outra causa potencial de hiperprolactinémia é a macroprolactinémia. Sabe‐se que cerca de 85% da prolactina circulante é monomérica, podendo também coexistir as formas dimérica (big prolactin) e a de alto peso molecular (big big prolactin ou macroprolactina), que resultam da polimerização das moléculas de prolactina e subsequente ligação a imunoglobulinas G2,12. Na macroprolactinémia o que se verifica é uma preponderância destas moléculas maiores, biologicamente menos ativas2,12. A caracterização destas três formas é idealmente efetuada por cromatografia de gel filtração, onde a separação ocorre através das diferenças de peso molecular2,12. No entanto, trata‐se de um método moroso, trabalhoso, de elevado custo e inadequado para utilização de rotina. Pelo que a técnica de rastreio mais utilizada é a precipitação com polietilenoglicol (PEG), pela sua simplicidade, boa reprodutibilidade e correlação com o método de referência2,12. Esta técnica tem como base a capacidade do PEG para precipitar a prolactina ligada à imunoglobulina (macroprolactina) procedendo‐se, após a centrifugação, ao doseamento da prolactina no sobrenadante2,12. Assim, perante um paciente com hiperprolactinémia assintomática deverá excluir‐se a macroprolactinémia, para evitar uma abordagem incorreta do paciente, já que são desnecessários exames complementares adicionais e o tratamento não está indicado nesta situação3.
Assim, na avaliação de um paciente com sintomas sugestivos de hiperprolactinémia e elevação da prolactina sérica confirmada, primeiro devem ser excluídas as várias causas possíveis através de uma anamnese detalhada, um exame físico minucioso, teste de gravidez (quando justificado), exames laboratoriais de rotina (função renal e hepática) e função tiroideia4,6. No caso da suspeita recair sobre um fármaco que o doente esteja a tomar, a confirmação pode ser obtida através da suspensão da medicação, o que resultará na normalização dos níveis de prolactina em 3‐4 dias4,11,13. Se se tratar de medicação antipsicótica que não possa ser descontinuada, o psiquiatra poderá substituir a medicação por outra que não cause hiperprolactinémia. Se esta última hipótese também não for possível, então deverá ser realizada uma RM‐CE para avaliação da sela turca e exclusão de possível etiologia hipotálamo‐hipofisária4,6,11.
Os prolactinomas são pouco frequentes na população infanto‐juvenil, sendo classificados de acordo com o tamanho em microadenomas (menos de 10mm de diâmetro) e macroadenomas (mais de 10mm de diâmetro)6. O seu diagnóstico requer não só a presença de hiperprolactinémia laboratorial, como também a evidência imagiológica de um adenoma pituitário1. O exame imagiológico de escolha é a RM em detrimento da tomografia axial computorizada (TAC), uma vez que esta última é menos eficaz no diagnóstico de pequenos adenomas e na definição da extensão dos tumores maiores1. No entanto, a TAC poderá ser realizada se a RM‐CE não estiver disponível ou for contra‐indicada1. Nas crianças com macroprolactinoma, a visão deve ser avaliada por campimetria computorizada, devido à possibilidade de compromisso do quiasma óptico1,6.
Assim, o achado de uma hiperprolactinémia na presença de um adenoma hipofisário é compatível com o diagnóstico de prolactinoma1,6,9. Contudo, este diagnóstico não é inequívoco, visto que, como anteriormente referido, qualquer massa hipofisária que comprima a haste hipotálamo‐hipofisária pode causar hiperprolactinémia1,6,9. Por outro lado, é importante relembrar que em cerca de 10% da população geral se encontra um microadenoma sem qualquer significado (incidentaloma)1,4,6,9. Deste modo, a confirmação empírica do diagnóstico é obtida através da resposta ao tratamento farmacológico1,6,9. Isto é, se ocorrer normalização dos níveis de prolactina e redução do tamanho tumoral (≥50%), confirma‐se o diagnóstico de prolactinoma1,4,6,9. No caso de se tratar de um adenoma pituitário que não um prolactinoma, também se verifica normalização da prolactina sérica, mas sem redução do volume tumoral1,6,9. No caso clínico 4 evidencia‐se a presença de um adenoma hipofisário, que poderá representar um adenoma misto secretor de prolactina e ACTH, uma vez que se verifica uma elevação intermitente dos valores de ACTH, que é uma situação rara4,6. A resposta ao tratamento farmacológico, em termos laboratoriais e imagiológicos, confirma a hipótese de prolactinoma.
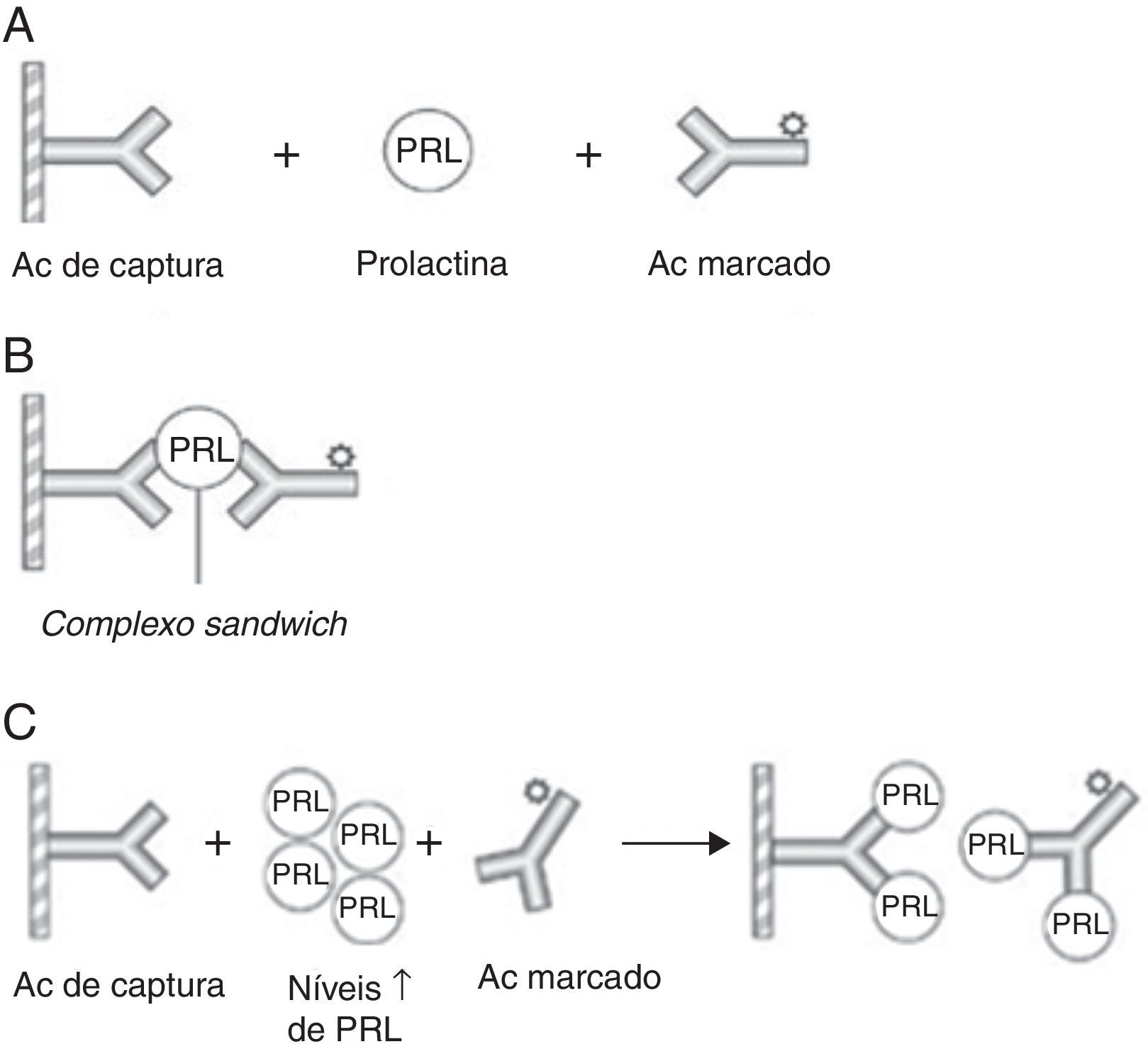
Do ponto de vista analítico, a prolactina sérica apresenta, por si só, um elevado valor diagnóstico. Tem‐se verificado que valores de prolactina acima do limite normal superior até 100 ng/mL podem ser encontrados em hiperprolactinémias de qualquer etiologia6, enquanto níveis acima de 200 ng/mL normalmente indicam a presença de um prolactinoma, cujo tamanho se relaciona diretamente com a concentração sérica de prolactina14. Os macroprolactinomas, por exemplo, associam‐se tipicamente a níveis superiores a 250 ng/mL6. Contudo, esta associação entre prolactina sérica e volume tumoral nem sempre é consistente, pelo que podemos deparar‐nos com uma situação de macroprolactinoma com níveis de prolactina baixos. Uma razão potencial para esta discrepância é o chamado “hook effect”, que ocorre quando a concentração de prolactina sérica é extremamente elevada, levando à saturação dos anticorpos no ensaio imunoradiométrico, o que causa a falsa diminuição dos níveis de prolactina2,6. Para ultrapassar este efeito, o ensaio deverá ser realizado numa amostra de soro submetida a diluição de 1:1002,6 (figura 1).
Representação esquemática de um imunoensaio de dois sítios para a prolactina e do «hook effect»
(A) Utilizam‐se dois Acs específicos ‐ o Ac de captura (fixo numa matriz de fase sólida) e o Ac marcado (sinalizador) – que se ligam a diferentes epítopos da PRL formando um complexo sandwich. (B) O excesso de Acs marcados não ligados é removido com a fase líquida, restando os complexos sandwich que vão emitir um sinal, o qual é directamente proporcional à concentração de PRL sérica. (C) O «hook effect» verifica‐se quando os níveis de PRL são muito elevados causando a saturação de ambos os Acs (de captura e sinalizador), o que impede a formação dos complexos sandwich com consequente diminuição da detecção quantitativa da PRL.
PRL: prolactina; Ac: anticorpo.
Adaptado da Smith et al.16.
Assim, perante um paciente com macroadenoma e valores de prolactina não tão elevados como expectável (<200 ng/mL), deve‐se excluir o «hook effect», para que seja possível a distinção entre um verdadeiro prolactinoma e um adenoma não funcionante cuja hiperprolactinémia resulta da compressão da haste hipofisária (pseudoprolactinoma)2,3,7.
Os objetivos do tratamento da hiperprolactinémia são: corrigir os níveis de prolactina para assegurar um normal desenvolvimento pubertário, restabelecer e/ou manter uma adequada função gonadal, reduzir e controlar a massa tumoral hipofisária, assim como permitir a aquisição de um adequado pico de massa óssea e assegurar a fertilidade futura1,9.
Em alguns casos, a vigilância pode ser a única atitude necessária ‐ hiperprolactinémia assintomática e microprolactinomas sem sintomatologia7. Isto porque, em 90‐95% dos casos os microprolactinomas não aumentam de tamanho, pelo que a supressão do crescimento tumoral não constitui um objetivo6,15. Nos restantes casos, a terapêutica médica com agonistas dopaminérgicos é o tratamento de eleição independentemente do tamanho tumoral7.
Os agonistas dopaminérgicos, como a bromocriptina e a cabergolina, são a terapêutica de primeira linha, visto que diminuem os níveis de prolactina e reduzem o tamanho tumoral6,15. Ambos os efeitos são mediados pela ligação aos recetores D2da dopamina, com consequente inibição da síntese e secreção de prolactina9,15.
A cabergolina tem demonstrado a sua superioridade em termos de tolerância (menos efeitos secundários), comodidade de administração (semi‐vida longa: administração uma a 2 vezes/semana), redução da secreção de prolactina, restabelecimento da função gonadal e diminuição do volume tumoral3,9. Também provou a sua eficácia em pacientes que previamente não responderam à bromocriptina, o que poderá ser explicado pela sua maior afinidade pelos recetores dopaminérgicos3,9.
Os efeitos secundários mais frequentes são náuseas, hipotensão postural e confusão mental15. Estes efeitos poderão ocorrer sobretudo no início do tratamento ou quando a dose terapêutica é aumentada15. Este problema pode ser contornado iniciando o tratamento com doses pequenas e aumento gradual da dose15.
A diminuição da prolactina sérica ocorre 2‐3 semanas após o início do tratamento com um agonista dopaminérgico6,15. A redução do tamanho tumoral ocorre posteriormente, cerca de 6 semanas após o início do tratamento; no entanto, em alguns pacientes só se verifica após 6 meses ou mais15. No caso dos macroprolactinomas, também há uma recuperação dos campos visuais6,15.
A resposta à terapêutica é monitorizada através dos níveis séricos de prolactina e da avaliação do tamanho tumoral por RM‐CE3. A prolactina sérica deverá ser avaliada um mês após o início do tratamento e a RM‐CE deve ser repetida após um ano (microprolactinoma) ou 3 meses (macroprolactinoma)3. No entanto, a sua realização deve ser antecipada se houver aumento dos níveis de prolactina ou se surgirem novos sintomas3.
Quando a prolactina sérica se mantém dentro da normalidade durante pelo menos um ano associada a uma redução do volume tumoral, a dose do agonista dopaminérgico poderá ser reduzida, desde que a prolactina se mantenha nos níveis normais15.
O tratamento poderá ser suspenso após 2 anos, desde que se verifique normoprolactinémia e o adenoma não seja visível na RM‐CE3,15.
O seguimento inclui a avaliação da prolactina sérica cada 3 meses no primeiro ano e depois anualmente3. A RM‐CE tem indicação para ser repetida se houver aumento dos níveis de prolactina3.
Quando a resposta ao agonista dopaminérgico não é adequada, considera‐se que o prolactinoma é resistente4,6. Neste caso, as opções terapêuticas passam por aumentar para a dose máxima tolerável, substituir por outro agonista dopaminérgico, considerar a cirurgia e mais raramente, a radioterapia4,6. Assim, a opção cirúrgica ‐ cirurgia transesfenoidal – só deve ser considerada se intolerância aos agonistas dopaminérgicos e nos adenomas resistentes à terapêutica médica3,4,15.
Os casos clínicos descritos demonstram a importância da realização de um adequado diagnóstico diferencial perante uma situação de hiperprolactinémia. Assim, só após realização de história clínica, exame físico completo e exclusão de doenças sistémicas, é que se deverá pensar na patologia tumoral4. A relevância do correto diagnóstico também se prende com a escolha do tratamento adequado, visto que a situação poderá ser facilmente revertida com medidas simples, como suspender um fármaco ou fazer terapêutica de substituição no caso do hipotiroidismo. Além disso, a decisão entre tratar com agonistas dopaminérgicos ou tratar cirurgicamente representa, respetivamente, o tratamento de escolha para os prolactinomas e adenomas hipofisários não produtores de prolactina.
Realça‐se também a importância da instituição atempada da terapêutica para correção das consequências hormonais2,14.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflitos de interessesOs autores declaram não haver conflito de interesses.