El tumor pardo es una rara consecuencia del hiperparatiroidismo, que resulta por alteración en el remodelamiento óseo y del metabolismo fosfocálcico óseo, produciendo en primer lugar una osteítis fibrosa y finalmente consolidándose en forma semejante a una neoplasia que por sus características microscópicas toma la denominación de tumor pardo. A continuación presentamos una condición atípica en la literatura médica de una particular presentación de tumor pardo en un paciente pediátrico relacionado con el hiperparatiroidismo secundario en una localización poco frecuente que por este hecho y otros lo convierte en un reto diagnóstico.
Brown tumor is a rare result of hyperparathyroidism, its cause is the impaired bone remodeling and of calcium‐phosphate bone metabolism, producing first a fibrous osteitis and finally consolidating like a neoplasm for its microscopic features takes the name brown tumor. Below is an unusual condition in the medical literature of a particular presentation of brown tumor in a pediatric patient related to secondary hyperparathyroidism in an uncommon location that this and other features makes it a diagnostic challenge.
El tumor pardo fue considerado como una forma de osteítis fibrosa quística (OFQ) desde 1950, fecha en la que se describió por primera vez este término para generalizar todo daño óseo producto del hiperparatiroidismo (HPT), sin importar la gravedad que tuviera la lesión. Tras el advenimiento de la tomografía computarizada (TC) ósea y el avance en la microscopia se evidenció una lesión ósea circunscrita con depósitos de hemosiderina de un característico color parduzco, presentes en casos de dolor óseo crónico y poco comunes, tomando el nombre de tumor pardo óseo. Esta entidad posee una clínica, imagenología e histopatología particular distintas al resto de las lesiones óseas por HPT o de las lesiones de osteodistrofia renal; el reemplazo de tejido óseo por fibroso y proliferación de células multinucleadas originan este tumor y está relacionado fuertemente con el HPT primario y muy rara vez con el secundario por enfermedad renal crónica (ERC); el diagnóstico se fundamenta en comprobar una lesión ósea de características anatomopatológicas singulares como lo es encontrar células gigantes multinucleadas en un tejido óseo específico1. El caso fue investigado en el Hospital José Carrasco Arteaga con un seguimiento de 6 meses. Se trata de un paciente masculino, procedente de la localidad de Celica, en la provincia de Loja en Ecuador; con antecedentes de insuficiencia renal crónica; el cuadro comenzó con dolor crónico a nivel de rodilla derecha. Al inició se realizó estudios de imagen con el fin de descartar procesos traumáticos y malignos, después de llevar a cabo estudios minuciosos de patología se evidenció el tumor pardo de características propias, iniciándose el tratamiento contra HPT a través de pulsos intravenosos de calcitriol. A continuación se describe cómo una enfermedad ósea tumoral benigna dependiente de los niveles de la paratohormona (PTH) se comporta de diferente manera a los casos reportados en la literatura médica, convirtiéndose en un caso atípico y por ende en un reto diagnóstico.
Presentación del casoPaciente de 13 años, 10 meses, con antecedentes patológicos personales de: insuficiencia renal crónica estadio 4 (diagnosticada hace un año, sin etiología) y como consecuencia de esto HPT secundario que provoca una enfermedad ósea hiperremodelante y retraso de crecimiento simétrico, pues su edad ósea fue de 7 años según carpograma (enanismo simétrico), el paciente está en tratamiento a base de eritropoyetina y calcitriol; refiere que hace 2 meses, y sin causa aparente, presenta dolor en articulación de rodilla izquierda, de moderada intensidad, de tipo gradual, después de actividad física, con predominio durante la noche; el dolor remite hasta que aproximadamente hace 3 días de su ingreso se exacerba con dolor en la misma zona anatómica, posterior a caída de propia altura, con impacto frontal en rodilla presentando eritema, sin limitación funcional. El dolor cede 2 días previos a su ingreso sin medidas farmacológicas; el paciente acude a consulta externa y ante hallazgos radiológicos de masa ocupante e infiltrante a nivel epifisiario distal de fémur izquierdo, se decide el ingreso.
En el examen físico se evidenció signos vitales dentro de parámetros normales y en la antropometría signos de estado pontoestatural de baja talla y peso severos, y emaciación severa (peso de 20kg, talla de 119cm, perímetro cefálico de 54cm, perímetro braquial de 15,5cm e índice de masa corporal de 14,1kg/m2), en el examen de genitales se observó hipogonadismo con estadio i de Tanner de órganos sexuales externos. Además se encontró palidez generalizada en piel y mucosas; durante el examen de extremidades se apreció escasa masa muscular, deformidad angular a nivel de rodillas, miembros inferiores en posición de genu‐valgo, simétricos, tono muscular conservado y arcos completos de movimientos. Finalmente en el examen neurológico se registró presencia de signos de neuropatía periférica, producto de su estado de HPT.
Se practicaron exámenes complementarios, encontrándose anemia microcítica e hipocrómica leve propia de su enfermedad de base (hemoglobina de 11,2g/dl, hematocrito de 34,4%, volumen corpuscular medio de 69,8fl, concentración media de hemoglobina de 22,7pg y concentración corpuscular media de hemoglobina de 32,6g/dl); en la bioquímica sanguínea se encontraron alteraciones como hipocalcemia (6,94mg/dl), hiperfosfatemia (6,30mg/dl), la vitamina D en niveles séricos bajos (18ng/dl) y dislipidemia (triglicéridos 247mg/dl, colesterol 187mg/dl, HDL de 66mg/dl y LDL de 114mg/dl).
En la función renal se denota una franca elevación de azoados con valores 3 veces mayores que los rangos normales (urea de 125mg/dl y creatinina de 4,64mg/dl), con aclaramiento de creatinina en 23ml/min/1,73m2, que representa un estadio funcional de ERC 4, que indica un daño renal severo.
En el examen de marcadores tumorales el único elevado fue la fosfatasa alcalina con valores de 1.110U/l.
El examen de orina fue negativo para infección, sin embargo existió microalbuminuria (120,5mg); asimismo se midió la creatinina en 24h sin alteración y proteínas en 24h con valores incrementados el doble sobre el valor normal (268,4mg/l).
Finalmente en el eje hormonal completo se evidenció: HPT severo (621pg/dl), dosificación de factor de crecimiento insulínico tipo 1 (somatomedina C) con valores de un niño de 10 años (231ng/ml); el resto de los valores hormonales respetaban los rangos normales.
Cabe destacar que en el resto de hemograma, coagulograma, proteinograma, ionograma, función hepática, pruebas inmunológicas (anticuepos anticentrómero y antinucleares), serología de pruebas infecciosas (VIH, VDRL y hepatitis A, B y C), electroforesis de proteínas y cuantificación de proteína de Bence‐Jones (para descartar mieloma múltiple), no hubo alteraciones.
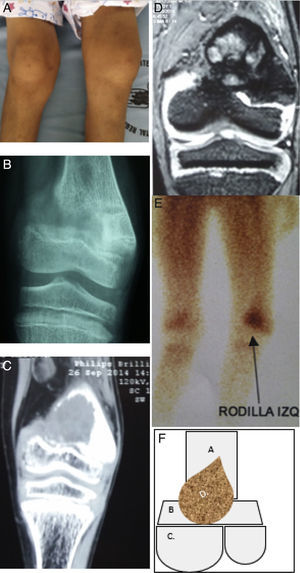
Se practicaron exámenes de imagen, tales como radiografía de 2 posiciones anteroposterior y lateral de rodilla en donde se evidenció una fractura incompleta en la zona de epífisis distal de fémur izquierdo, con imagen radioopaca infiltrante en la misma localización que da la apariencia de una fractura patológica; se procedió a realizar un TC en la misma localización donde se registra presencia de una lesión sólida osteolítica que mide 40×33mm que altera la morfología de la epífisis distal del fémur, mientras que el cartílago de crecimiento parecía respetado, además se observó mineralización ósea disminuida y marcado edema de tejidos blandos; estos hallazgos estaban relacionados con probable lesión ocupante neoplásica. El siguiente estudio que se utilizó fue la resonancia magnética nuclear de rodilla que reportó presencia de un proceso ocupante heterogéneo irregular metafisiario con compromiso de porción ósea y de la cortical con epicentro en la porción metafisiaria femoral distal, que mide 35×33m, y con la presencia de líquido perilesional. El resto de los componentes de la articulación de la rodilla estaban normales; se completó el estudio imagenológico con el empleo de la gammagrafía ósea en fase tardía con 99mTc metaestable, se evidenció captación homogénea de platillos de crecimiento y cartílagos costales, que se muestran sin alteraciones, existió captación homogénea en platillo de crecimiento de rodilla izquierda. Por lo tanto todos los estudios de imagen se caracterizaron por identificar una única lesión ósea circunscrita de características neoplásica y ocupante (figs. 1 y 2).
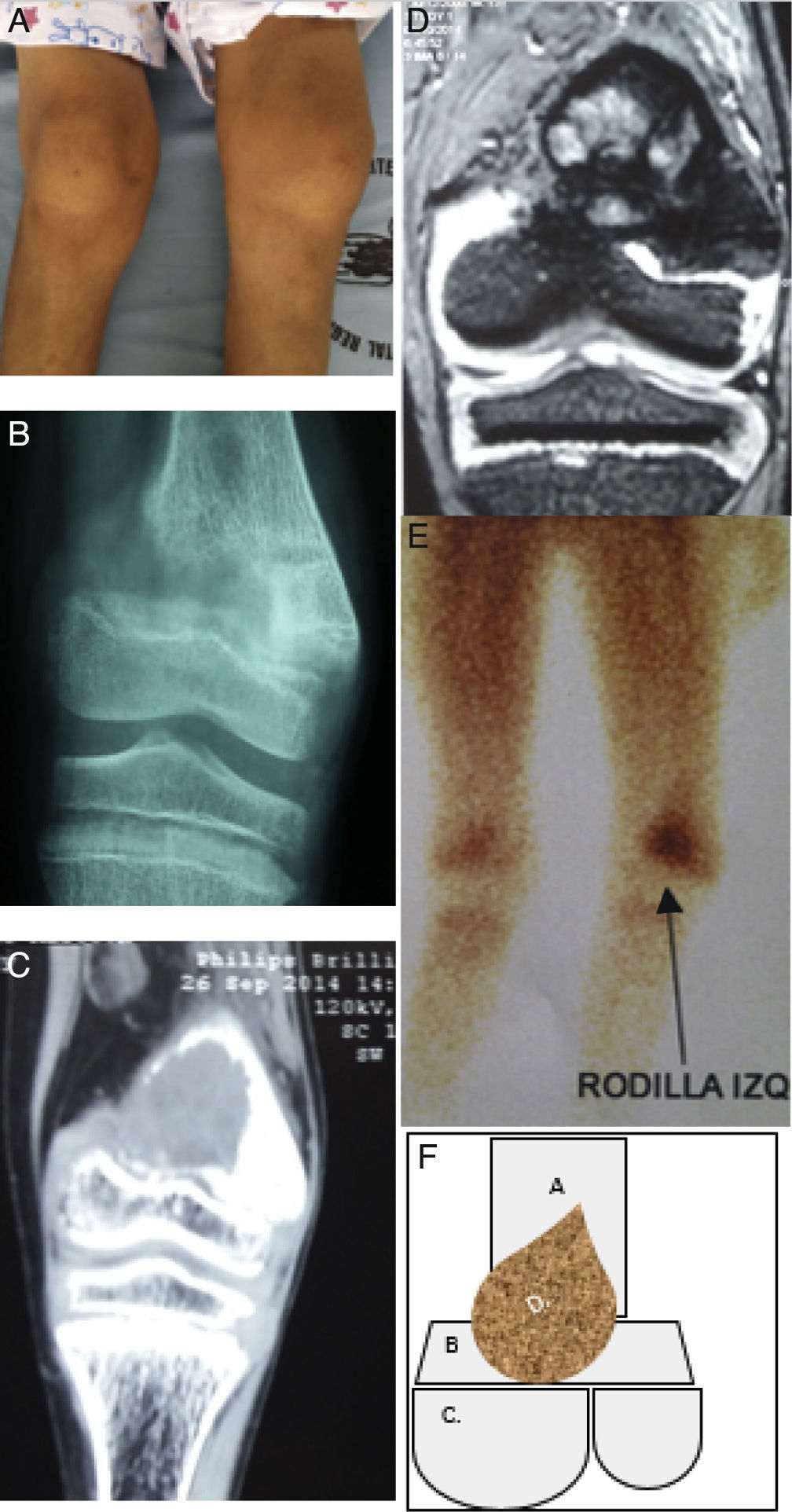
Descripción de la lesión ósea de tumor pardo en el paciente. 1A: En el examen físico se evidenció genu‐valgus marcado en miembro inferior izquierdo, con limitación funcional y edema leve. 1B: Radiografía anteroposterior de rodilla izquierda, donde se denota fractura incompleta en metáfisis de fémur izquierdo. 1C: TC en misma zona anatómica donde se evidencia disminución de densidad ósea a nivel de metáfisis femoral y lesión con apariencia de masa infiltrante. 1D: Resonancia magnética nuclear en misma zona anatómica donde se denota masa infiltrante que se localiza en metáfisis femoral y no compromete otras estructuras. 1E: Estudio de gammagrafía ósea donde se muestra captación de radiofármaco en metáfisis distal de fémur izquierdo. 1F: Esquema donde se describe como: A. Epífisis distal de fémur, B. Metáfisis femoral y cartílago fisiario, C. Superficies articulares distales de fémur y D. Tumor pardo localizado en metáfisis distal que respeta componente articular del fémur y tejidos blandos y sin embargo compromete cartílago fisiario. (Elaborado por: Juan Miguel Alemán I. Tomado de: Centro de imágenes del Hospital José Carrasco Arteaga).
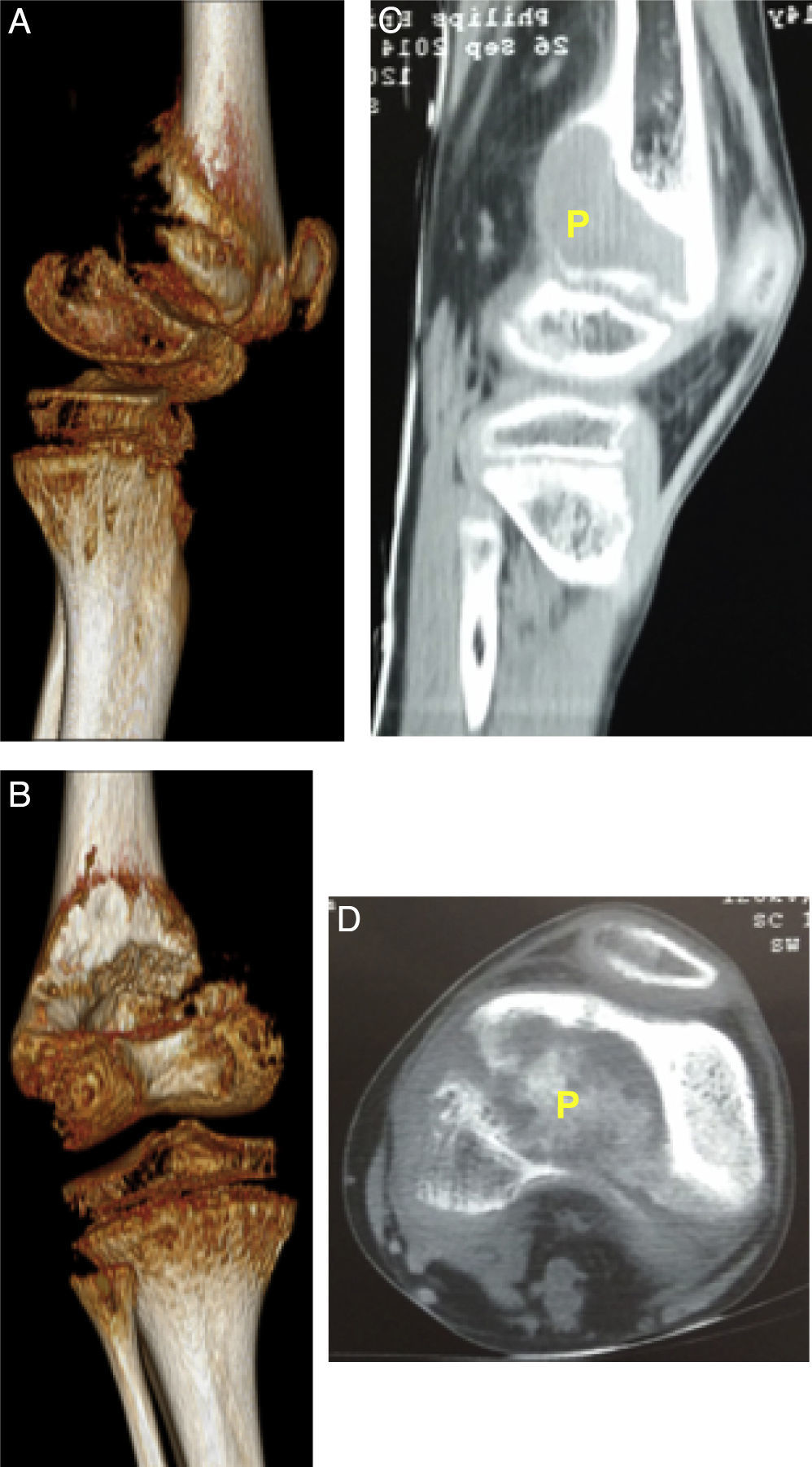
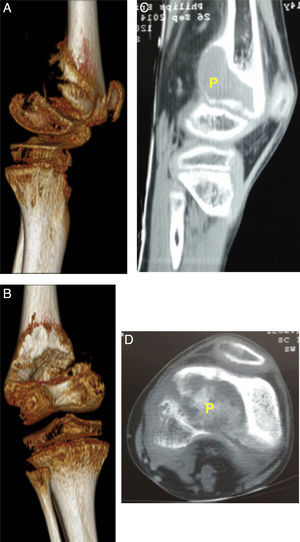
Descripción de la lesión ósea de tumor pardo en el paciente. 2A: Visión tomográfica en 3 dimensiones, vista lateral de epífisis distal de fémur izquierda. 2B: TC de fémur izquierdo vista sagital, se identifica como P, tumor pardo. 2C: Visión tomográfica en 3 dimensiones, vista posterior de epífisis distal de fémur izquierda. 2D: TC de fémur izquierdo vista coronal, se identifica como P al tumor pardo.
Se completaron los estudios de imagen siguiendo protocolo para buscar neoplasias en otros sitios, con serie metastásica ósea que evidenciaba lesión de características quísticas a nivel de calota, sin mostrar otra alteración en imágenes de tórax, ni abdomen, ni de pelvis, ni en extremidades.
Se realizó estudio de la glándula tiroides y paratiroides con ecografía donde se identifica una glándula de forma, tamaño y ecogenicidad normal. Sus bordes estaban regulares, sin lesiones focales con adecuada captación de flujos al doppler; el lóbulo derecho con un volumen de 1,14cc y el lóbulo izquierdo con un volumen de 0,98cc; mientras que el itsmo tenía 2,2mm de diámetro anteroposterior. Se procedió a la realización de gammagrafía de paratiroides con imágenes estáticas en proyección anterior sobre cuello a los 20, 60 y 120min. En las imágenes a los 20min que corresponde a la fase tiroidea se apreció captación en tiroides. En las imágenes a los 60 y 120min no se observa retención del radiotrazador que indique enfermedad. Se realizó además rastreo corporal total con 99mTc‐sestamibi en busca de posible enfermedad en donde se observa mayor captación en tercio inferior de fémur izquierdo. En conclusión, el estudio fue negativo para adenoma, hiperplasia y/o ectopia de paratiroides.
Finalmente en el estudio ecográfico de los riñones se apreció parénquima hiperecoico, heterogéneo, alteración de la diferenciación corticomedular; el riñón derecho mide 64×23×26mm, y el izquierdo 69×40×37mm. La vejiga se apreciaba con discreta irregularidad hacia el piso vesical con un volumen premicción de 109cc3 y volumen posmicción de 35,9cc.
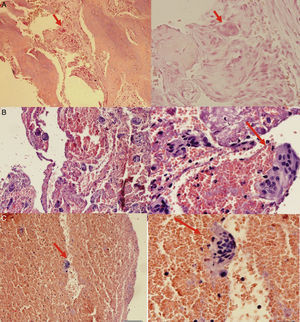
Con todos los resultados se decidió realizar biopsia (fig. 3) de la lesión empleando el procedimiento y aguja fina de Jamshidy; en la intervención se obtuvieron 2 fragmentos de tejido óseo, identificados macroscópicamente como: a. fragmento de tejido de color pardo que mide 0,4×0,2cm y b. fragmento de tejido de color blanquecino, de consistencia dura que mide 0,4×0,2cm; se procedió a realizar decalcificación de las muestras y tras el procesamiento se halló en los tejidos zonas de fibrosis, espículas óseas, células gigantes y estromales, escasos osteoblastos y zonas hemorrágicas. En el estudio del tejido blando se observó fibrina, eritrocitos y escasas células gigantes multinodulares. Ante estos hallazgos se concluyó con el diagnóstico anatomopatológico de tumor óseo pardo y de una avanzada OFQ (fig. 4)
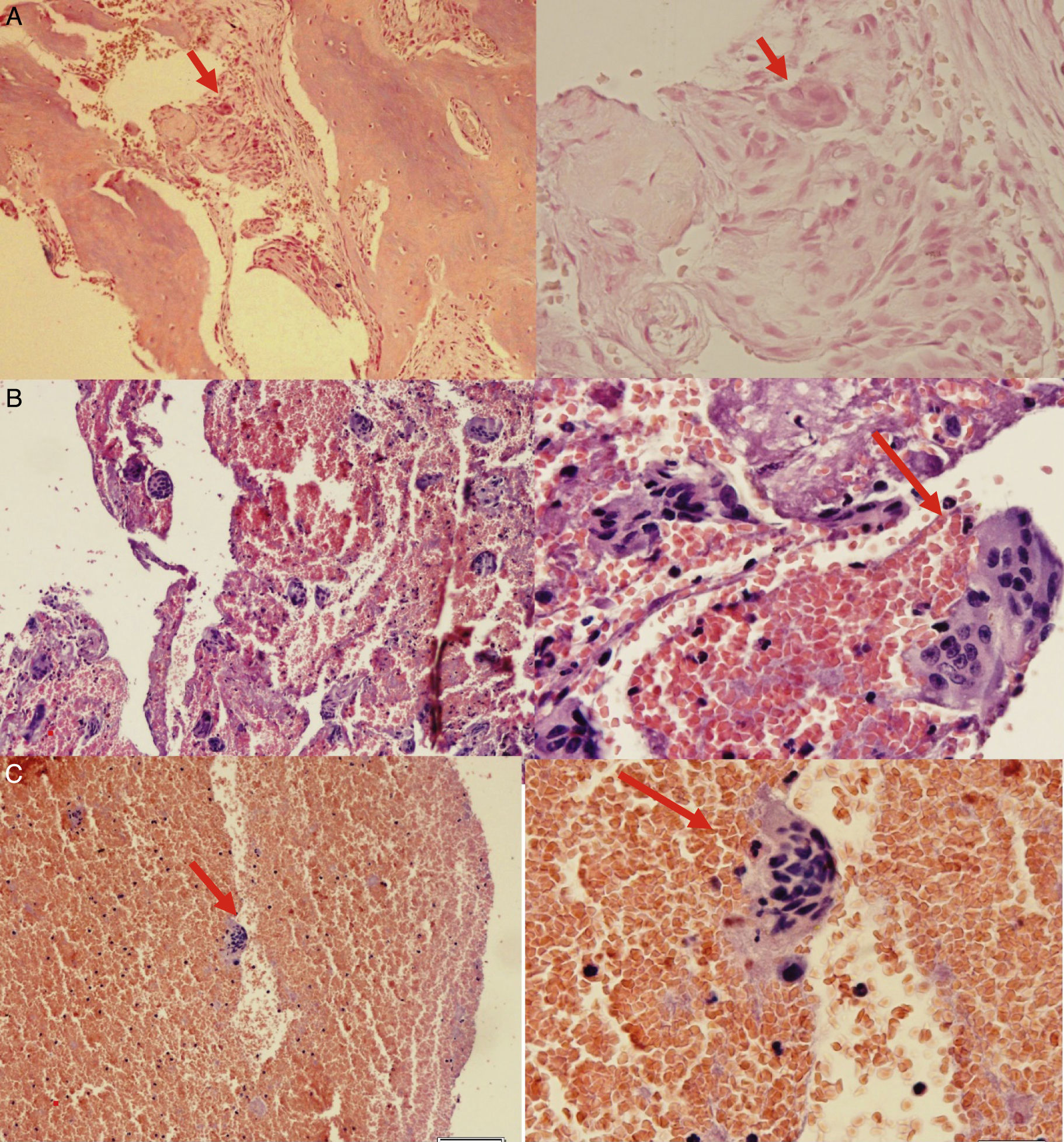
Hallazgos histológicos de la muestra tomada durante la biopsia. 3A: Muestra histológica procesada donde se evidencia célula gigante multinucleada. 3B: Muestra histológica procesada que denota gran cantidad de células multinucleadas. 3C: Identificación precisa de la célula gigante multinucleada, característica del tumor pardo óseo. (Elaborado por autores. Tomado de: Centro de Patología del Hospital José Carrasco Arteaga).
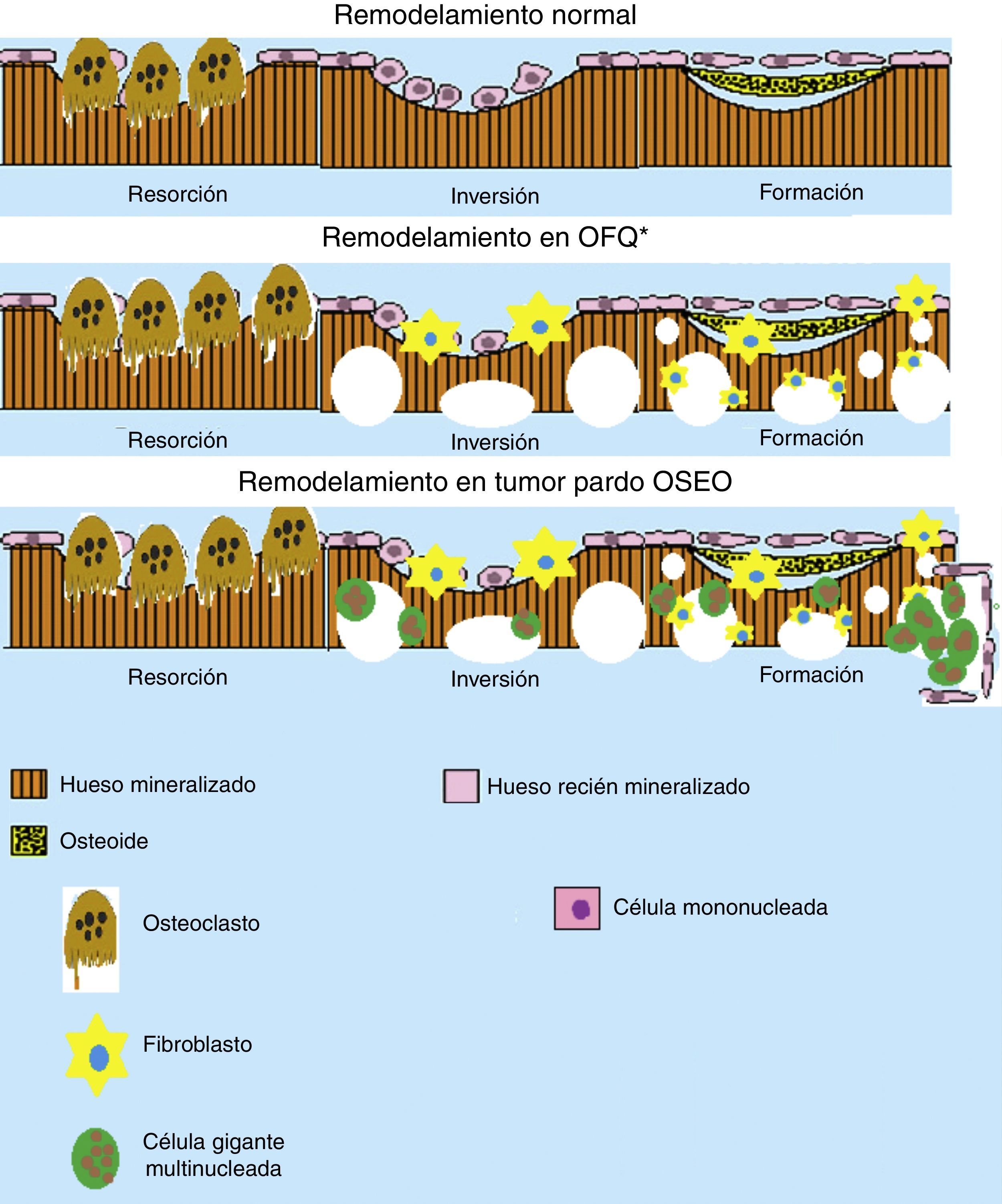
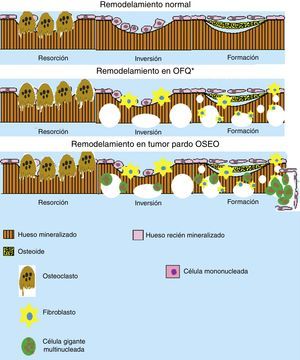
Esquema del remodelamiento óseo en la osteítis fibrosa quística (OFQ) y en la formación del tumor pardo. Se puede apreciar que durante el remodelamiento óseo en OFQ existe gran actividad osteoclástica dando aspecto quístico del hueso, la pérdida mineral ósea trae consigo la activación de los fibroblastos que crean fibrosis en los lugares de pérdida ósea. En cambio en la formación de tumor pardo se añade la presencia de células multinucleadas gigantes y los fibroblastos que crean la apariencia de un seudotumor óseo. (Elaborado por: Juan Miguel Alemán I. Tomado de: Rosenberg et al.4).
Los criterios usados en el diagnóstico del caso fueron los planteados para diferenciar el tumor pardo causado por HPT primario del secundario, además para distinguirlo de otras lesiones por osteodistrofia renal tales como la OFQ.
- •
Presencia de hipocalcemia, hiperfosfatemia y deficiencia de la 1,25 (OH) 2D: demuestra que es un HPT secundario según criterios de K/DOQI y KDIGO2,3.
- •
Patología: Presencia de células gigantes multinucleadas: comprueba que existe presencia de tumor pardo y no solo de una OFQ, además descarta osteosarcoma y osteocondroma como neoplasias más frecuentes localizadas en esa zona4.
- •
Normalidad imagenológica en glándula tiroides y paratiroides: sin alteración en gammagrafía de paratiroides, como prueba de oro diagnóstica de enfermedad en paratiroides5.
- •
Clínico y bioquímico: para diferenciar de la enfermedad ósea de bajo remodelamiento: El paciente no tiene antecedentes de toma prolongada de corticoides ni signos de baja densidad mineral ósea, sus valores de PTH son mantenidos y mayores de 120pg/l y no tiene historia de probable exposición alumínica prolongada2,3.
Diagnósticos diferenciales: se realizaron de acuerdo a la frecuencia en la localización en fémur.
- •
Tumores primarios óseos malignos: osteosarcoma, condrosarcoma, tumor de Edwing.
- •
Tumores primarios óseos benignos: quiste aneurismático óseo.
- •
Otros tumores sistémicos: mieloma múltiple, plasmocitoma óseo solitario, histiocitosis X o granuloma de células gigantes (enfermedad de Langerhans), displasia fibrosa poliostótica
- •
Infecciosas: osteomielitis multifocal.
- •
Alteraciones producto del HPT y osteodistrofia renal: OFQ (enfermedad renal ósea de alto remodelado), osteomalacia y raquitismo (enfermedad renal de bajo remodelado).
- •
El plan terapéutico elegido para tratar este caso fue en primer lugar corregir el HPT secundario con medidas farmacológicas. Una vez corregido el HPT se procederá a colocación de prótesis e injerto óseo en zona afectada con consiguiente estabilización. De igual manera se planteó el inicio de hemodiálisis para mejorar los valores de la PTH producto de su ERC.
Los pacientes con ERC desarrollan HPT secundario debido principalmente a la hipocalcemia que a su vez es consecuencia de la disminución de la síntesis de la vitamina D y esto va a provocar un efecto directo al tejido óseo, entidad que se conoce como osteodistrofia renal. Se describen 2 tipos de enfermedad ósea renal producto del HPT, uno es la enfermedad del hueso de alto remodelado, llamado osteítis fibrosa; la otra es la de bajo remodelado representada por la osteomalacia que se caracteriza por defecto de la calcificación y a menudo se complica con la deficiencia de vitamina D y con la acumulación de aluminio. En este artículo discutimos una complicación de la enfermedad ósea renal de alto remodelamiento, como es el tumor pardo6.
EpidemiologíaLos tumores pardos están presentes en el 3‐4% de los pacientes con HPT primario, convirtiéndose esta población en la más frecuentemente afectada; el 1,5‐1,7% de los pacientes con HPT secundario desarrolla tumores pardos7. Este hecho no se relaciona con que alrededor de la mitad de los pacientes con ERC puede desarrollar OFQ debido a HPT secundario7.
Cabe destacar que la tendencia de pacientes con tumor pardo por HPT secundario a ERC está en aumento por los aspectos de mayor supervivencia logrados con la hemodiálisis8. En cuanto a la presencia de tumores pardos en edades pediátricas y aún más cuando se relacionan con ERC, casi no se encuentran documentados y los pocos casos se refieren a niños a afectados por HPT primario; por este motivo llama la atención la evolución de ERC del caso descrito para que produzca una enfermedad renal ósea agresiva.
FisiopatologíaRaras veces el tumor pardo es producto del HPT secundario a insuficiencia renal, sin embargo es consecuencia de un proceso que empieza con el daño de la función exocrina del riñón, más específicamente del aparato yuxtaglomerular encargado entre otras funciones de la síntesis de la 25‐dihidroxivitamina D. Esto se traduce en la disminución de la absorción renal e intestinal de calcio, provocando la disminución sérica de calcio, y es entonces cuando ocurren varios eventos compensadores; uno de ellos es el aumento de fosfatos en suero y la disminución en huesos (produciendo desmineralización ósea) y otra situación es la hiperestimulación de hormona paratiroidea que tratará de compensar el déficit de calcio en suero, obteniéndolo de los depósitos en el tejido óseo, aumentando la desmineralización ósea. A nivel de huesos se produce mecanismo de reemplazo de tejido óseo mineral por fibrosis, dando lugar a las lesiones de OFQ, y cuando empieza la proliferación de células polinucleares gigantes, las lesiones toman el aspecto y densidad de una neoplasia, estableciéndose el tumor óseo pardo9.
El mecanismo óseo local obedece a la acción directa de la PTH y de producción local de factor α de necrosis tumoral y la interleucina 1 (IL‐1) por los monocitos que inducen a la proliferación y diferenciación de células de la médula ósea en osteoblastos; estos últimos estimulan la producción de IL‐6 e IL‐11 por macrófagos que a su vez inducen la migración y la diferenciación de los monocitos en osteoclastos, y de este modo aumentan la actividad de resorción ósea y reducen la densidad mineral; ante la pérdida de sustancia inorgánica del hueso esta es reemplazada por tejidos fibroso y matriz extracelular1.
Mientras tanto las células de las glándulas paratiroides comienzan a proliferar en respuesta al déficit de calcio, dando lugar primero a una hiperplasia del tejido de tipo difuso, más tarde a un tipo nodular (a este último se lo conoce como «tejido rebelde» ya que aparece en la insuficiencia renal terminal) y aquí es cuando se vuelve resistente a los tratamientos médicos convencionales tales como aglutinantes de fosfato y suplementos de vitamina D activa; el crecimiento de la glándula acelera el cambio del patrón de hiperplasia difusa al de tipo nodular. En este proceso, las células se vuelven resistentes a la captación de vitamina D, por lo tanto no se da el mecanismo de regulación de la secreción de la PTH. Muchos estudios experimentales han revelado como causas la baja regulación de receptor de la vitamina D, receptor sensible al calcio y el receptor retinoide X en células de glándula10. Mencionar que en el caso reportado los valores de PTH tuvieron mínimo descenso con el tratamiento farmacológico por lo tanto se relacionó con una enfermedad ósea renal complicada, se infiere que la hiperplasia en la glándula paratiroides ha alcanzado su modalidad nodular.
Cuadro clínicoEl cuadro clínico que se relaciona con el tumor pardo es variable y pasa inadvertido por el propio paciente; además pueden presentarse un sinnúmero de síndromes que se relacionen con la localización. Por citar un ejemplo, si el tumor se localiza en columna vertebral puede provocar un síndrome medular o de comprensión radicular11; si se ubicara en base del cráneo podría causar oftalmoplejía7; o si se ubicara en maxilar o mandíbula se presenta como una masa creciente que deforma estructuras12; y cuando se ubica en extremidades puede relacionarse con dolor crónico que no cede con medidas farmacológicas, que tiene periodos de renitencia, se puede acompañar de prurito y dolor nocturno; en otros casos comienza con fracturas patológicas13. Por esta circunstancia el diagnóstico diferencial con tumores malignos siempre debe estar presente. El paciente que se documenta en este artículo cumple con criterios clínicos con dolor crónico desencadenado por un trauma, poco específico que no imposibilita la funcionalidad; sin embargo, fue notoria la deformidad angular pues la pierna estaba en genu‐valgo.
Patología estructuralLos tumores pardos son lesiones ocupantes sin embargo no son neoplasias verdaderas, se comportan como tumores malignos por su capacidad osteolítica (mediada por los osteoclastos), y de hecho ese es el primer diagnóstico diferencial4.
La denominación de tumor pardo proviene de la evidencia de microhemorragias que conduce al depósito de hemosiderina, dando aquel característico color marrón rojizo4,12. Los tumores pardos atacan la región cortical de los huesos mayoritariamente, ya que aquí se produce la actividad osteoclástica5.
La localización del tumor pardo aún es un tema muy controvertido; los lugares son inespecíficos y no existe patrón sugestivo de que el tejido óseo sea el más afectado; sin embargo, el mayor número de casos se reportan en hueso maxilar y mandíbula5, en especial si se trata de HPT primario; si se habla de HPT secundario no se respeta ningún patrón frecuente de lesiones, y aquí las lesiones pueden ir a lugares tan raros como la columna vertebral11 o hueso esfenoides7 y tan inusuales que llegan afectar el cartílago cricoides14; si hablamos de extremidades sobre todo tienden a hallarse en falanges de las manos. El caso tiene una presentación atípica infrecuente en casos reportados en la revisión en la literatura; cuando se refiere a neoplasias en fémur la posibilidad de osteosarcoma siempre estará latente, o de un plasmocitoma óseo solitario, y cuando ocurre esta coincidencia anatómica es mandatorio la biopsia de manera urgente para realizar un correcto diagnóstico etiológico.
ImagenologíaLos hallazgos radiográficos del tumor pardo pueden incluir osteoporosis generalizada, resorción ósea cortical subperióstica y cambios quísticos; además pueden estar presentes con menor frecuencia esclerosis ósea y calcificación extraesquelética. Mientras que las características radiológicas en la OFQ por sí sola se asocia con: la desmineralización, pérdida de la lámina dura y el patrón trabecular con una apariencia de «vidrio esmerilado»13. En el caso se realizaron radiografías, tomografía, resonancia y finalmente la gammagrafía ósea en fase tardía, teniendo como común denominador la lesión subperióstica pero que se limitaba al hueso y no lesionaba tejidos blandos ni cartílago fisiario ni elementos de la articulación como dato importante para diferenciarlo del osteosarcoma.
Historia naturalLa posibilidad de coexistencia de tumor pardo con la ERC depende proporcionalmente de los valores de la PTH, por lo tanto es en los estadios terminales de la ERC, es decir 4 y 5 con valores de PTH mayores a 120pg/ml (como valor de cohorte), donde se presenta con mayor frecuencia; y aún más la tendencia a aumentar en pacientes con ERC terminal con mayor supervivencia lograda por la hemodiálisis. Al hablar de tumor pardo nos referimos a una complicación última de una osteodistrofia renal de alto remodelamiento, por lo tanto la mayoría de los casos producen fracturas patológicas que pueden evolucionar a cuadros agresivos, alterando totalmente la anatomía ósea en una ubicación específica13.
TratamientoEl tratamiento del tumor pardo por HPT secundario a ERC tiene que ser valorado en etapas. Por ser un tumor dependiente de los valores de la hormona paratiroidea, solo se resolverá con el control de la PTH, y en este ámbito se propone un manejo de tipo farmacológico y otro invasivo quirúrgico; el primero a través del calcitriol y el segundo mediante la paratiroidectomía. La discusión es aún controvertida acerca del beneficio de cada uno, sin embargo en un estudio realizado en Italia que compara estos 2 tratamientos en pacientes con HPT secundario a ERC con la curva sigmoide entre la concentración de calcio extracelular y los niveles de PTH en plasma en el HPT en la que esta última se desplaza hacia la derecha y arriba, se vio que la terapia con calcitriol tiene efectos claros en convertir una curva con tendencia hacia arriba y a la derecha en una curva hacia abajo y a la izquierda, resultados no tan alentadores con la paratiroidectomía; tal vez la causa se encuentre en el hecho de que en la ERC las células de las glándulas paratiroides aumentan su sensibilidad funcional y de que no depende del volumen ni de la masa de la glándula para producir la alteración, por lo tanto es más importante corregir la funcionalidad antes que el aspecto de la hiperplasia del tejido15. El pronóstico empeora en ERC terminal de larga evolución cuando la hiperplasia de la glándula paratiroides es de tipo nodular, haciendo que sea un blanco farmacológico y quirúrgico «rebelde»; desde 2010 se han diseñado trabajos con terapia genética, con el objetivo de actuar en los genes que codifican las proteínas que sintetizan la PTH, en modelos de experimentación desarrollados en adenovirus16.
Mencionar que la paratiroidectomía en casos de tumor pardo y OFQ por HPT primario tiene un buen pronóstico y reduce la posibilidad de recaídas, sin embargo en HPT secundario no obedece a la misma fisiopatología y la paratiroidectomía no logra el mismo efecto que en el HPT primario17.
Se ha observado que farmacológicamente altas dosis de vitamina D activa administrada por vía oral puede producir una pequeña regresión de la hiperplasia nodular a difusa en pacientes con HPT avanzado. Sin embargo la mejor terapéutica es el trasplante renal ya que puede restaurar expresiones de los genes que codifican los receptores de vitamina D y sensibles al calcio en las células de una glándula paratiroides con hiperplasia de tipo difuso. En conclusión, es importante tratar el HPT cuando la proliferación de las células de la glándula paratiroides está en la etapa reversible de la hiperplasia difusa (Tokumoto, et al.)10.
Otra etapa del manejo es la intervención quirúrgica ortopédica; esta se limita generalmente al tratamiento de fracturas (fig. 5). En algunos casos, las fracturas patológicas y lesiones osteolíticas por tumores pardos se pueden tratar con legrado quirúrgico, injerto de hueso o estabilización. Las fracturas incompletas tienen indicación quirúrgica profiláctica siempre y cuando se presenten en huesos que soportan gran peso, en particular del cuello femoral, y la intervención que se emplea es la fijación quirúrgica. En casos de fracturas completas desplazadas, a menudo requieren fijación quirúrgica y estabilización. En casos muy raros, donde la porosidad del hueso y la gran ocupación del tumor pardo producen fracturas patológicas junto con otras complicaciones podrían estar más allá de la reparación y requieren amputación. Dependiendo de la ubicación el tumor pardo podría convertirse en una urgencia quirúrgica, esto se puede ver en el desarrollo del tumor en las vértebras, que podría causar compresión medular con un consiguiente déficit neurológico. El tratamiento quirúrgico en casos graves y agresivos puede requerir injerto de hueso y la construcción adicional de hueso para reparar tejido dañado18,19.
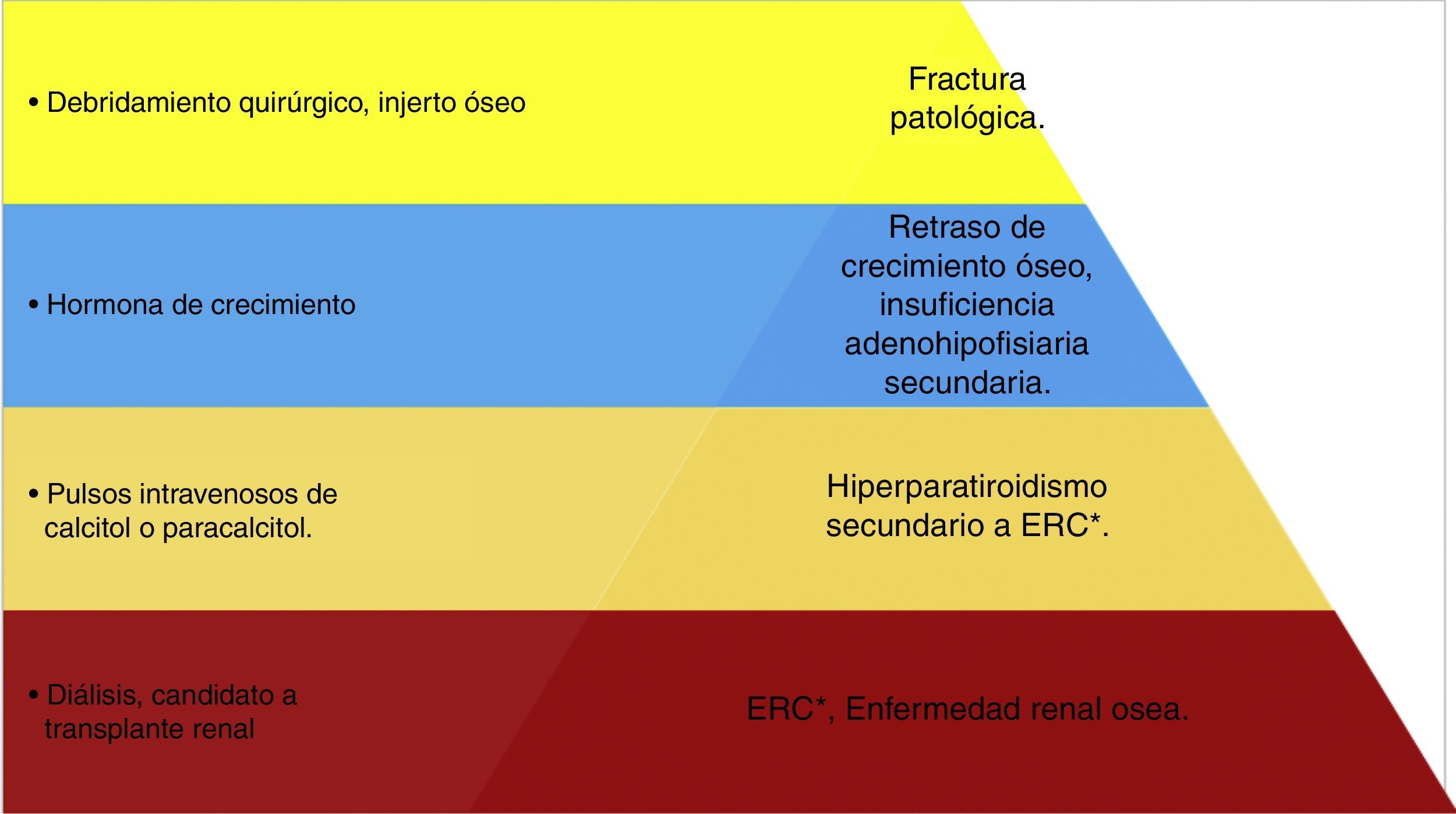
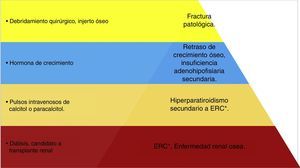
Jerarquización en el manejo del tumor pardo en paciente pediátrico. Esquema de manejo terapéutico del paciente en donde se jerarquizan los problemas; se observa que la base del tratamiento es el control de la enfermedad renal crónica con la diálisis y el trasplante renal; y el puntal del tratamiento será la colocación del injerto óseo. (Elaborado por: Juan Miguel Alemán I. Tomado de: Rosenberg et al.4).
El tumor pardo es una complicación poco frecuente, y cuando se relaciona a la ERC indica un daño severo producto de un síndrome de HPT. Después de la revisión bibliográfica se puede decir que el caso cumple todos los criterios diagnósticos para garantizar la correcta etiología del cuadro; la peculiaridad de la localización y el inespecífico cuadro clínico tienen una correlación con el tumor pardo pues como se vio en la literatura las lesiones se restringen en las áreas subperiósticas y de la cortical del hueso sin afectar tejido blando, ni cartílago fisiario, ni elementos de la articulación, importantes datos que lo diferencian de otros tumores malignos que infiltran tejidos como lo es el osteosarcoma. Ante la presencia imagenológica de un tumor óseo el diagnóstico debe empezar por analizar las frecuencias de la localización, en el caso de las neoplasias que en primera instancia se presentan en el fémur se citan: el osteosarcoma, condrosarcoma y sarcoma de Edwing, luego le siguen granulomas de células gigantes y plasmocitoma óseo solitario; el tumor pardo es muy poco frecuente en esta localización, por esta razón el diagnóstico definitivo se concretó en la biopsia de tejido donde se corroboró la evidencia de células gigantes multinucleadas que se acompañan de una osteítis fibrosa. La presentación atípica no solo se refiere a la localización sino a la edad del paciente ya que sabiendo que el tumor pardo es una complicación de un proceso de osteodistrofia renal en el contexto de la ERC terminal, no respeta mucho el hecho; la tasa de filtrado glomerular de paciente aún no tiene criterio de hemodiálisis, pero ante la evidencia de enfermedad renal ósea grave se convierte en mandatorio para control del HPT. El paciente tiene lesiones extensas que produjeron una fractura incompleta, por lo que se debe seguir el caso en etapas donde la primera corresponde al control del HPT, a través de la terapia de calcitol y paracalcitol en pulsos venosos, luego viene el control de la ERC donde es mandatorio empezar hemodiálisis, y por último se tratará la intervención ortopédica empleando injerto óseo y estabilización. Cabe indicar que otro problema es el retraso de crecimiento por lo que el paciente es candidato para terapia de hormona de crecimiento. El pronóstico del paciente es incierto pero se debe discutir la posibilidad de trasplante renal por su edad y la evolución temprana de la ERC terminal, de esta manera mejoraría el aspecto funcional y molecular en la fisiopatología de este caso de HPT secundario muy agresivo en edad pediátrica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.