Os doentes submetidos a tratamentos oncológicos podem apresentar diversas endocrinopatias, algumas das quais poderão afetar o tecido ósseo de forma permanente se não tratadas em tempo útil. Com a apresentação deste caso clínico pretendemos alertar para as potenciais morbilidades graves, a longo prazo, dos doentes com endocrinopatias secundárias ao tratamento do cancro não oportunamente tratadas.
Apresentamos o caso de um doente do sexo masculino, submetido a tratamento com quimio e radioterapia cervical e submaxilar aos 5 anos pelo diagnóstico de rabdomiossarcoma do seio maxilar direito. Aos 12 anos, o doente foi referenciado para a consulta de endocrinologia de reabilitação do nosso centro. Durante o seu desenvolvimento apresentou algumas disfunções endócrinas, nomeadamente deficiência de somatotropina (DS), não atempadamente tratada por o doente não apresentar indicações para terapêutica, segundo os critérios vigentes na altura. Apresentou também hipotiroidismo primário e hipogonadismo parcial misto adequadamente tratados. Durante a idade adulta verificou‐se o estabelecimento de osteoporose. Apesar da exposição a diversas terapêuticas passíveis de levar à diminuição da densidade mineral óssea, a DS não tratada foi, neste caso, preponderante para o desenvolvimento de osteoporose.
É importante o reconhecimento precoce das endocrinopatias secundárias ao tratamento para o cancro para se poder estabelecer um tratamento atempado destas condições, particularmente aquelas com consequências importantes, quando não tratadas, como a DS.
Childhood cancer survivors can develop several endocrinopathies, some of which may permanently affect bone tissue if not properly treated. With this case report presentation we intend to emphasize serious long‐term morbidities of patients with endocrine disorders secondary to cancer treatment not timely treated.
We present the case of a male patient, who was treated with chemotherapy and cervical and submaxillary radiotherapy at the age of 5 when he was diagnosed with a rhabdomyosarcoma of the right maxillary sinus. At the age of 12 he was referred to our Endocrine Rehabilitation Clinic. During his development he presented some endocrine disorders, including growth hormone deficiency (GHD) not promptly treated because he wasn’t eligible for somatropin therapy according to current criteria back then. He also developed primary hypothyroidism and partial hypogonadism which were appropriately treated. Establishment of osteoporosis was verified during adulthood. Despite the exposure to several therapeutic agents that could have conduct to decreased bone mineral density, the partial absence of GH was, in this case, the leading cause of osteoporosis.
Early identification of endocrinopathies secondary to cancer treatment is important in order to establish a timely treatment of these conditions, especially those with important consequences when not treated, like GHD.
Muitos doentes submetidos a tratamentos oncológicos, sobretudo crianças e jovens, apresentam um risco aumentado de desenvolvimento de complicações endócrinas. No nosso centro, após completarem os tratamentos para a neoplasia de base, os doentes são referenciados à consulta de endocrinologia de reabilitação. Esta referenciação pode ocorrer mais cedo se os doentes desenvolverem endocrinopatias ainda durante a terapêutica oncológica. Inicialmente, são identificados os seus riscos endócrinos e, de acordo com estes, é programado o seguimento periódico de forma a serem detetadas atempadamente as endocrinopatias secundárias ao tratamento oncológico ou à própria neoplasia e para se estabelecer o tratamento adequado. A terapêutica para o cancro pode alterar o metabolismo ósseo de diversas formas – efeitos diretos no osso pela radioterapia local ou por alguns fármacos; ações no sistema nervoso central por parte da radioterapia e/ou quimioterapia, causando disfunção hipotálamo‐hipofisária; efeitos periféricos da quimio ou radioterapia nos órgãos endócrinos (gónadas, tiroide e paratiroides) e alterações da dieta durante a terapêutica para o cancro (défice de vitamina D)1,2. Apesar disto, a maioria dos sobreviventes de doença oncológica durante a infância acaba por recuperar a massa óssea ao longo do tempo3 se a sua causa for reversível ou se for tratada convenientemente. Relatamos o caso de um doente que apresentou diversas sequelas endócrinas do tratamento oncológico, tendo a osteoporose acabado por se estabelecer pelo «não tratamento» de uma delas. Pretendemos assim alertar para o seguimento e tratamento completo destes doentes, de forma a evitar o desenvolvimento de endocrinopatias potencialmente graves e com elevada carga de morbilidade para o futuro.
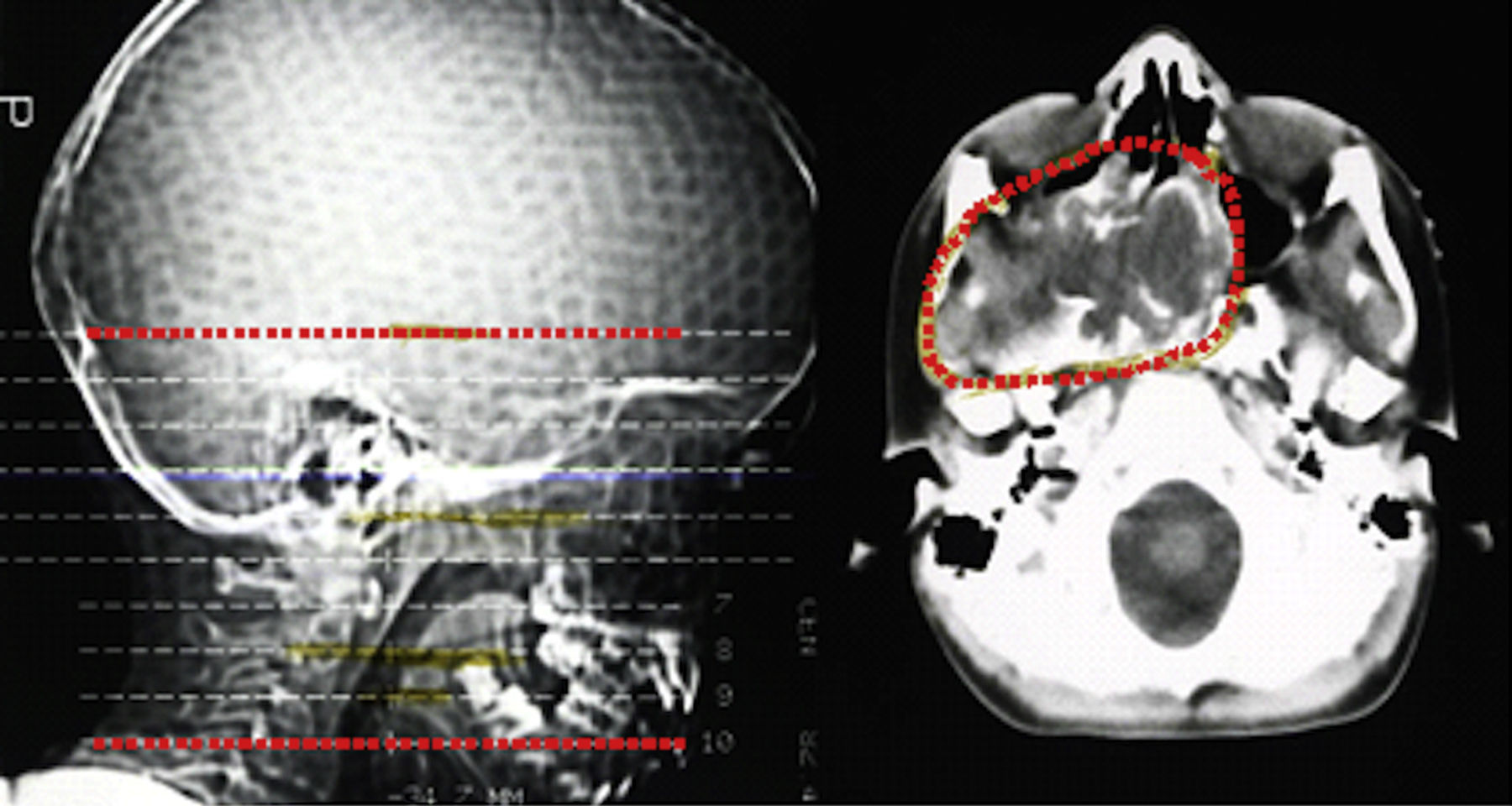
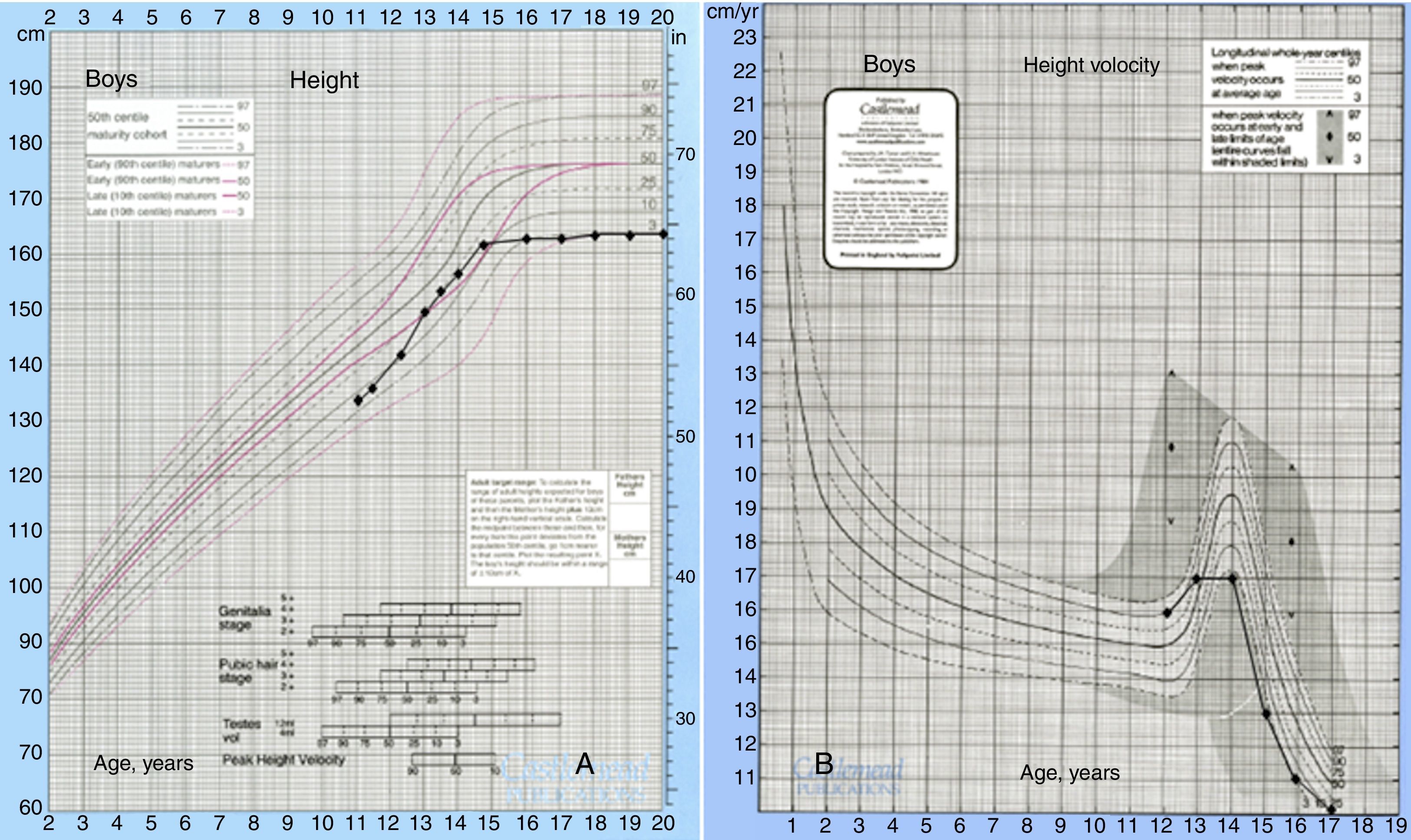
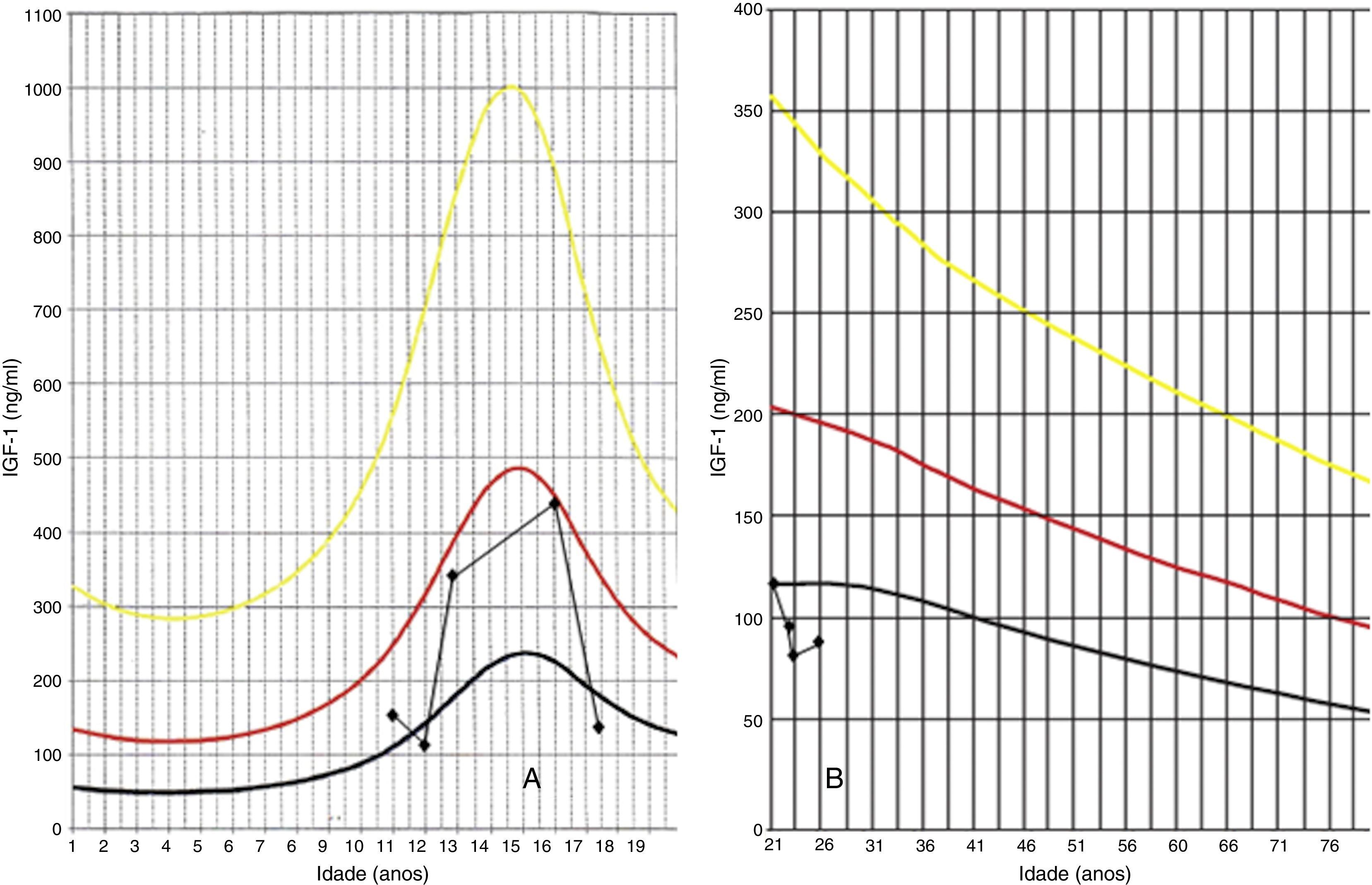
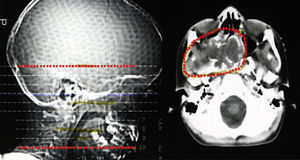
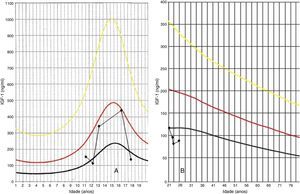
Descrição do casoDoente do sexo masculino, caucasiano, sem antecedentes pessoais ou familiares relevantes, com diagnóstico de rabdomiossarcoma do seio maxilar direito aos 5 anos de idade. Como tratamento realizou uma perfusão de quimioterapia intratecal com metotrexato e prednisolona e quimioterapia intravenosa com vincristina, actinomicina e ifosfamida (doses totais não disponíveis no processo). Foi submetido também a radioterapia (RT) cervical e submaxilar na dose total de 51Gy – a figura 1 mostra a TAC de planeamento da RT onde se pode verificar que a sela turca foi envolvida no campo irradiado. Aos 12 anos o doente foi referenciado à consulta de endocrinologia de reabilitação. Auxologicamente apresentava estatura de 139cm (percentil 10); estatura alvo familiar de 170cm (percentil 10); idade óssea de 9 anos; estádios de Tanner – pelos púbicos 2, genital 2, pelos axilares 2 – e volume testicular de 5mL. Realizou avaliação analítica – TSH (thyroid stimulating hormone) 7,4mUL/mL (0,3‐4,2); T4 livre 0,8ng/dL (0,9‐1,7); IGF‐1 (insulin‐like growth factor 1) 102ng/mL (<percentil 3); eixos gonádico e cortico‐suprarrenal sem alterações – e, posteriormente, prova de hipoglicemia insulínica, cujo valor máximo atingido de somatotropina foi 6,6ng/mL (normal>7) com correspondente glicemia de 45mg/dL. Portanto, apresentava hipotiroidismo primário, tendo sido medicado com levotiroxina 50μg/dia, e também deficiência parcial de somatotropina. No entanto, face aos critérios vigentes na altura em Portugal – uma vez que auxologicamente se apresentava dentro dos valores de normalidade e tinha sofrido uma doença oncológica – não apresentava indicação para terapêutica com somatotropina. Apesar de ter crescido no percentil 10 até por volta dos 14 anos, começou nesta altura a cruzar percentis, tendo a sua estatura final – 163cm – ficado aquém da estatura alvo familiar (fig. 2A). Progrediu autonomamente na puberdade, atingindo aos 17 anos (idade cronológica correspondente à óssea) estádio de Tanner 5 e volume testicular de 25mL. Contudo, o doente não realizou o surto pubertário (fig. 2B). Os níveis séricos de IGF‐1 permaneceram sempre abaixo do percentil 50, encontrando‐se, por vezes, inferiores ao percentil 3 (fig. 3A). Realizou ecografias tiroideias ao longo do seguimento que não revelaram alterações.
Aos 18 anos realizou osteodensitometria que revelou T‐score na coluna lombar de −3,1 e no colo do fémur −1,9, tendo iniciado terapêutica diária com carbonato de cálcio (1.500mg) e colecalciferol (400UI). Não apresentou melhoria destes parâmetros dado que, passados 3 anos, apresentava T‐score de −3,6 na coluna lombar e −1,9 no colo do fémur. Reavaliou‐se o eixo gonádico, tendo‐se verificado LH (luteinizing hormone) 1,7mUI/mL (>8), FSH (follicle‐stimulating hormone) 2,0mUI/mL (>10), testosterona total 324,8ng/dL (160‐730) e livre 10,2ng/dL (9‐27) e dihidrotestosterona 253ng/dL (300‐850), tendo‐se realizado, ainda, o doseamento de prolactina que foi de 5,1ng/mL (<18), pelo que se admitiu um hipogonadismo misto parcial, mas de predomínio central, tendo iniciado terapêutica com enantato de testosterona 250mg mensal. Realizou também, aos 21 anos, um espermograma que revelou oligoteratoastenozoospermia. Apesar da reposição correta, da prática adequada de desporto, da dieta equilibrada (com consumo de apenas um café/dia) e da inexistência de hábitos tabágicos ou etanólicos, apresentou, passados 2 anos, T‐score na coluna lombar de −3,8 e no colo do fémur de −2,1. Como continuava com IGF‐1 de 79ng/mL, inferior ao percentil 3 (fig. 3B), optou‐se por iniciar terapêutica com somatotropina na dose de 0,1mg/dia, suportado pelo próprio, uma vez que, apesar de apresentar défice desta hormona, atualmente não preenche os critérios portugueses para esta terapêutica, já que não apresenta este défice isoladamente. Aos 25 anos (idadeda última consulta) apresentava T‐score na coluna lombar de −3,6 e no colo do fémur de −2,3, pelo que se aumentou a dose para 0,2mg/dia.
DiscussãoO doente apresentou diversas endocrinopatias decorrentes dos tratamentos oncológicos aos quais foi submetido.
Deficiência de somatotropinaA deficiência de somatotropina estabeleceu‐se devido à radioterapia realizada (como observado na prova de hipoglicemia insulínica, valores de IGF‐1 e auxologia). Este eixo é o mais radiossensível, seguido pelo eixo das gonadotrofinas e depois pelo da TSH e ACTH4. Nos casos em que são usadas doses inferiores de radioterapia, como na leucemia, ocorre normalmente deficiência isolada de somatotropina, enquanto doses superiores (>60Gy) afetam outros eixos neuro‐endócrinos relativamente mais radiorresistentes, levando a défices pituitários múltiplos5,6. A vulnerabilidade destes eixos à radiação é maior nas crianças que nos adultos, afetando preferencialmente as crianças mais jovens7,8. A gravidade e a rapidez de aparecimento da deficiência de somatotropina após a radioterapia é dose‐dependente e a sua incidência aumenta com o tempo pós‐radiação. Quase 100% das crianças tratadas com doses superiores a 30Gy terão respostas diminuídas na prova de hipoglicemia insulínica aos 5 anos de sobrevivência. Esta prova tem sido considerada a «gold standard» para identificar a deficiência de somatotropina especialmente a induzida pela radiação4. Ao contrário dos testes com GHRH (growth hormone releasing hormone) ou GHRH+estimulação com arginina, esta prova reflete a reserva funcional do eixo hipotalamo‐hipófisário na criança irradiada. Uma resposta diminuída da somatotropina nesta prova, mesmo na presença de uma resposta normal nos outros testes, é significativa, uma vez que pode antecipar a necessidade de tratamento com reposição desta hormona num doente que já se encontra com o eixo da somatotropina hiperestimulado e que, provavelmente, não conseguirá desempenhar uma resposta adequada quando a sua necessidade aumentar, nomeadamente durante o crescimento e puberdade. Isto é, a radiação externa provoca primariamente deficiência de GHRH e secundariamente deficiência de somatotrofos, o que explica os padrões discordantes de resposta de alguns doentes que não respondem na prova de hipoglicemia insulínica e que apresentam respostas normais nos testes com GHRH ou GHRH+arginina. A extensão da lesão da radiação nestes 2 locais e a intensidade dos mecanismos compensatórios varia entre indivíduos e determina os padrões de resposta da somatotropina aos vários estímulos e a natureza da discordância entre a secreção espontânea e estimulada desta hormona nas diferentes fases da vida. Portanto, a falência da resposta da somatotropina na prova de hipoglicemia insulínica pode ocorrer antes de qualquer declínio na sua secreção espontânea. Esta acentuada diminuição, previamente atribuída à diminuição de GHRH endógena por lesão hipotalâmica9–12 pode ser consequência do efeito cumulativo da diminuição da massa de somatotrofos e de uma atividade hiperestimulada hipotalâmica associada, o que limita a estimulação adicional pela hipoglicemia. Esta hipótese está de acordo com os mecanismos de estimulação da somatotropina por este teste – para além de inibir o tónus da somatostatina, a hipoglicemia causa libertação de GHRH, significando que a libertação adicional de GHRH está atenuada se o próprio pool de GHRH já estiver previamente diminuído4.
HipotiroidismoO doente desenvolveu, também, hipotiroidismo primário devido à radioterapia a que foi submetido na região cervical. O hipotiroidismo primário é muito frequente após a irradiação cervical externa, principalmente após altas doses (30‐70Gy), ocorrendo normalmente nos 5 anos após a radioterapia, com pico de incidência entre os 2‐3 anos13. O efeito é dose‐dependente e a sua instalação gradual, sendo mais frequente nos doentes irradiados durante a infância. Nestes, existe uma relação inversa entre a idade da irradiação e o tempo necessário para o estabelecimento de hipotiroidismo. Dados do Childhood Cancer Survivor Study mostraram que a incidência de hipotiroidismo em doentes submetidos a radioterapia por linfoma de Hodgkin foi significativamente maior que no grupo controle; cerca de metade dos doentes apresentaram hipotiroidismo 2‐7 anos após a irradiação, com diminuição da incidência após esse período14. O tratamento do hipotiroidismo subclínico ou clínico deve ser iniciado precocemente, principalmente em crianças, uma vez que pode originar complicações graves no seu crescimento e desenvolvimento cognitivo. Os doentes submetidos a radioterapia cervical ou aqueles em que a radiação atingiu a glândula tiroideia devem realizar palpação e ecografia cervicais periodicamente, uma vez que apresentam risco aumentado de desenvolverem nódulos tiroideus e, posteriormente, carcinoma da tiroide15.
Hipogonadismo e alterações da fertilidadeConsideramos que o hipogonadismo desenvolvido, neste caso, teve 2 origens: toxicidade direta das gónadas pela quimioterapia, pelos agentes alquilantes (hipogonadismo primário), e lesão do eixo hipotálamo‐hipofisário pela radioterapia (hipogonadismo secundário), uma vez que o doente apresentava um doseamento de testosterona total no limite inferior da normalidade com uma LH inapropriadamente baixa. Os efeitos adversos da quimioterapia (sobretudo da ifosfamida, mas também da vincristina) nas gónadas masculinas refletem‐se, primariamente, no epitélio germinal16, o que justifica a oligoteratoastenozoospermia observada neste doente. A disfunção das células de Leydig provocada pela quimioterapia parece ser mais frequente com o aumento da idade17. O mecanismo desta alteração após a quimioterapia é ainda desconhecido, uma vez que não existem evidências histológicas de anomalias nas células de Leydig na biópsia testicular após este tratamento. Apesar deste tratamento apresentar um efeito tóxico no epitélio secretor e germinal, a disfunção secretora pode também danificar indiretamente as espermatogónias e células derivadas. As alterações no fluxo sanguíneo causadas pela terapêutica e as modificações estruturais dentro dos testículos podem ter também um importante papel na fisiopatologia do hipogonadismo pela quimioterapia. Contudo, mesmo após esquemas combinados de quimioterapia, os homens não evoluem rapidamente para hipogonadismo severo, dada a baixa taxa de proliferação das células de Leydig18. No entanto, estão documentados aumentos de LH em um terço destes doentes com valores subnormais/normais de testosterona. O aumento da LH representa um mecanismo compensatório resultante do feedback negativo da testosterona ao nível do eixo hipotálamo‐hipofisário, refletindo uma diminuição na produção de testosterona pelas células de Leydig17,19,20. Isto não se verificou neste caso, uma vez que, devido à radioterapia a que foi submetido, o doente apresentou concomitantemente hipogonadismo central devido à lesão das células gonadotróficas. Estas células representam 10‐15% das células funcionantes da hipófise anterior, sendo o eixo gonadotrófico o segundo mais sensível à radiação externa, quer em crianças ou adultos4. A deficiência de gonadotrofinas clinicamente relevante é frequente após uma radiação ≥40Gy, sendo uma complicação tardia, com uma incidência cumulativa de 20‐50% após um período de seguimento a longo prazo5,21–24, tal como se verificou neste caso.
OsteoporoseSão reconhecidas, na literatura, causas endócrinas e iatrogénicas de osteoporose nas crianças e adolescentes (tabela 1)25; está também estabelecido que certos tipos de neoplasias, como os osteossarcomas e os tumores cerebrais podem relacionar‐se com osteoporose2. Apesar da maioria dos doentes recuperar a densidade mineral óssea (DMO) após o tratamento oncológico, esta pode permanecer permanentemente reduzida se esta terapêutica contribuir para o não atingimento do adequado pico de massa óssea, estando os doentes submetidos antes ou durante a puberdade sob maior risco3,26,27. No que diz respeito a este doente, a osteoporose desenvolvida poderia ter sido secundária a um conjunto de etiologias – deficiência de somatotropina, hipogonadismo, terapêutica com ifosfamida, com glucocorticoides e com metotrexato –, embora advoguemos que a insuficiência de somatotropina constituiu o fator primordial para o seu desenvolvimento, como discutiremos a seguir.
Causas de osteoporose nas crianças e adolescentes
| Causas endócrinas e latrogénicas de osteoporose nas crianças e adolescentes | |
|---|---|
| Endócrinas | HipogonadismoDéfice de hormona do crescimentoSíndrome de TurnerHipertiroidismoDiabetes mellitusHiperprolactinemiaAmenorreia hipotalâmicaDoença/síndrome de Cushing |
| Latrogénicas | GlucocorticoidesMetotrexatoCiclosporinaRadioterapiaAcetato de medroxiprogesteronaTerapêutica supressiva com levotiroxinaAnticonvulsivantes |
Nos adultos jovens com uma doença crónica que reconhecidamente afeta o metabolismo ósseo, valores de T‐score inferiores a −2,5 na coluna lombar ou no colo do fémur são considerados diagnósticos de osteoporose. Nas crianças deve ser usado o padrão ajustado à idade e sexo, Z‐score, definindo‐se como diminuição da DMO um Z‐score inferior a −2,028. É reconhecido que os métodos de doseamento da massa óssea nas crianças e adolescentes, sobretudo naqueles com deficiência de somatotropina, têm certas limitações. A DMO encontra‐se intimamente relacionada, nas crianças em crescimento, com a idade, maturação óssea e variáveis antropométricas29. A Dual energy X‐ray absorptiometry (DEXA) é a técnica mais frequentemente utilizada para medir a DMO, refletindo o conteúdo de mineral por centímetro quadrado de osso – DMOárea. Outras técnicas, não tão comummente acessíveis, como a tomografia computorizada quantitativa, permitem a determinação da DMO volumétrica, portanto a «verdadeira DMO»30. A desvantagem do uso da DEXA relaciona‐se com o facto de esta não considerar a espessura do osso, podendo subestimar a verdadeira DMO. Os doentes com deficiência de somatotropina geralmente apresentam uma estatura final inferior à prevista, tendo sido proposto que uma diferença na altura de 20cm pode explicar uma discrepância na DMOárea de aproximadamente um desvio‐padrão, levando, assim, a uma perceção falsamente elevada do risco de fratura31. Para ajustar a DMOárea para a altura podem ser usados certos modelos matemáticos, no entanto, são necessárias mais investigações para se obter a DMO de uma forma mais fidedigna nestes doentes. Estudos que determinaram a DMO volumétrica em crianças com deficiência de somatotropina confirmaram os dados prévios obtidos com DMOárea, que mostraram uma redução significativa da DMO nestes doentes29,32, evidenciando a necessidade da somatotropina para o metabolismo ósseo.
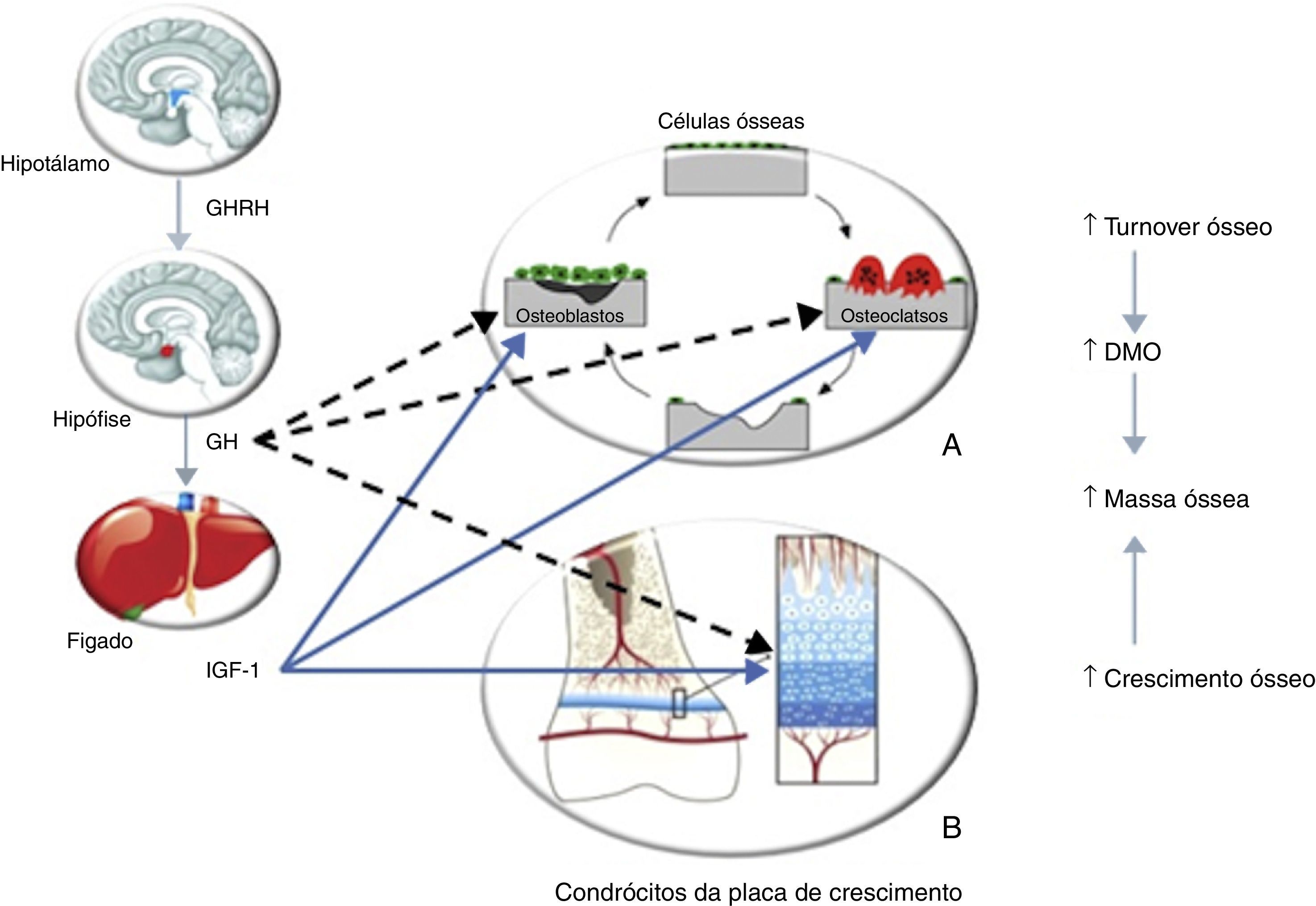
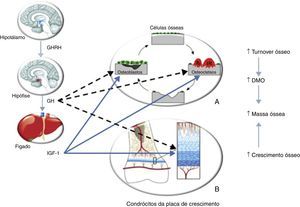
Vários autores demonstraram a diminuição da DMO em adultos com deficiência de somatotropina instalada na infância31,33–39. A somatotropina apresenta efeitos diretos e indiretos (via IGF‐1) na remodelação óssea, através da sua ação nos osteoblastos e osteoclastos40–43, e no crescimento linear, dado que regula a atividade dos condrócitos da placa de crescimento (fig. 4). Ocorre perda de massa óssea quando a reabsorção excede a formação óssea, como se verifica na deficiência de somatotropina. A DMO aumenta durante a infância, alcançando um pico entre os 20 e os 30 anos. Normalmente verifica‐se um marcado aumento da DMO durante a puberdade, resultado do crescimento acelerado e da remodelação óssea, sob influência da somatotropina e das hormonas sexuais. Sabe‐se que a deficiência de somatotropina apresenta um efeito relevante no osso dos adultos jovens, independentemente da idade de instalação e da etiologia deste défice, mas parece ter um papel menos importante nos doentes com instalação na idade adulta, o que fundamenta o papel primordial da somatotropina na aquisição do pico de massa óssea44. Consideramos que o doente apresentado não alcançou o pico de massa óssea desejado devido à insuficiência de somatotropina instalada na infância e não tratada. O facto desta hormona estimular todos os aspetos do turnover ósseo pode explicar, em parte, os efeitos do tratamento com somatotropina na DMO. Estudos com um longo seguimento45 mostraram um padrão da evolução da DMO com terapêutica com somatotropina – ocorre uma ligeira diminuição da DMO nos primeiros 6 meses; após 18 meses, verifica‐se um aumento da DMO, mantido aos 24 meses. Ensaios com 6 anos de tratamento demonstraram ganhos persistentes na DMO46; outros47 evidenciaram ainda um continuum do aumento da DMO mesmo após a suspensão da somatotropina. Estes dados levaram Ohlsson et al.48 a propor um modelo que defende que esta hormona aumenta o turnover ósseo globalmente, mas favorece a formação óssea. Uma vez que a reabsorção precede a formação óssea, verifica‐se uma diminuição da DMO no início da terapêutica com somatotropina; após 6 meses, a formação óssea prevalece havendo um aumento consequente da DMO; aos 12 meses, a DMO perdida no período inicial é restabelecida. Outros autores demonstraram ainda que não ocorreu redução na DMO até 2 anos após a suspensão da terapêutica com somatotropina (após o crescimento linear estar completo), nos adultos com deficiência desta hormona instalada na infância49. Contudo, estes doentes apresentaram redução dos marcadores do turnover ósseo, sugerindo que o ciclo de remodelação do osso teria sido afetado pela descontinuação do tratamento. Um ensaio randomizado multicêntrico50, que englobou 128 doentes adultos com deficiência de somatotropina diagnosticada em idade pediátrica, avaliou o efeito na DMO do tratamento com somatotropina com doses de adulto, doses pediátricas ou nenhum tratamento. Aos 2 anos a DMO era significativamente maior nos doentes sob terapêutica, sem diferenças significativas entre as doses, sugerindo que as de adulto são satisfatórias para a continuação da aquisição de massa óssea após o encerramento das epífises. Portanto, uma terapêutica com somatotropina adequada durante a infância, adolescência e no adulto jovem é essencial para a aquisição do pico de massa óssea. Esta terapêutica deve ser continuada mesmo após a cessação do crescimento linear, altura em que a aquisição da massa óssea continua a decorrer, de forma a que o doente possa atingir o pico de massa óssea adequado; esta recomendação aplica‐se igualmente aos doentes com deficiência de somatotropina com instalação na idade adulta que ainda não atingiram o referido pico. Neste sentido, consideramos que o tratamento com somatotropina requererá um longo período até que a sua eficácia se reflita nos valores de DMO, neste doente. Outras terapêuticas para a osteoporose, nomeadamente os bifosfonatos cujo uso em adultos jovens não é consensual, não nos parecem adequadas neste doente, sobretudo por nos parecer mais plausível tratar a etiologia desta osteoporose – a deficiência de somatotropina.
Efeito da somatotropina (GH)/IGF‐1 no metabolismo ósseo. A – A somatotropina estimula os precursores dos osteoblastos; esta hormona e o IGF‐1 estimulam a proliferação e atividade dos osteoblastos, resultando na formação de novo osso. A somatotropina pode estimular ou inibir o recrutamento dos precursores dos osteoclastos; o IGF‐1 estimula também o recrutamento e atividade dos osteoclastos, resultando em reabsorção óssea. Portanto, o efeito da somatotropina e IGF‐1 é promover o turnover ósseo. B – A somatotropina estimula a proliferação dos condrócitos e dos seus precursores. O IGF‐1 estimula a divisão e atividade das células proliferativas. Portanto, o outro efeito da somatotropina e do IGF‐1 é estimular o crescimento ósseo, contribuindo para o aumento da massa óssea. Adaptado de: Olney30. GHRH: growth hormone releasing hormone.
É reconhecido o papel das hormonas sexuais, principalmente dos estrogénios (no sexo masculino a sua ação requer a aromatização da testosterona) na aquisição e manutenção da massa óssea, sendo estas hormonas essenciais para o crescimento pubertário normal e para a maturação das epífises dos rapazes51. O hipogonadismo parcial neste doente instalou‐se após a puberdade, altura em que o doente já se encontrava numa fase mais tardia de aquisição da massa óssea. Além disso, o seu tratamento não originou melhoria da DMO pelo que consideramos que o hipogonadismo não constituiu o fator chave no desenvolvimento da osteoporose.
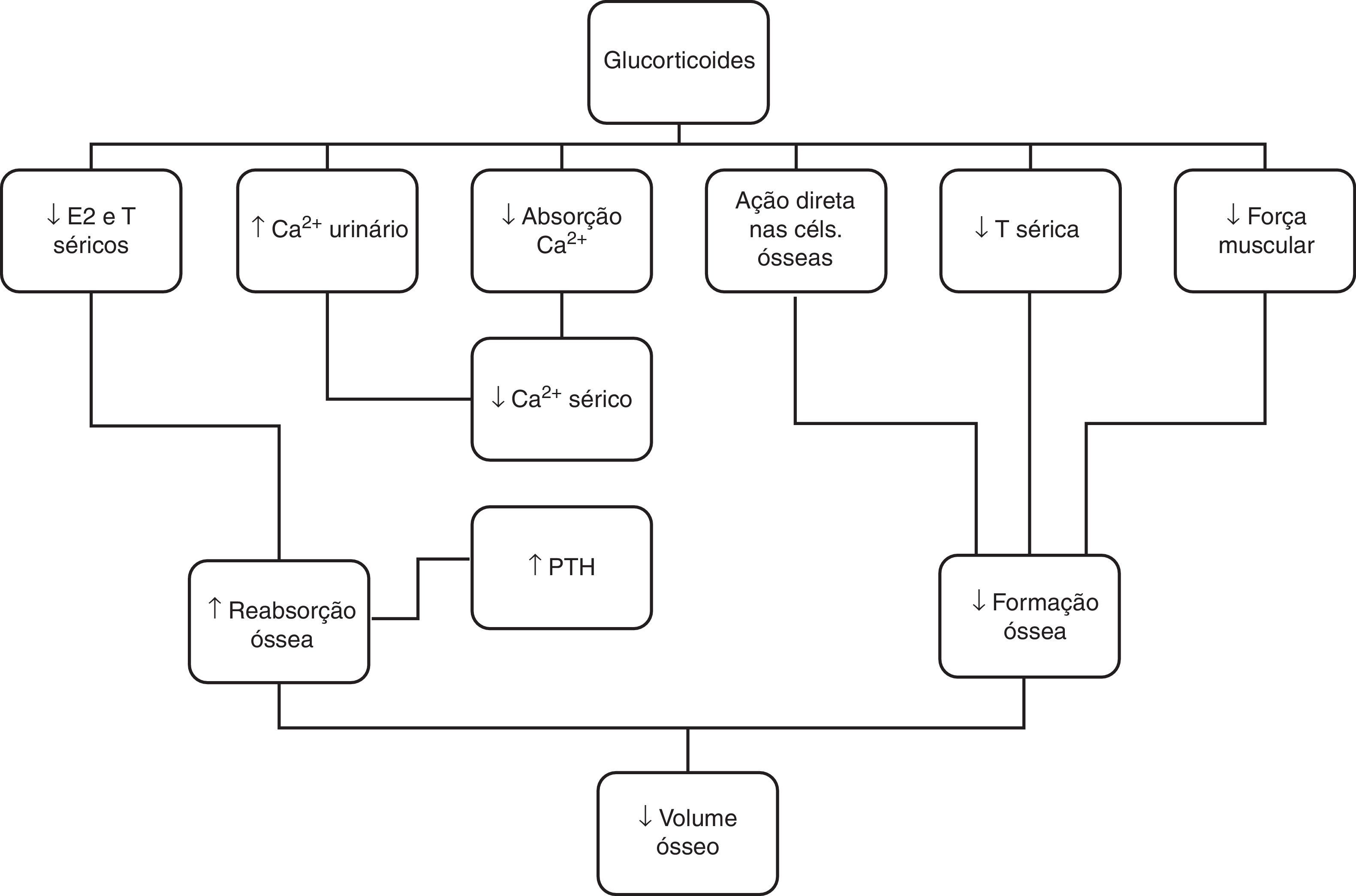
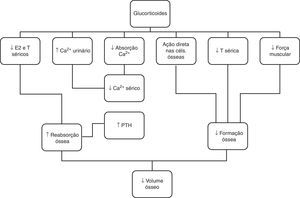
O tratamento com glucocorticoides pode também apresentar efeitos nefastos no tecido ósseo, uma vez que estas hormonas estimulam a reabsorção e reduzem a formação óssea52,53, através de diferentes mecanismos, nomeadamente inibição dos osteoblastos e estimulação da proliferação dos osteoclastos, diminuição dos esteroides sexuais e interferência direta com o metabolismo do cálcio (fig. 5)54. O risco de perda de massa óssea é mais pronunciado nos primeiros meses da corticoterapia, seguida por uma perda menor, mas mantida com o seu uso continuado53. Os doentes expostos a doses cumulativas>9.000mg/m2 de prednisona (ou equivalente) estão sob maior risco de desenvolvimento de osteoporose55,56. No caso apresentado, admitimos que a perfusão de prednisolona, em dose única, não foi responsável pela osteoporose, dado que nem a dose nem a duração da terapêutica com este fármaco foram suficientes para que esta complicação se desenvolvesse.
Existem estudos que demonstram que o metotrexato reduz a DMO, sobretudo quando usado em doses>40.000mg/m23,55,57,58. Este fármaco pode levar ao aumento da reabsorção e inibição da formação ósseas com consequente diminuição do turnover59–61. Um estudo prospetivo com 40 crianças com leucemia linfática aguda tratadas com metotrexato demonstrou que 64% apresentaram diminuição da DMO e 39% desenvolveram fraturas durante o tratamento, recuperando de seguida62. Contudo, consideramos que o tratamento com este fármaco no doente por nós apresentado não teve impacto na diminuição da DMO pelas mesmas razões que a corticoterapia.
A ifosfamida, um agente de quimioterapia frequentemente associado à redução da massa óssea63, é gonadotóxico e, portanto, um dos mecanismos responsáveis pelos efeitos no osso é a diminuição da produção de esteroides sexuais64. Contudo, o seu impacto no tecido ósseo deve‐se sobretudo à lesão do túbulo contornado proximal renal que ocorre com doses≥50g/cm2 de ifosfamida ou em combinação com cisplatina, provocando perda de fosfato renal, acidose metabólica e hipercalciúria; em casos mais severos, o tratamento com ifosfamida pode resultar em osteomalacia hipofosfatémica65,66. Mais uma vez, esta não nos parece a causa provável da osteoporose deste doente, uma vez que este doente não desenvolveu alterações da função renal ou do metabolismo fosfo‐cálcico durante o seu seguimento, embora consideremos que a gonadotoxicidade verificada seja devida, em parte, à ifosfamida.
ConclusãoAs sequelas endócrinas são frequentes nos doentes sobreviventes de cancro. É essencial reconhecer e tratar a deficiência de somatotropina nestes doentes, sabendo‐se que é uma das principais complicações da radioterapia quando atinge o eixo hipotálamo‐hipofisário, sobretudo em crianças e jovens. No caso apresentado, apesar do doente ter sido exposto a diversas terapêuticas passíveis de conduzirem a uma diminuição da DMO, a deficiência de somatotropina não tratada foi preponderante no desenvolvimento de osteoporose. Devem ser realizados esforços para criar condições que permitam a terapêutica de reposição com somatotropina em tempo útil e duração adequadas às particularidades de cada um destes doentes.
As crianças sobreviventes de doença oncológica devem ter um seguimento multidisciplinar envolvendo obrigatoriamente um endocrinologista/pediatra com experiência em endocrinologia pediátrica.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.